2. 中国科学院海洋研究所,山东青岛 266071;
3. 中国海洋大学,山东青岛 266071;
4. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室,山东青岛 266071
2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao, Shandong, 266071, China;
3. Ocean University of China, Qingdao, Shandong, 266071, China;
4. Marine Biology and Biotechnology Laboratory, Qingdao National Laboratory for Marine Science and Technology, Qingdao, Shandong, 266071, China
【研究意义】多毛纲(Polychaeta)隶属于环节动物门(Annelida)。多毛类动物多生于海水,淡水种类较少。成体一般营底栖生活,幼体有浮游阶段,仅极少数种类终生浮游生活。多毛类是底栖生物群落中最常见、数量最多的类群。在浅水区、深海区、开阔的海岸、河流入海口、港口和珊瑚礁区域,多毛类都是种类最丰富的类群[1]。多毛类在种类和数量上通常占整个大型底栖生物群落的三分之一甚至更多,作为底栖生物最重要的类群,具有重要的生态学意义。【前人研究进展】之前有关多毛类多样性的研究多局限于局部海域,如毕洪生和孙道元[2]探讨了胶州湾多毛类的种类组成、分布、数量变动以及多样性等生态特点,初步分析了影响多毛类数量变化的原因;王金宝等[3]重点讨论了胶州湾多毛类数量变化与环境因子的关系,认为海底底质是影响多毛类数量分布与变化的重要因子;吴宝玲等[4]的研究则侧重于西沙群岛多毛类的动物地理学方面;还有的研究是讨论潮间带多毛类数量变化与环境的关系等[5]。【本研究切入点】目前,尚未见在黄东海范围内讨论多毛类多样性的研究。【拟解决的关键问题】本研究对2011年8月航次调查所获得的多毛类的样品进行准确的分类鉴定,分析黄东海多毛类的种类组成,统计计算得出优势种并分析其空间分布状况,为黄东海多毛类多样性的进一步研究提供资料。
1 材料与方法于2011年8月(以下简称夏季航次)搭乘“科学三号”考察船对黄东海大型底栖动物进行调查采样。共设置大面站位69个。因天气等原因,本航次有4个站位(I1, L4, Q7, S3)未采集到样品。调查站位的设置见图 1。
|
图 1 黄东海夏季航次调查站位 Fig.1 Sampling stations of the Yellow Sea and East China Sea in Summer flight |
每个采样站用0.1 m2 Gray-O’Hara箱式采泥器重复采样2次,用底层孔径为0.5 mm的套筛筛选,两次取样获得的样品合并作为该站采样0.2 m2内样品,所获样品用75%的酒精固定后带回实验室。之后进行种类鉴定、个体计数、称重(使用0.001 g精度天平),并对所获数据进行统计分析,得出优势种并分析其空间分布状况。
优势种的选取采用优势度计算公式:
Y=(ni/N)fi。
式中N为该海域所有种类的总个体数目,ni为第i种的个体数;fi为该种在各站位出现的频率;当物种优势度Y>0.02时,该种即为优势种。
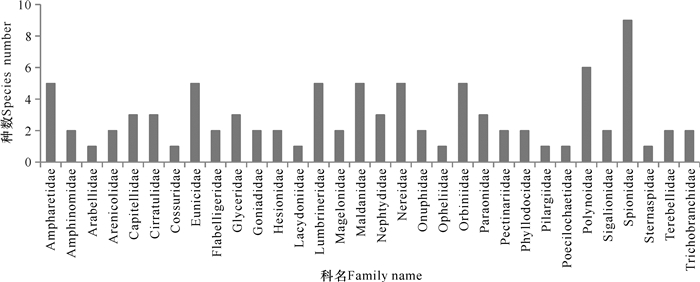
2 结果与分析 2.1 多毛类的物种组成夏季航次共获得有效多毛类标本1 704个,经分类鉴定出共计90种,分属于32科(附录1)。从获得的种数来看,海稚虫科Spionidae物种最多,共有9种;其次是多鳞虫科Polynoidae为6种;双栉虫科,索沙蚕科,沙蚕科,矶沙蚕科,竹节虫科和锥头虫科均为5种;以上8科为黄东海多毛类种类数的优势科;有7个科仅发现一种,低于3种的科占总科数的75%(图 2)。
|
图 2 夏季航次不同科的种类数统计 Fig.2 Number of species in different families in Summer fright |
共发现2个优势种,即小头虫科的背蚓虫Notomastus latericeus Sars, 1857和索沙蚕科的掌鳃索沙蚕Ninoe palmata Moore, 1903。其中,背蚓虫优势度非常明显,为0.133 8。从获得的标本数量来看,本次调查共获得背蚓虫标本449个,在所调查的65个站位中出现了33次,出现频率为50.77%。除优势种外,其它种类如欧努菲虫科的四齿欧努菲虫Onuphis tetradentata Imajima, 1986出现6次,共采集到313个标本;寡鳃齿吻沙蚕Nephtys oligobranchia Southern, 1921出现26次,共采集到134个标本,它们是物种数量占优势的科,在群落中占据相对重要的位置。种类数量较多的科与物种数量较多的科并不完全相同,体现了不同科的多毛类分布方式的不同。种数多而数量少的科往往分布比较均匀;种数较少而数量较多的科往往是聚集分布,而且数量较大。
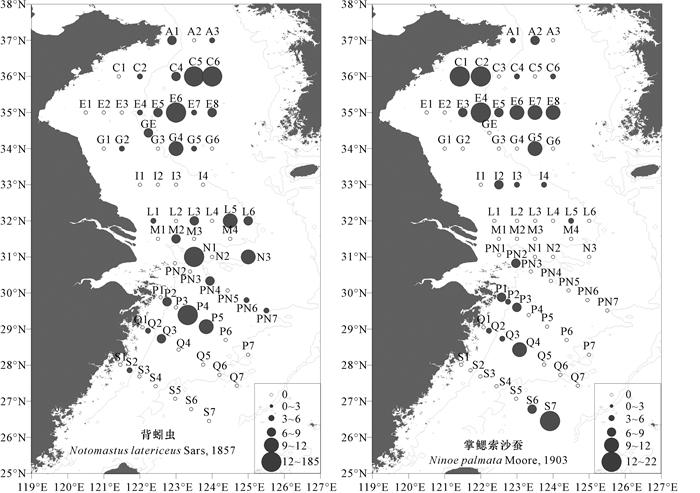
2.3 优势种的空间分布从动物地理学角度分析,背蚓虫为广布种,从我国黄海、东海、南海到印度尼西亚、菲律宾都有分布;而掌鳃索沙蚕分布范围比较窄,仅见于中国海,日本海和加利福尼亚中部。本次调查中,优势种的分布均没有表现出明显的规律性(图 3)。背蚓虫有聚集分布的现象,黄海冷水团海域和长江口是两个主要的分布区,这些海域底质多为砂质,与背蚓虫的生活环境相吻合。掌鳃索沙蚕主要分布于黄海深水区域,长江口海域则出现较少,可能是因为长江口的淡水环境不适合其生存。
|
图 3 夏季航次多毛类优势种的空间分布(个/m2) Fig.3 Distribution of dominant species of Polycheeta in Summer flight(inds/m2) |
生物多样性研究中,物种的分类鉴定是最基础且最重要的内容,因其繁琐、复杂且耗时巨大,在实际操作过程中往往重视不足。这也进一步导致了分类学研究的进展缓慢。
目前来看,中国海多毛纲动物分类学研究有非常多的工作亟待开展。多数学者认为中国海多毛纲动物应有约60科,1 000余种。然而,仅有数量不到一半的科(24科)有过较为系统的种类记述,大多数科的种类仅有零星记录,如竹节虫科、小头虫科、仙虫科、笔帽虫科、丝鳃虫科等,部分科属的分类学研究基本属于空白[6]。杨德渐等[7]曾对中国近海多毛类种类做过总结,是如今中国海多毛类分类学研究的重要参考书之一,其中共记录356种,后续研究尚需做进一步增补。
近年来分类学研究表明,中国沿岸多毛类种类已有的记录中存在一定数量的错误鉴定,甚至是一些种群数量很高的优势种。如中国海沿岸常见种不倒翁虫被鉴定为一新种S.Chinensis Wu, Salazar-Vallejo & Xu, 2015。两者主要区别:(1)从形态上来看,前者身体后部刚毛6对呈弧线状分布,而后者只有5对呈近似直线分布;(2)从分布来看,前者分布在地中海和东北大西洋;而后者分布在西北太平洋。此外还有海稚虫科奇异稚齿虫属中奇异稚齿虫Paraprionospio pinnata (Ehlers, 1901)实际包括3种,即扭鳃奇异稚齿虫P.inaequibranchia (Caullery, 1914)、枫香树奇异稚齿虫P.coora Wilson, 1990和冠奇异稚齿虫P.cristata Zhou, Yokoyama & Li, 2008[8]。其中冠奇异稚齿虫为一新种,扭鳃奇异稚齿虫和枫香树奇异稚齿虫在中国海属首次记录。枫香树奇异稚齿虫主要分布于黄海,其分布南界为121°30′E,34°30′N,扭鳃奇异稚齿虫分布于南海,其分布北界为114°00′E,21°45′N,冠奇异稚齿虫分布区域较广,从长江口到南海的沿岸水域均有分布。奇异稚齿虫是分布在智利、南加利福尼亚、西墨西哥(可能还有安哥拉)的种,在我国海域未见分布[9]。又如,我国北方近岸极其常见但长期被记录为鳞腹钩虫Scolelepis (Scolelepis) squamata (Müller, 1806)的标本经重新鉴定,已确定为一个新种,即红纹腹钩虫S.(S.) daphoinos Zhou & Li, 2009;鳞腹钩虫分布于北大西洋和地中海沿岸水域,在我国海域未见分布[10]。
分类学的发展与变化为我们的分类鉴定带来了更大的挑战。比如,以前我国文献记录的双栉虫科扇栉虫属的米氏扇栉虫Amphicteis mederi Annerova,1929,实际为中国海伪扇栉虫属一新种中国伪扇栉虫Pseudoamphicteis sinensis Sui & Li,2014。其中,伪扇栉虫属为中国首次记录[11]。而最近的研究表明,伪扇栉虫属是副栉虫属的同物异名[12]。这样,广泛分布于中国黄东海的中国伪扇栉虫实为中国副栉虫Paramphicteis sinensis (Sui & Li, 2014)。而与它相似种副栉虫P.angustifolia (Grube, 1878)则主要分布于中国南海。又如,中国海记录的双栉虫科双栉虫属的回双栉虫Ampharete reducta Chamberlin, 1920实为中国海新纪录种纳氏沟栉虫Anobothrus nataliae Jirkov,2009[13]。而最近的研究表明[14-15],纳氏沟栉虫A.nataliae Jirkov,2009实为多稃沟栉虫A.paleatus Hilbig, 2000的同物异名。
此外,中国海新纪录种和新种的发现与发表[16-21],为我们的分类鉴定提供了更多的参考资料。上述问题说明中国海多毛纲动物分类学研究需要更为科学系统的深入,不仅要依靠已有研究基础,更需要扎实有效、创新性的工作。
3.2 黄东海多毛类的物种组成与优势种对比以往的调查资料[22],2000年10月黄东海的多毛类优势种为角海蛹Ophelina acuminate öersted, 1843和长吻沙蚕Glycrea chirori Izuka, 1912;2001年3月黄东海多毛类优势种为角海蛹、斑角吻沙蚕Goniada maculata öersted, 1843和掌鳃索沙蚕;更早的1958-1960年“全国近海海洋综合调查(即全国海洋普查)”黄东海多毛类优势种为不倒翁虫Sternaspis scutata (Ranzani, 1817)[23]、斑角吻沙蚕和虹彩欧努菲虫Onuphis iridescens (Johnson, 1901)。调查发现,五十年前多毛类绝对优势种不倒翁虫[7]在近十几年来已经不再是优势种,甚至已经不在相对优势的多毛类名单里,取而代之的是角海蛹、背蚓虫和掌鳃索沙蚕。其它两种优势种中,仅斑角吻沙蚕在2001年3月还是优势种,本次调查没有发现。
多毛类多数营底内生活,对沉积环境非常敏感,经常作为海洋生态环境的指示种,但不代表相同科的种类具有相近的生活环境。如常见的小头虫科的种类小头虫Capitella capitata (Fabricius, 1780),对有机物有很强的耐受力,是海洋有机污染的重要指示生物;而同一科的背蚓虫(夏季航次的绝对优势种)则喜欢生活在清洁的沙底。同样是本次调查的重要多毛类,索沙蚕科的长叶索沙蚕Lumbrineris longifolia (Imajima & Hartman, 1975)和掌鳃索沙蚕,前者生活于潮间带和潮下带800 m以内的软泥、砂质、贝壳等混合底质,在有机污染较严重的潮间带也有富集现象,后者则喜居于10~1 500 m的较为清洁的砂质和碎贝壳底质。
4 结论黄东海多毛类物种丰富,不同种类分布方式与生存环境有所不同,优势种随时间变化而改变。分类学作为多样性研究的基础,更应该引起足够的重视。
| 表 附录1 夏季航次多毛类种名录 Table 附录1 Polychaete species collected in Summer flight |
| [1] |
HESSLER R R, JUMARS P A. Abyssal community analysis from replicate box cores in the central north Pacific[J]. Deep Sea Research and Oceanographic Abstracts, 1974, 21(3): 185-209. DOI:10.1016/0011-7471(74)90058-8 |
| [2] |
毕洪生, 孙道元. 胶州湾多毛类的生态特点[J]. 生态学报, 1998, 18(1): 63-68. BI H S, SUN D Y. The ecological characteristics of Polychaete in Jiaozhou Bay[J]. Acta Ecologica Sinica, 1998, 18(1): 63-68. |
| [3] |
王金宝, 李新正, 王洪法, 等. 胶州湾多毛类环节动物数量分布与环境因子的关系[J]. 应用与环境生物学报, 2006, 12(6): 798-803. WANG J B, LI X Z, WANG H F, et al. Relationship between quantitive distribution of benthic Polychaete annelida and environmental factors in Jiaozhou Bay[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(6): 798-803. |
| [4] |
吴宝铃, 孙瑞平, 陈木. 西沙群岛及其附近海域多毛类动物地理学的研究[J]. 海洋学报, 1980, 2(1): 111-130. WU B L, SUN R P, CHEN M. Zoogeographical studies on Polychaeta from the Xisha Islands and its adjacent waters[J]. Acta Oceanologica Sinica, 1980, 2(1): 111-130. |
| [5] |
蔡立哲, 历红梅, 林鹏, 等. 深圳河口潮间带泥滩多毛类的数量变化及环境影响[J]. 厦门大学学报:自然科学版, 2001, 40(3): 741-750. CAI L Z, LI H M, LIN P, et al. Analysis of environmental effect and Polychaete quantitative variations on intertidal mudflat in Shenzhen estuary[J]. Journal of Xiamen University:Natural Science, 2001, 40(3): 741-750. |
| [6] |
周进, 李新正. 中国海多毛纲动物研究现状及展望[J]. 海洋科学, 2011, 35(6): 82-89. ZHOU J, LI X Z. Analysis and outlook for Polychaete studies from China' s seas[J]. Marine Sciences, 2011, 35(6): 82-89. |
| [7] |
杨德渐, 孙瑞平. 中国近海多毛环节动物[M]. 北京: 农业出版社, 1988. YANG D J, SUN R P. Polychaeta in China Seas[M]. Beijing: Agriculture Press, 1988. |
| [8] |
ZHOU J, YOKOYAMA H, LI X Z. New records of Paraprionospio (Annelida:Spionidae) from Chinese waters, with the description of a new species[J]. Proceedings of the Biological Society of Washington, 2008, 121(3): 308-320. DOI:10.2988/08-10.1 |
| [9] |
周进.中国海异毛虫科和海稚虫科分类学和地理分布研究[D].青岛:中国科学院海洋研究所, 2008. ZHOU J.Study on the Taxonomy and Faunistic Characters of Families Paraonidae and Spionidae (Annelida:Polychaeta) from China Seas[D].Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2008. http://cdmd.cnki.com.cn/article/cdmd-80068-2008117237.htm |
| [10] |
ZHOU J, JI W W, LI X Z. A new species of Scolelepis (Polychaeta:Spionidae) from sandy beaches in China, with a review of Chinese Scolelepis species[J]. Zootaxa, 2009, 2236: 37-49. |
| [11] |
SUI J X, Li X Z. Pseudoamphicteis sinensis sp.nov., a new species of Ampharetidae (Polychaeta) from China[J]. Zootaxa, 2014, 3872(4): 376-380. DOI:10.11646/zootaxa.3872.4 |
| [12] |
REUSCHER M, FIEGE D, IMAJIMA M. Ampharetidae (Annelida:Polychaeta) from Japan.Part Ⅲ:The genus Amphicteis Grube, 1850 and closely related genera[J]. Journal of the Marine Biological Association of the United Kingdom, 1850, 95(5): 929-940. |
| [13] |
SUI J X, LI X Z. Review of Anobothrus (Polychaeta:Ampharetidae) from China[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(3): 632-635. DOI:10.1007/s00343-013-2209-9 |
| [14] |
IMAJIMA M, REUSCHER M G, FIEGE D. Amph-aretidae (Annelida:Polychaeta) from Japan.Part Ⅱ:Genera with elevated and modified notopodia[J]. Zootaxa, 2013, 3647(1): 137-166. DOI:10.11646/zootaxa.3647.1 |
| [15] |
SCHVLLER M, JIRKOV I A. New Ampharetidae (Polychaeta) from the deep Southern Ocean and shallow Patagonian waters[J]. Zootaxa, 2013, 3692(1): 204-237. DOI:10.11646/zootaxa.3692.1 |
| [16] |
ZHOU J, LI X Z. Report of Prionospio complex (Annelida:Polychaeta:Spio-nidae) from China's waters, with description of a new species[J]. Acta Oceanologica Sinica, 2009, 28(1): 116-127. |
| [17] |
周进, 纪炜炜, 李新正. 中国海才女虫属复合体(多毛纲:海稚虫科)种类记述[J]. 海洋渔业, 2010, 32(1): 1-15. ZHOU J, JI W W, LI X Z. Records of Polydora complex spionids (Polychaeta:Spionidae) from China's coastal waters, with emphasis on parasitic species and the description of a new species[J]. Marine Fisheries, 2010, 32(1): 1-15. |
| [18] |
SUI J X, LI X Z. First report of the genus Lysippe Malmgren, 1866 (Polychaeta:Ampharetidae) from Chinese waters[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(4): 846-849. DOI:10.1007/s00343-013-2312-y |
| [19] |
CAI W Q, LI X Z. Eranno carrerai sp.nov., a new polychaete worm(Lumbrineridae) from coastal waters of China[J]. Chniese Journal of Oceanology and Limnology, 2011, 29(1): 217-231. DOI:10.1007/s00343-011-9951-7 |
| [20] |
CAI WQ, LI X Z. A new species and new recorded species of Lumbrineridae Schmarda, 1861(Annelida:Polychaete) from China[J]. Chinese Journal of Oceanology and Limonlogy, 2011, 29(2): 356-365. DOI:10.1007/s00343-011-0024-8 |
| [21] |
CAI W Q, LI X Z. Three new records of Lumbrineridae Schmarda, 1861(Annelida:Polychaeta) from coastal areas of species in China[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(6): 1207-1301. |
| [22] |
彭松耀.黄东海大型底栖动物群落结构特征[D].青岛:中国科学院海洋研究所, 2013. PENG S Y.Characteristics of Macrobenthic Community Structure in the Yellow Sea and East China Sea[D].Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2013. http://cdmd.cnki.com.cn/article/cdmd-80068-1013300032.htm |
| [23] |
WU X W, SALAZAR-VALLEJO S I, XU K D. Two new species of Sternaspis Otto, 1821 (Polychaeta:Sternaspidae) from China Seas[J]. Zootaxa, 2015, 4052(3): 373-382. DOI:10.11646/zootaxa.4052.3 |
 2016, Vol. 23
2016, Vol. 23 


