糖基修饰在很多天然产物中都有发现,如小分子化合物、蛋白质、脂类和糖类等,对这些物质的水溶性、稳定性和生物活性都具有重要的影响。因此,糖基修饰技术已逐渐被应用于药物先导化合物发现、农药开发、食品加工、新型生物材料研发以及精细化工品制备等多个领域,并展现出广泛的研究和应用价值[1]。由于缺乏区域和立体化学选择性,传统的化学法糖基化修饰技术一直是困扰化学家的难题[2]。作为糖基化修饰产物重要来源之一的提取分离法则存在糖基化修饰种类单一、产率低和提取难度大等多种不足[3]。因此,基于糖基转移酶和糖苷合成酶的酶法糖基化修饰技术被逐步开发和应用,并展现出了较好的立体和区域选择性、产物多样性以及巨大的应用潜力[4]。本文将重点概述糖苷合成酶及其在糖基化产物合成中的应用,为生物大分子和小分子化合物的糖基化修饰提供实例和参考。
1 糖苷合成酶及其反应机制虽然糖基转移酶已被广泛应用于小分子化合物或生物大分子的糖基化修饰,但糖供体种类的局限性促使了糖苷合成酶的发现。天然糖苷水解酶的随机突变和理性设计是糖苷合成酶的主要来源,涉及多个家族的糖苷水解酶 (表 1)。根据糖苷合成机制的不同,现有糖苷合成酶可被分为保留型和翻转型两大类[5]。
| 表 1 外切/内切糖苷水解酶突变所得的糖苷合成酶 Table 1 Glycosynthases derived from exo-and endo-glycosidases to date |
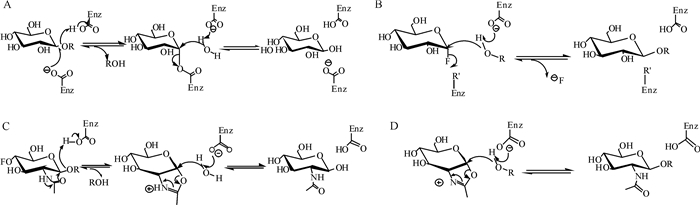
保留型糖苷合成酶是基于保留型糖苷水解酶的催化机制而改造获得的一类糖苷合成酶[24]。如图 1A所示,保留型糖苷水解酶的反应机制属于双替换机理,分为酶的糖基化和去糖基化两步反应历程,其中催化基团通常为两个谷氨酸残基。在反应中,一个谷氨酸残基 (E1) 作为酸碱催化剂质子化糖苷氧原子使底物发生扭曲,而另一个谷氨酸残基 (E2) 作为亲核试剂进攻异头碳原子,形成糖基-酶共价中间体。E1夺取水分子的一个质子,而失去质子的水分子进攻异头碳,形成游离糖[25]。
|
图 1 保留型糖苷水解酶 (A)、保留型糖苷合成酶 (B)、底物辅助N-乙酰氨基葡糖苷酶 (C) 和恶唑啉糖供体依赖的保留型糖苷合成酶 (D) 的反应机制 Fig.1 Catalytic mechanisms for retaining glycoside hydrolase (A), retaining glycosynthase (B), substrate-assisted N-acetyl glucosaminidase (C) and oxazoline sugar-dependent glycosynthase (D) |
保留型糖苷水解酶的催化性亲核残基 (谷氨酸) 被突变为非亲核残基之后就无法形成糖基-酶共价中间体,从而丧失糖苷水解活性,变成具有糖苷合成活性的糖苷合成酶。保留型糖苷合成酶的活化糖供体 (如α-氟代糖) 与野生糖苷水解酶的底物具有构型相反的异头碳结构,反应过程中只形成糖基-底物受体的共价中间体,从而实现糖基转移活性。保留型糖苷合成酶活性中心无催化性亲核基团,所以转糖基合成糖苷的反应难以可逆,糖基化产物不被水解从而得以积累 (图 1B)[26]。另一种无亲核基团的保留型糖苷酶可以利用底物辅助机制水解2-乙酰胺基糖[27]。乙酰胺基氧攻击异头碳产生恶唑啉盐离子中间体,该中间体被水攻击即可释放水解产物。当活性氨基酸残基被特异地突变即可形成相应的糖苷合成酶[28](图 1C和D)。
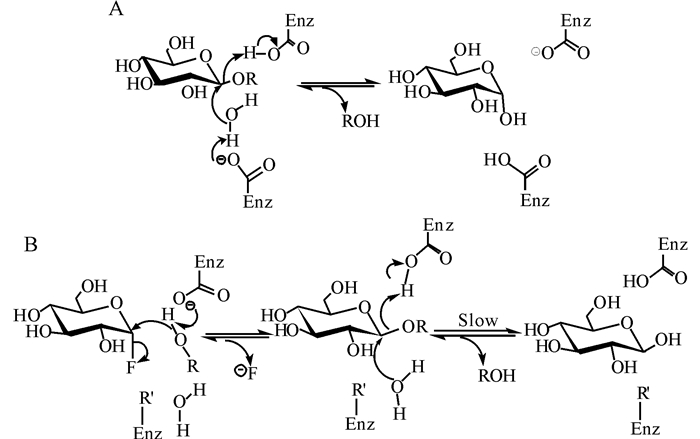
1.2 翻转型糖苷合成酶目前,绝大多数糖苷合成酶都是由保留型糖苷水解酶突变而来,但翻转型糖苷水解酶的改造也是糖苷合成酶的重要来源之一。翻转型糖苷水解酶的活性中心有两个具有催化功能的酸性氨基酸残基 (多为天冬氨酸或谷氨酸),参与糖苷键水解过程中的亲核进攻,其中一个作为质子供体质子化糖苷键上的氧,另外一个作为亲核碱催化水分子去质子化,协助其完成亲核进攻异头碳,翻转异头碳的立体结构,释放游离糖 (图 2A)[29]。根据该反应机制,翻转型糖苷水解酶活性中心内的亲核碱氨基酸残基突变即可产生糖苷合成酶活性,氟化糖供体上的氟原子不需要酸活化即可脱离,实现有效的糖苷键合成 (图 2B)。
|
图 2 翻转型糖苷水解酶 (A) 和翻转型糖苷合成酶 (B) 的反应机制 Fig.2 Catalytic mechanisms of an inverting glycoside hydrolase (A) and an inverting glycosynthase (B) |
糖复合物中的聚糖成分对糖复合物的理化性质和生物学功能的研究均有重要影响,然而,天然糖复合物中糖链长度不均一性和结构不确定性已成为糖复合物研究的难点问题之一,而且天然的糖苷合成酶也无法实现糖链的可控合成[30]。相比之下,人工糖苷合成酶则可以合成糖链结构相对明确的糖复合物,因此,糖苷合成酶常被用于聚糖和糖复合物的合成研究,以提高糖链合成的可控性和增加糖链结构的多样性。
2.1 寡糖合成寡糖类可作为营养物质常被用作食品添加剂或辅助治疗药物,但寡糖的合成或制备是学术界与工业界共有难题之一。近年来,基于糖苷合成酶建立的化学-酶合成方法在寡糖的合成方面也开展了大量的尝试,并取得了一定的成果。Honda等[29]首次将芽孢杆菌的翻转型外切-木聚糖酶Rex的亲核碱Asp-263进行饱和突变,通过筛选获得了具有糖苷合成酶活性的突变体Rex D263C,其可以α-D-氟代木糖作为活性糖供体合成聚合度为2~3的低聚木糖。芽孢杆菌木糖苷酶Bhx的亲核突变体Bhx E334G催化α-D-氟代木糖和4-硝基苯基-β-D-木吡喃糖苷受体反应,产生β-(1, 4) 连接的寡糖[31],这些低聚木糖可被用作底物或抑制剂研究木聚糖酶的构效关系。此外,GH10家族的纤维单胞菌内切-β-1, 4-木聚糖酶CFXcd的催化残基被亲核突变后,产生了具有糖苷合成活性的β-木糖合成酶CFXcd-E235G,其同样借助α-D-氟代木糖合成聚合度为4~12的β-(1, 4)-连接低聚木糖[32]。
作为食品添加剂的甘露聚糖类只能从植物中提取获得,无法采用化学合成方法制备[33]。Nashiru等[11]将纤维单胞菌的β-甘露糖苷酶Man2a亲核催化氨基酸残基, 成功地获得了甘露糖苷合成酶Man2a E519S。在以α-氟代甘露糖为糖供体的条件下,Man2a E519S可催化PNP-β-葡糖苷、β-木糖苷、β-纤维二糖苷或β-龙胆二糖苷等糖基受体发生糖基化反应,分别产生聚合度为2~6的寡糖产物,且产率均在90%以上。此外,Jahn等[34]将纤维弧菌的β-甘露糖苷酶Man26A亲核突变产生的糖苷合成酶Man26A E320G,可高效催化α-氟代甘露糖与pNP-葡萄糖聚合产生聚合度为3~6且只含β-(1, 4) 糖苷键的甘露寡糖,产率为59%。重要的是,β-(1, 4) 甘露糖苷键是化学合成法中最难合成的连接键,因此,糖苷合成酶Man26A E320G具有巨大的应用价值。
2.2 多糖合成天然多糖需要借助糖基转移酶、转糖苷酶和磷酸化酶等一系列酶协同催化合成的碳水化合物组合模块而形成。在实际应用中,序列已知和结构相对明确对多糖理化性质和生物学功能研究至关重要,但传统化学合成法无法控制单糖聚合的单体序列和糖链长度均一性,且成本极高,而基于糖苷合成酶的酶法合成则有可能成为解决多糖合成难题的有效技术手段。基于芽孢杆菌的1, 3-1, 4-β-葡聚糖酶的催化机制和空间结构,Faijes等[35]将催化残基谷氨酸突变为丙氨酸制备了新型糖苷合成酶E134A突变体。以α-氟化昆布二糖作为底物,E134A突变体催化合成了首个非天然来源的多糖——β-1, 3和β-1, 4糖苷键混合连接的葡聚糖。2016年,Faijes等[36]又对纤维素酶Cel7B进行理性改造获得了新的糖苷合成酶HiCel7B E197A。HiCel7B E197A可以催化6’-叠氮基-纤维二糖氟化物的高效聚合,形成6’-叠氮基-6’-脱氧纤维素单元重复的多糖。此外,HiCel7B E197A展现出很宽的底物谱,能够催化多种功能基团或取代基改变的氟化二糖底物聚合,获得了多种结构新颖的纤维素衍生物,为制备结构多样性的多糖衍生物提供了方法。
木糖葡聚糖是一类结构复杂的植物多糖,与纤维素具有高度的亲和性,可用于细胞培养。Spadiut等[17]对饲料类芽孢杆菌XG5中一种高度特异性的木糖葡聚糖酶亲核突变 (E323G) 后得到了PpXG5 E323G糖苷合成酶,其可催化α-F-XLLG的聚合,产生分子量高达12 000的双半乳糖基化的木糖葡聚糖,并结合拟南芥的α-1, 2-岩藻糖基转移酶AtFUT1催化得到了岩藻糖化的木糖葡聚糖,增加了产物多样性。不过,该方法获得的木糖葡聚糖产物具有多分散性特征,即骨架长度不一,形成多糖混合物,这给目标多糖的分离纯化带来了困难,但有助于研究木糖葡聚糖与上下游纤维素和其他生物分子的相互作用关系。
2.3 糖脂的修饰糖苷合成酶在糖脂类合成中也有应用。糖苷神经鞘脂是一类重要的神经节苷脂,主要存在于哺乳动物神经元细胞膜中,在生物信号传递中发挥着重要作用。由于这类分子难以通过化学方法合成,目前只能从牛脑中提取,且也尚未发现合适的转移酶类可以生物合成糖脂中的糖链。此外,糖脂的溶解性较差,不易分离纯化。如能酶法在脂质结构中添加寡糖,其溶解性和纯化问题就可解决。
红球链霉菌的神经节苷脂内切糖苷酶 (EGCⅡ) 作为GH 5家族成员可以选择性水解糖和脂质苷元的糖苷键。Vaughan等[37]发现EGCⅡ的亲核氨基酸残基突变体E351S可催化3’-唾液酸乳糖氟化物为糖供体和D-赤藓-鞘氨醇为受体产生可溶的GM3神经节苷脂,产率高达90%。因此,E351S突变体属于一种新型的糖苷合成酶,具有糖基化修饰神经节苷脂和糖脂的功能。Vaughan等[37]还发现E351S底物谱很宽,能利用多种氟化糖作为糖供体和不同的脂质作为糖受体,如高效合成乳糖鞘氨醇和纤维二糖鞘氨醇。此外,糖苷合成酶E351S还可以利用很多种鞘氨醇类似物作为受体,在天然和非天然糖苷神经鞘脂类的合成中都具有较大的应用潜力,并且通过定向进化其底物谱被进一步拓宽,产生了更加优良的突变体E351S/D314Y。近年来,Rich等[38]利用EGCase改造所得的糖苷合成酶 (E351S/D314Y) 建立了糖基鞘氨醇和神经节苷脂等的化学-酶法糖基修饰技术,并成功利用α-氟代乳糖供体合成了复杂的海星神经节苷脂LLG-3,产率达到66%。该方法对利用来源自EGCase的糖苷合成酶获得各种具有治疗价值的糖苷神经鞘脂类有重要意义。
2.4 糖蛋白的修饰目前,大多数治疗用的蛋白质都具有特异性糖基化修饰,对蛋白质的生物活性至关重要。借助糖苷合成酶则有可能获得结构相对确定的糖肽和糖蛋白,有利于探索其构效关系,定向获得疗效更好的治疗糖蛋白。内切-β-N-乙酰氨基葡糖苷酶 (ENGase) 能够催化各种糖肽和糖蛋白的N-聚糖β-1, 4-糖苷键水解,并将释放的糖链转移至其他受体形成新的糖苷键。Umekawa等[28]首次将冻土毛霉的ENGase进行改造而得的Y217F突变体可作为糖苷合成酶催化修饰N-糖基化位点。Umekawa等[28]先利用ENGase切除N-糖基化蛋白的原始聚糖,使末端GlcNAc残基离去,然后使用Y217F转移一个均质的N-聚糖恶唑啉至蛋白质,结果糖基化蛋白质的产率可达到70%。Hojo等[39]改造冻土毛霉Endo-M获得的糖苷合成酶N175Q可催化结构复杂的N-聚糖类修饰合成肽Saposin C,产率高达为64%,在不影响肽结构的情况下使Saposin C水溶性大为提高,解决了人工合成肽的溶解性问题。
此外,脓链球菌的Endo-S N322Q突变体同样展示出良好的糖苷合成酶活性,可用于抗体糖基化模式的重构。Huang等[40]先用岩藻糖苷酶从治疗性抗体利妥昔单抗的Fc区域去除异质的N-聚糖,在此基础上,利用Endo-S N322Q突变体通过β-1, 4-糖苷键将完全唾液酸化的N-聚糖或叠氮基标记的聚糖连接利妥昔单抗的Fc区域,赋予了其较强的抗炎症活性。Giddens等[2]发现了两种通过自脑膜败血伊丽莎白金菌的内切糖苷酶F3(Endo-F3) 突变而来的糖苷合成酶 (Endo-F3 D165A和Endo-F3 D165Q),其能高效糖基化修饰利妥昔单抗,产生均质的抗体糖链。与商业抗体相比,糖苷合成酶改造利妥昔单抗显示出更高的半乳凝素-3亲和力,为抗体的糖链重构提供有效措施。
3 糖苷合成酶与小分子化合物的糖基化修饰小分子化合物的糖基化修饰可改善其水溶性,并有可能赋予其新的生物学功能。虽然糖基转移酶在小分子化合物的糖基化修饰中已被广泛应用,但糖供体单一的不足 (多为UDP-G) 造成糖基化衍生物的结构多样性严重受限。因此,糖供体多样性更佳的糖苷合成酶已逐渐被用于合成结构新颖多样的糖修饰化合物,在改善水溶性的同时,拓展新的生物学功能。
3.1 黄酮类化合物的糖基化修饰黄酮类化合物是一类具有2-苯基色原酮 (flavone) 结构的天然化合物,具有一定的抗肿瘤、抗炎、抗菌、抗病毒和治疗心血管系统疾病的活性,但水溶性较差一直困扰着黄酮类化合物的成药开发。鉴于糖苷合成酶糖基化供体的多样性,其在黄酮类化合物的糖基化修饰以改善水溶性,增加新活性等方面的尝试已经开始。特异腐质霉的糖苷酶Cel7B的亲核氨基酸残基谷氨酸被突变成丝氨酸后变成了糖苷合成酶E197S,其可催化氟化糖供体与黄酮类化合物的活性羟基形成糖苷键产生糖基化修饰黄酮,并且糖苷合成酶的催化效率不亚于UDP-G依赖的糖基转移酶。Yang等[41]采用基于质谱的高通量筛选方法考察了糖苷合成酶E197S对20多种氟化糖基供体和80种黄酮受体的特异性。结果显示,当以氟化乳糖作为活性糖供体时,黄芩素、木犀草素、槲皮素以及非瑟酮能够被糖基化修饰,并且糖苷合成酶E197S具新型的区域特异性,糖基化位点为母核结构的4’位和6位的O原子,糖基化产物水溶性显著提高。在此基础上,乳糖修饰的槲皮素经半乳糖苷酶水解去除半乳糖后可以得到具有良好抗口腔癌和抗血栓的绣线菊苷,产率达到90%以上,而该化合物的化学合成产率仅为6%。
3.2 抗生素的糖基化修饰抗生素是由微生物 (包括细菌、真菌、放线菌属) 或高等动植物代谢所产生的一类具有抗菌或其它活性的次级代谢产物,目前已知的天然抗生素不下万种。水溶性差和稳定性低等问题一直困扰着抗生素的开发,增加临床给药方式的复杂性。在不改变治疗效果的前提下,特定位点的糖基修饰是增加抗生素水溶性和临床应用方式方便性的重要方法之一,也是提高抗菌先导化合物成药性的技术手段。Jakeman等[14]为增加大环内酯类抗生素红霉素的水溶性,将GH 3家族的保留型糖苷酶β-D糖苷酶EryBI进行了多点突变,构建了3个EryBI亲核氨基酸残基突变体D257G、D257S和D257A,其中突变体D257G展现出良好的糖苷合成酶活性,能以氟代葡萄糖为活性糖供体,成功地将葡萄糖基添加至红霉素分子,产率达到38%,水溶性明显增加,但仍需进一步改善。核磁共振结果进一步显示葡糖基通过β-糖苷键连接于红霉素脱氧糖胺的2位碳的羟基,通过糖苷合成酶首次实现了难度较大的氨基糖受体的糖基化修饰。此外,糖苷合成酶D257G的底物谱较为宽广,可利用氟代-葡萄糖供体糖基化修饰克拉霉素,使其水溶性显著改善,且产率亦能达到30%以上。
3.3 醇类化合物的糖基化修饰一级醇、二级醇和芳香醇类药物和兴奋剂在人体代谢过程中常被葡萄糖醛酸修饰形成葡萄糖醛酸苷类化合物,因此该类化合物常被用作兴奋剂检测和药物代谢动力学中的目标分子[42]。由于化学方法和UDP-G依赖的糖基转移酶难以特异性的合成葡萄糖醛酸修饰的醇类化合物,所以科学家尝试了糖苷合成酶的酶法合成方法。Wilkinson等[43]对大肠杆菌的β-葡糖醛酸糖苷酶的亲核氨基酸残基谷氨酸突变获得突变体E504G、E504A和E504S,三者均展现出稳定的糖苷合成酶活性,实现一级醇、二级醇和芳香醇类的葡萄糖醛酸修饰。相比之下,糖苷合成酶E504G的活性最佳,底物谱也很广,不仅可以催化分子骨架相对较小的醇类化合物糖基化修饰,还可以α-D-氟代葡萄糖醛酸为活性糖供体催化甾体醇类化合物的高效糖基化,产率高达88%以上,有效地增加了水溶性,防止了自凝聚反应。该类糖苷合成酶的应用为葡萄糖醛酸修饰的醇类药物和兴奋剂的合成和检测提供了可行方法。
4 糖苷合成酶的不足和限制与糖基转移酶相比,糖苷合成酶具有更广的底物谱,可实现更多类型生物大分子和化合物的糖基化修饰,但目前糖苷合成酶仍然存在一些问题有待解决。i.糖供体的活化过程较为复杂,合成成本高。目前糖苷合成酶只能以氟化糖作为糖供体,其合成过程涉及乙酰基保护、亲核取代和脱乙酰基保护等步骤,产率较难控制。ii.脱保护的氟化糖的稳定性不佳,在水溶液中易分解。氟化糖羟基的乙酰化一旦脱除,其在水溶液中容易发生降解,影响整体反应进程,降低反应效率。iii.糖苷合成酶保留了部分水解酶活性。虽然糖苷合成酶是糖苷水解酶的亲核催化残基突变产物,但有些糖苷合成酶未彻底丧失水解酶活性,造成糖苷键的合成与水解始终处于动态变化过程,使目标产物的得率难以提高[44]。针对上述问题,作者认为采用定向进化和理性改造手段,对糖苷合成酶进行系统改造以改变其催化特征,使其能直接利用酸性氨基酸残基来质子化非氟化糖供体的碳原子,或者利用碱性氨基酸残基使底物上的氧原子去质子化,然后通过亲核反应完成底物的糖基化修饰。该反应特性既可避免使用稳定性差的氟化糖为供体,又利于降低目标产物的合成成本,提高产业化应用的可行性。与此同时,筛选糖苷合成酶活性中心外与水解活性相关的氨基酸残基并系统突变,获得水解活性完全丧失和糖苷合成活性提高的突变体,从而提高其在实际应用中的催化效率。
5 展望本文概述了糖苷合成酶的来源、催化机理和潜在应用等方面内容,展现了糖苷合成酶在生物大分子和化合物糖基化修饰中的重要作用。目前糖苷合成酶的研究处在“原理验证”阶段,且存在一些有待解决的难题如糖供体稳定差、活力低、产业化应用难等,但是其已经成为科学家们糖基化修饰目标分子以增加水溶性,实现结构和生物活性多样性的重要工具之一。工业化应用的糖苷合成酶应具有酶稳定性好、催化效率高、底物谱广和糖供体稳定易得等优点,但是每一种工业酶的开发过程都需要经过不断的改进和完善。因此,理想糖苷合成酶的获取仍需要依赖于相关科学技术的突破性发展和科学研究者们的不断努力。
| [1] |
COBUCCI-PONZANO B, MORACCI M. Glycosynthases as tools for the production of glycan analogs of natural products[J]. Natural Product Reports, 2012, 29(6): 697-709. DOI:10.1039/c2np20032e |
| [2] |
GIDDENS J P, LOMINO J V, AMIN M N, et al. Endo-F3 glycosynthase mutants enable chemoenzymatic synthesis of core-fucosylated triantennary complex type glycopeptides and glycoproteins[J]. Journal of Biological Chemistry, 2016, 291(17): 9356-9370. DOI:10.1074/jbc.M116.721597 |
| [3] |
PENGTHAISONG S, KETUDAT CAIRNS J R. Effects of active site cleft residues on oligosaccharide binding, hydrolysis, and glycosynthase activities of rice BGlu1 and its mutants[J]. Protein Science, 2014, 23(12): 1738-1752. DOI:10.1002/pro.v23.12 |
| [4] |
KIM Y W, LEE S S, WARREN R A J, et al. Directed evolution of a glycosynthase from Agrobacterium sp^increases its catalytic activity dramatically and expands its substrate repertoire[J]. The Journal of Biological Chemistry, 2004, 279(41): 42787-42793. DOI:10.1074/jbc.M406890200 |
| [5] |
COBUCCI-PONZANO B, PERUGINO G, STRAZZULLI A, et al. Thermophilic glycosynthases for oligosaccharides synthesis[J]. Methods in Enzymology, 2012, 510: 273-300. DOI:10.1016/B978-0-12-415931-0.00015-X |
| [6] |
MACKENZIE L F, WANG Q P, WARREN R A J, et al. Glycosynthases:Mutant glycosidases for oligosaccharide synthesis[J]. Journal of the American Chemical Society, 1998, 120(22): 5583-5584. DOI:10.1021/ja980833d |
| [7] |
MORACCI M, TRINCONE A, ROSSI M. Glycosyntha-ses:New enzymes for oligosaccharide synthesis[J]. Journal of Molecular Catalysis B Enzymatic, 2001, 11(4/5/6): 155-163. |
| [8] |
PERUGINO G, TRINCONE A, GIORDANO A, et al. Activity of hyperthermophilic glycosynthases is significantly enhanced at acidic pH[J]. Biochemistry, 2003, 42(28): 8484-8493. DOI:10.1021/bi0345384 |
| [9] |
FAIJES M, SAURA-VALLS M, PÉREZ X, et al. Acceptor-dependent regioselectivity of glycosynthase reactions by Streptomyces, E383A β-glucosidase[J]. Carbohydrate Research, 2006, 341(12): 2055-2065. DOI:10.1016/j.carres.2006.04.049 |
| [10] |
HOMMALAI G, WITHERS S G, CHUENCHOR W, et al. Enzymatic synthesis of cello-oligosaccharides by rice BGlu1 β-glucosidase glycosynthase mutants[J]. Glycobiology, 2007, 17(7): 744-753. DOI:10.1093/glycob/cwm039 |
| [11] |
NASHIRU O, ZECHEL D L, STOLL D, et al. β-Mannosynthase:Synthesis of β-mannosides with a mutant β-mannosidase[J]. Angewandte Chemie International Edition, 2001, 40(2): 417-420. DOI:10.1002/(ISSN)1521-3773 |
| [12] |
JAKEMAN D L, WITHERS S G. On expanding the repertoire of glycosynthases:Mutant β-galactosidases forming β-(1, 6)-linkages[J]. Canadian Journal of Chemistry, 2002, 80(8): 866-870. DOI:10.1139/v02-077 |
| [13] |
WILKINSON S M, WATSON M A, WILLIS A C, et al. Experimental and kinetic studies of the Escherichia coli glucuronylsynthase:An engineered enzyme for the synthesis of glucuronide conjugates[J]. The Journal of Organic Chemistry, 2011, 76(7): 1992-2000. DOI:10.1021/jo101914s |
| [14] |
JAKEMAN D L, SADEGHI-KHOMAMI A. A β-(1, 2)-glycosynthase and an attempted selection method for the directed evolution of glycosynthases[J]. Biochemistry, 2011, 50(47): 10359-10366. DOI:10.1021/bi201438q |
| [15] |
OKUYAMA M, MORI H, WATANABE K, et al. α-Glucosidase mutant catalyzes "α-Glycosynthase"-type reaction[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(4): 928-933. DOI:10.1271/bbb.66.928 |
| [16] |
BEN-DAVID A, BRAVMAN T, BALAZS Y S, et al. Glycosynthase activity of Geobacillus stearothermophilus GH52 β-xylosidase:Efficient synthesis of xylooligosaccharides from α-D-xylopyranosyl fluoride through a conjugated reaction[J]. ChemBioChem, 2007, 8(17): 2145-2151. DOI:10.1002/(ISSN)1439-7633 |
| [17] |
SPADIUT O, IBATULLIN F M, PEART J, et al. Building custom polysaccharides in vitro with an efficient, broad-specificity xyloglucan glycosynthase and a fucosyltransferase[J]. Journal of the American Chemical Society, 2011, 133(28): 10892-10900. DOI:10.1021/ja202788q |
| [18] |
FORT S, BOYER V, GREFFE L, et al. Highly efficient synthesis of β (1→4)-oligo-and-polysaccharides using a mutant cellulase[J]. Journal of the American Chemical Society, 2000, 122(23): 5429-5437. DOI:10.1021/ja9936520 |
| [19] |
SUGIMURA M, NISHIMOTO M, KITAOKA M. Ch-aracterization of glycosynthase mutants derived from glycoside hydrolase family 10 xylanases[J]. Bioscience, Biotechnology, and Biochemistry, 2006, 70(5): 1210-1217. DOI:10.1271/bbb.70.1210 |
| [20] |
GULLFOT F, IBATULLIN F M, SUNDQVIST G, et al. Functional characterization of xyloglucan glycosynthases from GH7, GH12, and GH16 scaffolds[J]. Biomacromolecules, 2009, 10(7): 1782-1788. DOI:10.1021/bm900215p |
| [21] |
VAN LIESHOUT J, FAIJES M, NIETO J, et al. Hyd-rolase and glycosynthase activity of endo-1, 3-β-glucanase from the thermophile Pyrococcus furiosus[J]. Archaea, 2004, 1(4): 285-292. DOI:10.1155/2004/731548 |
| [22] |
HRMOVA M, IMAI T, RUTTEN S J, et al. Mutated barley (1, 3)-β-D-glucan endohydrolases synthesize crystalline (1, 3)-β-D-glucans[J]. The Journal of Biological Chemistry, 2002, 277(33): 30102-30111. DOI:10.1074/jbc.M203971200 |
| [23] |
FUJIKAWA S I, OHMAE M, KOBAYASHI S. Enzymatic synthesis of chondroitin 4-sulfate with well-defined structure[J]. Biomacromolecules, 2005, 6(6): 2935-2942. DOI:10.1021/bm050364p |
| [24] |
GLOSTER T M, TURKENBURG J P, POTTS J R, et al. Divergence of catalytic mechanism within a glycosidase family provides insight into evolution of carbohydrate metabolism by human gut flora[J]. Chemistry & Biology, 2008, 15(10): 1058-1067. |
| [25] |
KOSHLAND JR D E. Stereochemistry and the mechanism of enzymatic reactions[J]. Biological Reviews, 1953, 28(4): 416-436. DOI:10.1111/brv.1953.28.issue-4 |
| [26] |
WANG Q P, GRAHAM R W, TRIMBUR D, et al. Changing enzymatic reaction mechanisms by mutagenesis:Conversion of a retaining glucosidase to an inverting enzyme[J]. Journal of the American Chemical Society, 1994, 116(25): 11594-11595. DOI:10.1021/ja00104a060 |
| [27] |
MACAULEY M S, WHITWORTH G E, DEBOWSKI A W, et al. O-GlcNAcase uses substrate-assisted catalysis:Kinetic analysis and development of highly selective mechanism-inspired inhibitors[J]. The Journal of Biological Chemistry, 2005, 280(27): 25313-25322. DOI:10.1074/jbc.M413819200 |
| [28] |
UMEKAWA M, HUANG W, LI B, et al. Mutants of Mucor hiemalis endo-β-N-acetylglucosaminidase show enhanced transglycosylation and glycosynthase-like activities[J]. The Journal of Biological Chemistry, 2008, 283(8): 4469-4479. DOI:10.1074/jbc.M707137200 |
| [29] |
HONDA Y, KITAOKA M. The first glycosynthase derived from an inverting glycoside hydrolase[J]. The Journal of Biological Chemistry, 2006, 281(3): 1426-1431. DOI:10.1074/jbc.M511202200 |
| [30] |
RAWAT M, GAMA C I, MATSON J B, et al. Neuroactive chondroitin sulfate glycomimetics[J]. Journal of the American Chemical Society, 2008, 130(10): 2959-2561. DOI:10.1021/ja709993p |
| [31] |
GODDARD-BORGER E D, FIEGE B, KWAN E M, et al. Glycosynthase-mediated assembly of xylanase substrates and inhibitors[J]. ChemBioChem, 2011, 12(11): 1703-1711. DOI:10.1002/cbic.v12.11 |
| [32] |
KIM Y W, FOX D T, HEKMAT O, et al. Glycosynthase-based synthesis of xylo-oligosaccharides using an engineered retaining xylanase from Cellulomonas fimi[J]. Organic & Biomolecular Chemistry, 2006, 4(10): 2025-2032. |
| [33] |
BLIBECH M, CHAARI F, BHIRI F, et al. Production of manno-oligosaccharides from locust bean gum using immobilized Penicillium occitanis mannanase[J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 73(1/2/3/4): 111-115. |
| [34] |
JAHN M, STOLL D, WARREN R A J, et al. Expansion of the glycosynthase repertoire to produce defined manno-oligosaccharides[J]. Chemical Communications, 2003(12): 1327-1329. DOI:10.1039/B302380J |
| [35] |
FAIJES M, IMAI T, BULONE V, et al. In vitro synthesis of a crystalline (1→3, 1→4)-beta-D-glucan by a mutated (1→3, 1→4)-beta-D-glucanase from Bacillus[J]. Biochemical Journal, 2004, 380(3): 635-41. DOI:10.1042/bj20040145 |
| [36] |
CODERA V, EDGAR K J, FAIJES M, et al. Functionalized celluloses with regular substitution pattern by glycosynthase-catalyzed polymerization[J]. Biomacromolecules, 2016, 17(4): 1272-1279. DOI:10.1021/acs.biomac.5b01453 |
| [37] |
VAUGHAN M D, JOHNSON K, DEFREES S, et al. Glycosynthase-mediated synthesis of glycosphingolipids[J]. Journal of the American Chemical Society, 2006, 128(19): 6300-6301. DOI:10.1021/ja058469n |
| [38] |
RICH J R, WITHERS S G. A chemoenzymatic total synthesis of the Neurogenic starfish ganglioside LLG-3 using an engineered and evolved synthase[J]. Angewandte Chemie International Edition, 2012, 51(34): 8640-8643. DOI:10.1002/anie.201204578 |
| [39] |
HOJO H, TANAKA H, HAGIWARA M, et al. Chemoenzymatic synthesis of hydrophobic glycoprotein:Synthesis of saposin C carrying complex-type carbohydrate[J]. The Journal of Organic Chemistry, 2012, 77(21): 9437-9446. DOI:10.1021/jo3010155 |
| [40] |
HUANG W, GIDDENS J, FAN S Q, et al. Chemoenz-ymatic glycoengineering of intact IgG antibodies for gain of functions[J]. Journal of the American Chemical Society, 2012, 134(29): 12308-12318. DOI:10.1021/ja3051266 |
| [41] |
YANG M, DAVIES G J, DAVIS B G. A glycosynthase catalyst for the synthesis of flavonoid glycosides[J]. Angewandte Chemie International Edition, 2007, 46(21): 3885-3888. DOI:10.1002/(ISSN)1521-3773 |
| [42] |
WELLS P G, MACKENZIE P I, CHOWDHURY J R, et al. Glucuronidation and the UDP-glucuronosyltransferases in health and disease[J]. Drug Metabolism and Disposition, 2004, 32(3): 281-290. DOI:10.1124/dmd.32.3.281 |
| [43] |
WILKINSON S M, LIEW C W, MACKAY J P, et al. Escherichia coli glucuronylsynthase:an engineered enzyme for the synthesis of β-glucuronides[J]. Organic Letters, 2008, 10(8): 1585-1588. DOI:10.1021/ol8002767 |
| [44] |
SHIM J H, CHEN H M, RICH J R, et al. Directed evolution of a β-glycosidase from Agrobacterium sp^to enhance its glycosynthase activity toward C3-modified donor sugars[J]. Protein Engineering Design and Selection, 2012, 25(9): 465-472. DOI:10.1093/protein/gzs045 |
 2017, Vol. 24
2017, Vol. 24 


