2. 清华大学化学工程系生物化工研究所,工业生物催化教育部重点实验室,北京 100084;
3. 清华大学合成与系统生物学中心,北京 100084
2. MOE Key Laboratory of Industrial Biocatalysis, Institute of Biochemical Engineering, Department of Chemical Engineering, Tsinghua University, Beijing, 100084, China;
3. Center for Synthetic and Systems Biology, Tsinghua University, Beijing, 100084, China
黄嘌呤氧化酶 (Xanthine oxidase,简称XOD,EC 1.17.3.2) 是一种包含[2Fe-2S]簇、钼蝶呤和黄素辅基的复杂氧化还原酶类,可以利用分子氧作为电子受体或者亚甲基蓝、苯醌、高铁氰化物和硝酸盐等人工电子受体催化氧化嘌呤、蝶呤和醛类等多种杂环化合物底物sp2杂化碳原子,伴随产生过氧化氢和超氧化物自由基等活性氧类[1]。已有的研究表明,XOD是由前体蛋白-黄嘌呤脱氢酶 (Xanthine dehydrogenase,简称XDH,EC 1.17.1.4) 经过翻译后修饰转化而来,XDH利用氧化型黄素腺嘌呤核苷二磷酸 (NAD+) 作为电子受体。两者统称为黄嘌呤氧化还原酶 (Xanthine oxidoreductase,简称XOR)。XOR的研究最早可以追溯到1902年Schardinger[2]首次报道牛奶XDH氧化甲醛反应。20世纪70年代开始,人们已经可以从牛奶中提取生产XOD,并随后作为模式酶之一广泛用于基础和应用研究中[3]。经过110多年的发展,人们已经系统掌握了XOR的结构与功能、催化过程及代谢途径、合成与调控机制。同时开展了XOR在嘌呤类物质代谢、H2O2、过氧化物等活性氧的产生及其在生理病理条件下的功能研究。目前XOR研究重点主要包括两个方面的内容:1) XOR与高尿酸血症、痛风、心血管疾病等关系研究、基于XOD靶点的抑制剂药物设计,以及对新基因的挖掘及其功能鉴定[4-10];2) 酶 (联) 法检测疾病标志物、核苷类药物合成、环境中有机污染物的检测和生物修复、生物传感器以及低嘌呤食品生产[11-15]。然而,随着应用领域的不断扩展,商品化XOD仍然面临着酶种类少、酶催化活性不高、生产效率低下的问题。因此,有必要从高活性XOD新酶的挖掘、酶学性质的改造以及基于生物合成和调控机制高产XOD 3个方面研究和开发新型XOD及其生产技术。从基因、蛋白、生物合成和调控过程、催化机制以及XOD的生产现状与应用前景角度系统总结活性XOD,将为研究这种新型高活性XOR及其生产方法提供有益的借鉴和指导,然而国内外已有的XOR综述主要围绕抑制剂的设计、生理病理作用展开[6-7, 9, 16],尚未见到对活性XOD的基础和应用研究现状及发展前景的系统总结。基于此,本文系统综述XOD的研究进展及其应用前景,简述其生物合成、催化机制、生产现状以及在工业、医疗检测和健康食品领域的应用,探讨XOD基础和应用研究存在的问题并提出发展建议。
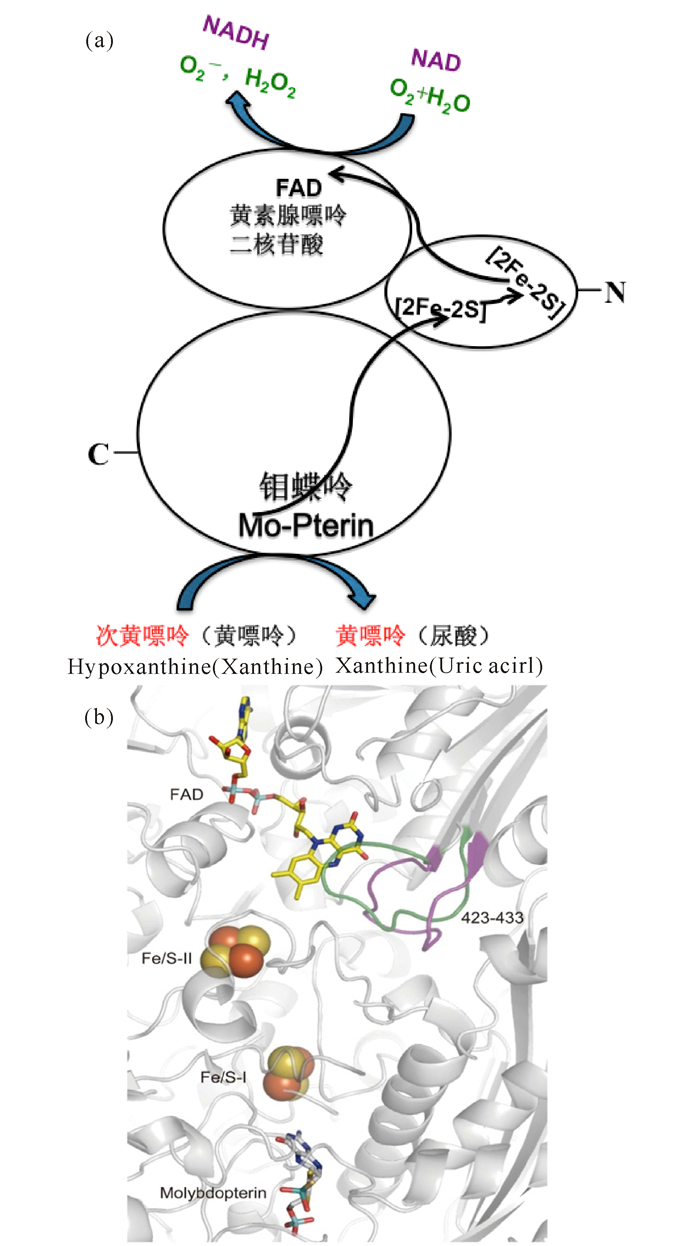
1 黄嘌呤氧化酶的基因、结构、催化机制与生物合成 1.1 黄嘌呤氧化酶的编码基因和蛋白结构作为翻译后修饰产物,XOD与其前体蛋白XDH由同一基因编码而来[17]。截止2017年1月,GenBank数据库收录了超过12万条XDH基因,其来源宿主包括真细菌、真核生物和古细菌所有三界生物系统,其中绝大部分为细菌XDH[18]。目前,已有数十个真核和细菌的XDH的酶学性质得到了研究[2],但尚未见到极端微生物、宏基因组以及病毒来源XDH的酶学表征结果[10, 18]。自从2000年首次报道牛奶XOD的晶体结构,截止目前蛋白质晶体结构数据库 (PDB) 中仅收录了鼠和人的XOD,以及来源于牛奶和荚膜红细菌的XDH晶体结构。尽管XOR在基因、蛋白和亚基组成上展示了丰富的多样性,但是其结构相似、催化机制相同[18]。如图 1所示,XOD与XDH均含有2个[2Fe-2S]簇中心 (N端),1个黄素腺嘌呤二核苷酸FAD中心 (中间域) 和一个1钼蝶呤中心 (C端),4个氧化还原中心几乎呈线性排列,结构区别仅在于FAD结合部位 (图 1b)。XOD中FAD区域附近柔环阻塞了NAD+的进入,但不影响分子O2的进入,从而使XOD能以O2为电子受体,而XDH优选NAD+为电子受体[20]。相对于XDH利用昂贵的NAD+作为电子受体而言,可以直接利用空气中O2作为电子受体的XOD成为商业用酶的首选。XOD和XDH利用不同电子受体催化相同底物反应的特性,使其成为研究氧化还原酶类蛋白质结构与功能关系的理想模型[21]。
|
(a) 单体XOD/XDH结构及催化过程中电子传递示意图;(b) 牛奶XOD (PDB ID:1FIQ) 与XDH (PDB ID:1FO4) 结构叠合图。FAD结合区域附近的423-433环分别用紫色 (XDH) 和绿色 (XOD) 表示 (a) Schematic diagram of domain structures of XOD/XDH and their electric transfer pathway; (b) Structural superimposition of bovine milk XOD (PDB ID:1FIQ) and XDH (PDB ID:1FO4).The loop consisting of 423-433 amino acid residues of FAD binding domain of XOD and XDH are colored by green and purple, respectively 图 1 黄嘌呤氧化酶/脱氢酶结构及其辅因子分布示意图[19] Fig.1 Schematic diagram of redox center domains of xanthine oxidoreductase[19] |
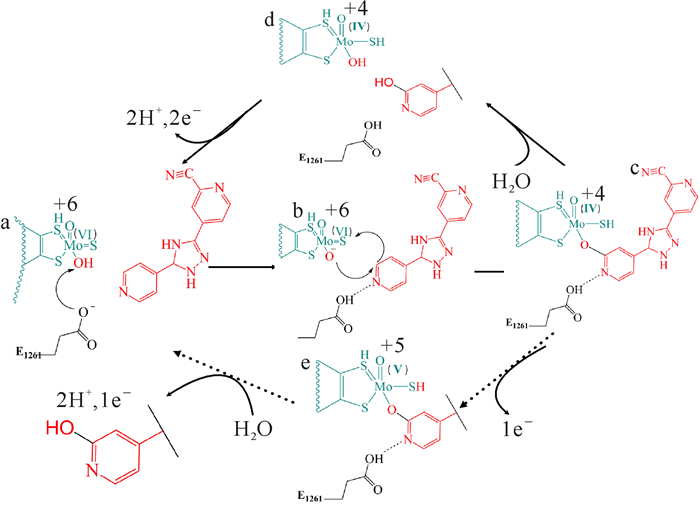
XOD的催化过程包括两个偶联的步骤:1) 底物在活性中心 (钼蝶呤氧化还原中心) 氧化加氧;2) 电子从底物依次通过钼蝶呤、两个铁硫簇和FAD 3个氧化还原中心传递到电子受体过程 (图 1)。晶体学和光谱学实验表明,XOR催化氧化插入产物的氧原子来自水而不是分子氧[22]。如图 2所示,XOD的催化反应机制由E1261(牛XOD中标记号) 作为催化碱基辅助Mo-OH亲核进攻底物杂环sp2杂化碳原子,随后氢转移产生反应中间体 (图 2c)。氧化态XOD的Mo-OH (图 2a) 处于催化不稳定状态,它通过 (在催化碱E1261的辅助下) 亲核进攻碳原子 (将被羟基化的sp2杂化碳原子) 启动催化反应,同时伴随着氢的转移 (图 2a和b)。该过程将氧化态酶的Mo (Ⅵ)=S还原成为Mo (Ⅳ)-SH (图 2c),而同时产物通过新引入的羟基基团共价偶联到钼原子上。反应中间物 (图 2c) 通过d或e两个途径 (两者比例随底物的不同而发生变化) 氧化生成产物,并使酶回到原始状态以进入下一轮循环。例如,在黄嘌呤作为底物时,产物解离大多发生在Mo (Ⅴ) 水平,Mo (Ⅳ) 复合体发生单电子氧化 (经过图 2e)。底物类似物FYX-051作为底物时,产物从Mo (Ⅳ) 酶离开后,2个电子才从钼中心传递到其他氧化还原活性中心 (经过图 2d)。
1.3 黄嘌呤氧化酶的生物合成及调控机制活性XOD的合成主要包括3个环节:XDH酶蛋白的生产、辅因子的正确组装和XDH向XOD的转化 (参考文献[18]中图 3)。其中,氧化还原中心的形成与组装是影响活性状态的关键。[2Fe-2S]簇的生物合成包括3个过程:[2Fe-2S]簇组装进“脚手架”蛋白 (Scaffolding protein),铁硫簇从脚手架蛋白转移进目标蛋白和[2Fe-2S]簇结构域蛋白的成熟。该过程必需半胱氨酸脱硫酶 (Cysteine desulfurase) 和铁硫簇“脚手架”蛋白的参与[23-25]。IscS是一个重要的L-半胱氨酸脱硫酶,参与铁硫簇合成、硫胺素合成和tRNA硫修饰过程。在大肠杆菌中,IscS通过与不同的配体相结合介导,将L-半胱氨酸中硫转移用于合成铁硫簇蛋白、钼蝶呤等几种重要功能生物分子。而TusA是一个小的硫载体蛋白,与IscS发生相互作用。tusA基因对于含钼蛋白及其代谢通路具有全局性调控作用,IscS/TusA复合体在钼蛋白中发挥独特的传递硫作用[24-25]。Leimkühler等[26-27]发现荚膜红细菌 (Rhodobacter capsulatus) XDHC对于XDH蛋白的重组表达合成与组装,特别使钼辅因子的插入起到了关键作用。Ivanov等[28-29]和笔者[30]的研究工作表明,XDHC对表达活性XDH必不可少,而xdhC与xdhAB的共表达可以获得高活力XDH。

|
图 3 生物合成黄嘌呤氧化还原酶的区域化调控机制 Fig.3 Regional regulation of biosynthesis of xanthine oxidoreductase |
活性XDH可以通过两种方式翻译后修饰成为活性XOD:氧化生成二硫键导致的可逆转变和部分酶解断裂引起的不可逆转变。目前商品化XOD的生产是采用体外自然氧化或者加入巯基氧化剂如二巯基嘧啶 (DTE) 方式形成二硫键,然后通过蛋白酶有限裂解方式获得不可逆状态的活性XOD。但该方法存在生产步骤多、效率低、过程难以控制等问题,无法从根本上提高具有活性的XOD产量。大量的研究表明,伴侣蛋白二硫键异构酶 (DPI) 或者调控氧化还原电位促进二硫键的形成,有助于改善含二硫键酶的活性。2013年,Ringel等[31]发现Neurospora carssa钼蛋白硝酸还原酶各氧化还原中心之间相互独立合成与组装,这为同样属于钼氧化还原酶家族的XOD的合成提供了借鉴。如图 3所示,笔者基于独立地调控XOR各氧化还原中心产生与装配的思路,提出了一种体内源头辅助装配XOR的细胞工厂设计策略,即通过过表达调控各“区域”的关键辅助蛋白,辅助活性XOR的合成与装配,构建了高产活性XOR的细胞工厂 (尚未发表)。
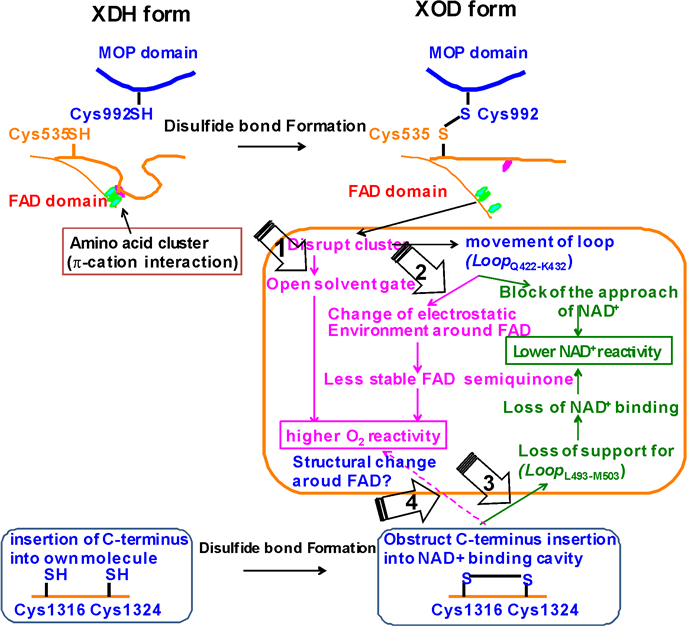
1.4 黄嘌呤脱氢酶转变成黄嘌呤氧化酶的机制XDH转变成XOD的结构基础在于电子受体区域中NAD+结合区转变成为与O2反应的构型,实现电子受体替代。活性XOD和XDH具有相同的电子传递系统 (图 1a),但电子受体区域黄素半醌/氢醌对 (Esq/hq) 氧化还原电位差为~170 mV,这造成XDH优选NAD+作为电子传递系统最终的电子受体底物,而XOD只接受氧气[19]。实验与基于晶体结构的理论计算结果表明,XDH与XOD的氧化还原电位差值绝大部分贡献来自靠近FAD结合位点附近的柔环氨基酸 (LoopQ422-K432),其构型改变造成半醌状态的稳定性改变[19]。如图 4中箭头所示,转变成XOD的关键结构因素还包括[32]:1) 打开溶剂通道以利于O2进入活性位点 (FAD结合区域)(箭头1);2) 改变FAD结合区域氨基酸电荷组成和静电环境,降低FAD半醌稳定性,增加与O2的反应活性 (箭头2),同时阻塞NAD+进入活性位点,从而降低NAD+反应活性;3) 使结合NAD+的柔环 (LoopL493-M503) 丧失支撑作用,从而丧失NAD+结合能力 (箭头3);同时4) 改变FAD结构域微环境、增强与O2的反应活性 (箭头4)。因此,针对XDH转化成XOD机制的核心要素 (图 4中箭头所指),选择电子受体区域关键氨基酸残基,特别是柔环 (LoopQ422-K432) 区域,获取稳定性降低的半醌状态FAD,将是通过理性设计和定向进化等蛋白质工程技术改造XOD酶学特性的关键。
|
橙色方框内箭头1,2,3和4分别指示脱氢酶转变成氧化酶形式结构转变的4个核心要素;虚线细箭头指示需要进一步证实;紫色部分指代对氧气反应活性增加的因素,绿色部分指代对NAD+反应活性降低的因素;MOP为钼蝶呤简写;SH为巯基基团 The arrows in the orange box indicate the four key steps in converting from XDH to XOD, the dotted line with an arrow means needing further evidence; the purple parts are responsible for the higher reactivity toward O2, and the green factors contribute to the lower activity toward NAD+; MOP and SH are short for molybdopterin and sulfhydryl group, respectively 图 4 黄嘌呤脱氢酶转变成氧化酶的机制[33] Fig.4 Mechanism for converting from xanthine dehydrogenase to xanthine oxidase[33] |
如图 5所示,XOR是生物体内嘌呤代谢关键酶。生物体内核酸经核酸酶降解生成核苷酸,其中嘌呤核苷酸类在核苷酸酶和核苷磷酸化酶的依次作用下生成4种嘌呤碱基 (鸟嘌呤、腺嘌呤、黄嘌呤和次黄嘌呤)。XOR催化嘌呤碱基生成尿酸是生物体内嘌呤代谢的关键节点,其中包括人类在内的灵长类等动物体内缺乏将尿酸进一步降解生成尿囊素的尿酸酶,因此只能以尿酸的形式排出,而在其他哺乳类动物、腹足类动物和龟体内,尿酸氧化酶将尿酸氧化成为尿囊素排出体外。硬骨鱼类进一步在尿囊素酶作用下,将尿囊素氧化成尿囊酸排泄体外。鱼类、两栖类和淡水瓣鳃类中以尿素形式排出,在甲壳类和咸水瓣鳃类中以氨气和二氧化碳形式排出 (图 5蓝色线框部分)。相对于溶解度极低的尿酸而言,下游代谢途径生成的尿囊素、尿囊酸、尿素等水溶性很大,所以在以这些代谢产物形式排泄的动物体内不会沉积,可以消除患痛风的风险。XOD及其包括尿酸氧化酶等在内的下游代谢途径实现核酸、核苷酸、嘌呤碱基和ATP等嘌呤类物质的彻底降解。
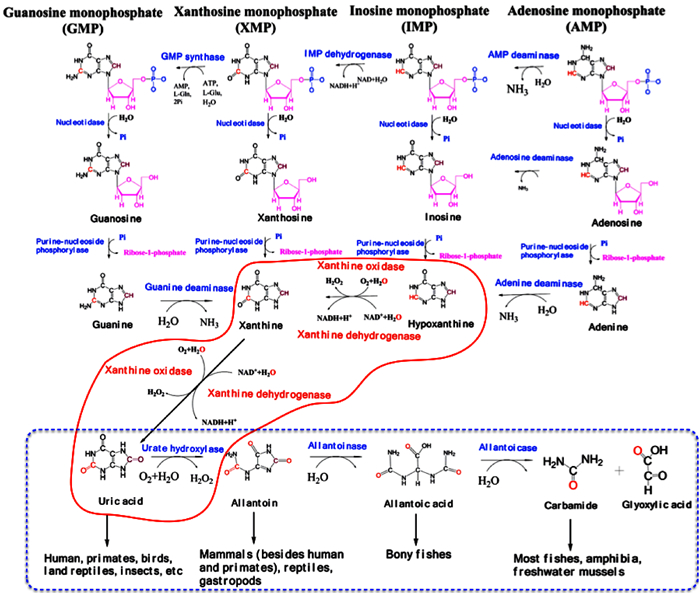
|
红色曲线框内为黄嘌呤氧化酶/脱氢酶参与的催化过程;蓝色虚线框为不同动物体内嘌呤碱代谢的终端产物及排泄方式 The red box indicates the metabolic processes catalyzed by xanthine oxidase/dehydrogenase, the blue dashed box shows the final products and excretion pathways of different animals 图 5 以黄嘌呤氧化酶/脱氢酶为核心的嘌呤代谢途径 Fig.5 Catabolic pathway of purines based on xanthine oxidoreductase |
XOD在生物体内发挥了一系列重要的生理和病理作用。在人等灵长类哺乳动物中,XOD功能异常造成的高尿酸血症是造成痛风的主要原因,而对杂环化合物的氧化降解实现药物和有害中间代谢产物解毒的重要功用。此外,XOD作为一个主要的氧化酶产生超氧自由基和过氧化氢分子,它们的升高会造成氧化应激损伤、代谢综合症和诸如高血压等心血管疾病和缺血再灌注损伤[34]。特别是近年来,XOD在生理和病理情况下产生活性氧 (Reactive oxygen species, ROS) 和一氧化氮 (Nitric oxide, NO) 的生理作用研究也得到重视[35]。在基础医学理论研究中,XOD被用于探讨自由基分子损伤机理发生、先天免疫诱发炎症及杀菌作用的模型酶和痛风治疗的靶点酶[36-37]。然而,XOD的结构复杂性、特定的组织分布特性和高度调控性表明,XOD还具有其他尚未完全鉴定的功能有待进一步阐述[18]。
2.3 黄嘌呤氧化酶缺乏造成的疾病1954年Dent和Philpot[38]首次正式报道了黄嘌呤尿症,也被称为黄嘌呤氧化酶缺失症,它是一种由于黄嘌呤积累造成的罕见的遗传紊乱病。黄嘌呤尿包括两种临床症状相似但产生原因根本不同的两种形式:Ⅰ型由缺乏XDH/XOD造成,而Ⅱ型由同时缺乏XDH/XOD和醛氧化酶所致[39]。Ⅰ型病人可以代谢XOD抑制剂别嘌呤醇 (Allopurinol),而Ⅱ型病人不能。患者通常血液和尿液中含有高浓度黄嘌呤,易于形成肾衰竭和黄嘌呤肾结石,而血清和尿液中尿酸含量明显减少。目前,黄嘌呤尿症除了多摄入液体、避免高嘌呤食物外,无特异性治疗方法。XDH/XOD缺乏症的相关研究还包括低尿酸血症,先天性代谢缺陷,尿结石病,肾结石,肾功能衰竭,钼黄素蛋白结合酶缺乏症等。
3 黄嘌呤氧化酶的生产现状最早的XOR产品是牛奶XOD,可以追溯至1970年代,目前仍然是市场上最重要的商业化产品[3]。其他商品化XOR主要包括龟甲万公司 (Kikkoman Company) 生产的E.cloacae XOD和东洋纺公司 (Toyobo Company) 提供的A.luteus XOD[40-41](表 1)。然而,这些商业化产品提取自天然宿主,通常混杂有大量非活性状态XOD或前体蛋白XDH,包括脱硫、脱钼或脱其他氧化还原中心的失活形态XOD/XDH[35]。一些XDH基因已经被克隆并在异源宿主中表达,包括在昆虫细胞表达系统中表达鼠肝脏XDH,在毕赤酵母中表达拟南芥XDH,以及在大肠杆菌中表达荚膜红细菌XDH[27, 42-43]。甚至,Sigma公司提供一种据称为重组大肠杆菌XOD。然而,从表 1可以看出,与其他工业用酶相比,已有的商品化XOD仍然存在以下3个方面的问题:1) 酶活性相对较低,大概为20 s-1,远低于常规工业生产用酶,后者通常具有成百上千的转化数;2) 酶生产装配效率低下、活性态与非活性态混杂;3) 活性XOD的生产依赖于提取法,多步生物合成过程及纯化步骤造成生产成本高。因此,亟需进一步研发高活性XOD并改进活性XOD的生产效率的技术。笔者分别从鲍氏不动杆菌和荚膜红细菌中克隆鉴定出新的高活性XDH酶基因,并通过理性设计截断体的方法大大提高了荚膜红细菌XDH的酶活力和温度耐受性,获得了迄今为止报道的最高催化活性[10, 30]。
| 表 1 部分商品化黄嘌呤氧化酶和3种细菌黄嘌呤脱氢酶比较[44] Table 1 Comparison of partial commercial XOD products and three bacterial XDHs[44] |
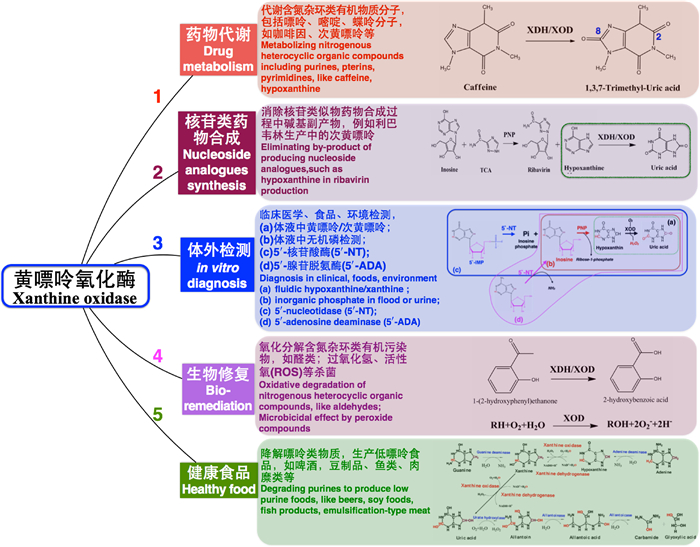
如图 6所示,XOD的潜在应用领域包括:1) 药物代谢降解杂环化合物,诸如咖啡因和次黄嘌呤;2) 核苷类药物的工业化生产,消除副反应和副产物;3) 临床、食品和环境中嘌呤类和嘌呤相关酶的检测和诊断;4) 生物修复,降解有害杂环类化合物;5) 健康食品工业领域,低嘌呤食品的制备。其中,核苷类药物合成的一个重要应用是生物酶法生产利巴韦林[46]。XOR通过及时移除副产物次黄嘌呤,从而将反应平衡向生成产物利巴韦林的方向偏移,增加生产效率[13, 47]。临床检测的一个重要的应用,是酶法检测“痛风”相关疾病的标志物——体液中黄嘌呤和次黄嘌呤含量,以及通过与其他酶如嘌呤核苷磷酸化酶和尿酸酶联用,检测其他疾病标志物如无机磷、5′-核苷酸酶和腺苷脱氨酶。前4种应用已经在笔者近期发表的综述文章[18]中得到阐述,本文接下来将介绍XOD在降低食品中嘌呤类物质含量的应用前景。
近年来,伴随着饮食模式由传统粮谷类为主逐渐转变为高热量、高蛋白、高脂肪的膳食模式,我国人民痛风发病率逐年上升,而发病年龄呈下降趋势。低嘌呤饮食对提高痛风病人缓解率,降低血尿酸浓度具有较好的疗效[48]。一个新的发展思路是仿造生物体内嘌呤类物质天然代谢途径 (图 5),对食品中嘌呤进行充分降解和开发利用。该思路的一个前瞻性应用案例是,2015年胡勇等[15]利用来源于节杆菌ATCC21606的XOD降解蘑菇的嘌呤碱基,制造一种低嘌呤、富含氨基酸和维生素D的食用菌醋。采用超声波破碎制备蘑菇破碎液,使核酸与蛋白质充分分离,便于核酸的降解;同时,高压破碎节杆菌ATCC21606释放其内源的XOD,达到充分降解各种嘌呤碱 (腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤) 的目的。
目前,已有低嘌呤啤酒的开发方式包括以下4类:1) 减少原料中核酸含量,例如用小麦芽代替大麦芽,增加其他谷物和糖浆等替代性辅料的添加量,麦芽脱种胚芽处理[49-50];2) 通过生物或物理化学方法,例如酸、碱和温度调控释放出游离的嘌呤类物质[51],强化酵母对游离嘌呤的同化吸收,降低啤酒中嘌呤含量[52-55];3) 通过生物发酵和过滤吸附等措施来降低嘌呤的含量[52],例如发酵中利用麦根、米曲霉、枯草芽孢杆菌等来源核酸酶降解残余的核酸物质[55-56],通过酸性吸附剂、沸石、硅藻土、活性炭等吸附移除嘌呤类物质[49, 51, 57];4) 通过常压室温等离子体 (ARTP) 诱变育种技术选育能够快速代谢利用麦汁中嘌呤并减少酵母自溶出嘌呤的低嘌呤酵母,所酿造低嘌呤啤酒口味纯正、保持了与传统啤酒不变的酒精含量及口感、风味等[58]。整合XOD酶等嘌呤代谢途径关键酶,充分降解各种嘌呤碱基将是创造性开发低嘌呤啤酒的一个新的选择。
5 黄嘌呤氧化酶研究存在的问题及展望虽然活性XOD的生物合成是复杂的多步过程,但是作为嘌呤代谢的关键酶,XOR广泛存在于生物界中。XOD在基因、蛋白和亚基组成上展示了丰富的多样性,但是其结构相似、催化机制相同。在一百多年的研究历史中,XOD被广泛认为在各种细胞过程中发挥重要作用,包括嘌呤代谢以及生理病理条件下ROS和NO的产生。近年来,XOD在药物代谢、核苷类药物的工业化生物合成、临床诊断、生物修复和低嘌呤食品领域展示了良好的发展前景。然而,目前XOD的生产和应用仍然面临一些需要解决的问题,这包括:1) 酶活性相对较低;2) 活性XOD的生产装配效率低;3) XOD的应用领域特别是医药检测和健康食品领域有待进一步发展。
综上所述,采用“发现-改造-生产-应用”一体化的系统研究思路[18],系统开展XOD的基础和应用研究,将有助于从根本上解决XOD的生产和应用面临的问题,以下4个方面的研究值得特别关注:1) 新型高活性XDH/XOD基因的挖掘;2) 基于催化机制、通过理性设计和定向进化手段定制面向工业操作过程的高催化活性、高耐受性的新型XOD突变体;3) 基于生物合成机制采用体内源头辅助装配思路、构建高效装配高活性XOR酶的细胞工厂;4) 基于XOD的嘌呤代谢的作用机理,偶联上游代谢途径酶开发新型体外酶联法检测疾病标志物的检测试剂盒,以及偶联下游代谢酶类开发低嘌呤类食品及生产技术。
| [1] |
李丽书, 陈献华, 邵叶波, 等. 黄嘌呤氧化还原酶的结构、功能和作用[J]. 细胞生物学杂志, 2004, 26(4): 381-384. LI L S, CHEN X H, SHAO Y B, et al. The structure and function of xanthine oxidoreductase[J]. Chinese Journal of Cell Biology, 2004, 26(4): 381-384. |
| [2] |
SCHARDINGER F. Ueber das verhalten der kuhmilch gegen methylenblau und seine verwendung zur unterscheidung von ungekochter und gekochter milch[J]. Zeitschrift für Untersuchung der Nahrungs-und Genuẞmittel, Sowie der Gebrauchsgegenstände, 1902, 5(22): 1113-1121. DOI:10.1007/BF02506750 |
| [3] |
ZIKAKIS J P.Preparation of high purity xanthine oxidase from bovine milk:US4172763[P].1979-10-30.
|
| [4] |
陆海波, 鲁传华. 高尿酸血症治疗药物黄嘌呤氧化酶抑制剂的研究进展[J]. 安徽医药, 2016, 20(4): 626-630. LU H B, LU C H. Research process of xanthine oxidase inhibitors as hyperuricemia drug[J]. Anhui Medical and Pharmaceutical Journal, 2016, 20(4): 626-630. |
| [5] |
涂彩霞, 刘旭, 李玲, 等. 痛风治疗新药研究进展[J]. 国际药学研究杂志, 2016, 43(5): 858-862. TU C X, LIU X, LI L, et al. New drugs for gont:Research advances[J]. J Int Pharm Res, 2016, 43(5): 858-862. |
| [6] |
ROBERT A M, ROBERT L. Xanthine oxido-reductase, free radicals and cardiovascular disease.A critical review[J]. Pathology & Oncology Research, 2014, 20(1): 1-10. |
| [7] |
HIGGINS P, DAWSON J, LEES K R, et al. Xanthine oxidase inhibition for the treatment of cardiovascular disease:A systematic review and meta-analysis[J]. Cardiovasc Ther, 2012, 30(4): 217-226. DOI:10.1111/cdr.2012.30.issue-4 |
| [8] |
NEOGI T, GEORGE J, REKHRAJ S, et al. Are either or both hyperuricemia and xanthine oxidase directly toxic to the vasculature? A critical appraisal[J]. Arthritis Rheumtol, 2012, 64(2): 327-338. DOI:10.1002/art.v64.2 |
| [9] |
WU Z M, TAN X M, HAN R C, et al. Advances of studies on xanthine dehydrogenase in higher plants[J]. Chinese Agricultural Science Bulletin, 2012, 28(21): 159-163. |
| [10] |
WANG C H, ZHAO T X, LI M, et al. Characterization of a novel Acinetobacter baumannii xanthine dehydrogenase expressed in Escherichia coli[J]. Biotechnol Lett, 2016, 38(2): 337-344. DOI:10.1007/s10529-015-1986-y |
| [11] |
KALIMUTHU P, LEIMKVHLER S, BERNHARDT P V. Low-potential amperometric enzyme biosensor for xanthine and hypoxanthine[J]. Analytical Chemistry, 2012, 84(23): 10359-10365. DOI:10.1021/ac3025027 |
| [12] |
HILLE R. The mononuclear molybdenum enzymes[J]. Chemical Reviews, 1996, 96(7): 2757-2816. DOI:10.1021/cr950061t |
| [13] |
孟疆辉, 陈蔚梅. 利用黄嘌呤氧化酶提高病毒唑转化率[J]. 武汉大学学报:自然科学版, 1999, 45(6): 838-840. MENG J H, CHEN W M. Using xanthine oxidase to improve the productivity of Ribavirin (RBV)[J]. Journal of Wuhan University:Natural Science Edition, 1999, 45(6): 838-840. |
| [14] |
AGARWAL A, BANERJEE A, BANERJEE U C. Xanthine oxidoreductase:A journey from purine metabolism to cardiovascular excitation-contraction coupling[J]. Crit Rev Biotechnol, 2011, 31(3): 264-280. DOI:10.3109/07388551.2010.527823 |
| [15] |
胡勇, 汪超, 徐宁, 等. 一种低嘌呤、富含氨基酸和维生素D的食用菌醋制备方法: CN201510616009x[P]. 2015-12-16. HU Y, WANG C, XU N, et al.A method for preparing edible fungus vinegar with low purine, rich in amino acid and vitamin D:CN201510616009x[P].2015-12-16. |
| [16] |
GREWAL H K, MARTINEZ J R, ESPINOZA L R. Febuxostat:Drug review and update[J]. Expert Opinion on Drug Metabolism & Toxicology, 2014, 10(5): 747-758. |
| [17] |
WOOLFOLK C A, DOWNARD J S. Distribution of xanthine oxidase and xanthine dehydrogenase specificity types among bacteria[J]. J Bacteriol, 1977, 130(3): 1175-1191. |
| [18] |
WANG C H, ZHANG C, XING X H. Xanthine dehydrogenase:An old enzyme with new knowledge and prospects[J]. Bioengineered, 2016, 7(6): 395-405. DOI:10.1080/21655979.2016.1206168 |
| [19] |
ISHIKITA H, EGER B T, OKAMOTO K, et al. Protein conformational gating of enzymatic activity in xanthine oxidoreductase[J]. Journal of the American Chemical Society, 2012, 134(2): 999-1009. DOI:10.1021/ja207173p |
| [20] |
ENROTH C, EGER B T, OKAMOTO K, et al. Crystal structures of bovine milk xanthine dehydrogenase and xanthine oxidase:Structure-based mechanism of conversion[J]. P Natl Acad Sci USA, 2000, 97(20): 10723-10728. DOI:10.1073/pnas.97.20.10723 |
| [21] |
李忠琴. 节杆菌黄嘌呤氧化酶的发酵、纯化、特性及基因研究[D]. 无锡: 江南大学, 2007. LI Z Q.Fermentation, purification, characterization and gene studies of Arthrobacter xanthine oxidase[D].Wuxi:Jiangnan University, 2007. |
| [22] |
OKAMOTO K, MATSUMOTO K, HILLE R, et al. The crystal structure of xanthine oxidoreductase during catalysis:Implications for reaction mechanism and enzyme inhibition[J]. P Natl Acad Sci USA, 2004, 101(21): 7931-7936. DOI:10.1073/pnas.0400973101 |
| [23] |
JOHNSON D C, DEAN D R, SMITH A D, et al. Structure, function, and formation of biological iron-sulfur clusters[J]. Annu Rev Biochem, 2005, 74(1): 247-281. DOI:10.1146/annurev.biochem.74.082803.133518 |
| [24] |
DAHL J U, RADON C, BVHNING M, et al. The sulfur carrier protein TusA has a pleiotropic role in Escherichia coli that also affects molybdenum cofactor biosynthesis[J]. J Biol Chem, 2013, 288(8): 5426-5442. DOI:10.1074/jbc.M112.431569 |
| [25] |
KOZMIN S G, STEPCHENKOVA E I, SCHAAPER R M. TusA (YhhP) and IscS are required for molybdenum cofactor-dependent base-analog detoxification[J]. Microbiology Open, 2013, 2(5): 743-755. |
| [26] |
LEIMKVHLER S, KLIPP W. Role of XDHC in Mo-lybdenum cofactor insertion into xanthine dehydrogenase of Rhodobacter capsulatus[J]. J Bacteriol, 1999, 181(9): 2745-2751. |
| [27] |
LEIMKVHLER S, HODSON R, GEORGE G N, et al. Recombinant Rhodobacter capsulatus xanthine dehydrogenase, a useful model system for the characterization of protein variants leading to xanthinuria Ⅰ in humans[J]. J Biol Chem, 2003, 278(23): 20802-20811. DOI:10.1074/jbc.M303091200 |
| [28] |
IVANOV N V, HUBÁLEK F, TRANI M, et al. Factors involved in the assembly of a functional molybdopyranopterin center in recombinant Comamonas acidovorans xanthine dehydrogenase[J]. European Journal of Biochemistry, 2003, 270(23): 4744-4754. DOI:10.1046/j.1432-1033.2003.03875.x |
| [29] |
IVANOV N V, TRANI M, EDMONDSON D E. High-level expression and characterization of a highly functional Comamonas acidovorans xanthine dehydrogenase in Pseudomonas aeruginosa[J]. Protein Expr Purif, 2004, 37(1): 72-82. DOI:10.1016/j.pep.2004.05.002 |
| [30] |
WANG C H, LI G, ZHANG C, et al. Enhanced catalytic properties of novel (αβγ)2 heterohexameric Rhodobacter capsulatus xanthine dehydrogenase by separate expression of the redox domains in Escherichia coli[J]. Biochemical Engineering Journal, 2017, 119: 1-8. DOI:10.1016/j.bej.2016.12.009 |
| [31] |
RINGEL P, KRAUSZE J, VAN DEN HEUVEL J, et al. Biochemical characterization of molybdenum cofactor-free nitrate reductase from Neurospora crassa[J]. J Biol Chem, 2013, 288(20): 14657-14671. DOI:10.1074/jbc.M113.457960 |
| [32] |
KUWABARA Y, NISHINO T, OKAMOTO K, et al. Unique amino acids cluster for switching from the dehydrogenase to oxidase form of xanthine oxidoreductase[J]. P Natl Acad Sci USA, 2003, 100(14): 8170-8175. DOI:10.1073/pnas.1431485100 |
| [33] |
NISHINO T, OKAMOTO K, KAWAGUCHI Y, et al. Mechanism of the conversion of xanthine dehydrogenase to xanthine oxidase:Identification of the two cysteine disulfide bonds and crystal structure of a non-convertible rat liver xanthine dehydrogenase mutant[J]. J Biol Chem, 2005, 280(26): 24888-24894. DOI:10.1074/jbc.M501830200 |
| [34] |
KONTOS H A.Role of products of univalent reduction of oxygen in hypertensive vascular injury[M]//LARAGH J H, BRENNER B M (eds.).Hypertension:Pathophysiology, diagnosis and management.New York:Raven Press Ltd, 1990.
|
| [35] |
HARRISON R. Structure and function of xanthine oxidoreductase:Where are we now[J]. Free Radic Biol Med, 2002, 33(6): 774-797. DOI:10.1016/S0891-5849(02)00956-5 |
| [36] |
MARTIN H M, HANCOCK J T, SALISBURY V, et al. Role of xanthine oxidoreductase as an antimicrobial agent[J]. Infect Immun, 2004, 72(9): 4933-4939. DOI:10.1128/IAI.72.9.4933-4939.2004 |
| [37] |
GLATIGNY A, SCAZZOCCHIO C. Cloning and mole-cular characterization of hxA, the gene coding for the xanthine dehydrogenase (purine hydroxylase Ⅰ) of Aspergillus nidulans[J]. J Biol Chem, 1995, 270(8): 3534-3550. DOI:10.1074/jbc.270.8.3534 |
| [38] |
DENT C E, PHILPOT G R. Xanthinuria:An inborn error (or deviation) of metabolism[J]. Lancet, 1954, 263(6804): 182-185. DOI:10.1016/S0140-6736(54)91257-X |
| [39] |
ICHIDA K, AMAYA Y, KAMATANI N, et al. Identification of two mutations in human xanthine dehydrogenase gene responsible for classical type Ⅰ xanthinuria[J]. J Clin Invest, 1997, 99(10): 2391-2397. DOI:10.1172/JCI119421 |
| [40] |
TORU N, TORU M.Method and test composition for the determination of the substrate for xanthine oxidase:4341868[P].1982-07-27.
|
| [41] |
TANIGAKI N, FURUKAWA K, SOGABE Y, et al.Thermostable xanthine oxidase from Arthrobacter Luteus:5185257[P].1993-02-09.
|
| [42] |
CHEN C G, CHENG G Y, HAO H H, et al. Mechani-sm of porcine liver xanthine oxidoreductase mediated N-oxide reduction of cyadox as revealed by docking and mutagenesis studies[J]. PLoS One, 2013, 8(9): e73912. DOI:10.1371/journal.pone.0073912 |
| [43] |
ZAREPOUR M, KASPARI K, STAGGE S, et al. Xanthine dehydrogenase AtXDH1 from Arabidopsis thaliana is a potent producer of superoxide anions via its NADH oxidase activity[J]. Plant Molecular Biology, 2010, 72(3): 301-310. DOI:10.1007/s11103-009-9570-2 |
| [44] |
王成华. 高活性黄嘌呤脱氢酶/氧化酶的表达细胞工厂研究[D]. 北京: 清华大学, 2016. WANG C H.Construction of Escherichia coli cell factory for highly active xanthine dehydrogenase/oxidase production[D].Beijing:Tsinghua University, 2016. |
| [45] |
SCHUMANN S, SAGGU M, MÖLLER N, et al. The mechanism of assembly and cofactor insertion into Rhodobacter capsulatus xanthine dehydrogenase[J]. J Biol Chem, 2008, 283(24): 16602-16611. DOI:10.1074/jbc.M709894200 |
| [46] |
World Health Organization.WHO model list of essential medicines[M/OL].2013.[2016-12-10].http://www.who.int/medicines/publications/essentialmedicines/en.
|
| [47] |
HORI N, UEHARA K, MIKAMI Y. Effects of xanth-ine oxidase on synthesis of 5-methyluridine by the ribosyl transfer reaction[J]. Agric Biol Chem, 1991, 55(4): 1071-1074. |
| [48] |
卢味, 詹玉云, 邱秀娉. 合理饮食对痛风病人治疗作用的观察[J]. 中外健康文摘, 2010, 7(27): 27-28. LU W, ZHAN Y Y, QIU X P. Observation on therapeutic effect of reasonable diet on gout patients[J]. The Chinese and Foreign Health Abstract, 2010, 7(27): 27-28. |
| [49] |
刘助水, 李雅文. 一种低嘌呤啤酒及其制备方法: CN201010292418. 6[P]. 2010-09-26. LIU Z S, LI Y W.A low purine beer and its preparation method:CN201010292418.6[P].2010-09-26. |
| [50] |
吕吉鸿, 潘国恒. 酿造低嘌呤啤酒的原料选择和处理[J]. 酿酒科技, 2010(11): 16-17. LV J H, PAN G H. Brewing low purine beer of selecting and handling material[J]. Liquor-Making Science & Technology, 2010(11): 16-17. |
| [51] |
李崎, 李永仙, 董建军, 等. 一种含低嘌呤类物质的啤酒的制造方法: CN200510094670. 5[P]. 2005-09-30. LI Q, LI Y X, DONG J J, et al.A method for producing beer containing low purines:CN200510094670.5[P].2005-09-30. |
| [52] |
杨子龙. 一种低嘌呤啤酒及其制备方法: CN200910077272. 0[P]. 2009-01-21. YANG Z L.A low purine beer and its preparation method:CN200910077272.0[P].2009-01-21. |
| [53] |
胡鹏刚, 郑义刚, 邱树毅, 等. 一种低嘌呤啤酒的生产方法: CN201210012067. 8[P]. 2012-01-16. HU P G, ZHENG Y G, QIU S Y, et al.A method for producing beer containing low purine:CN201210012067.8[P].2012-01-16. |
| [54] |
李红, 刘常姝, 韩兴林. 一种低嘌呤啤酒的生产方法: CN201310600728. 3[P]. 2013-11-25. LI H, LIU C S, HAN X L.A method for producing beer containing low purine:CN201310600728.3[P].2013-11-25. |
| [55] |
SHIBANO Y, YOMO H, MATSUMOTO T, et al.Process for manufacturing beer:US 6013288[P].2000-01-11.
|
| [56] |
吕吉鸿, 贺子福, 郭泽峰. 利用麦根生产低嘌呤啤酒的方法及其产品: CN201110193596. 8[P]. 2011-07-12. LV J H, HE Z F, GUO Z F.Method for producing low purine beer by using wheat root and its products:CN201110193596.8[P].2011-07-12. |
| [57] |
易昕, 胡金成, 曹又新, 等. 一种低嘌呤啤酒的生产方法: CN200410014422. 0[P]. 2004-03-24. YI X, HU J C, CAO Y X, et al.A method for producing beer containing low purine:CN200410014422.0[P].2004-03-24. |
| [58] |
康富帅, 颜兵, 吕南拳, 等. 低嘌呤酿酒酵母的ARTP法诱变育种[J]. 现代食品科技, 2014, 30(2): 188-191. KANG F S, YAN B, LV N Q, et al. Mutation breeding of Saccharomyces cerevisiae with low purine by atmospheric and room temperature plasma[J]. Modern Food Science and Technology, 2014, 30(2): 188-191. |
 2017, Vol. 24
2017, Vol. 24