2. 亚热带农业资源保护利用与利用国家重点实验, 广西南宁 530005;
3. 广西科学院, 广西南宁 530007
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning, Guangxi, 530005, China;
3. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
【研究意义】我国是香蕉生产大国[1],但是在收获大量香蕉产品的同时也产生了大量的香蕉杆。据统计,每年收获1 hm2香蕉就会产生大约100 t的香蕉杆[2],既造成巨大的生物资源浪费,又严重影响生态环境。香蕉秆等副产物含有丰富的营养和纤维[3-4],可用于生物质能源的开发,这对改善农村生态环境、提高香蕉产值和增加蕉农收入等均具有重要的意义。【前人研究进展】国外学者Deivanai等[5]提取香蕉杆的纤维,测得香蕉秆纤维中的纤维素、半纤维素和木质素分别为42%、14%、8.67%,但其并未直接以香蕉杆原料为样品进行测定。Khan等[6]对比了香蕉杆、香蕉皮、香蕉果肉和香蕉果实的产气潜力,其中香蕉杆产气能力最低,为0.256 m3/kg VS。在国内,熊月林等[7]指出香蕉茎纤维中纤维素、半纤维素和木质素总量可达90%以上,具有广阔的开发前景。李坤等[8]对香蕉茎的化学成分进行测定和分析,得出香蕉茎纤维的纤维素和综纤维素分别为39.12%和72.72%,木素含量低,为10.78%,这与Jústiz-Smith等[9]研究的结果类似。【本研究切入点】香蕉杆纤维素、半纤维素和木质素含量丰富,可资源化利用;而与其他农作物秸秆相比,香蕉杆厌氧发酵产沼气的研究鲜有报道。【拟解决的关键问题】在前人研究基础上[10-13],直接以香蕉杆原料为样品,测定香蕉杆纤维素、半纤维素和木质素的含量,并对其发酵产沼气的潜力进行研究,为香蕉杆的能源化利用提供有益参考。
1 材料与方法 1.1 材料(1) 发酵原料
香蕉杆来源于广西大学农学院果园,去除心蕊部分,取用新鲜部分压榨去汁,一部分剪碎成5 mm×5 mm,用于厌氧发酵产沼气;另外一部分于65℃烘箱烘干,粉碎,过60目筛,用于接种物的驯化和纤维素、半纤维素和木质素的测定。玉米秸秆、水稻秸秆采集于广西大学农学院实验田基地,均取用新鲜部分,剪碎成5 mm×5 mm,用于厌氧发酵产沼气。
(2) 接种物
采取广西大学东校园碧云湖池塘底泥,取回后去除树叶等杂质,调节污泥浓度,分装置于2.5 L广口瓶,加入15 g香蕉杆粉末,用带孔橡胶塞封口,置于35℃培养箱,每天摇瓶一次,驯化周期为40 d。
(3) 试剂
重铬酸钾、浓硫酸、硝酸钙等试剂药品均为市售分析纯。
1.2 方法 1.2.1 香蕉杆纤维素、半纤维素和木质素的测定(1) 纤维素
使用硫酸-重铬酸钾氧化法[14]测定,具体测定步骤:称取约0.06 g香蕉杆粉末于磨口试管中,加入冰醋酸和硝酸混合液 (V:V=2:1)5 mL,沸水浴25 min,定期搅拌。取出,冷却后转移入离心管,12 000 r/min离心3 min,用蒸馏水洗涤沉淀,直至沉淀变为白色为止。加入10 mL 0.1 mol/L重铬酸钾溶液和8 mL浓硫酸,混匀,沸水浴10 min。冷却后转至锥形瓶中,用适量蒸馏水冲洗,一并倒入锥形瓶中。溶液冷却后滴加3滴试亚铁灵指示剂,用0.2 mol/L硫酸亚铁铵溶液滴定。另外单独滴定10 mL 0.1 mol/L重铬酸钾溶液和8 mL浓硫酸混合液作为空白试验。纤维素含量按下试计算:
| $ 纤维素含量\left( \% \right) = \frac{{0.675k\left( {a - b} \right)}}{n} \times 100\% , $ |
式中,k为硫酸亚铁铵溶液的浓度,mol/L;a为空白滴定所消耗硫酸亚铁铵溶液的体积,mL;b为溶液所消耗硫酸亚铁铵溶液的体积,mL;n为所称取香蕉杆粉末的质量,g。
(2) 半纤维素
使用2 mol/L盐酸水解法测定,具体测定步骤如下:称取约0.10 g香蕉杆粉末于离心管中,加入80%硝酸钙溶液10 mL,沸水浴5 min,加入10 mL蒸馏水,冷却后12 000 r/min离心5 min,弃上清,热蒸馏水洗涤沉淀3次。向离心管加入2 mol/L盐酸10 mL,混匀,沸水浴45 min,定期搅拌。冷却后离心,将溶液转至烧杯,用2 mol/L NaOH溶液中和至恰显红玫瑰色。用布氏漏斗抽滤,洗涤滤渣,留取滤液和洗涤液混匀后测体积。取适量待测样液,用DNS法[15]测定OD540。以不加样品为空白对照进行以上操作,对照葡萄糖标准曲线进行分析。半纤维素含量按下式计算:
| $ 半纤维素含量\left( \% \right) = \frac{{m \times \frac{{{V_0}}}{{{V_1}}}}}{n} \times 0.9 \times 100\% , $ |
式中,m为查标准曲线得到的葡萄糖质量,mg;V0为滤液和洗涤液总体积,mL;V1为测定OD540时所用待测液体积,mL;n为所称取香蕉杆粉末的质量,g。
(3) 木质素
采用72%浓硫酸水解法测定,具体测定步骤如下:称取约0.10 g香蕉杆粉末于离心管中,加入1%冰醋酸10 mL浸泡5 min,离心弃上清,用5 mL 1%冰醋酸洗涤沉淀。加入5 mL丙酮浸泡5 min后,洗涤沉淀。加72%硫酸3 mL,搅匀,室温静置16 h,使全部纤维素溶解。加10 mL蒸馏水,搅匀,沸水浴5 min。再加5 mL蒸馏水和0.5 mL 10%BaCl2溶液,摇匀,离心,去上清。用蒸馏水洗涤沉淀2次。再向冲洗过的木质素加入10 mL 0.1 mol/L重铬酸钾溶液和8 mL浓硫酸,沸水浴10 min,定期搅拌。冷却后,溶液转至锥形瓶中,用蒸馏水冲洗离心管,将洗涤液一并倒入锥形瓶中。加入3滴试亚铁灵指示剂,用0.2 mol/L硫酸亚铁铵溶液滴定待测溶液。另外单独滴定10 mL 0.1 mol/L重铬酸钾溶液和8 mL浓硫酸混合液作为空白试验。木质素含量按下式计算:
| $ 木质素含量\left( \% \right) = \frac{{0.433k\left( {a - b} \right)}}{n} \times 100\% , $ |
式中,k为硫酸亚铁铵溶液的浓度,mol/L;a为空白滴定所消耗硫酸亚铁铵溶液的体积,mL;b为溶液所消耗硫酸亚铁铵溶液的体积,mL;n为所称取香蕉杆粉末的质量,g。
1.2.2 香蕉杆产沼气潜力试验(1) 测定项目和方法
发酵原料和接种污泥总固体含量 (TS) 采用烘干称重法,即将样品放置在烘箱中干燥箱中于105℃烘干至恒重;日产气量采用排水法来表征,即排水体积近似等于产气量;pH值采用精密pH试纸测定。
(2) 试验设计
本试验采用自制厌氧发酵装置 (图 1),每组试验装置都由一个反应瓶、一个集气瓶和一个排水计量瓶组成,反应瓶和集气瓶用胶皮管连接后密封,以保证良好的厌氧环境。实验组总发酵体积为250 mL,同时设置空白参比组 (不添加任何原料),发酵温度为35℃,接种率 (指接种污泥体积与发酵总体积之比,V/V) 为48%,基质含量 (指发酵原料湿重与发酵总体积之比,W/V) 为8%,初始pH值为7.0。试验运行周期为20 d,每天摇瓶一次,每次10 min;每天测一次产气量。试验结束后,综合试验数据进行产气指标分析。
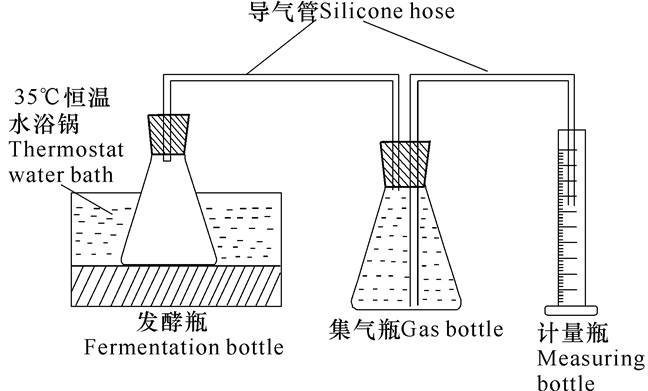
|
图 1 香蕉杆厌氧发酵产沼气实验装置 Fig.1 Schematic diagram of biogas production from anaerobically digested banana stalk |
测得接种污泥的总固体含量 (TS) 为8.95%。香蕉杆、玉米秸秆和水稻秸秆的总固体含量 (TS) 分别为13.96%、18.87%和24.23%(表 1),说明香蕉杆的含水率明显高与其它两种秸秆,因此对香蕉杆进行压榨后较易进行沼气发酵实验。与其它两种原料相比,香蕉杆纤维素、半纤维素和木质素较低,分别为17.47%、11%和6.81%。有研究表明香蕉杆中脂质、蛋白等营养成分含量较高[16],这可能是其木质纤维素成分较其他秸秆低的原因。
| 表 1 发酵原料组分组成 Table 1 Composition of different straw materials |
从图 2中可以看出,不管发酵体积是250 mL还是500 mL,香蕉杆发酵产沼气的时间变化趋势是一致的,说明体积对产气潜力的影响不大,所以采用250 mL发酵体积来研究香蕉杆产沼气潜力。在250 mL发酵体积中,香蕉杆产气率达到 (155±3) mL/g TS,前10 d产气比率达到93%(表 2)。
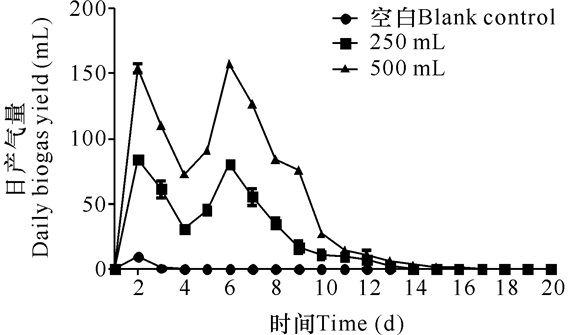
|
图 2 香蕉杆发酵产沼气量的时间变化曲线 Fig.2 The curves of biogas production from banana stalk anaerobic digestion |
| 表 2 香蕉杆发酵产沼气结果 Table 2 The results of biogas production from banana stalk anaerobic digestion |
在一个发酵周期内,香蕉杆、玉米秸秆和稻草发酵产沼气趋势基本一致,说明不同秸秆原料对产气趋势影响不大 (图 3)。另外如图 4所示,香蕉杆、玉米秸秆和水稻秸秆3种原料的产气率分别为 (150±2) mL/g TS、(163±2) mL/g TS、(170±2) mL/g TS。因此,与后两者相比,香蕉杆原料的产沼气潜力存在一定的差距。
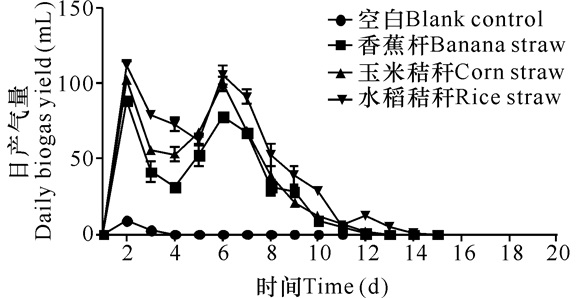
|
图 3 不同原料发酵产沼气的时间变化曲线 Fig.3 The curves of daily biogas production at different time |
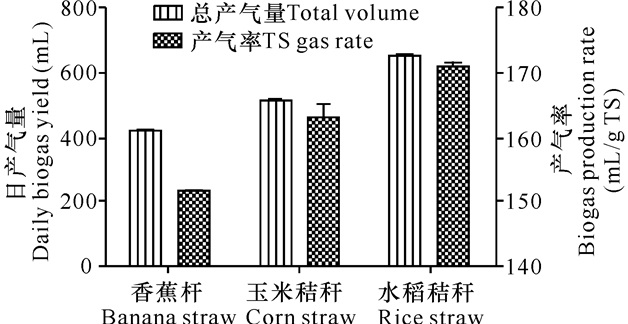
|
图 4 不同原料产沼气结果对比 Fig.4 The comparison of biogas production at different feed |
木质纤维素素的测定方法很多,除本研究所采用方法外,还有Van Soest法[19]、NREL法[20]、红外光谱定量分析法[21]等,Van Soest法一般耗时2~3 d,NREL法需要HPLC设备,红外光谱定量分析法对实验条件要求亦较高,在普通化学实验室使用有困难。本研究采用硫酸-重铬酸钾氧化法、2 mol/L盐酸水解法和72%浓硫酸法测定木质纤维素成分,并加以改进,具有耗时短、不需要昂贵仪器和复杂操作的优点,在一般具有化学分析条件的实验室都可使用。经测定,香蕉杆纤维素、半纤维素和木质素含量分别为17.47%、11%、6.86%,纤维相对含量达35.15%,因此香蕉杆在能源化、材料化、生态化等方面拥着巨大的应用潜力。本研究所测定结果与Deivanai等[5]所测结果 (42%、14%、8.67%) 存在差异,这是由于他们先采用物理化学方法提取了香蕉杆的纤维后,再测定香蕉杆纤维的纤维素、半纤维素和木质素的相对含量。而本研究所用香蕉杆原料只进行了干燥、粉碎等简单处理,未进行脱脂、去糖、去蛋白等操作,而脂质、糖类等物质对测定结果存在一定的干扰,故本研究测得香蕉杆纤维素、半纤维素和木质素的相对含量较低。若在不需要了解原料中纤维素、半纤维素和木质素绝对含量的话,即只需进行对比性研究时,本研究所采用的测定方法可以放心使用。
沼气发酵是多菌群相互作用的非线性复杂系统,主要涉及水解产酸菌、产氢乙酸菌、产甲烷菌这3类微生物相互作用[22]。根据本研究产气曲线趋势,可判断香蕉杆发酵产沼气符合一般厌氧发酵过程[23]。在发酵的初期,水解微生物分泌酶类把香蕉杆中的高分子物质 (碳水化合物、蛋白质、脂质) 降解成易被利用的小分子有机物 (单糖、氨基酸),并且由于机械压榨使原料的有机物更易渗入发酵液,有利于各种厌氧微生物的生长发育,因此在发酵的前3 d大量产气。在第3~5天,产酸细菌利用水解产物的单体生成挥发性酸 (丙酮酸、乙酸等),产气量降低,并伴随着菌群的生长。在发酵第6天时达到产气高峰,此时产甲烷菌最为活跃,主要把乙酸、甲酸 (或氢气) 转化成甲烷。一个发酵周期内,产气主要集中在前10 d,在第12天以后,由于原料基本消耗殆尽,产气量明显变少;第15天以后,发酵停止,发酵液处于静止状态,较发酵前澄清。因此合理利用产气曲线来指导沼气发酵有重要意义。
在中温条件下,本研究中香蕉杆发酵产沼气潜力为 (155±3) mL/g TS,与稻草和玉米秸秆沼气发酵潜力相比较低,这主要是由于香蕉杆自身特殊结构造成的。虽然香蕉杆具有一般秸秆的普遍特征即木质纤维素含量高,但其也有自身特殊之处,即其含水量高。硬度大和自身含有较高的抑制微生物生长的物质——单宁[24-25],因此限制了沼气发酵效果。本研究在发酵前对香蕉杆原料进行压榨,优点主要有3点:其一,可一定程度防止发酵过程中原料上浮,充分利用发酵空间,降低香蕉杆原料的单宁含量; 其二,机械压榨破坏纤维质底物中木质素、纤维素和半纤维素组成的复杂包裹结构,促进底物与微生物及酶的接触,进而促进底物的水解和发酵,并最终改善底物的沼气发酵性能; 其三,从经济角度考虑,可降低原料运输成本和效率,如果香蕉杆含水量从90%降到70%时,其运输重量会减少80%。然而,机械压榨会造成部分有机物的流失,从而降低甲烷产率[26]。
4 结论本研究结果表明,利用香蕉杆发酵产沼气是可行的,但由于受到原料预处理、接种物、基质含量以及碳氮比等因素[27-29]以及发酵装置的限制,目前产气量还很低。在接下来的工作中,将主要着力于发酵条件的优化和发酵装置的改进,以期通过开发一种高效、快速、环保的工艺技术来获得更高的产气率和原料降解率。
| [1] |
FAO. 联合国粮食及农业组织数据库[EB/OL]. [2016-12-06]. http://www.fao.org/faostat/en/#data. FAO.FAOSTAT, Online statistical service of the Food and Agriculture Organization (FAO)[EB/OL].[2016-12-06].http://www.fao.org/faostat/en/#data. |
| [2] |
ZHANG C M, LI J H, LIU C, et al. Alkaline pretreatment for enhancement of biogas production from banana stem and swine manure by anaerobic codigestion[J]. Bioresource Technology, 2013, 149: 353-358. DOI:10.1016/j.biortech.2013.09.070 |
| [3] |
MOHAPATRA D, MISHRA S, SUTAR N. Banana and its by-product utilisation:An overview[J]. Journal of Scientific & Industrial Research, 2010, 69(5): 323-329. |
| [4] |
樊小林. 香蕉营养与施肥[M]. 北京: 中国农业出版社, 2007: 214-215. FAN X L. Banana nutrition and fertilization[M]. Beijing: China Agriculture Press, 2007: 214-215. |
| [5] |
DEIVANAI K, KASTURI R. Batch biomethanation of banana trash and coir pith[J]. Bioresource Technology, 1995, 52(1): 93-94. DOI:10.1016/0960-8524(95)00016-8 |
| [6] |
KHAN M T, BRULÉ M, MAURER C, et al. Batch anaerobic digestion of banana waste-energy potential and modelling of methane production kinetics[J]. Agricultural Engineering International:The CIGR e-Journal, 2016, 18(1): 110-128. |
| [7] |
熊月林, 崔运花. 香蕉纤维的研究现状及其开发应用前景[J]. 纺织学报, 2007, 28(9): 122-124. XIONG Y L, CUI Y H. Research status of banana fiber and its prospect of development and application[J]. Journal of Textile Research, 2007, 28(9): 122-124. |
| [8] |
李坤, 付时雨, 周雪松, 等. 香蕉茎的化学成分及其微观形态分析[J]. 中国造纸学报, 2009, 24(4): 11-14. LI K, FU S Y, ZHOU X S, et al. Chemical analysis and microscope observation of banana stem[J]. Transactions of China Pulp and Paper, 2009, 24(4): 11-14. |
| [9] |
JU'STIZ-SMITH N G, VIRGO G J, BUCHANAN V E. Potential of Jamaican banana, coconut coir and bagasse fibres as composite materials[J]. Materials Characterization, 2008, 59(9): 1273-1278. DOI:10.1016/j.matchar.2007.10.011 |
| [10] |
陈洪章. 纤维素生物技术[M]. 北京: 化学工业出版社, 2011: 251-252. CHEN H Z. Biotechnology of lignocellulose[M]. Beijing: Chemical Industry Press, 2011: 251-252. |
| [11] |
KOCH K, LVBKEN M, GEHRING T, et al. Biogas from grass silage-measurements and modeling with ADM1[J]. Bioresource Technology, 2010, 101(21): 8158-8165. DOI:10.1016/j.biortech.2010.06.009 |
| [12] |
李春光, 周伟铎, 田魏, 等. 甘蔗渣纤维素提取及木质素与半纤维素脱除工艺探讨[J]. 中国农学通报, 2011, 27(4): 316-320. LI C G, ZHOU W D, TIAN W, et al. Study on extraction of cellulose and removal of hemicelluloses and lignin from bagasse[J]. Chinese Agricultural Science Bulletin, 2011, 27(4): 316-320. |
| [13] |
唐国涛, 邢沙沙, 黄榕彬, 等. 脂麻秆中纤维素与半纤维素的含量测定[J]. 作物研究, 2012, 26(1): 53-55. TANG G T, XING S S, HUANG R B, et al. Determination of content of cellulose and hemicellulose in stem of Sesamum indicum L[J]. Crop Research, 2012, 26(1): 53-55. |
| [14] |
张涛, 张静, 耿可聪. 用重铬酸钾标定硫酸亚铁铵滴定液[J]. 河北化工, 2008, 31(8): 76. ZHANG T, ZHANG J, GENG K C. Improvement on determination of aluminium oxide content in catalyze crackin catalyst[J]. Chemical Industry in Hebei, 2008, 31(8): 76. |
| [15] |
魏群. 基础生物化学实验[M]. 3版.北京: 高等教育出版社, 2009: 86-89. WEI Q. Basic biochemistry experiment[M]. 3rd ed.Beijing: Higher Education Press, 2009: 86-89. |
| [16] |
CORDEIRO N, BELGACEM M N, TORRES I C, et al. Chemical composition and pulping of banana pseudo-stems[J]. Industrial Crops and Products, 2004, 19(2): 147-154. DOI:10.1016/j.indcrop.2003.09.001 |
| [17] |
SAMBUSITI C, MONLAU F, FICARA E, et al. A comparison of different pre-treatments to increase methane production from two agricultural substrates[J]. Applied Energy, 2013, 104: 62-70. DOI:10.1016/j.apenergy.2012.10.060 |
| [18] |
罗立娜, 李文哲, 徐名汉, 等. 预处理方式对水稻秸秆厌氧发酵产气特性的影响[J]. 农业机械学报, 2012, 43(11): 152-156. LUO L N, LI W Z, XU M H, et al. Effect of pretreatment methods on anaerobic fermentation characteristics from rice straw[J]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43(11): 152-156. DOI:10.6041/j.issn.1000-1298.2012.11.029 |
| [19] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [20] |
张红漫, 郑荣平, 陈敬文, 等. NREL法测定木质纤维素原料组分的含量[J]. 分析试验室, 2010, 29(11): 15-18. ZHANG H M, ZHENG R P, CHEN J W, et al. Investigation on the determination of lignocellulosics components by NREL method[J]. Chinese Journal of Analysis Laboratory, 2010, 29(11): 15-18. DOI:10.3969/j.issn.1000-0720.2010.11.004 |
| [21] |
杜娟, 安东, 夏田, 等. 近红外光谱技术检测植物木质素纤维素研究进展[J]. 光谱学与光谱分析, 2013, 33(12): 3207-3211. DU J, AN D, XIA T, et al. The research progress in determining lignocellulosic content by near infrared reflectance spectroscopy technology[J]. Spectroscopy and Spectral Analysis, 2013, 33(12): 3207-3211. DOI:10.3964/j.issn.1000-0593(2013)12-3207-05 |
| [22] |
BRYANT M P. Microbial methane production-theoretical aspects[J]. Journal of Animal Science, 1979, 48(1): 193-201. DOI:10.2527/jas1979.481193x |
| [23] |
BATSTONE D J, KELLER J, ANGELIDAKI I, et al. The IWA anaerobic digestion model No 1 (ADM1)[J]. Water Science and Technology, 2002, 45(10): 65-73. |
| [24] |
KOUGIAS P G, TREU L, CAMPANARO S, et al. Dynamic functional characterization and phylogenetic changes due to Long Chain Fatty Acids pulses in biogas reactors[J]. Scientific Reports, 2016, 6: 28810. DOI:10.1038/srep28810 |
| [25] |
WANG C F, MUHAMMAD A U R, LIU Z Y, et al. Effects of ensiling time on banana pseudo-stem silage chemical composition, fermentation and in Sacco rumen degradation[J]. The Journal of Animal & Plant Sciences, 2016, 26(2): 339-346. |
| [26] |
ZHANG C M, BI S L, ZHAO M X, et al. Biogas production performance of different components from banana stems[J]. Energy & Fuels, 2016, 30(8): 6425-6429. |
| [27] |
裴培, 张成明, 李纪红, 等. 物理法处理对香蕉秸秆沼气发酵能力影响分析[J]. 食品与发酵工业, 2014, 40(1): 8-13. PEI P, ZHANG C M, LI J H, et al. The influence of physical treatment on biogas production potential of banana pseudo stem[J]. Food and Fermentation industries, 2014, 40(1): 8-13. |
| [28] |
HUA B B, DAI J L, LIU B, et al. Pretreatment of non-sterile, rotted silage maize straw by the microbial community MC1 increases biogas production[J]. Bioresource Technology, 2016, 216: 699-705. DOI:10.1016/j.biortech.2016.06.001 |
| [29] |
WU X, YAO W Y, ZHU J, et al. Biogas and CH4 productivity by co-digesting swine manure with three crop residues as an external carbon source[J]. Bioresource Technology, 2010, 101(11): 4042-4047. DOI:10.1016/j.biortech.2010.01.052 |
 2017, Vol. 24
2017, Vol. 24 


