【研究意义】黑木耳(Auricularia auricula)是最为常见的食用菌之一,具有食、药两用性,富含人体必需氨基酸、多糖、腺苷类物质、黄酮类物质、麦角留醇、尿苷、黑色素以及多种微量成分[1-2]。其中木耳多糖具有抗血栓[3]、降血脂[4]、抗衰老[5]、提高免疫[6]、抗肿瘤[7]等生理功能,在食品、药品等方面具有良好的应用前景。研究促进剂对木耳多糖发酵生产的影响,以提高多糖的生产效率,对活性木耳多糖的工业化生产具有促进作用。【前人研究进展】木耳多糖可从木耳子实体中提取,但木耳子实体生长周期长,产量有限。而液体发酵具有发酵周期短、活性成分产量高、易于工业化生产等优势,因此采用液体深层发酵可有效地进行木耳多糖的生产,并且通过优化发酵条件和营养组成[8]等办法可提高木耳多糖产量。添加促进剂是提高真菌代谢产物生物合成的重要途径之一,通过促进剂改变细胞膜通透性,从而增加胞外次生代谢产物[9]。研究表明在灵芝、灰树花、蛹虫草等真菌液体发酵培养基中添加促进剂可增加多糖的生物合成[10-16],但对于木耳液体发酵促进剂的选择和添加量的研究很少见到报道。【本研究切入点】从促进剂的选择和添加量出发,在黑木耳发酵培养基中分别添加脂肪酸(棕榈酸、硬脂酸、油酸、亚油酸)、植物油(花生油、橄榄油、玉米油、葵花油)、醇(甲醇、乙醇、丙醇、丁醇)、表面活性剂(Tween40、Tween80、Span20、Span40)、聚乙二醇(PEG400、PEG1000、PEG2000、PEG4000) 等20种不同促进剂,设置4个添加浓度(V:V):0.10%、0.25%、0.50%、1.00%。考察不同的液体促进剂及其添加量对黑木耳菌发酵生物量及产胞外多糖的影响。【拟解决的关键问题】筛选出适于黑木耳菌产胞外多糖的促进剂种类及添加量,通过正交试验优化确定促进剂的最佳组合,为黑木耳胞外多糖的高效发酵生产提供基础。
1 材料与方法 1.1 材料 1.1.1 实验菌种黑木耳菌SS-022温州大学发酵工程研究室保藏。原种保存在PDA斜面上,每两个月转接一次。保存在4℃,取一小块接入PDA平板中进行活化,28℃,培养7 d,备用。
1.1.2 主要试剂甲醇和无水乙醇购自安徽安特食品股份有限公司;丙醇购自广州汕头西陇化工;正丁醇购自中国上海试剂总厂,以上醇类均为分析纯。棕榈酸购自国药集团化学试剂有限公司,为分析纯;油酸购自苏州工业园区正兴化工研究所,为化学纯;亚油酸生化试剂购自源叶生物有限公司;硬脂酸购自温州市化学用料厂,为化学纯。玉米油、花生油、葵花油、橄榄油购自上海融氏企业有限公司。Tween40购自源叶生物有限公司;Span20购自上海麦克林生物化学有限公司;Span40购自国药集团化学试剂有限公司;Tween80购自温州清明化工有限公司,以上表面活性剂均为化学纯。PEG400购自宜兴市第二化学试剂厂,为分析纯;PEG1000、PEG2000、PEG400购自国药集团化学试剂有限公司,为化学纯。
1.1.3 培养基种子培养基:可溶性淀粉20 g/L、麸皮20 g/L、三水合磷酸氢二钾1 g/L、磷酸二氢钾1 g/L、硫酸镁0.75 g/L。发酵基础培养基:蔗糖10 g/L、L-酪氨酸1.5 g/L、硫酸镁0.75 g/L、三水合磷酸氢二钾1 g/L、磷酸二氢钾1 g/L。
1.2 方法 1.2.1 接种和培养培养基121℃,灭菌30 min,冷却后接入黑木耳菌。500 mL三角瓶装液量200 mL,接种量10%(V:V),摇床转速165 r/min,温度28℃,培养6 d。
在黑木耳发酵培养基中分别添加脂肪酸(棕榈酸、硬脂酸、油酸、亚油酸)、植物油(花生油、橄榄油、玉米油、葵花油)、醇(甲醇、乙醇、丙醇、丁醇)、表面活性剂(Tween40、Tween80、Span20、Span40)、聚乙二醇(PEG400、PEG1000、PEG2000、PEG4000) 等20种不同促进剂,设置4个添加浓度:0.10%、0.25%、0.50%、1.00%。以未添加促进剂的基础培养基作为对照组。
1.2.2 菌体生物量的测定发酵液过滤取菌体,用去离子水清洗两次离心,沉淀在60℃烘箱中烘干至恒重,称重得生物量。
1.2.3 木耳胞外多糖含量测定发酵液过滤后,取滤液于试管,加入4倍95%乙醇(V:V),置于4℃冰箱12 h,4 000 r/min,离心20 min,倒出上层清液,沉淀放入60℃烘箱中烘干,蒸馏水溶解,采用苯酚硫酸法进行测定[14]。
2 结果与分析 2.1 脂肪酸对生物量及胞外多糖的影响硬脂酸、亚油酸、棕榈酸、油酸等4种脂肪酸在添加浓度为0.10%~1.00%时,对黑木耳菌生物量的积累表现出了极大的促进作用,其中,硬脂酸和棕榈酸在添加浓度为1.00%时的生物量分别是无添加时的4.5倍和4.6倍。亚油酸、棕榈酸、油酸的添加浓度为0.10%时,木耳胞外多糖含量相应增加到了(1.42±0.16) mg/mL、(1.72±0.073) mg/mL、(1.61±0.028) mg/mL,分别是对照组的2倍、2.5倍、2.3倍。硬脂酸的添加浓度为1.00%时,木耳胞外多糖含量是对照组的1.48倍(图 1)。

|
图 1 脂肪酸对木耳发酵生物量和胞外多糖的影响 Fig.1 Effects of fatty acids on biomass and exopolysaccharide (EPS) in submerged culture of Auricularia auricula |
生物量随着花生油、玉米油、橄榄油添加比例的增加而增加。在添加1.00%的橄榄油时生物量是对照组的4.3倍。添加浓度为0.10%~1.00%时,胞外多糖含量随着橄榄油浓度的增加而增加,在橄榄油添加浓度增加到1.00%时胞外多糖含量达到最大值,为(0.73±0.02) mg/mL,是对照组的1.6倍;玉米油、葵花油对黑木耳菌产胞外多糖有轻微的促进作用;花生油在添加浓度为0.10%时对黑木耳菌产胞外多糖有一定的促进作用,含量是对照组的1.3倍(图 2)。

|
图 2 植物油对木耳发酵生物量和胞外多糖的影响 Fig.2 Effects of plant oils on biomass and EPS in submerged culture of A.auricula |
Tween40、Span40在添加量为0.10%~1.00%时对生物量积累均表现为促进作用,其中,在添加浓度为1.00%时,生物量分别是对照组的3.5倍和4.9倍。而添加Span20对生物量几乎无影响,Tween80添加浓度为0.25%时,生物量是对照组的2.7倍。添加Span20对木耳胞外多糖含量影响不大,Tween40和Tween80在添加浓度为0.50%时,胞外多糖含量分别是对照组的3.4倍和2.3倍;在添加浓度为0.10%~1.00%时,胞外多糖含量随Span40浓度的增加而增加,在Span40添加浓度增加到1.00%时,胞外多糖含量为对照组的1.9倍(图 3)。
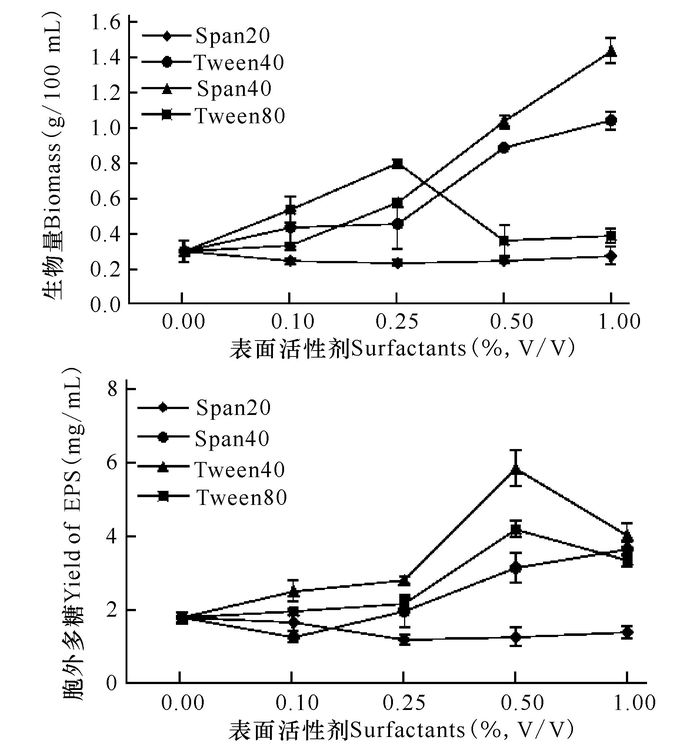
|
图 3 表面活性剂对木耳发酵生物量和胞外多糖的影响 Fig.3 Effects of surfactants on biomass and EPS in submerged culture of A.auricula |
在添加浓度为1.00%时,仅PEG400表现为促进生物量积累,是对照组的1.7倍。PEG1000、PEG2000和PEG4000在添加浓度为0.10%~1.00%时对生物量积累均有促进作用。PEG400、PEG1000、PEG2000和PEG4000均对黑木耳菌产胞外多糖有一定的抑制作用(图 4)。
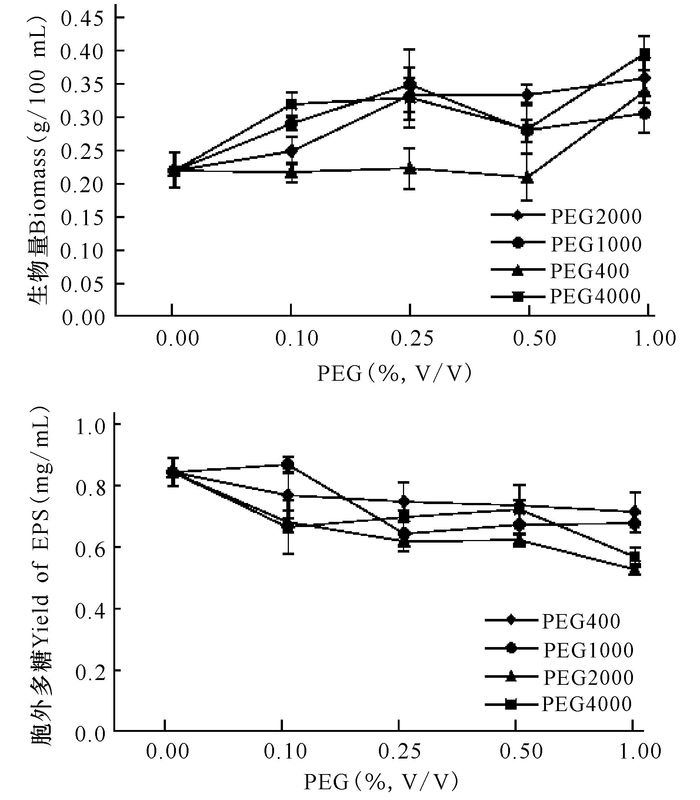
|
图 4 聚乙二醇对木耳发酵生物量和胞外多糖的影响 Fig.4 Effects of polyethylene glycol on biomass and EPS in submerged culture of A.auricula |
甲醇和乙醇在添加量为0.10%时,对生物量积累有一定的促进作用,但超过该浓度则抑制菌体生长,其余的醇均表现为抑制作用。乙醇、丙醇、丁醇在添加浓度为0.10%~1.00%时对木耳菌产胞外多糖有促进作用,木耳胞外多糖含量随着这些醇添加量的增加而增加。甲醇、乙醇、丙醇、丁醇在添加浓度为1.00%时,木耳胞外多糖含量分别是对照组的1.09倍,1.37倍,1.30倍和1.59倍(图 5)。
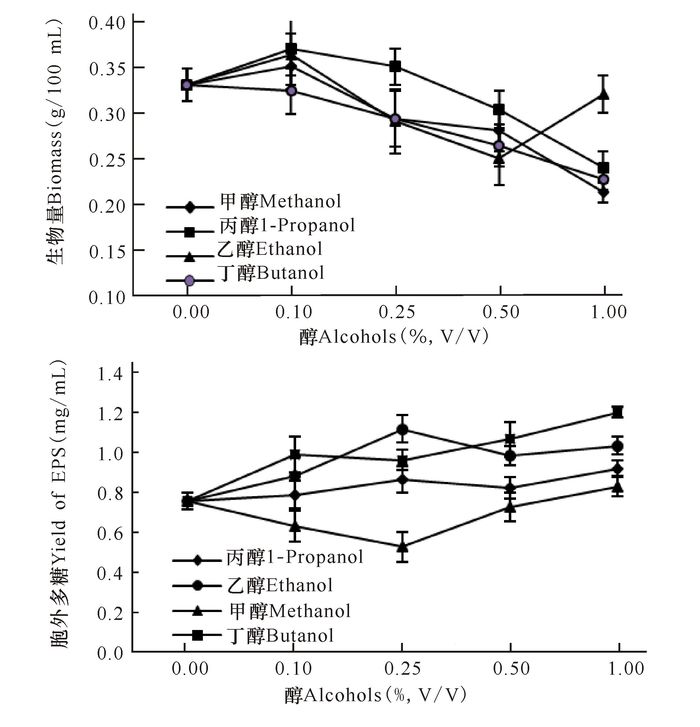
|
图 5 醇对木耳发酵生物量和胞外多糖的影响 Fig.5 Effects of alcohols on biomass and EPS in submerged culture of A.auricula |
根据上述实验,挑选出产木耳胞外多糖较好的4种促进剂:Tween40、硬脂酸、棕榈酸、油酸,设计4因素3水平正交试验共9组,试验设计见表 1,试验结果见表 2。
| 表 1 促进剂对黑木耳菌产胞外多糖的正交试验设计 Table 1 Orthogonal experiment design of stimulators on EPS in submerged culture of A.auricular |
| 表 2 促进剂对黑木耳菌产胞外多糖的正交试验结果 Table 2 Orthogonal experiment result of stimulators on EPS in submerged culture of A.auricula |
由表 2可知,促进剂对木耳菌产胞外多糖的影响主次顺序依次为油酸>Tween40>棕榈酸>硬脂酸。木耳多糖发酵生产的最佳添加剂组合为0.5% Tween40、1.5%硬脂酸、0.1%棕榈酸、0.25%油酸,最佳组合产胞外多糖为(2.39±0.153) mg/mL。
3 讨论近年来,为了提高木耳多糖的产量,主要采用优化发酵条件和营养组成等办法。有科研工作者从微生物自身代谢模式出发,通过增加外在因素改变真菌次级代谢产物[9, 17]。细胞膜磷脂的重要组成成分属于多不饱和脂肪酸,脂肪酸中作为原料参与形成细胞膜的磷脂双分子层,不饱和程度越高,双分子层排列越疏散,磷脂分子膜流动性增加,通透性增强,从而增加胞外次级代谢产物的产量。雷德柱等[18]的研究表明添加1%的棕榈酸、油酸对灰树花发酵生物量积累有明显的正效应;姚强等[13]发现在添加较低浓度(0.1%)的油酸、硬脂酸时,灵芝胞外多糖含量为最高。随着添加量增加,对胞外多糖反而表现为抑制。在本研究中,在添加0.10%~1.00%的脂肪酸时黑木耳菌生物量不断增加;在添加0.10%棕榈酸、油酸、亚油酸时,木耳胞外多糖含量达到最大值。在0.10%浓度刺激下,按照产木耳胞外多糖的效果排列有硬脂酸>棕榈酸>油酸>亚油酸。硬脂酸(C18) 和棕榈酸(C16) 属于饱和脂肪酸,油酸(一烯酸)和亚油酸(二烯酸)属于不饱和脂肪酸。脂肪酸不饱和度越低,木耳发酵产胞外多糖效果越好,这与雷德柱等[18]得到的结论相似,作用机理可能与生物膜结构有关。灵芝胞外多糖的合成与细胞的生长呈现复杂的部分偶联关系[19],木耳胞外多糖是菌丝体合成后分泌至胞外,其产量与菌体生物量有关,但并不呈线性关系。
在真菌液体发酵中常会有气泡,添加植物油等消泡剂后发现可以促进多糖含量的提高,花生油、玉米油、豆油、橄榄油等植物油富含单不饱和脂肪酸和多不饱和脂肪酸。不饱和脂肪酸在发酵中不仅具有消泡作用,而且还能通过参与形成细胞膜,改变细胞膜的通透性,进而改变胞外聚合物产量。雷德柱等[18]的实验中橄榄油在添加量为0.2%时灰树花生物量达到最大,在添加量为0.1%时胞外多糖达到最大。Park等[20]研究发现在添加2%的葵花油、橄榄油时,灵芝胞外聚合物达到最大值,花生油对胞外聚合物影响明显偏小。葵花油、橄榄油、花生油、玉米油等不同油脂中含有饱和脂肪酸、单不饱和脂肪、多不饱和脂肪酸比例不同[9],在本研究中按照产木耳胞外多糖效果排列有橄榄油>玉米油>花生油>葵花油。植物油中的不饱和脂肪酸参与细胞膜的形成,因此植物油作用机理可能与脂肪酸相似。
Tween和Span可拮抗脂肪酸的合成[9],加入表面活性剂后,细胞膜中脂肪酸的比例发生了变化,使菌体细胞膜的通透性增大更加有利于细胞向胞外分泌多糖。Hsieh等[15]研究表明:加入Tween80,灰树花生物量积累增加,并且用添加1%Span80获得最大生物量。Tween80和Span80对胞外多糖有抑制作用。Span20对灰树花的细胞生长以及对胞外多糖生产表现出的严重的抑制作用。本研究中Tween40、Span40对黑木耳产生物量和胞外多糖表现出较强的促进作用,按照产木耳胞外多糖效果排列:Tween40>Tween80>Span40>Span20,对产胞外多糖的促进作用,可能与拮抗脂肪酸的合成有关。
表面活性剂PEG附着细胞膜表面,并因此增加膜的疏水性,使细胞表面吸附营养物质,使得细胞吸收葡萄糖速率增加,从而增加多糖和生物量。Chen等[11]研究表明PEG分子量在8 000时对灰树花发酵体系产生物量和多糖效果最佳。在本研究中PEG400、PEG1000、PEG2000和PEG4000对黑木耳产胞外多糖均为抑制作用。Yang等[21]的研究显示脂肪醇可以很好地促进灵芝多糖和生物量的增长,添加1.5%的乙醇对生物量的积累效果最佳,添加2%的甲醇对灵芝产多糖的促进效果为最佳。本研究中添加醇之后胞外多糖的变化与Yang等[21]的研究结果基本吻合,按照黑木耳产胞外多糖效果排列为丁醇>乙醇>丙醇>甲醇,但醇对生物量积累表现为抑制,可能是黑木耳菌自身的原因,原理机制有待进一步研究。
4 结论在木耳发酵培养基中加入不同的促进剂,发现在添加1.00%的硬脂酸和棕榈酸时,黑木耳菌生物量分别为对照组的4.5倍和4.6倍;添加1.00%的花生油、葵花油、玉米油、橄榄油时,生物量分别为对照组的3.66倍、4.03倍、4.04倍和4.26倍;添加1.00%的Span40和Tween40时,生物量分别为对照组的4.9倍和3.5倍;聚乙二醇各分子量对生物量的影响并不显著;添加甲醇和乙醇在低浓度(0.1%)时对生物量有一定的促进作用,丙醇和丁醇对菌体生长有抑制作用。
不同促进剂种类及添加量显著影响木耳胞外多糖的生物合成,油酸、棕榈酸、亚油酸添加量在低浓度(0.10%)添加时达到最大值,分别是对照组的2.0倍、2.4倍和2.3倍,而硬脂酸在添加量为1.00%时达到最大值(为对照的2.5倍);添加不同植物油对木耳胞外多糖的生产影响差异较大,其中以添加1.0%的橄榄油,效果最佳,胞外多糖含量是对照组的1.6倍;添加0.50%的Tween40时,胞外多糖产量是对照组的3.4倍;PEG对木耳胞外多糖生产有抑制作用;添加1.00%的丁醇时木耳胞外多糖产量为对照组的1.59倍,而甲醇、乙醇、丙醇对木耳多糖生产的促进作用不显著。正交试验优化后黑木耳产胞外多糖促进剂的最佳组合是0.5% Tween40、1.5%硬脂酸、0.1%棕榈酸、0.25%油酸。
| [1] |
严泽湘, 陈启武, 刘建先. 食药用菌疗方1366例[M]. 北京: 农村读物出版社, 2002. YAN Z X, CHEN Q W, LIU J X. 1366 cases of medicinal herbs treatment[M]. Beijing: Rural Reading Press, 2002. |
| [2] |
张琳. 木耳的化学成分及药理作用研究[D]. 长春: 吉林农业大学, 2013. ZHANG L.Studies on the chemical constituents and pharmacological effects of Auricularia auricular-judae[D].Changchun:Jilin Agricultural University, 2013. |
| [3] |
樊一桥, 武谦虎, 盛健惠. 黑木耳多糖抗血栓作用的研究[J]. 中国生化药物杂志, 2009, 30(6): 410-412. FAN Y Q, WU Q H, SHENG J H. Study on the antithrombotic effect of polysaccharide of Auricularia auricular judae[J]. Chinese Journal of Biochemical Pharmaceutics, 2009, 30(6): 410-412. |
| [4] |
韩春然, 徐丽萍. 黑木耳多糖的提取、纯化及降血脂作用的研究[J]. 中国食品学报, 2007, 7(1): 54-58. HAN C R, XU L P. Studies on the extraction, purification and hypolipidemia activity of Auricularia auricular polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology, 2007, 7(1): 54-58. |
| [5] |
周国华. 黑木耳多糖抗衰老及降血脂生物功效的研究[D]. 哈尔滨: 东北农业大学, 2005. ZHOU G H.Research on Auricularia auricular polysaccharide antiaging and regulating blood lipid[D].Harbin:Northeast Agricultural University, 2005. |
| [6] |
赛福丁·阿不拉, 王君敏, 米克热木·沙衣布扎提. 多糖及其硫酸化衍生物的抗病毒及免疫增强活性研究进展[J]. 天然产物研究与开发, 2013, 25(4): 572-575. SAIFUDING A, WANG J M, MIKEREMU S, et al. Progress on antivirus and immune enhancement activities of polysaccharides and sulfated derivatives[J]. Natural Product Research and Development, 2013, 25(4): 572-575. |
| [7] |
黄滨南, 张秀娟, 邹翔, 等. 黑木耳多糖抗肿瘤作用的研究[J]. 哈尔滨商业大学学报:自然科学版, 2004, 20(6): 648-651. HUANG B N, ZHANG X J, ZOU X, et al. Study on anti-tumor effects of Auricularia auricular judae polysaccharide[J]. Journal of Harbin University of Commerce:Natural Science Edition, 2004, 20(6): 648-651. |
| [8] |
肖彩霞. 黑木耳液体深层发酵的研究[D]. 无锡: 江南大学, 2004. XIAO C X.Studies on the submerged fermentation of Auricularia auricular[D].Wuxi:Jiangnan University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10295-2004121431.htm |
| [9] |
全丽丽. 促进剂对桦褐孔菌液体深层发酵多糖产生和活性的影响[D]. 杭州: 浙江理工大学, 2015. QUAN L L.Stimultaneously stimulated productian and antioxidant activity of expolysaccharides and endopolysaccharides of Inonolus obliauus in submerged fermentation[D].Hangzhou:Zhejiang Sci-Tech University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10338-1015564283.htm |
| [10] |
HUANG H C, CHEN C I, HUNG C N, et al. Experimental analysis of the oil addition effect on mycelia and polysaccharide productions in Ganoderma lucidum submerged culture[J]. Bioprocess and Biosystems Engineering, 2009, 32(2): 217-224. DOI:10.1007/s00449-008-0239-z |
| [11] |
CHEN H B, HUANG H C, CHEN C I, et al. The use of additives as the stimulator on mycelial biomass and exopolysaccharide productions in submerged culture of Grifola umbellata[J]. Bioprocess and Biosystems Engineering, 2010, 33(3): 401-406. DOI:10.1007/s00449-009-0338-5 |
| [12] |
YANG H L, MIN W H, BI P Y, et al. Stimulatory effects of Coix lacryma-jobi oil on the mycelial growth and metabolites biosynthesis by the submerged culture of Ganoderma lucidum[J]. Biochemical Engineering Journal, 2013, 76: 77-82. DOI:10.1016/j.bej.2013.04.012 |
| [13] |
姚强, 高兴喜, 宫志远, 等. 不同脂肪酸对灵芝液体发酵的影响[J]. 食用菌学报, 2010, 17(3): 59-63. YAO Q, GAO X X, GONG Z Y, et al. Effect of fatty acid supplementation on mycelium biomass, polysaccharide and triterpene production by Ganoderma lucidum grown in submerged culture[J]. Acta Edulis Fungi, 2010, 17(3): 59-63. |
| [14] |
YANG F C, KE Y F, KUO S S. Effect of fatty acids on the mycelial growth and polysaccharide formation by Ganoderma lucidum in shake flask cultures[J]. Enzyme and Microbial Technology, 2000, 27(3/4/5): 295-301. |
| [15] |
HSIEH C, WANG H L, CHEN C C, et al. Effect of plant oil and surfactant on the production of mycelial biomass and polysaccharides in submerged culture of Grifola frondosa[J]. Biochemical Engineering Journal, 2008, 38(2): 198-205. DOI:10.1016/j.bej.2007.07.001 |
| [16] |
HSIEH C, LIU C J, TSENG M H, et al. Effect of olive oil on the production of mycelial biomass and polysaccharides of Grifola frondosa under high oxygen concentration aeration[J]. Enzyme and Microbial Technology, 2006, 39(3): 434-439. DOI:10.1016/j.enzmictec.2005.11.033 |
| [17] |
谢意珍, 周静文, 李崇. 黑木耳液体发酵条件的优化及发酵物的降血脂功能[J]. 食用菌学报, 2008, 15(2): 50-53. XIE Y Z, ZHOU J W, LI C. Optimization of conditions for submerged culture of Auricularia auricular and hypolipidemic function of mushroom fermentation products[J]. Acta Edulis Fungi, 2008, 15(2): 50-53. |
| [18] |
雷德柱, 高大维, 于淑娟. 植物油和脂肪酸对灰树花深层发酵的作用[J]. 微生物学通报, 2002, 29(1): 19-22. LEI D Z, GAO D W, YU S J. Effect of vegetable oil and fatty acid on the submerged fermentation of Grifola frondosa[J]. Microbiology, 2002, 29(1): 19-22. |
| [19] |
徐鹏, 钱竹, 董亮, 等. 灵芝深层发酵生产胞外多糖和灵芝酸的动力学分析[J]. 应用与环境生物学报, 2008, 14(4): 562-565. XU P, QIAN Z, DONG L, et al. Kinetic analysis of exopolysaccharide and ganoderic acid production by submerged culture of Ganoderma lucidum[J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(4): 562-565. |
| [20] |
PARK J P, KIM S W, HWANG H J, et al. Stimulatory effect of plant oils and fatty acids on the exo-biopolymer production in Cordyceps militaris[J]. Enzyme and Microbial Technology, 2002, 31(3): 250-255. DOI:10.1016/S0141-0229(02)00099-6 |
| [21] |
YANG H L, WU T X, ZHANG K C. Enhancement of mycelial growth and polysaccharide production in Ganoderma lucidum (the Chinese medicinal fungus, Lingzhi) by the addition of ethanol[J]. Biotechnology Letters, 2004, 26(10): 841-844. DOI:10.1023/B:BILE.0000025888.93564.a0 |
 2017, Vol. 24
2017, Vol. 24 


