2. 中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003;
3. 山东鲟龙渔业科技开发有限公司,山东 泗水 273211
2. Key Laboratory of Mariculture, Ministry of Education, College of Fishery, Ocean University of China, Qingdao, Shandong, 266003, China;
3. Shandong XunLong SCI-Tech CO., STD., Sishui, Shandong, 273211, China
【研究意义】鲟鱼是现存最古老的重要经济鱼类,素有“水中活化石”之称[1]。俄罗斯鲟在20世纪90年代被引入中国[2],其育苗成活率高、生长速度快、肉质好、抗病力强,迅速得到养殖户的青睐。尤其是其鱼子酱,因营养价值极高被冠以“黑色黄金”的美名[3],而且俄罗斯鲟体色优美,具有很高的观赏价值,是极具开发潜力的新品种。【前人研究进展】在集约化水产养殖过程中可能会产生多种多样的环境胁迫因子,如水温、盐度、光照、水质条件和养殖密度等[4]。其中养殖密度是生产上的关键性因素,也是一种重要的环境胁迫因子,国外已有许多关于拥挤胁迫对鱼类免疫功能影响的报道[5-6],但在国内却鲜有报道。自由基是鱼体进行正常生理活动所必需的生物活性物质,但同时对其体内大分子生物物质、细胞或组织具有很强的毒性作用[7]。在正常情况下,鱼体内自由基会维持一个相对稳定的状态,新的自由基不断产生的同时一部分自由基被机体清除[8]。但作为水生低等脊椎动物,鱼类易受到外界环境胁迫因子的影响,导致体内超氧化物歧化酶(SOD)活性降低,打破自由基稳态平衡,引起体内自由基含量增多,易与生物膜中多不饱和脂肪酸发生脂质过氧化反应,使得机体丙二醛(MDA)含量上升,进而对机体造成损伤[9]。【本研究切入点】国内关于拥挤胁迫对鲟鱼免疫功能影响研究尚无。【拟解决的关键问题】研究养殖密度对俄罗斯鲟幼鱼非特异性免疫功能的影响,为探明养殖密度对鱼类影响的作用机制和鲟鱼生产实践中日常养殖管理提供借鉴。
1 材料和方法 1.1 实验条件在山东省鲟龙渔业科技开发有限公司进行实验,实验鱼体质健康,规格一致,由同一批受精卵孵化而成,平均初始体重为(29.70±1.32) g,平均体长为(17.06±0.56) cm。采用流水池塘养殖模式,实验池为9个正边形室外水泥池,池底面积18.23 m2,每个水泥池设有一个进水口和一个位于池底中央的出水口,水深控制在47 cm左右。实验用水为当地地下井水,水质无污染,经曝气池曝气,进水口水流速为4.0 m3/L。池中溶氧水平为(7.52±1.05) mg/L,水温保持在(17.05±1.62)℃水平,pH值为(7.64±0.52),氨氮含量在(0.028±0.006) mg/L。
实验饲料为宁波天邦股份有限公司生产的人工配合饲料。
1.2 方法 1.2.1 实验设计与日常管理设3个养殖密度:SD1组(低密度组)、SD2组(中密度组)、SD3组(高密度组),不同养殖密度的初始放养量分别为700尾、1 000尾和1 300尾,初始养殖密度分别为2.5 kg/m3、3.6 kg/m3、4.7 kg/m3,每个密度组设3个重复。实验用鱼先暂养3 d,期间不投喂饵料,之后正常投喂和测定各项指标,实验历时90 d。实验期间,每天8:00, 16:00和21:00投喂3次配合饲料,每天总投饵量为鱼体重1.5% ~ 3%,以投喂完30 min后池内无剩余饵料为准,稍作调整。实验期间,每天监测温度、溶解氧、pH值,每隔10 d测氨氮浓度。每10 d抽样一次,每次每池随机取80尾鱼称湿重,重复3次,以此估算平均体重,并以此来决定投饵量。
1.2.2 样品采集实验期间,每10 d采样一次,采样前12 h停止投喂饲料,每次每池取5尾鱼,用MS-222(100 mg/L)快速麻醉。尾静脉采血,血样4℃静置6 h后,在3 000 r/min下离心10 min,吸取上清放置-80℃保存。解剖取脾脏、肝脏,置于-80℃保存。
1.2.3 指标的测定补体因子C3、谷草转氨酶(AST)和谷丙转氨酶(ALT)通过BS-180全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)测定,补体因子C3采用免疫透射比浊法,ALT和AST采用IFCC法。
超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法(羟胺法)测定:通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基O2-,羟胺被氧化生成亚硝酸盐,遇显色剂变成紫红色,再利用分光光度计测吸光度。当被测样品中含有SOD时,则对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管的吸光度值,通过公式即可计算出被测样品的SOD活性。丙二醛(MDA)采用TBA法测定:MDA在高温或酸性条件下可与2-硫代巴比妥酸(TBA)反应生成红棕色产物3,5,5 -三甲基恶唑2,4-二铜(三甲川),该物质在532 nm处有一吸收高峰,并且在600 nm处有较小吸光值,根据其吸光值可测出丙二醛含量。溶菌酶(LZY)采用试管比浊法测定:一定浓度的混浊细菌溶液中,由于溶菌酶水解细菌细胞壁黏多肽使细菌裂解,浓度降低,透明度增强,就可以根据浊度变化来推测溶菌酶的含量。
SOD活性(U/mL)= [(对照管吸光度-测定管吸光度)/对照管吸光度]/50%×反应体系的稀释倍数×样本测试前的稀释倍数。
MDA含量(nmol/mL)=[(测定管吸光度-测定空白管吸光度)/(标准管吸光度-标准空白吸光度)]×标准品浓度(10 nmol/mL)×样本测试前稀释倍数。
溶菌酶活性(U/mL)=(测定管吸光度-测定空白管吸光度)/样品量×样本测试前稀释倍数。
1.3 数据统计与检验数据用SPSS19.0统计软件进行处理,利用方差分析(ANOVA)中的Duncan多重比较来检验密度处理对俄罗斯鲟幼鱼相关抗氧化、代谢以及免疫指标的显著性,P<0.05为差异显著,P<0.01为差异极显著,所得数据均用平均值±标准误(Mean ± SEM)表示。
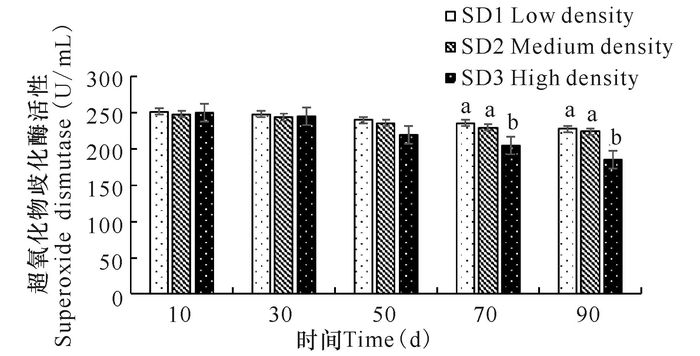
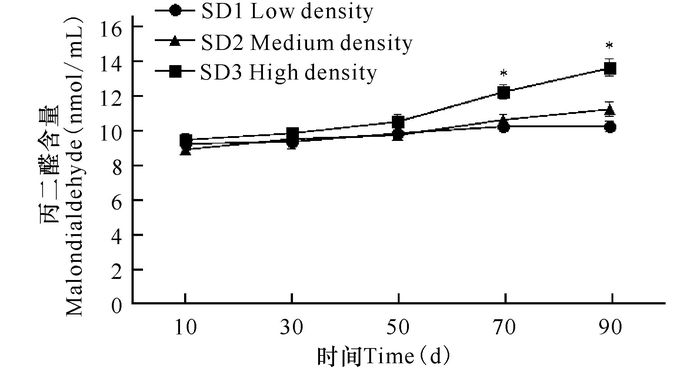
2 结果与分析 2.1 养殖密度对俄罗斯鲟幼鱼抗氧化功能的影响由图 1可知,各密度组SOD活性随着时间的推移均呈现下降的趋势,自70 d起,SD3组SOD活性显著低于SD1和SD2组(P<0.05)。各密度组俄罗斯鲟幼鱼丙二醛含量随着时间呈现逐渐升高的趋势(图 2),自70 d起,SD3组MDA含量显著高于SD1和SD2组(P<0.05)。
|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 1 养殖密度对俄罗斯鲟幼鱼超氧化物歧化酶活性的影响 Fig.1 The effects on the activity of SOD in Russian sturgeon at different stocking densities |
|
图 2 养殖密度对俄罗斯鲟幼鱼丙二醛的影响 Fig.2 The variation of MDA content of Russian sturgeon at different stocking densities |
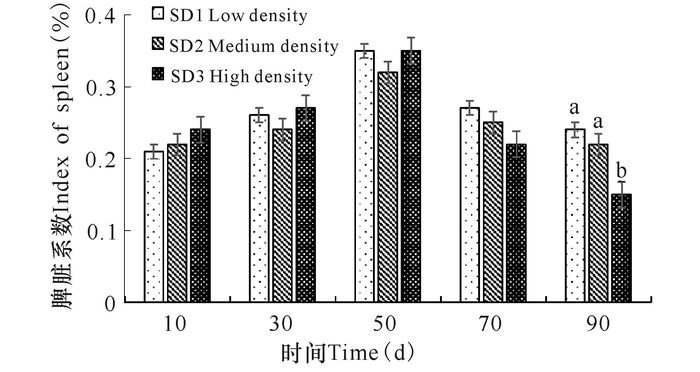
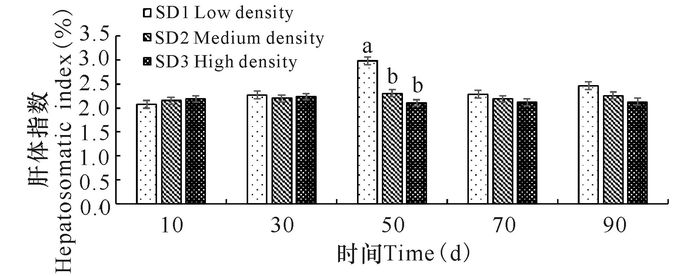
不同养殖密度组俄罗斯鲟幼鱼脾脏系数在整个实验期间整体呈现先上升后下降的趋势,在第50天时达到最大值,第90天时,SD3组幼鱼脾脏系数显著低于SD1、SD2组水平(图 3)。各密度组俄罗斯鲟幼鱼肝体指数初始最终波动不显著(P>0.05),在50 d时,SD1组肝体指数显著高于SD2、SD3组,自50 d后肝体指数随养殖密度增加逐渐降低(图 4)。
|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 3 养殖密度对俄罗斯鲟幼鱼脾脏系数的影响 Fig.3 The variation of index of spleen in Russian sturgeon at different stocking densities |
|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 4 养殖密度对俄罗斯鲟幼鱼肝体指数的影响 Fig.4 The variation of index of hepatosomatic in Russian sturgeon at different stocking densities |
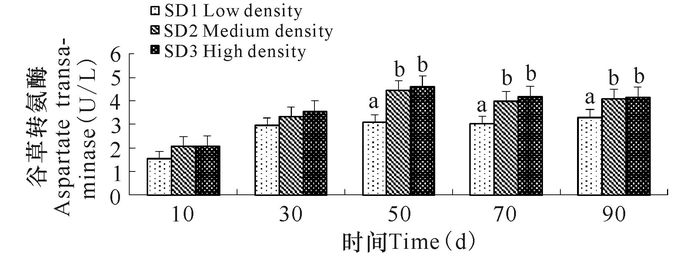
不同养殖密度俄罗斯鲟幼鱼谷草转氨酶和谷丙转氨酶呈现出相似的变化趋势,均随着养殖密度的增加和时间的推移活性逐渐增加,且SD2组、SD3组酶活性显著高SD1组(P<0.05)(图 5,图 6)。

|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 5 养殖密度对俄罗斯鲟幼鱼谷丙转氨酶的影响 Fig.5 The variation of index of alanine aminotransferase in Russian sturgeon at different stocking densities |
|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 6 养殖密度对俄罗斯鲟幼鱼谷草转氨酶影响 Fig.6 The variation of index of aspartate transaminase in Russian sturgeon at different stocking densities |
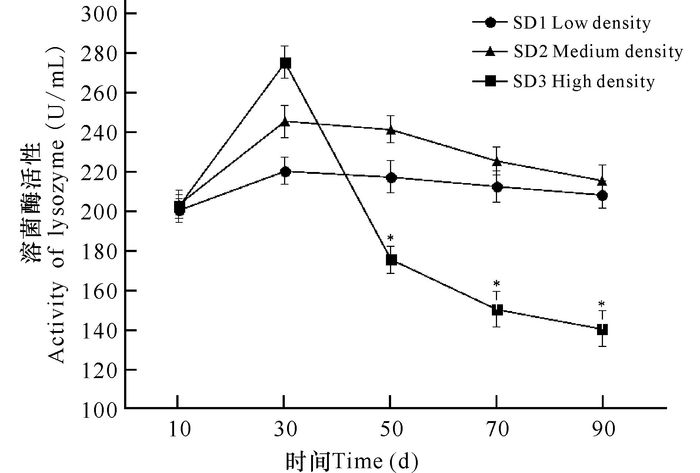
由图 7可知,溶菌酶活性随时间呈现先上升后下降的趋势,在第30天时达到最大值,自30 d起SD3组俄罗斯鲟幼鱼溶菌酶活性急剧降低,50 d以后低于正常水平,且与SD1、SD2组具有显著性差异(P<0.05)。而SD1、SD2组溶菌酶活性虽然略有升高但并无显著性变化。各密度组幼鱼C3补体因子与溶菌酶活性变化相似,也是随时间呈现出先上升后下降的趋势,但最终随着密度增加, C3含量降低,且各组间差异性显著(P<0.05)(图 8)。
|
图 7 养殖密度对俄罗斯鲟幼鱼溶菌酶活性的影响 Fig.7 Effects on the activity of lysozyme in Russian sturgeon at different stocking densities |

|
相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) The same small letter superscripts or no letter superscripts mean no significant differences(P > 0.05), different small letter superscripts mean significant differences(P < 0.05) 图 8 养殖密度对俄罗斯鲟幼鱼C3补体因子的影响 Fig.8 The effects on C3 in Russian sturgeon at different stocking densities |
普遍认为,自由基是鱼体完成各项生理生化调节活动不可或缺的活性物质,但同时它也是体内其他活性物质、细胞甚至组织的重大威胁[10]。鱼体在进行各项生命活动中均会生成新的自由基,在抗氧化酶和抗氧化剂的协同作用下自由基又会被消耗掉,使之维持相对自稳态。但当鱼体受到外界环境因子胁迫后,会迫使鱼体加强各种生理活动来应对胁迫,从而自由基含量短时间内急剧增加,而鱼体自身抗氧化系统无法将新生的自由基完全清除,进而会影响鱼体各项生理活动的正常运行,使机体处于胁迫状态,最终会对鱼体本身产生损伤[11]。
本研究中,初始SOD活性以及MDA含量各密度组并无显著性差异,随着养殖密度的增加,自70 d起,SD3组SOD活性显著低于SD1组、SD2组(P<0.05),且同时MDA含量显著高于SD1组、SD2组(P<0.05)。SOD是细胞内清除氧自由基的主要酶,其活力的高低间接反映了机体清除自由基的能力,当机体的氧自由基含量过多时,SOD消耗增加,体内含量下降[12]。MDA是脂质过氧化物的主要分解产物,MDA含量升高实际上是氧自由基产生过多,脂质过氧化反应增强,脂质过氧化物增多的表现[13]。它是一种具有很强生物毒性的物质,因而会对机体造成损伤。在遭受低氧胁迫后的褐斑牙鲆(Paralichthys olivaceus)幼鱼肌肉中MDA含量显著升高,给机体造成氧化性损伤[14]。从实验结果可以看出,过分提高养殖密度,将会导致俄罗斯鲟幼鱼出现拥挤胁迫,使机体的自由基“稳态性动态平衡”遭受破坏,影响机体的正常生理状态。
3.2 养殖密度与俄罗斯鲟脾脏系数、肝体指数和代谢酶的关系脾脏是血液循环中的过滤器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。此外,脾脏还可以合成免疫球蛋白、补体等免疫物质,发挥免疫作用[15]。在本研究中,实验90 d后SD3组俄罗斯鲟幼鱼脾脏系数显著低于SD1组、SD2组水平(P<0.05),表明长期的拥挤胁迫致使高密度组俄罗斯鲟幼鱼脾脏严重受损。王文博等[16]对草鱼(Ctenopharyngodon idellus)的研究也发现,鱼体在遭受慢性拥挤胁迫60 d后,中、高密度组鱼体的脾脏受到严重损伤。李爱华[17]的研究也得到相似结论。
肝脏是鱼体中大部分酶进行代谢活动的主要场所,储存大量肝糖元,还起着关键的生物转化作用,可以将鱼体维持生命活动所需葡萄糖、蛋白质、脂肪等营养物质进行相互转化,因此肝体指数常用作衡量鱼体品质的一个重要指标[18-19]。研究中肝体指数在50 d时SD2组、SD3组显著低于低密度组SD1(P<0.05),且随着密度增加呈现出愈加降低的趋势,这表明较高的养殖密度对俄罗斯鲟幼鱼产生拥挤胁迫,影响了鱼体正常生命活动的进行。诸多研究表明鱼体在遭受外界环境胁迫后会通过糖异生作用为机体抵御胁迫、维持正常生理活动的进行提供能量,正常鱼体血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活性是极低的[20],其主要存在于肝脏或者心肌中,本研究中俄罗斯鲟幼鱼血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活性显著升高,且随养殖密度增加而增加,高密度组显著高于低密度组(P<0.05),这表明俄罗斯鲟幼鱼在经受拥挤胁迫后,机体通过糖异生作用消耗更多的蛋白质和脂肪来提供能量。李波等[21]也发现黄颡鱼在氨氮慢性胁迫下其ALT和AST的活性均升高;Tejpal等[22]对鲮鱼(Cirrhinus mrigala)的研究中也发现,较高的养殖密度会促使鱼体加强糖异生作用来应对拥挤胁迫。
3.3 养殖密度与俄罗斯鲟非特异性免疫功能的关系溶菌酶广泛存在于鱼类的血清、皮肤黏液和组织器官当中,具有各种不同的生理生化作用,包括非特异性的防御感染免疫反应、血凝作用, 间隙连接组织的修复, 参与粘多糖的生物合成代谢及抗菌等[23], 在防御系统中扮演一个重要角色。鱼类的非特异性免疫功能在它的防御系统中占主要地位。Montero等[24]认为,鱼体受到急性胁迫后,通常会引起溶菌酶水平的提高。所以在本研究初期各密度组俄罗斯鲟幼鱼溶菌酶活性呈现出上升的趋势。补体作为鱼类免疫系统的重要组成成分,具有杀菌、溶菌、灭活病毒等作用,作为抗体和吞噬细胞间连接的中介,鱼类补体能够增强体液和细胞介导的特异性免疫,而且在宿主非特异性自然防御机制中发挥重要作用,其中C3被认为是补体系统的关键成分[25-26]。在本研究中高密度SD3组俄罗斯鲟幼鱼C3含量显著低于SD1组、SD2组水平,表明长期的拥挤胁迫引起了补体活性或浓度的下降,或是补体中某些蛋白组份的失活,从而阻断了补体的激活途径,使其不能发挥杀菌功能。
高密度组俄罗斯鲟幼鱼在长期拥挤胁迫后,血液溶菌酶活性受到严重抑制,显著低于正常值,补体C3因子含量也显著降低,表明高密度养殖对俄罗斯鲟免疫功能具有明显的抑制效应,且随密度增加抑制效应愈加严重。
4 结论由实验结果可以看出,过分提高养殖密度,将会导致俄罗斯鲟幼鱼出现拥挤胁迫,使机体的自由基“稳态性动态平衡”遭受破坏,影响机体的正常生理状态,肝脏和脾脏均受损,免疫功能也受到一定程度的抑制,且随养殖密度增加抑制效应愈加严重。说明俄罗斯鲟幼鱼以较低养殖密度流水放养是安全的,不会对鱼体健康产生损害。但超过一定密度后,机体免疫功能可能就会受到抑制,而且密度越大,时间越长,抑制程度就越深,也更容易引发鱼病。
| [1] |
姜礼燔. 世界鲟鱼资源及养殖前景[J]. 中国渔业经济, 1998(2): 33-35. JIANG L F. The current world status in sturgeon resources and the future cultivation prospects[J]. Chinese Fisheries Economics, 1998(2): 33-35. |
| [2] |
冯广朋, 庄平, 章龙珍, 等. 我国鲟鱼类养殖现状及发展前景[J]. 海洋渔业, 2004, 26(4): 317-320. FENG G P, ZHUANG P, ZHANG L Z, et al. Status quo and prospects of sturgeon aquaculture in China[J]. Marine Fisheries, 2004, 26(4): 317-320. |
| [3] |
石振广, 董双林, 王云山, 等. 我国鲟鱼养殖业现状及问题分析[J]. 中国渔业经济, 2008, 26(2): 58-62. SHI Z G, DONG S L, WANG Y S, et al. Status and problems confronted in sturgeon aquaculture in China[J]. Chinese Fisheries Economics, 2008, 26(2): 58-62. |
| [4] |
PICKERING A D, STEWART A. Acclimation of the interrenal tissue of the brown trout, Salmo trutta L., to chronic crowding stress[J]. Journal of Fish Biology, 1984, 24(6): 731-740. DOI:10.1111/jfb.1984.24.issue-6 |
| [5] |
FEVOLDEN S E, RØED K H, FJALESTAD K. A combined salt and confinement stress enhances mortality in rainbow trout (Oncorhynchus mykiss) selected for high stress responsiveness[J]. Aquaculture, 2003, 216(1/2/3/4): 67-76. |
| [6] |
WAFA A H, PIERRE D, DANIEL B. Modelling growth and food intake rhythms of brook trout Salvelinus fontinalis under the effects of density and ration[J]. Ecological Modelling, 2004, 175(4): 385-394. DOI:10.1016/j.ecolmodel.2003.10.024 |
| [7] |
方春华, 乔琨, 刘智禹, 等. 海洋生物中抗氧化酶的研究进展[J]. 渔业研究, 2016, 38(4): 331-342. FANG C H, QIAO K, LIU Z Y, et al. The research progress of antioxidant enzymes in marine organisms[J]. Journal of Fisheries Research, 2016, 38(4): 331-342. |
| [8] |
段绍瑾. 氧化应激[M]//方允中, 郑荣梁. 自由基生物学的理论与应用. 北京: 科学出版社, 2002: 454-494. DUAN S J.Oxidative stress[M]//FANG Y Z, ZHENG R L (eds.).Theory and application of free radical biology.Beijing:Science Press, 2002:454-494. |
| [9] |
MOURENTE G, DIAZ-SALVAGO E, BELL J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil:Attenuation by dietary vitamin E[J]. Aquaculture, 2002, 214(1/2/3/4): 343-361. |
| [10] |
方允中, 杨胜, 伍国耀. 自由基、抗氧化剂、营养素与健康的关系[J]. 营养学报, 2003, 25(4): 337-343. FANG Y Z, YANG S, WU G Y. Free radicals, antioxidants, and nutrients in relation to health[J]. Acta Nutrimenta Sinica, 2003, 25(4): 337-343. |
| [11] |
柏华, 刘佳, 刘福柱. 自由基的研究进展[J]. 江西饲料, 2007(3): 1-4. BAI H, LIU J, LIU F Z. Research progress of free radical[J]. Jiangxi Feed, 2007(3): 1-4. |
| [12] |
孙金辉, 王庆奎, 陈成勋, 等. 嗜水气单胞菌灭活疫苗对虹鳟免疫力和抗病力的影响[J]. 淡水渔业, 2013, 43(1): 44-49. SUN J H, WANG Q K, CHEN C X, et al. Effects of inactivated Aeromonas hydrophila vaccine on immunity and disease resistance of Oncorhynchus mykiss[J]. Freshwater Fisheries, 2013, 43(1): 44-49. |
| [13] |
彭士明, 尹飞, 孙鹏, 等. 不同饲料对银鲳幼鱼增重率、肝脏脂酶及抗氧化酶活性的影响[J]. 水产学报, 2010, 34(6): 769-774. PENG S M, YIN F, SUN P, et al. Effects of different diets on weight gain, hepatic lipase and antioxidant enzyme of juvenile silver pomfret (Pampus argenteus)[J]. Journal of Fisheries of China, 2010, 34(6): 769-774. |
| [14] |
李洁, 唐夏, 张灵燕, 等. 溶解氧水平对褐牙鲆幼鱼能量代谢和氧化应激的影响研究[J]. 广西科学院学报, 2015, 31(1): 22-27. LI J, TANG X, ZHANG L Y, et al. Study on the energy metabolism and oxidative stress of juvenile brown flounder, Paralichthys olivaceus in dissolved oxygen content descending water[J]. Journal of Guangxi Academy of Sciences, 2015, 31(1): 22-27. |
| [15] |
张永安, 孙宝剑, 聂品. 鱼类免疫组织和细胞的研究概况[J]. 水生生物学报, 2000, 24(6): 648-654. ZHANG Y A, SUN B J, NIE P. Immune tissues and cells of fish:A review[J]. Acta Hydrobiologica Sinica, 2000, 24(6): 648-654. |
| [16] |
王文博, 李爱华, 汪建国, 等. 拥挤胁迫对草鱼非特异性免疫功能的影响[J]. 水产学报, 2004, 28(2): 139-144. WANG W B, LI A H, WANG J G, et al. The effect of crowding stress on non-specific immune functions of Ctenopharyngodon idellus[J]. Journal of Fisheries of China, 2004, 28(2): 139-144. |
| [17] |
李爱华. 拥挤胁迫对草鱼血浆皮质醇、血糖及肝脏中抗坏血酸含量的影响[J]. 水生生物学报, 1997, 21(4): 384-386. LI A H. Effects of crowding stress on plasma cortisol, glucose and liver ascorbic acid in Grass carp (Ctenopharyngodon idellus)[J]. Acta Hydrobiologica Sinica, 1997, 21(4): 384-386. |
| [18] |
殷帅文, 林学群, 陈洁辉. 谈谈鱼类的比肝重及其意义[J]. 科学养鱼, 2002(9): 54-54. YIN S W, LIN X Q, CHEN J H. The importance of fish hepatosomatic index[J]. Scientific Fish Farming, 2002(9): 54-54. |
| [19] |
区又君, 柳琪, 刘泽伟. 3种笛鲷的含肉率、肥满度、比肝重和肌肉营养成分的分析[J]. 大连海洋大学学报, 2006, 21(3): 287-289. OU Y J, LIU Q, LIU Z W. Addressed rates, condition factors, hepatosomatic index and approximate compositions of muscles in emperor snapper (Lutjanus sebae), red snapper (L.erythopterus) and silver snapper (L.argentimacualtus)[J]. Journal of Dalian Fisheries University, 2006, 21(3): 287-289. |
| [20] |
侯俊利, 庄平, 冯琳, 等. 铅暴露与排放对中华鲟幼鱼血液中ALT、AST活力的影响[J]. 生态环境学报, 2009, 18(5): 1669-1673. HOU J L, ZHUANG P, FENG L, et al. Effects of lead on activity of ALT and AST in serum of juvenile Chinese sturgeon, Acipenser sinensis[J]. Ecology and Environmental Sciences, 2009, 18(5): 1669-1673. |
| [21] |
李波, 樊启学, 杨凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J]. 应用与环境生物学报, 2011, 17(6): 824-829. LI B, FAN Q X, YANG K, et al. Effects of chronic ammonia stress on foraging, growth, and haematological parameters of yellow catfish (Pelteobagrus fulvidraco) juveniles[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 824-829. |
| [22] |
TEJPAL C S, PAL A K, SAHU N P, et al. Dietary supplementation of L-tryptophan mitigates crowding stress and augments the growth in Cirrhinus mrigala fingerlings[J]. Aquaculture, 2009, 293(3/4): 272-277. |
| [23] |
吴晓英, 林影, 陈慧英. 溶菌酶的研究进展[J]. 工业微生物, 2002, 32(4): 55-58. WU X Y, LIN Y, CHEN H Y. Advances in lysozyme research[J]. Industrial Microbiology, 2002, 32(4): 55-58. |
| [24] |
MONTERO D, IZQUIERDO M S, TORT L, et al. High stocking density produces crowding stress altering some physiological and biochemical parameters in gilthead seabream, Sparus aurata, juveniles[J]. Fish Physiology and Biochemistry, 1999, 20(1): 53-60. DOI:10.1023/A:1007719928905 |
| [25] |
BOSHRA H, LI J, SUNYER J O. Recent advances on the complement system of teleost fish[J]. Fish & Shellfish Immunology, 2006, 20(2): 239-262. |
| [26] |
HOLLAND M C H, LAMBRIS J D. The complement system in teleosts[J]. Fish & Shellfish Immunology, 2002, 12(5): 399-420. |
 2017, Vol. 24
2017, Vol. 24 


