2. 广西科学院生物物理实验室,广西 南宁 530007
2. Laboratory of Biophysis of Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
【研究意义】菝葜(Smilax china L.),又名金刚藤,其用药部位为百合科菝葜属植物的干燥根茎,为《中国药典》2010年版所收载品种,大多数分布于长江以南各省,其中贵州产33种、3变种,分布于全省各地,为贵州民间用中药,主要用于治疗痢疾、肠胃炎、风湿性关节痛和跌打损伤等,还可用于胃癌、食管癌、直肠癌、糖尿病等的治疗[1-2]。菝葜被广泛应用于治疗各种疾病,得益于其含有丰富的有效成分,如皂苷类、黄酮类、甾醇类等[3-4]。【前人研究进展】关于菝葜黄酮类成分的研究已有较多报道,且研究表明,黄酮化合物可能是菝葜发挥药效的主要物质基础[5-7]。目前菝葜有效成分提取仍采用传统提取技术——水提醇沉工艺,其活性成分很难得到保证,同时由于菝葜生长周期长,野生资源逐渐减少。因此,对现有提取工艺进行改革,可提高有效成分提取率从而达到充分利用植物资源和提高药物疗效的目的。【本研究切入点】酶法提取是一种较为新型的方法,具有提取黄酮类化合物的潜力。植物有效成分通常被包裹在细胞壁内,而细胞壁的主要成分为果胶质、纤维素和半纤维素等,用果胶酶和纤维素酶催化这些物质水解,破坏细胞壁,可减少扩散阻力,使细胞壁内的有效成分溶出。酶法提取条件温和、简单,克服活性成分在高温下易分解的缺点,是一种安全、有效、无污染的提取方法[8]。超声波是利用超声空化效应,破坏细胞组织,有助于细胞内的活性物质溶出和扩散,具有效率高、时间短的优点[9-10]。超声波辅助酶法兼具酶法和超声波法的优点,已用于芹菜总黄酮[11]、锁阳多糖[12]、香菇多糖[13]等方面的研究,但尚未见用于提取菝葜黄酮的相关报道。【拟解决的关键问题】以野生菝葜为原料,采用响应面法对超声波协同酶法提取菝葜总黄酮的工艺条件进行优化,从而选取最佳工艺参数,以检验超声波耦合生物酶法获得中药活性成分的可行性,以期为开发菝葜资源提供理论和实践依据。
1 材料与方法 1.1 材料野生菝葜采自贵州省都匀市,洗净烘干后,将其粉碎过80目筛,储藏备用;芦丁标准品购自中国药品生物制品检定所;纤维素酶(酶活力/(U/g)≥15 000,批号:20140319) 和果胶酶(酶活力/(U/g)≥50,批号:20131210) 购自国药集团化学试剂公司;实验过程中所用化学试剂均为国产分析纯。
超声波清洗器(昆山超声仪器有限公司);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);HH-S2型数显恒温水浴锅(郑州英峪予华仪器有限公司);AG-285型十万分之一电子天平(赛多利斯);PHS-3C型pH计(上海精密仪器);优普超纯水器(成都超纯水有限公司)。
1.2 方法 1.2.1 标准曲线绘制参照文献[14],标准曲线回归方程为Y=14.714X+0.0019,R2=0.999 8。
1.2.2 提取液制备及总黄酮得率测定称取1.00 g菝葜置于锥形瓶中,加入一定pH值水溶液,经超声波作用一段时间后,加入一定体积复合酶(等体积1 mg/mL果胶酶与1 mg/mL纤维素酶混合,下同),在一定温度下浸泡一定时间后,抽滤,离心;取上清液1 mL稀释一定倍数,按上述制作标准曲线方法分别加入化学试剂,在波长为508 nm下测定吸光度,代入回归方程计算样品液中黄酮类化合物的含量。按式(1) 计算样品得率:
| $Y = \frac{{c \times v \times n}}{{M \times 1000}} \times 100\% 。$ | (1) |
式中:Y是总黄酮得率,%;c是总黄酮浓度,mg/L;v是样品体积,mL;n是稀释倍数;M是菝葜质量,g。
1.3 单因素试验精密称取菝葜粉末1 g,加入50 mL一定pH值水溶液后,使用功率500 W超声波清洗器作用10~60 min,停止超声,加入一定量复合酶。依次以酶用量0.2 mL、0.4 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL; 酶解时间15 min、30 min、45 min、60 min、75 min、90 min); 酶解温度40℃、45℃、50℃、55℃、60℃、65℃; pH值4.0, 4.5, 5.0, 5.5, 6.0, 6.5;粒径50目、80目、100目、150目、200目为因素,提取液经过抽滤,离心,取上清液稀释一定倍数,按照1.2节项下测定溶液吸光度,考察以上因素对总黄酮提取率的影响。
1.4 响应面优化试验综合考虑单因素试检结果,固定超声波作用时间和料液比,筛选出对总黄酮得率影响显著的因素进行后续优化试验。利用Desing-Expert V8.0.6的中心组合试验设计原理,选取pH值(A)、酶解时间(B)、酶解温度(C)3个因素,以总黄酮得率为响应值,因素及水平见表 1。
| 表 1 响应面实验因素与水平 Table 1 Factors and levels of reponse surface analysis |
由图 1可知,随着超声波作用时间增加,总黄酮得率也随之增长;当超声波作用时间超过20 min后,总黄酮得率增加幅度明显变缓。这是因为随着作用时间的增加,溶质与溶剂的接触时间随之增加,总黄酮融入溶剂的量增多;20 min后总黄酮得率增幅明显降低,所以从节能降耗方面考虑,选取超声波作用时间20 min进行后续试验。

|
图 1 超声时间对总黄酮得率的影响 Fig.1 Effect of ultrasonic time on the extraction yield of total flavonoids |
由图 2可知,随着酶用量的添加,总黄酮得率逐步提高;酶添加量超过0.4 mL,总黄酮得率并没有显著增加。这可能是由于酶添加量低于最佳值时,酶解不彻底,黄酮溶出的量少;酶添加量大于0.4 mL时,虽然酶解反应彻底,但考虑到提取成本问题,因此选择添加0.4 mL复合酶溶液为宜。

|
图 2 酶用量对总黄酮得率的影响 Fig.2 Effect of enzyme loading on the extraction yield of total flavonoids |
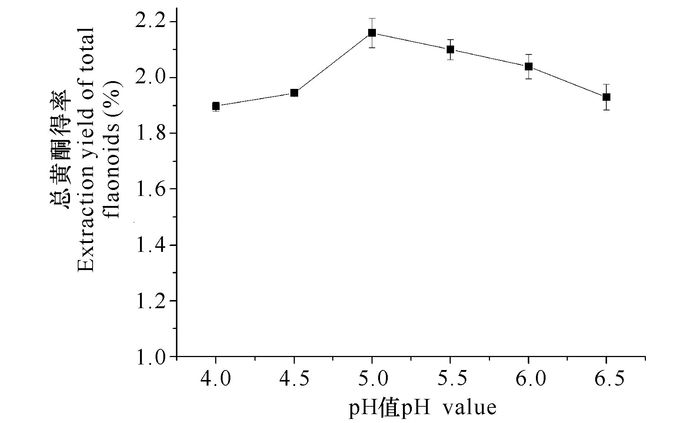
从图 3可看出,随着pH值的增加,总黄酮得率明显增加,pH值5.0时达到最高值,pH值继续增大,反而总黄酮提取率开始下降。这表明混合酶在pH值为5.0时具有较高的催化效率,所以选取pH值为5.0进行后续单因素试验。
|
图 3 pH值对总黄酮得率的影响 Fig.3 Effect of pH on the extraction yield of total flavonoids |
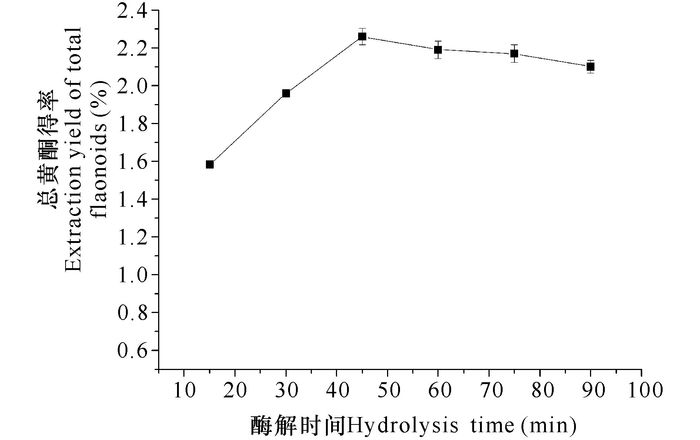
由图 4可知,菝葜总黄酮得率随酶解时间的增加不断升高,酶解时间为45 min时,达到最大值,45 min之后总黄酮得率开始缓慢下降。这是因为随着时间的增加,细胞内的黄酮释放融入溶剂中的量增多,但提取时间过长,溶液中的黄酮易被氧化,因此选择酶解时间为45 min进行后续试验。
|
图 4 酶解时间对总黄酮得率的影响 Fig.4 Effect of hydrolysis time on the extraction yield of total flavonoids |
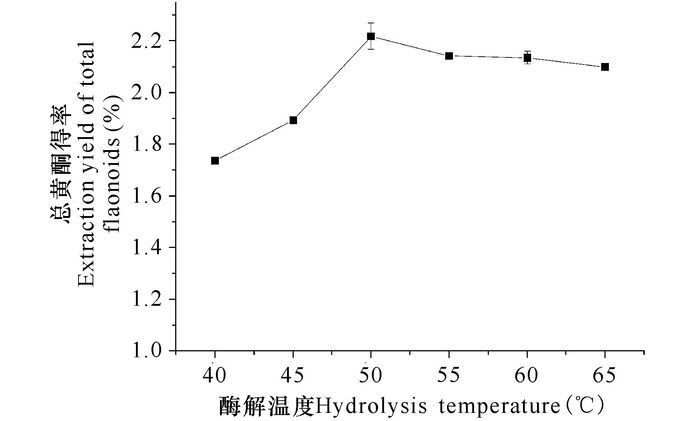
由图 5可知,酶解温度对总黄酮得率有显著影响。当温度小于50℃时,随着酶解温度升高,总黄酮得率逐渐增加,说明温度使酶的活性逐渐增强,促进复合酶对细胞壁的破坏,有利于黄酮释放,从而提高总黄酮得率;当温度高于50℃后,提取率明显开始降低,可能是由于高温导致酶活性降低,也可能是由于高温导致黄酮分子结构发生变化。因此选择酶解温度为50℃。
|
图 5 酶解温度对总黄酮得率的影响 Fig.5 Effect of hydrolysis temperature on the extraction yield of total flavonoids |
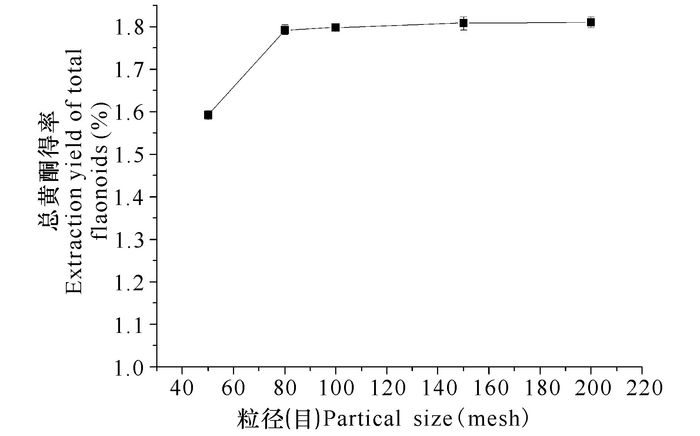
由图 6可知,随着菝葜粉末直径越来越小,总黄酮提取率也逐步升高;粉末直径越小,其植物细胞结构破坏越严重,而且表面与酶溶液的接触面积也增大,从而进一步提高总黄酮得率。80目以后,总黄酮提取率增幅不明显,从经济角度考虑,选择80目的粉末作为后续试验。
|
图 6 粉末粒径对总黄酮得率的影响 Fig.6 Effect of partical size on the extraction yield of total flavonoids |
采用Desing-Expert V8.0.6软件对表 2中菝葜总黄酮得率数据进行回归拟合分析,得到回归方程:
| 表 2 试验设计表及结果 Table 2 Experimental design of Box-Behnken and corresponding results |
Y=-15.28225+6.4025A-0.065133B+0.10775C+0.018667AB+0.031AC+1.3333×10-4 BC-0.877A2-3.85556×10-4B2-2.57×10-3C2,
式中:Y为总黄酮得率,A、B和C分别为pH值、酶解时间和酶解温度。
由表 3可知,P<0.000 1表明回归模型极度显著;失拟项P=0.445 6>0.05,表明失拟项差异不显著,说明回归模型与实验数据拟合度较高。R2=0.983 4,表明实测值与预测值高度相关,拟合度大于98%。在此试验设计中,模型方程的一次项C(P= 0.001 1<0.05) 影响显著;二次项A2、B2、C2的P值均小于0.001,表明影响均极显著;交互项AB和AC的P值均小于0.01,表明影响也极显著。此回归模型结果说明各因素对总黄酮得率的影响不是简单的线性关系。
| 表 3 方差分析结果 Table 3 Analysis of variance of Box-Behnken experiment |
对表 2实验结果进行二次多元回归拟合,得到二次回归方程的响应面图(图 7)。通过响应面三维图,即可知任意两因素之间交互作用对黄酮得率的影响,并从中确定提取工艺的最佳水平范围。由图 7可知,在所选的因素水平范围内存在最大值,即响应面的最高点。等高线形状越扁平表明因素之间的交互作用越显著,对响应值的影响越大[15]。还可以看出三维曲线图底部投影的等高线图呈椭圆,即pH值与酶解温度、酶解时间两者之间交互作用对黄酮得率的影响显著。

|
图 7 各交互作用对总黄酮得率影响的响应曲面 Fig.7 Response surface plots showing the interactive effects of different factors on the extraction yield of total flavonoids |
通过Design-Expert软件求解回归方程得到最优提取工艺参数pH值、酶解时间和酶解温度分别为5.10, 48.1 min和52.95℃时,提取率预测值达到2.325%。考虑到实验的可操作性,将提取工艺参数进行修正,选取pH值为5.10,酶解时间为48 min和酶解温度为53℃进行3次验证试验,黄酮得率平均值为2.289%,预测值和实验值相对误差1.54%,表明响应面法所建立回归方程所预测的优化提取工艺参数准确可靠,具有实用价值。
3 讨论试验采用超声波与生物酶法结合提取菝葜中黄酮类化合物。超声波在液体中通过高频振动,对菝葜粉末表面产生强大的剪切力,从而破坏植物细胞组织。超声波同时结合生物酶的高效、专一性,选择可以破坏植物细胞壁的纤维素酶和果胶酶,破坏植物细胞壁结构,使黄酮类化合物暴露并溶解或悬浮于溶剂中。基于以上原理建立超声耦合酶法提取菝葜黄酮类化合物,以期获得较高提取率。
实验发现,反应体系pH值、酶解温度和酶解时间对总黄酮得率都有显著影响。酶用量和粉末粒径虽然对黄酮提取率有一定影响,但随着酶用量和粒径目数增大,提取率增加并不显著,考虑到生产成本,故不再进一步优化。不同粉末粒径的提取率差异小的原因,可能是在超声作用过程中超声波空化致使细胞壁结构遭到破坏,变得松散。pH值和温度直接影响酶活力,生物酶作用于细胞壁需要一段时间,因此各因素之间不是独立存在的,而是具有一定的交互作用。
4 结论本实验在单因素的基础上筛选对黄酮得率影响显著的因素进行响应面优化分析,通过Design-Expert软件建立多元回归方程,得到最优工艺参数pH值、酶解时间和酶解温度分别为5.10, 48 min和53℃,在此条件下黄酮得率为2.289%,与预测值(2.325%)基本吻合。与传统提取方法相比,超声波辅助酶法具有选择性高、时间短、无有机溶剂污染等优点,且设备简单,有效成分溶出率显著提高,符合当今绿色化学技术的发展趋势,对菝葜有效成分的提取具有重要意义。
| [1] |
李时珍. 本草纲目(校点本)[M]. 北京: 人民卫生出版社, 1982: 1293-1296. LI S Z. Compendium of material medica[M]. Beijing: People's Medical Publishing House, 1982: 1293-1296. |
| [2] |
王志刚, 秦民坚, 郝利君, 等. 超声法提取菝葜中总黄酮的正交实验研究[J]. 中国野生植物资源, 2009, 28(5): 54-57. WANG Z G, QIN M J, HAO L J, et al. Orthogonal test of total flavonoids extraction from Smilax china L.jones by ultrasonic method[J]. Chinese Wild Plant Resources, 2009, 28(5): 54-57. |
| [3] |
徐燕, 王海燕, 蒋家月, 等. 菝葜中的甾体皂苷及其细胞毒活性[J]. 中国实验方剂学杂志, 2011, 17(11): 92-96. XU Y, WANG H Y, JIANG J Y, et al. Studies on steroidal saponins from Smilax china and their cytotoxic activities[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(11): 92-96. DOI:10.3969/j.issn.1005-9903.2011.11.029 |
| [4] |
李燕婧, 钟正贤, 陈学芬. 黄杞总黄酮的抗血栓作用及其机理研究[J]. 广西科学, 2015, 22(2): 143-147. LI Y J, ZHONG Z X, CHEN X F. Experimental study of total flavonoids of Engelhardtia roxburghiana on antithrombotic effects and its mechanisms[J]. Guangxi Sciences, 2015, 22(2): 143-147. |
| [5] |
晏绿金, 文莉, 干国平, 等. 菝葜抗炎活性物质筛选研究[J]. 中药材, 2008, 31(7): 1054-1056. YAN L J, WEN L, GAN G P, et al. Screening anti-inflammatory from Smilax china[J]. Journal of Chinese Medicinal Materials, 2008, 31(7): 1054-1056. |
| [6] |
曹波. 金刚藤含药血清对人肝癌SMMC-7721细胞POLD1基因表达的影响[D]. 南宁: 广西医科大学, 2013. CAO B.Effect of Smilax china L.containing serum on the expression of POLD1 mRNA in human hepatcarinoma[D].Nanning:Guangxi Medical University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10598-1013249844.htm |
| [7] |
范银洲, 向海艳, 罗艳琴, 等. RP-HPLC同时测定金刚藤4个黄酮类成分含量[J]. 中国实验方剂学杂志, 2014, 20(10): 62-65. FAN Y Z, XIANG H Y, LUO Y Q, et al. Determination of four flavonoids in Smilax china by RP-HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(10): 62-65. |
| [8] |
王芸芸, 李莉, 李香玉, 等. 复合酶法提取甘草渣中总黄酮[J]. 化学与生物工程, 2008, 25(8): 49-51. WANG Y Y, LI L, LI X Y, et al. Composite enzymatic extraction of total flavonoids from licorice slag[J]. Chemistry & Bioengineering, 2008, 25(8): 49-51. |
| [9] |
XIE J H, SHEN M Y, XIE M Y, et al. Ultrasonic-assisted extraction, antimicrobial and antioxidant activities of Cyclocarya paliurus (Batal.) Iljinskaja polysaccharides[J]. Carbohydrate Polymers, 2012, 89(1): 177-184. DOI:10.1016/j.carbpol.2012.02.068 |
| [10] |
PINGRET D, FABIANO-TIXIER A S, LE BOURVE-LLEC C, et al. Lab and pilot-scale ultrasound-assisted water extraction of polyphenols from apple pomace[J]. Journal of Food Engineering, 2012, 111(1): 73-81. DOI:10.1016/j.jfoodeng.2012.01.026 |
| [11] |
张翔宇, 谭兴和, 蔡文, 等. 超声波协同酶法提取芹菜中总黄酮的工艺优化[J]. 中国酿造, 2015, 34(1): 50-53. ZHANG X Y, TAN X H, CAI W, et al. Optimization of total flavonoids extraction technology from celery by ultrasonic-enzyme synergistic method[J]. China Brewing, 2015, 34(1): 50-53. DOI:10.11882/j.issn.0254-5071.2015.01.012 |
| [12] |
张慧瑛, 罗光宏, 郝军元, 等. 超声波-生物酶法提取锁阳多糖工艺优化及其抗肿瘤活性[J]. 食品科学, 2016, 37(12): 59-64. ZHANG H Y, LUO G H, HAO J Y, et al. Optimization of ultrasonic-assisted enzymatic extraction of polysaccharides from Cynomorium songaricum and their antitumor activity[J]. Food Science, 2016, 37(12): 59-64. DOI:10.7506/spkx1002-6630-201612010 |
| [13] |
张双灵, 李文香, 赵海燕, 等. 超声波协同酶法提取香菇多糖的工艺优化[J]. 食品科技, 2016, 41(3): 192-196. ZHANG S L, LI W X, ZHAO H Y, et al. Lentinan extraction by amylase assistant with ultrasonic[J]. Food Science and Technology, 2016, 41(3): 192-196. |
| [14] |
黄德娜, 李锋, 曾承露. 复合酶法提取鱼腥草中黄酮类化合物工艺优化[J]. 食品科技, 2016, 41(7): 211-216. HUANG D N, LI F, ZENG C L. Optimizing conditions for enzymatic extraction of flavonoids from Houttuynia cordata Thund[J]. Food Science and Technology, 2016, 41(7): 211-216. |
| [15] |
宋丽军, 侯旭杰, 李雅雯, 等. 核桃青皮中多酚的超高压提取工艺优化[J]. 食品与机械, 2015, 31(4): 178-182. SONG L J, HOU X J, LI Y W, et al. Extra-high pressure extraction of polyphenols from walnut green peels by response surface methodology[J]. Food & Machinery, 2015, 31(4): 178-182. |
 2017, Vol. 24
2017, Vol. 24 


