2. 广西大学动物科学技术学院,广西南宁 530004
2. College of Animal Science and Technology, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】大型底栖动物是红树林生态系统中的主要类群之一,是系统中能量流动、物质循环中的消费者和转移者[1]。红树林生态系统复杂多样的生境结构,为生活于其中的生物提供了丰富的食物来源和重要的栖息繁衍场所[2]。由于红树林生态系统处于陆海交界处,受潮汐和陆源性碳的输入影响,其生境中大型底栖动物的食物来源也变得多源复杂,因此,弄清红树林生态系统大型底栖动物的食物来源,对进一步深入了解红树林生态系统结构和功能有重要意义。【前人研究进展】传统的动物食性研究方法具有局限性,不能充分反映食物在能量流动过程中的同化比例情况。稳定同位素技术能够在时间尺度上反映出动物所摄食食物的准确信息,因此,已成为研究动物食物源及营养关系的一个重要手段,被广泛应用于红树林、海草床、盐沼湿地等复杂生态系统中消费者的食物来源研究[3-5]。传统观点认为,红树植物碎屑(凋落物)为消费者提供重要的食物来源,对整个红树林生态系统的能量具有供应作用[6]。随着稳定同位素技术的广泛应用,越来越多学者对这一观点提出质疑,认为颗粒有机物(POM)、沉积物、底栖微藻、附生植物、当地和外源输入的藻类等食物源对底栖动物的贡献作用更大[5, 7],大型底栖动物对红树植物来源的有机物质的依赖性只有在特定的环境下才能体现出来[8]。【本研究切入点】大型底栖动物的多样性与其生活环境有着密切的关系[9-13]。红树林大型底栖动物种类丰富多样,食物来源也较为复杂,许多物种由于体型较小,运用传统的动物食性研究方法往往无法准确地对它们的食物来源进行追踪,而稳定同位素技术能很好地解决这些问题,并且具有检测速度快、结果准确等优点。【拟解决的关键问题】以广西廉州湾红树林为例,应用碳氮稳定同位素技术对红树林区大型底栖动物的食物来源进行研究,以期了解红树林生态系统物质循环和能量流动过程,为红树林的资源保护提供科学依据。
1 材料与方法 1.1 研究地概况廉州湾位于广西北海市区北面,为断陷河口湾,天然红树林面积594.6 hm2,红树群落有向陆缘的秋茄群落以及向海缘的白骨壤群落,其潮汐为正规全日潮[14]。
1.2 样品采集样品采集于2015年12月的广西廉州湾红树林区域(21°33′N,109° 9′E)(图 1),红树植物群落为白骨壤群落。从高潮区到低潮区,设置3个站位。退潮时,每个站位采3~5个大小为25 cm×25 cm×20 cm的样方,用1 mm孔径的网筛淘洗以采集大型底栖动物,同时抓取样方附近红树植物树干或根部的软体动物,采集在地表、树干的蟹类等大型底栖动物。

|
图 1 廉州湾地点位置和采样位点 Fig.1 Location of Lianzhou Bay and the sampling site |
采集大型底栖动物可能的食物来源。红树植物叶片样品为白骨壤成熟的叶片;落叶样品为凋落发黄的叶片;红树植物树皮样品为白骨壤的表层树皮;用小刀从红树根部刮取附生植物,大型藻类从样地的地表或者红树植物气生根表面采集;用药匙刮取红树林群落内表层0~1 cm的沉积物。所有样品均放于低温保温箱中带回实验室。涨潮时,用聚乙烯桶采集站位附近的表层海水1~2 L,去除大型漂浮物及碎屑,再过滤到孔径为0.7 μm的Whatman GF/C玻璃纤维滤膜上(事先在马弗炉中以450℃灼烧4 h以去除有机物),作为颗粒有机物(POM)样品。
1.3 样品处理与测定将采集的大型底栖动物、红树叶片、树皮、落叶、附生植物以及大型藻类用超纯水洗净。鱼类取其背部肌肉,蟹类取其螯足或步足的肌肉,软体动物去壳分离出其肌肉,所有样品于60℃烘箱中烘48 h,磨粉,过100目筛,干燥后-20℃保存待测。个体较小的大型底栖动物则用1 mol/L的盐酸酸化处理。沉积物样品加入1 mol/L的盐酸静置过夜,去除碳酸盐,再烘干研磨。由于酸化对氮同位素的值有影响,酸化的样品只用于碳同位素的测定,测氮同位素的样品则不酸化。
样品的δ13C、δ15N值在中国农业科学院农业环境稳定同位素实验室的元素分析仪(vario PYRO cube,德国elementar公司)和稳定同位素质谱仪(IsoPrime100,英国Isoprime公司)进行检测,得到的碳氮稳定同位素比值用δ表示[15]:
| $ {\rm{ \mathsf{ δ} }} \mathit{X}{\rm{ = (}}{\mathit{R}_{{\rm{sample}}}}{\rm{/}}{\mathit{R}_{{\rm{standard}}}}{\rm{ - 1) \times 1000‰, }} $ | (1) |
其中,X表示13C或15N,R=13C/12C或15N/14N,Rstandard表示标准品的碳或氮稳定同位素比值,Rsample表示所测样品的碳或氮稳定同位素比值,碳、氮同位素的标准物质分别采用国际标准物VPDB和大气氮。为保证测定结果的准确性和仪器的稳定性,每测10~12个样品穿插一个标准品进行校正,样品δ13C和δ15N值分析精度均为±0.2‰。
1.4 数据分析大型底栖动物的营养位置通过如下公式计算[16]:
| $ {\rm{营养位置 = }}\mathit{\lambda }{\rm{ + (}}{{\rm{ \mathsf{ δ} }}^{{\rm{15}}}}{{\rm{N}}_{{\rm{consumer}}}}{\rm{ - }}{{\rm{ \mathsf{ δ} }}^{{\rm{15}}}}{{\rm{N}}_{{\rm{baseline}}}}{\rm{)/}}\vartriangle {{\rm{ \mathsf{ δ} }}^{{\rm{15}}}}{\rm{N, }} $ | (2) |
其中,δ15Nconsumer为消费者的δ15N值;δ15Nbaseline为基线生物的δ15N值(即λ=1时,δ15Nbaseline为生产者的δ15N值;而λ=2时,δ15Nbaseline为初级消费者δ15N值);△δ15N为营养传递过程中δ15N的富集值,取值为3.4‰[16]。
本研究利用orign9.0软件绘制大型底栖动物及其食物源的δ13C、δ15N位置图,运用基于R语言程序的Bayesian稳定同位素混合模型(SIAR)计算不同食物源对大型底栖动物的贡献比率[17]。将大型底栖动物及食物来源的δ13C、δ15N值输入R语言的程序包中,经过营养富集因子校正后,拟合得出各种潜在食物源对大型底栖动物的贡献比率,其中,δ13C和δ15N值的营养富集因子分别为(0.4±1.3)‰和(3.4±1.0)‰[16]。
2 结果与分析 2.1 大型底栖动物及其可能性食物源的同位素比值本研究共采集到19种大型底栖动物以及7种可能性食物来源(表 1~2)。稳定同位素测量结果表明,大型底栖动物的δ13C值为-23.37‰~-18.09‰,总跨度为5.28‰,平均值为(-20.59±1.49)‰;其中黑口滨螺(Littorina melanostoma)的δ13C值均值最高(-18.19±0.09)‰,有孔团水虱(Sphaeroma terebrans)的δ13C值均值最低(-22.71±0.12)‰,其他种类的δ13C值均值居中。大型底栖动物δ15N值为6.59‰~17.00‰,总跨度为10.41‰,均值为(-12.84±2.13)‰;其中,δ15N值最高的为弹涂鱼(Periophthalmus modestus),均值为(16.86±0.21)‰,最低的为粗糙滨螺(L.scabra),均值为(8.26±1.45)‰。7种可能性食物源的δ13C值为-29.09‰~-21.53‰,平均值为(-25.51±2.64)‰;红树植物的叶片、落叶和树皮的δ13C值较为贫化,POM的δ13C值最高。7种可能性食物源的δ15N值为6.85‰~15.67‰,平均值为(11.45±2.81)‰;其中大型藻类具有最高δ15N值,附生植物次之,SOM的δ15N值最低。
| 表 1 红树林大型底栖动物的碳、氮稳定同位素比值及营养级(平均值±标准差) Table 1 The δ13C values, δ15N values and trophic levels of mangrove macrobenthos(mean ± standard deviation) |
| 表 2 7种可能性食物来源的碳、氮同位素比值和C/N比值(平均值±标准差) Table 2 The δ13C values, δ15N values and C/N ratios of seven kinds of possible food sources (mean ± standard deviation) |
从图 2可以看出,大型底栖动物δ13C值、δ15N值的位置与POM、SOM、附生植物、大型藻类比较近,而与红树植物叶片、落叶、树皮相距较远,说明大型底栖动物摄食红树植物的可能性不大,它们的食物来源可能是POM、SOM、附生植物、大型藻类。
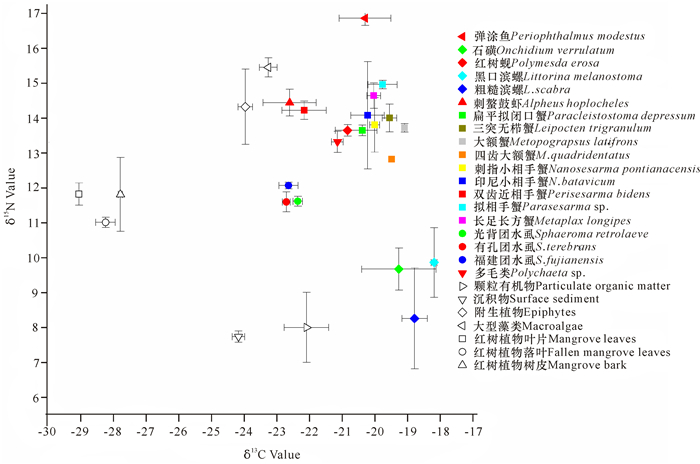
|
图 2 红树林大型底栖动物及其可能性食物源的δ13C和δ15N值散点图 Fig.2 Scatter diagram of δ13C values and δ15N values of mangrove macrobenthos and their possible food sources |
根据物种的分类及δ13C值、δ15N值的特征,将19种大型底栖动物分为鱼类、软体动物、虾类、蟹类、团水虱以及多毛类等6大类群,并利用SIAR模型计算出7种可能食物源的贡献率。由图 3可知,7种可能性食物源对鱼类(弹涂鱼)的贡献率均比较低,POM的平均贡献率为12.4%,SOM的平均贡献率为11.9%,附生植物的平均贡献率为16.8%,大型藻类的平均贡献率为18.1%,红树植物叶片的平均贡献率为13.5%,红树植物落叶的平均贡献率为13.2%,红树植物树皮的平均贡献率为14.0%。对于软体动物,POM的平均贡献率为40.6%,SOM的平均贡献率为25.4%,其它几种食物源的贡献率均小于8%。虾类中,POM的平均贡献率最高(19.2%),其他食物源对其贡献率均不高。蟹类中,贡献率最高也是POM(44.9%),其次为大型藻类(19.7%),红树植物叶片、落叶及树皮的贡献率均小于5%。团水虱的主要食物来源为POM(平均贡献率为49.2%),其次为SOM(平均贡献率34.1%),其他的几种食物源对团水虱的贡献率极低。7种可能性食物源对多毛类贡献率最高的为POM,平均贡献率为23.1%,其次为SOM(22.2%),附生植物和大型藻类以及红树植物相关的碳源对多毛类贡献率较低。总体来说,红树植物对本研究的大型底栖动物的贡献率不高,说明大型底栖动物的主要食物来源并非来自于红树植物。

|
图中的条带宽度由窄变宽分别代表 95%,75%,50%的置信区间;1:POM;2:SOM;3:附生植物;4:大型藻类;5:红树植物叶片;6:红树植物落叶;7:红树植物树皮 The widths of bars from narrow to wide show the 95%, 75% and 50% credibility intervals, respectively; 1:Particulate organic matter; 2:Surface sediment; 3:Epiphytes; 4:Macroalgae; 5:Mangrove leaves; 6:Fallen mangrove leaves; 7:Mangrove bark 图 3 基于SIAR混合模型分析7种可能性食物源对大型底栖动物的贡献率 Fig.3 Results of estimated contribution of 7 possible food sources to mangrove macrobenthos based on the SIAR mixing model analysis |
双壳贝类的食性较为单一,生活周期较长,在营养级分析中常被选为基线生物[18]。本研究以红树蚬为基线生物,根据大型底栖动物氮稳定同位素的比值及营养级的计算公式,计算得出各种大型底栖动物的营养级位置。由表 1可知,弹涂鱼的营养级位置最高,为2.94±0.06;粗糙滨螺的营养级位置最低,为0.41±0.43;本研究所采集的大型底栖动物营养级别均小于3,说明它们属于初级消费者。
3 讨论 3.1 大型底栖动物及其可能食物源的同位素特征本研究所采集的19种大型底栖动物的δ13C值范围相互之间有重叠,不同类群之间的δ13C值差异不是很大,消费者的δ13C值通常与其食物的δ13C值比较接近[19],说明这些大型底栖动物之间可能存在食物竞争关系或者捕食与被捕食的关系。大型底栖动物中,团水虱的δ13C值范围跨度最小,表明团水虱的食性较为简单;而蟹类的δ13C值范围跨度相对较大,说明蟹类的食性较为复杂,摄食的食物种类较多。另一方面,大型底栖动物的δ15N值也存在相互重叠的现象,虾类、蟹类的δ15N值范围比较接近,反映出它们所处的营养位置相当。
研究结果显示,红树植物叶片、落叶、树皮的δ13C值较为贫化,与大多数研究结果一致[20-21]。POM、SOM与附生植物、大型藻类的δ13C值较为接近,而与红树植物叶片、落叶及树皮的δ13C值相差较远,可以推测,POM、SOM的来源可能主要由附生植物和大型藻类贡献,而红树植物对其贡献率较低。7种食物源的δ15N值比其它红树林或盐沼生态系统中初级生产者的δ15N值高[3, 21];有研究表明来自人类和动物排泄物的硝态氮进入水域生态系统后会使该区域初级生产者的δ15N值显著增加[22],本研究地点周围有不少虾塘,大量的养殖废水排放可能是引起这几种食物源的δ15N值较高的主要原因。
3.2 大型底栖动物的食物来源大型底栖动物的δ13C值与红树植物的δ13C值相差5.08‰~9.60‰,这个差值表明红树植物贡献相对较小,不支持红树植物为大型底栖动物食物来源的结论;而一些底栖微藻、当地和外源输入藻类、附生植物对它们的贡献作用可能更大。有学者认为食物中C/N比值小于或等于17有利于无脊椎动物的生长[23],而红树植物的叶片、落叶、树皮的C/N比值为23.7~46.11,均大于17,高C/N比值的红树植物叶片难以满足一些大型底栖动物对氮的需求,它们还需要通过摄食动物残体组织和底栖微生物来获得足够的氮[24]。红树植物碎屑C/N比值高和不溶解性是其难以被消费者所同化的原因[25]。本研究中POM、SOM、大型藻类的C/N比值小于17,它们比红树植物更具营养价值,因此被摄食的可能性更大。
本研究中7种食物源对弹涂鱼的贡献率均很低,说明弹涂鱼的主要食物并非来自这7种食物源。弹涂鱼的δ15N值较高,其δ13C值在部分蟹类、虾类、多毛类之间,推测弹涂鱼可能会摄食小型的虾蟹。袁传宓[26]的研究也表明弹涂鱼是杂食性动物,主要以小型底栖动物为食。刺螯鼓虾与弹涂鱼相似,7种食物源对其贡献率都比较低;其δ13C值较低而δ15N值较高,说明它除摄食POM、SOM以外,可能还会摄食大量氮富集的小型底栖动物来补充氮。刺螯鼓虾的大螯快速合拢时,会产生一股高速水流,同时发出响亮的爆破音,这股高速水流会迅速击晕甚至杀死小型动物[27]。多毛类是红树林大型底栖动物的一个重要成员之一,本研究的多毛类采于底泥中层,其δ13C值为-21.15‰,营养级为1.90±0.09,POM和SOM对多毛类的平均贡献率分别为23.1%、22.2%,附生植物、大型藻类以及红树植物对其贡献率非常低,推测多毛类可能也是以小型底栖动物为主要食物来源。
本研究所采集的蟹类所占比例最大,是红树林大型底栖动物中的重要组成成员,蟹类的δ13C值跨度相对较大,营养级位置居中,表明蟹类的食物源种类较多。由图 3可知,POM对蟹类的平均贡献率为44.9%,其后依次为大型藻类、SOM、附生植物,而红树植物对蟹类的贡献率非常低。红树植物过于贫化的δ13C值以及高C/N比值,也表明红树植物不太可能成为这9种蟹类的食物来源,这与国外的研究结果相似[28]。结合野外观察发现,大额蟹、四齿大额蟹、双齿近相手蟹的活动能力很强,能攀爬于红树植物树干上,它们还会摄食一些死亡的动物组织;扁平拟闭口蟹主要穴居于底泥中,常在退潮后于洞穴附近取食表层沉积物;长足长方蟹亦营穴居生活,活动能力较强,有较高的δ13C值、δ13N值,表明长足长方蟹除取食POM和大型藻类外,可能还会摄食一些小型底栖动物;三突无栉蟹、刺指小相手蟹、印尼小相手蟹则穴居于红树植物树干的基部位置,极少出洞穴外摄食,它们的δ13C值、δ13N值均较高,说明这3种蟹类主要可能摄食一些生活于树干中的底栖动物,共同穴居于树干中的团水虱可能是它们的食物源之一。
对软体动物食物源的研究中发现,POM对软体动物的平均贡献率为40.6%,SOM的平均贡献率为25.4%,而红树植物对其贡献率很低,说明POM是这几种软体动物一个重要食物来源,但不是主要食物来源。蔡英亚等[29]认为红树蚬为滤食性贝类,主要滤食水体中的浮游植物,也有研究认为红树蚬主要摄食红树植物碎屑、细菌和底栖微藻[30];王瑁等[21]在对海南清澜港红树林区红树蚬的稳定同位素研究中发现其主要以红树植物碎屑为食,其次为颗粒有机物和表层沉积物。本研究中红树蚬的δ13C值均值为-20.84‰,与POM、SOM的δ13C值比较接近,而与红树植物的δ13C值相差较远,说明红树蚬的主要食物源可能是水体中的浮游植物或者表层沉积物,而并非红树植物碎屑。由此也可以看出,不同红树林区域的红树蚬食物来源有较大差异,这可能是由于红树蚬所栖息的环境不同所致。Christensen等[31]表明红树林螺类是机会主义者,食物来源包括叶片、呼吸根上的附生物、POM和红树碎屑等。王瑁等[21]认为粗糙滨螺与黑口滨螺生活在红树植物的树叶或枝干上,有躲避潮汐的行为,不可能摄食颗粒有机物,而粗糙滨螺与黑口滨螺较低的δ15N值可能是由于摄食大量的固氮微生物造成。本研究中黑口滨螺、粗糙滨螺的δ15N值非常低,而δ13C值较高,与王瑁等[21]的研究一致,推测亦可能摄食了固氮微生物。虽然粗糙滨螺和黑口滨螺的δ13C值与大型藻类、附生植物较为接近,但由于其活动范围受到限制,取食这类食物的可能性也比较低,因此,大型藻类、附生植物对粗糙滨螺、黑口滨螺的贡献率比较低。石磺的δ13C值、δ15N值与这两种滨螺相似,说明它也可能是摄食固氮微生物。
由图 3可知,团水虱的主要食物来源为POM,其次为SOM,附生植物、大型藻类及红树植物对团水虱的碳源贡献率几乎为零,由此可见团水虱并不摄食红树植物。Si等[32]对有孔团水虱虑食性研究的证据表明团水虱的主要食物来源是浮游生物,它只是将木质作为蛀洞的材料,并不会摄食蛀洞中的根系物质。野外观察发现,团水虱穴居于红树植物树干基部,在涨潮时,通过快速扇动腹肢,加速洞穴内水流来摄食水体中的浮游生物及有机碎屑,因此,POM成为团水虱的重要食物源之一,并且团水虱会有选择性地摄食POM中的浮游生物。
4 结论POM、SOM是广西廉州湾红树林大型底栖动物重要的食物来源,其次为大型藻类、附生植物,而红树植物叶片、落叶、树皮对大型底栖动物碳源的贡献率最低。廉州湾是一个开放式海湾,潮汐的涨落会带入大量的浮游生物和有机质,从而使得大型底栖动物对红树植物碎屑有机物质的依赖程度降低,这可能是造成红树植物叶片、落叶、树皮对大型底栖动物贡献率低的主要原因。本研究中的大型底栖动物营养级位置不高,均属于初级消费者;大型底栖动物中不同种类之间的食物来源有差异,体现大型底栖动物食性的多样性与复杂性,这可能与大型底栖动物不同的生态位和生存策略有关。
| [1] |
徐姗楠, 陈作志, 黄小平, 等. 底栖动物对红树林生态系统的影响及生态学意义[J]. 生态学杂志, 2010, 29(4): 812-820. XU S N, CHEN Z Z, HUANG X P, et al. Influence of benthic fauna on mangrove ecosystem and its ecological significance[J]. Chinese Journal of Ecology, 2010, 29(4): 812-820. |
| [2] |
MANSON F J, LONERAGAN N R, SKILLETER G A, et al. An evaluation of the evidence for linkages between mangroves and fisheries:A synthesis of the literature and identification of research directions[J]. Oceanography and Marine Biology, 2005, 43: 483. |
| [3] |
CURRIN C A, NEWELL S Y, PAERL H W. The role of standing dead Spartina alterniflora and benthic microalgae in salt marsh food webs:Considerations based on multiple stable isotope analysis[J]. Marine Ecology Progress Series, 1995, 121: 99-116. DOI:10.3354/meps121099 |
| [4] |
CARDONA L, REVELLES M, SALES M, et al. Meadows of the seagrass Posidonia oceanica are a significant source of organic matter for adjoining ecosystems[J]. Marine Ecology Progress Series, 2007, 335: 123-131. DOI:10.3354/meps335123 |
| [5] |
BOUILLON S, KOEDAM N, RAMAN A, et al. Primary producers sustaining macro-invertebrate communities in intertidal mangrove forests[J]. Oecologia, 2002, 130(3): 441-448. DOI:10.1007/s004420100814 |
| [6] |
ODUM W E, HEALD E J, CRONIN L.The detritusba-sed food web of an estuarine mangrove community[M]//CRONIN L E.Estuarine Research.New York:Academic Press, 1975:265-286.
|
| [7] |
WARDIATNO Y, MARDIANSYAH T P, TSUCHIYA M. Possible food sources of macrozoobenthos in the manko mangrove ecosystem, Okinawa (Japan):A stable isotope analysis approach[J]. Tropical Life Sciences Research, 2015, 26(1): 53-65. |
| [8] |
TUE N T, HAMAOKA H, SOGABE A, et al. Food so-urces of macro-invertebrates in an important mangrove ecosystem of Vietnam determined by dual stable isotope signatures[J]. Journal of Sea Research, 2012, 72: 14-21. DOI:10.1016/j.seares.2012.05.006 |
| [9] |
李宝泉, 李晓静, 周政权, 等. 围填海及其对底栖生物群落的生态效应[J]. 广西科学, 2016, 23(4): 293-298. LI B Q, LI X J, ZHOU Z Q, et al. Ecological effects of reclamation on benthic communities[J]. Guangxi Sciences, 2016, 23(4): 293-298. |
| [10] |
徐勇, 隋吉星, 李新正, 等. 南黄海大型底栖动物群落划分及变化[J]. 广西科学, 2016, 23(4): 339-345. XU Y, SUI J X, LI X Z, et al. Variations of macrofaunal community classification in the South Yellow Sea[J]. Guangxi Sciences, 2016, 23(4): 339-345. |
| [11] |
刘甜甜, 李晓静, 周政权, 等. 芝罘岛污水排放对大型底栖动物群落的影响[J]. 广西科学, 2016, 23(4): 346-353. LIU T T, LI X J, ZHOU Z Q, et al. Effects of sewage discharge on the macrobenthic community offshore area of Yantai, Shandong Province[J]. Guangxi Sciences, 2016, 23(4): 346-353. |
| [12] |
刘晓收, 史书杰, 周红, 等. 渤海大型底栖动物多样性及其与环境因子的关系[J]. 广西科学, 2015, 22(5): 540-548. LIU X S, SHI S J, ZHOU H, et al. Macrofaunal diversity and its relationship with environmental factors in the Bohai Sea[J]. Guangxi Sciences, 2015, 22(5): 540-548. |
| [13] |
朱延忠, 周娟, 林岿璇, 等. 基于MCI的厦门湾大型底栖动物群落健康状况评价[J]. 广西科学, 2015, 22(5): 549-557. ZHU Y Z, ZHOU J, LIN K X, et al. Assessment on the macrozoobenthos community health in Xiamen Bay using macrozoobenthos community index[J]. Guangxi Sciences, 2015, 22(5): 549-557. |
| [14] |
何斌源, 赖廷和, 王欣, 等. 廉州湾滨海湿地潮间带大型底栖动物群落次级生产力[J]. 生态学杂志, 2013, 32(8): 2104-2112. HE B Y, LAI T H, WANG X, et al. Secondary productivity of benthic macrofaunal community in intertidal zone of Lianzhou Bay, China[J]. Chinese Journal of Ecology, 2013, 32(8): 2104-2112. |
| [15] |
FRY B. Stable isotope ecology[M]. New York: Springer-Verlag, 2006.
|
| [16] |
POST D M. Using stable isotopes to estimate trophic position:Models, methods, and assumptions[J]. Ecology, 2002, 83(3): 703-718. DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
| [17] |
PARNELL A C, INGER R, BEARHOP S, et al. Source partitioning using stable isotopes:Coping with too much variation[J]. PloS One, 2010, 5(3): e9672. DOI:10.1371/journal.pone.0009672 |
| [18] |
VANDER ZANDEN M J, CABANA G, RASMUSSEN J B. Comparing trophic position of freshwater fish calculated using stable nitrogen isotope ratios (δ15N) and literature dietary data[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(5): 1142-1158. DOI:10.1139/f97-016 |
| [19] |
DENIRO M J, EPSTEIN S. Influence of diet on the distribution of carbon isotopes in animals[J]. Geochimica et Cosmochimica Acta, 1978, 42(5): 495-506. DOI:10.1016/0016-7037(78)90199-0 |
| [20] |
BOUILLON S, CONNOLLY R M, LEE S Y. Organic matter exchange and cycling in mangrove ecosystems:Recent insights from stable isotope studies[J]. Journal of Sea Research, 2008, 59(1/2): 44-58. |
| [21] |
王瑁, 高雪芹, 丁弈朋, 等. 海南清澜港不同栖息位置红树林软体动物的食物来源[J]. 湿地科学, 2015, 13(2): 171-176. WANG M, GAO X Q, DING Y P, et al. Identification of the food sources of mangrove molluscs from different microhabitats at Qinglangang, Hainan[J]. Wetland Science, 2015, 13(2): 171-176. |
| [22] |
BANNON R O, ROMAN C T. Using stable isotopes to monitor anthropogenic nitrogen inputs to estuaries[J]. Ecological Applications, 2008, 18(1): 22-30. DOI:10.1890/06-2006.1 |
| [23] |
RUSSEL-HUNTER W D.Aquatic productivity:An introduction to some basic aspects of biological oceanography and limnology[Z]. Collier-Macmillan:[s.n.], 1970.
|
| [24] |
KRISTENSEN D K, KRISTENSEN E, MANGION P. Food partitioning of leaf-eating mangrove crabs (Sesarminae):Experimental and stable isotope (13C and 15N) evidence[J]. Estuarine, Coastal and Shelf Science, 2010, 87(4): 583-590. DOI:10.1016/j.ecss.2010.02.016 |
| [25] |
RODELLI M R, GEARING J N, GEARING P J, et al. Stable isotope ratio as a tracer of mangrove carbon in Malaysian ecosystems[J]. Oecologia, 1984, 61(3): 326-333. DOI:10.1007/BF00379629 |
| [26] |
袁传宓. 弹塗魚和大弹塗魚消化道的比较解剖及其和食性的关系[J]. 南京大学学报:自然科学版, 1963(2): 36-46. YUAN C M. Comparative anatoma of the alimentary tracts of Periophthalmus cantonensis (Osbeck) and Boleophthalmus chinensis (Osbeck) in relation to their feeding habits[J]. Journal of Nanjing University:Natural Sciences, 1963(2): 36-46. |
| [27] |
VERSLUIS M, SCHMITZ B, VON DER HEYDT A, et al. How snapping shrimp snap:Through cavitating bubbles[J]. Science, 2000, 289(5487): 2114-2117. DOI:10.1126/science.289.5487.2114 |
| [28] |
MAZUMDER D, SAINTILAN N. Mangrove leaves are not an important source of dietary carbon and nitrogen for crabs in temperate Australian mangroves[J]. Wetlands, 2010, 30(2): 375-380. DOI:10.1007/s13157-010-0021-2 |
| [29] |
蔡英亚, 黄翔鹄, 吴洞科. 红树蚬的生态观察[J]. 热带海洋, 1995, 14(1): 94-98. CAI Y Y, HUANG X H, WU D K. Studies on the ecology of Polymesoda erosa (Solander)[J]. Tropic Oceanology, 1995, 14(1): 94-98. |
| [30] |
BACHOK Z, MFILINGE P L, TSUCHIYA M. The diet of the mud clam Geloina coaxans (Mollusca, Bivalvia) as indicated by fatty acid markers in a subtropical mangrove forest of Okinawa, Japan[J]. Journal of Experimental Marine Biology and Ecology, 2003, 292(2): 187-197. DOI:10.1016/S0022-0981(03)00160-6 |
| [31] |
CHRISTENSEN J T, SAURIAU P G, RICHARD P, et al. Diet in mangrove snails:Preliminary data on gut contents and stable isotope analysis[J]. Journal of Shellfish Research, 2001, 20(1): 423-426. |
| [32] |
SI A, BELLWOOD O, ALEXANDER C G. Evidence for filter-feeding by the wood-boring isopod, Sphaeroma terebrans (Crustacea:Peracarida)[J]. Journal of Zoology, 2002, 256(4): 463-471. DOI:10.1017/S095283690200050X |
 2017, Vol. 24
2017, Vol. 24 

