【研究意义】近几年,球形棕囊藻(Phaeocystis globosa)成为广西北部湾海域的典型有害赤潮原因种,赤潮发生时几乎覆盖北部湾的整个海域。该赤潮是一种有害赤潮,首次在我国广东沿海暴发时就造成了6 500万元的经济损失[1]。除了能产生对养殖业具有危害的溶血毒素,球形棕囊藻还跟酸雨以及大气状况有重要联系,这是因为棕囊藻细胞可以释放二甲基硫化物(DMS)到环境中[2]。因此研究与该赤潮发生相关的影响因子对于揭示赤潮的发生原因及预防具有重要意义。【前人研究进展】磷是海洋初级生产力和食物链的基础元素,是浮游植物生长(如DNA、RNA及脂质等)、胞内能量(ATP)和信号通路所必需的大量营养元素,而无机态的正磷酸盐是浮游植物能够直接吸收利用的唯一磷源[3]。然而越来越多的研究表明磷是近岸和寡营养海域的限制因子,甚至在远洋海域也因为固氮作用而逐步成为磷限制[4]。在无机磷缺乏的条件下,很多浮游植物可以通过碱性磷酸酶(Alkaline phosphatase,AP)的作用利用溶解有机磷(Dissolved organic phosphorus, DOP)[5],洪华生等[6]便采用32P示踪法证实了小球藻在碱性磷酸酶的作用下可以直接利用DOP,而王艳等[7]用球形棕囊藻南海株进行研究,结果表明该藻既能利用小分子DOP(β-甘油磷酸钠),也可以利用大分子DOP(卵磷脂LEC)进行生长,具槽帕拉藻在DOP培养下生长甚至更优于无机磷[8]。磷饥饿条件下的吸收动力学参数可以指示藻类对无机磷的竞争能力。通过碱性磷酸酶动力学参数,可以计算底物的周转时间[9],从而了解浮游植物对DOP的利用情况。韦蔓新等[10]和马媛等[11]发现钦州湾水域的营养盐结构已经由明显的氮限制逐渐演变为显著的磷限制,这主要表现在无机氮(DIN)呈明显递增趋势,而无机磷(DIP)则与此相反。因此,研究球形棕囊藻北部湾株在不同磷源条件下的生长情况有利于分析其在自然海水中对磷的利用情况。【本研究切入点】在无机磷相对缺乏的条件下,球形棕囊藻能在北部湾海域维持长时间、大面积赤潮,了解DOP在其中所起的作用具有重要意义。而目前关于球形棕囊藻北部湾株对无机及有机磷源的竞争利用还不清楚。【拟解决的关键问题】本研究以球形棕囊藻北部湾株为材料,研究其在无机磷和不同形态磷源培养条件下的生长及碱性磷酸酶活性的变化,结合无机磷吸收动力学与酶动力学参数,分析球形棕囊藻利用磷源的策略机制,从营养生理学的角度为球形棕囊藻赤潮的发生提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验藻种实验用球形棕囊藻于2016年分离自钦州湾赤潮发生区域,保存于北部湾海洋研究中心赤潮藻种质资源库,编号BBW PG-01。
1.1.2 主要仪器和试剂Perkin Elmer LS55荧光分光光度计、Olympus BX51倒置显微镜、Agilent cary 100紫外-可见分光光度计。
KH2PO4(国药试剂,AR)、核糖核酸(Ekear公司)、葡萄糖-6-磷酸钠盐(Ekear公司)、三磷酸腺苷二钠盐(Amresco公司)和大豆卵磷脂(Ruibio公司)、4-甲基伞形酮磷酸酯(Sigma-Aldrich公司)、4-甲基伞形酮(Sigma-Aldrich公司)。
1.2 方法 1.2.1 培养条件藻种在f/2培养基中进行保种,实验开始前,为了避免培养液中的无机磷对实验造成影响,要进行磷饥饿处理,具体方法:将保种用的天然海水更换为人工配置海水,取对数生长期的藻细胞逐代接种于逐渐降低磷源浓度的培养液中(即培养基中磷浓度先减半降低至18 μmol/L, 再传代时为9 μmol/L,最后降至4.5 μmol/L),除磷外的其他营养成分不变。待长到指数期时,经测定藻液中的无机磷浓度低于检出限,即可正式开始实验。
设置起始密度为2×107cells/L,将无磷的藻液接种于含有5种不同形态磷源的人工海水培养基中,各形态磷的初始浓度约为5 μmol/L,其余按f/2的量添加,每个处理均设3个平行。培养条件为22℃,光照强度2 500 lx,光暗比为12 h:12 h。5种不同形态磷源分别为KH2PO4(PO43-),核糖核酸(RNA),葡萄糖-6-磷酸钠盐(G-6-P),三磷酸腺苷二钠盐(ATP)和卵磷脂(LEC)。每天取样进行细胞计数以及碱性磷酸酶活性(Alkaline phosphatase activity, APA)测定,实验开始当天记为第0天。
1.2.2 细胞计数藻液摇匀后,取1.0 mL样品于1.5 mL离心管中,加入20 μL鲁哥氏碘液进行固定,采用100 μL浮游植物计数框进行计数。
1.2.3 APA测定APA的测定参考Hoppe[12]和Pettersson[13]的方法进行,取9 mL的培养藻液,加入1 mL的MUP底物(终浓度为50 μmol/L),在30℃黑暗条件下水浴1 h,经0.22 μm滤膜过滤后在荧光分光光度计下检测。
1.2.4 碱性磷酸酶动力学实验取磷饥饿状态下的藻液,按检测APA的方法,分别加入MUP底物使其终浓度为0.0 μmol/L,0.1 μmol/L,0.2 μmol/L,0.5 μmol/L,2 μmol/L,5 μmol/L,10 μmol/L,20 μmol/L,50 μmol/L(每个浓度3个平行)。水解速率(V,fmol/cell/h)遵循米氏方程(Michaelis-Menten equation):
| $ V = \frac{{{V_{\max }} \cdot S}}{{{K_s} + S}}, $ |
式中,Vmax为最大水解速率(fmol/cell/h),Ks为半饱和常数(μmol/L),S为底物MUP的浓度(μmol/L)。
1.2.5 无机磷吸收动力学实验将磷饥饿条件下的藻液45 mL加入灭菌三角瓶中。分别添加5 mL的配好的各浓度的磷酸盐使其终浓度分别为0.0 μmol/L,0.2 μmol/L,0.5 μmol/L, 1.0 μmol/L, 2.0 μmol/L, 5.0 μmol/L, 10 μmol/L(每个浓度3个平行)。采用米氏方程拟合吸收速率(ρ,fmol/cell/h)与底物浓度(S,μmol/L)之间的关系:
| $ \rho = \frac{{{\rho _{\max }} \cdot S}}{{{K_s} + S}}, $ |
式中,ρmax为最大吸收速率(fmol/cell/h),Ks为半饱和常数(μmol/L)。
1.2.6 数据处理与分析文中的图采用SigmaPlot 12.5绘制,显著性分析使用SPSS 13.0完成。
2 结果与分析 2.1 不同磷源培养条件下球形棕囊藻的生长情况由图 1可知,5种不同形态磷源培养条件下球形棕囊藻都能生长,但是生长情况有差异。其中以RNA为磷源条件下的藻细胞生长最好,甚至优于无机磷,该条件下的球形棕囊藻从第2天开始进入指数生长期且密度高于其它几种磷源,至第4天就进入稳定生长期,其稳定期内(4~7 d)细胞密度平均值为(4.28±0.20)×108 cells/L;以ATP和PO43-为磷源的实验组在前5 d生长情况较一致,到第6天时PO43-组达到最大密度(3.33×108 cells/L)并进入稳定期,而ATP组第7天才长到最大密度(4.12×108cells/L)进入稳定期。G-6-P实验组球形棕囊藻细胞生长情况较前两种稍差,没有明显的稳定生长期,细胞密度在第6天达到峰值(2.75×108 cells/L)后迅速下降。以LEC为磷源的实验组的细胞生长情况最差,在第6天时细胞密度达到最大值(2.39×108cells/L),之后马上进入衰亡期。

|
图 1 不同形态磷源对球形棕囊藻生长的影响 Fig.1 Effects of different phosphurus substrates on the growth of Phaeocystis globosa |
单因素方差结果表明,在4~7 d,各组的平均细胞密度之间均存在显著差异,RNA组平均密度极显著高于其他磷源组(P < 0.01),而ATP组和PO43-组极显著高于LEC组(P < 0.01)并显著高于G-6-P组(P < 0.05)。
2.2 不同磷源培养条件下碱性磷酸酶活性的变化如图 2所示,在以LEC为磷源培养条件下,球形棕囊藻APA呈现先极速上升而后稳定的趋势,且该组的APA值始终保持最高,在0~3 d极显著高于其他组(P < 0.01)。而其他4种磷源条件下,APA均先下降,后上升至一个稳定值,且在0~3 d 4个实验组之间无显著差异(P>0.05),G-6-P组APA在第4天激增,APA达6.53 μmol/L/h,随后维持在相对稳定水平。RNA组在第5天快速升高至6.82 μmol/L/h,5~8 d平均值为(7.11±0.20)μmol/L/h。其次是PO43-组,4~8 d APA平均值为(5.18±0.32) μmol/L/h,ATP组的APA水平最低,最高值出现在第8天为4.97 μmol/L/h。当各组的AP均达到稳定后(第5天),APA由高到低的顺序为LEC>RNA>G-6-P> PO43-> ATP。经SPSS分析,在5~8 d,LEC组APA平均值极显著高于ATP组和PO43-组(P < 0.01)并显著高于G-6-P组(P < 0.05),而ATP组和PO43-组的APA水平极显著低于其他3个实验组(P < 0.01),RNA组、LEC组及G-6-P组之间无显著差异(P>0.05)。
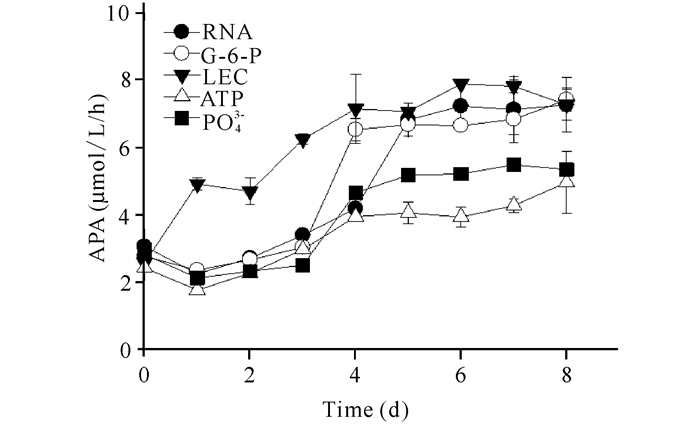
|
图 2 不同形态磷源培养下球形棕囊藻碱性磷酸酶活性(APA)随时间的变化 Fig.2 The variation of APA of Phaeocystis globosa cultivated in different phophorus sources with time |
碱性磷酸酶动力学研究结果表明(图 3a),磷饥饿条件下球形棕囊藻碱性磷酸酶的最大水解速率Vmax为50.81 fmol/cell/h,对底物DOP的半饱和常数Ks为2.78 μmol/L,拟合曲线R2=0.96。在磷饥饿条件下,球形棕囊藻对无机磷的吸收速率在一定浓度范围内随着浓度的增大而变大,到一定浓度时呈饱和状态(图 3b),球形棕囊藻对无机磷的最大吸收速率ρmax 为7.56 fmol/cell/h,对底物无机磷的半饱和常数Ks为1.09 μmol/L,拟合曲线的相关系数R2=0.94。

|
图 3 球形棕囊藻磷饥饿条件下碱性磷酸酶活性(APA)随MUP浓度变化(a)和对无机磷吸收速率随DIP浓度变化(b)的Michaelis-Menten拟合曲线 Fig.3 The Michaelis-Menten matched curve of changes of alkaline phosphatase activities (APA) varying with MUP concentrations (a) and phosphate uptake rate of Phaeocystis globosa with phosphate concentrations (b) |
天然海水中DOP的组成成分种类繁多,结构复杂,主要有G-6-P、2-磷酸甘油酸、磷肌酸、核苷酸、ATP等形态。为了模拟天然海水中DOP的组成,在研究浮游植物对海水中DOP的利用特性时,人们常以上述几种有机磷作为研究对象[14]。在关于藻类对不同形态磷源的研究中,大部分种类都以DIP为最优生长磷源[15]。而不同种类浮游植物在无机磷缺乏条件下对DOP的利用策略存在差异,如骨条藻对DOP的利用能力低于塔玛亚历山大藻、海洋卡盾藻和赤潮异弯藻等鞭毛藻类[16]。海洋卡盾藻能利用磷酸三乙酯(TEP),而赤潮异弯藻却不能利用TEP进行生长[17]。海洋卡盾藻不能利用LEC进行生长[18],而具槽帕拉藻在LEC下能良好生长[8]。王艳等[7]在研究球形棕囊藻南海株对不同磷源中的生长情况时发现,该菌株在无机磷与DOP中生长很接近,其中大分子DOP(LEC)的生长曲线介于DIP和小分子DOP(β-甘油磷酸钠)之间。在本研究中,球形棕囊藻北部湾株可以利用多种形态的磷源进行生长,意味着在自然海水中该藻具有广泛的磷源。但是对不同形态的磷源吸收具有差异性,球形棕囊藻北部湾株在小分子RNA下生长最好,其次是DIP、小分子有机磷G-6-P及ATP,而在大分子有机磷LEC为磷源条件下生长最差。这意味着即使是同一种类,对DOP的利用能力也会因株系不同而存在差异。
藻类对DOP的利用需要AP的水解作用,大多数浮游植物的AP都是诱导酶,在低磷条件下诱导产生。在实验起始期检测到了(2.74±0.24)μmol/L/h/的APA,这是因为为了消除原藻液培养基中无机磷的影响,本实验所用藻种是经过磷饥饿处理的,所以在实验开始时藻液就具有较高的APA。随着培养时间的延长,APA有所上升,其中LEC组的APA始终高于其他处理组,且在第1天便开始增大至1.9倍,这意味着在大分子DOP培养条件下,球形棕囊藻处于更严重的磷限制状态,因而表达更高水平的APA。大多数情况下总APA会随着细胞数目的增大而升高,因而光从单位水体总APA上可能无法用来验证浮游植物的磷限制状态,借助额外的指标,例如Ks的降低或周转时间的减少可以用来辅助验证浮游植物处于磷限制状态[19],所以对浮游植物碱性磷酸酶特征的研究还需要结合酶动力学参数分析[20],本研究中球形棕囊藻对DOP模拟底物MUP的亲和常数(Ks)为2.78 μmol/L,其潜在最大水解速率为50.81 fmol/cell/h(6.45 μmol/L/h),对DOP的周转时间仅为0.43 h。与其他同样使用MUP为底物研究藻类碱性磷酸酶的动力学参数进行比较(表 1)可知,当环境中的DOP较低时,球形棕囊藻凭借较高的1/Ks和周转速率,在竞争DOP上具有优势。
| 表 1 不同浮游植物的碱性磷酸酶动力学参数比较 Table 1 The comparation of alkaline phosphatase dynamics parameters of different phytoplankton |
浮游植物对营养盐的亲和力决定了在营养盐限制的环境中,浮游植物群落种间竞争营养盐的能力,而最常用的表达浮游植物对营养盐亲和力的方法就是通过营养盐吸收动力学方程求得浮游植物的最大吸收速率ρmax与半饱和常数Ks[23-24]。当环境中无机磷浓度较高时,ρmax 越大的浮游植物越能够迅速吸收磷储存于细胞内,而在环境中的无机磷浓度较低时,较高的1/Ks值意味着对无机磷具有更高的亲和力。球形棕囊藻北部湾株对无机磷的Ks为1.09 μmol/L,比文献中大部分研究藻类稍低,如王丹等[22]研究中旋链角毛藻和玛氏骨条藻的Ks分别为0.90 μmol/L和2.02 μmol/L,其他藻类如古老卡盾藻(Chattonella antique),链状裸甲藻(Gymnodium catenatum)和浮动弯角藻(Eucampia zoodiacus)对无机磷吸收动力学的Ks分别为1.76 μmol/L、3.4 μmol/L和4.85 μmol/L[25-27],相比较而言,球形棕囊藻北部湾株对无机磷的亲和力较高。由于藻类的体积不同,因此在此它们的单位细胞ρmax之间不具有可比性。
Li等[28]指出在长江口藻华发生过程中有机营养盐具有很重要的作用,尤其是DOP在磷限制的海域在早期藻华发生时起重要作用。在赤潮爆发的季节,长江口海域DOP约占总溶解磷(TDP)的40%左右[29]。我们前期调查发现,钦州湾海域夏季和冬季DOP占TDP之比均超过50%,大于DIP成为海区的最主要磷源[30],结合本研究的结果,可以推测,在广西北部湾球形棕囊藻赤潮的发生与维持期间,DOP为藻类的繁殖提供了重要磷源。
4 结论球形棕囊藻北部湾株在无机磷缺乏的条件下可以利用不同形态的DOP进行生长,在以小分子DOP为唯一磷源的条件下生长甚至优于无机磷。球形棕囊藻北部湾株对大分子DOP如LEC的利用能力比较差,需要较高的碱性磷酸酶活性水平的水解作用。DOP是北部湾TDP的主要成分,因此在广西北部湾球形棕囊藻赤潮的发生与维持期间,DOP为藻类的繁殖提供了重要磷源。
| [1] |
QI Y Z, CHEN J F, WANG Z H, et al. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998[J]. Hydrobiology, 2004, 512: 209-214. DOI:10.1023/B:HYDR.0000020329.06666.8c |
| [2] |
王艳, 齐雨藻, 沈萍萍, 等. 温度和盐度对球形棕囊藻细胞DMSP产量的影响[J]. 水生生物学报, 2003, 27(4): 367-371. WANG Y, QI Y Z, SHEN P P, et al. Effects of temperature and salinity on DMSP production in Phaeocystis globosa[J]. Acta Hydrobiologica Sinica, 2003, 27(4): 367-371. |
| [3] |
覃仙玲, 欧林坚, 吕颂辉. 尖刺拟菱形藻和抑食金球藻碱性磷酸酶生理学特性的比较研究[J]. 生态科学, 2014, 33(1): 1-6. QIN X L, OU L J, LU S H. Comparative alkaline phosphatase physiological characteristics of Pseudonitzschia pungens and Aureococcus anophagefferens[J]. Ecological Science, 2014, 33(1): 1-6. |
| [4] |
INGRID I, MARTIN P, JELENA G, et al. Alkaline phosphatase activity related to phosphorus stress of microphytoplankton in different trophic conditions[J]. Progress in Oceanography, 2016, 146: 175-186. DOI:10.1016/j.pocean.2016.07.003 |
| [5] |
HUANG B Q, OU L J, WANG X L, et al. Alkaline phosphatase activity of phytoplankton in East China Sea coastal waters with frequent harmful algal bloom occurrences[J]. Aquatic Microbial Ecology, 2007, 49: 195-206. DOI:10.3354/ame01135 |
| [6] |
洪华生, 戴民汉, 郑效成. 海水中碱性磷酸酶活力的测定及其在磷的循环中的作用初探[J]. 海洋与湖沼, 1992, 23(4): 415-420. HONG H S, DAI M H, ZHENG X C. Measurement of alkaline phosphatase activity in seawater substrates and investigation on the role of alkaline phosphatase in the cycling of phosphorus[J]. Oceanologia Et Limnologia Sinica, 1992, 23(4): 415-420. |
| [7] |
王艳, 唐海溶. 不同形态的磷源对球形棕囊藻生长及碱性磷酸酶的影响[J]. 生态科学, 2006, 25(1): 38-40. WANG Y, TANG H R. Effects of different phosphorus on the growth and alkaline phospohatase activity in Phaeocystis globosa[J]. Ecological Science, 2006, 25(1): 38-40. |
| [8] |
于倩, 王清, 袁泽轶, 等. 不同形态磷源对具槽帕拉藻(Paralia sulcata)生长和磷酸酶活性的影响[J]. 海洋与湖沼, 2015, 46(5): 1018-1023. YU Q, WANG Q, YUAN Z Y, et al. Effects of different phosphorus substrates on growth and phosphatase activity of algae Paralis sulcata[J]. Oceanologia Et Limnologia Sinica, 2015, 46(5): 1018-1023. |
| [9] |
LABRY C, DELMAS D, HERBLAND A. Phytoplankton and bacterial alkaline phosphatase activities in relation to phosphate and DOP availability within the Gironde plume waters (Bay of Biscay)[J]. Journal of Experimental Marine Biology and Ecology, 2005, 318(2): 213-225. DOI:10.1016/j.jembe.2004.12.017 |
| [10] |
韦蔓新, 赖廷和, 何本茂. 钦州湾近20 a来水环境指标的变化趋势Ⅰ平水期营养盐状况[J]. 海洋环境科学, 2002, 21(3): 49-52. WEI M X, LAI T H, HE B M. Change trend of the chemical items in Qinzhou Bay in the last twenty yearsⅠNutrient condition in usual discharged period[J]. Marine Environmental Science, 2002, 21(3): 49-52. |
| [11] |
马媛, 魏巍, 高振会, 等. 钦州湾营养盐的分布特征及影响因素[J]. 海洋通报, 2013, 32(5): 481-487. MA Y, WEI W, GAO Z H, et al. Study of the nutrient distribution and its influence factors in the Qinzhou Bay[J]. Marine Science Bulletin, 2013, 32(5): 481-487. DOI:10.11840/j.issn.1001-6392.2013.05.001 |
| [12] |
HOPPE H G. Significance of exoenzymatic activities in the ecology of brackish water:Measurements by means of methylumbelliferyl-substrates[J]. Marine Ecology Progress Series, 1983, 11: 299-308. DOI:10.3354/meps011299 |
| [13] |
PETTERSSON K. Alkaline phosphatase activity and algal surplus phosphorus as phosphorus-deficiency indicators in Lake Erken[J]. Arch Hydrobiol, 1980, 89: 54-87. |
| [14] |
李英, 吕颂辉, 徐宁, 等. 东海原甲藻对不同磷源的利用特征[J]. 生态科学, 2005, 24(4): 314-317. LI Y, LV S H, XU N, et al. The utilization of Prorocen-trum donghaiense to four different types of phosphorus[J]. Ecologic Science, 2005, 24(4): 314-317. |
| [15] |
REN L X, WANG P F, WANG C, et al. Algal growth and utilization of phosphorus studied by combined mono-culture and co-culture experiments[J]. Environmental Pollution, 2017, 220: 274-285. DOI:10.1016/j.envpol.2016.09.061 |
| [16] |
WANG Z H, LIANG Y, KANG W. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa[J]. Harmful Algae, 2011, 12: 113-118. DOI:10.1016/j.hal.2011.09.005 |
| [17] |
WANG Z H, LIANG Y. Growth and alkaline phosphatase activity of Chattonella marina and Heterosigma akashiwo in response to phosphorus limitation[J]. Journal of Environmental Sciences, 2015, 28: 1-7. DOI:10.1016/j.jes.2014.04.015 |
| [18] |
庞勇, 李斌, 吕颂辉. 不同磷源对海洋卡盾藻生长和碱性磷酸酶活性的影响[J]. 安徽农业科学, 2010, 38(17): 9146-9148. PANG Y, LI B, LV S H. Effects of different kinds of phosphorus sources on growth and alkaline phosphatase activity(APA) of Chattnella marina(raphidophyceae)[J]. Journal of Anhui Agriculture Sciences, 2010, 38(17): 9146-9148. DOI:10.3969/j.issn.0517-6611.2010.17.118 |
| [19] |
LLUIS B, MARTA R P, XAVIER P C, et al. Phospho-rus deficiency and kinetics of alkaline phosphatase in isolates and natural populations of phototrophic sulphur bacteria[J]. FEMS Microbiology Ecol, 2010, 73(2): 243-253. |
| [20] |
JAUZEIN C, LABRY C, YOUENOU A, et al. Growth and phosphorus uptake by the toxic dinoflagellate Alexandrium catenella (dinophyceae) in response to phosphate limitation[J]. Journal of Phycology, 2010, 46: 926-936. DOI:10.1111/jpy.2010.46.issue-5 |
| [21] |
YAMAGUCHI H, SAKOU H, FUKAMI K, et al. Utilization of organic phosphorus and production of alkaline phosphatase by the marine phytoplankton, Heterocapsa circularisquama, Fibrocapsa japonica and Chaetoceros ceratosporum[J]. Plankton Biology and Ecology, 2005, 52(2): 67-75. |
| [22] |
王丹, 黄春秀, 黄邦钦, 等. 黄海两种典型硅藻的磷胁迫生理研究[J]. 海洋科学, 2008, 32(5): 22-27. WANG D, HUANG C X, HUANG B Q, et al. Physiological responses of two typical species of diatoms to phosphorus stress in Yellow Sea[J]. Marine Sciences, 2008, 32(5): 22-27. |
| [23] |
BUTTON D. Biochemical basis for whole-cell uptake kinetics:Specific afinity, oligotrophic capacity, and themeaning of the Michaelis constant[J]. Applied and Environmental Microbiology, 1991, 57(7): 2033-2038. |
| [24] |
HEALEY F P, HENDZEL L L. Physiological indica-tors of nutrient deficiency in lake phytoplankton[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37: 442-453. DOI:10.1139/f80-058 |
| [25] |
NAKAMURA Y. Kinetics of nitrogen-or phosphorus-limited growth and effects of growth conditions on nutrient uptake in Chattonella antique[J]. Journal of the Oceanographical Society of Japan, 1985, 41: 381-387. DOI:10.1007/BF02109032 |
| [26] |
YAMAMOTO T, OH S J, KATAOKA Y. Growth and uptake kinetics for nitrate, ammonium and phosphate by the toxic dinoflagellate Gymnodium catenatum isolate from Hiroshima Bay, Japan[J]. Fisheries Science, 2004, 70: 108-115. DOI:10.1111/fis.2004.70.issue-1 |
| [27] |
NISHIKAWA T, TARUTANI K, YAMAMOTO T. Nitrate and phosphate uptake kinetics of the harmful diatom Eucampia zodiacus Ehrenberg, a causative organism in the bleaching of aquacultured Porphyra thalli[J]. Harmful Algae, 2009, 8: 513-517. DOI:10.1016/j.hal.2008.10.006 |
| [28] |
LI J, GLIBERT P M, ZHOU M J, et al. Relationships between nitrogen and phosphorus forms and ratios and the development of dinoflagellate blooms in the East China Sea[J]. Marine Ecology Progress Series, 2009, 383: 11-26. DOI:10.3354/meps07975 |
| [29] |
HUANG B Q, OU L J, HONG H S, et al. Bioavailability of dissolved organic phosphorus compounds to typical harmful dinoflagellate Prorocentrum donghaiense Lu[J]. Marine Pollution Bulletin, 2005, 51: 838-844. DOI:10.1016/j.marpolbul.2005.02.035 |
| [30] |
覃仙玲, 陈宪云, 赖俊翔, 等. 钦州湾表层海水中总溶解态氮磷分布特征及季节变化[J]. 海洋环境科学, 2017, 36(3): 349-353. QIN X L, CHEN X Y, LAI J X, et al. The distribution characteristics and seasonal variation of total dissolved nitrogen and phosphorus in the surface of Qinzhou Bay[J]. Marine Environmental Science, 2017, 36(3): 349-353. |
 2018, Vol. 25
2018, Vol. 25 


