2. 广西大学轻工与食品工程学院,广西南宁 530004;
3. 广西民族大学海洋与生物技术学院,广西南宁 530006
2. College of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi, 530004, China;
3. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China
【研究意义】海绵是一类多细胞无脊椎动物,以固着方式生活在海底。在生存竞争激烈的海底环境中,海绵缺乏有效的物理防御却能经久不衰,这一现象引起人们对海绵体内存在的极强生理活性物质的广泛关注[1]。研究发现,海绵通过集聚或分泌多种具有抵御性或是毒害性的次级代谢产物来保护自身种群的生存,其产生的活性物质数量远超于其他海洋生物来源的活性物质,是目前发现活性物质最多的海洋生物[2]。然而,海绵等海洋软体生物资源的过量捕捞,造成了海洋生态平衡严重破坏。越来越多的研究证实,某些来源于海绵的活性物质实际上是由其共附生微生物代谢产生的[3-4]。因此,研究海绵共附生细菌多样性,挖掘其潜在的应用价值具有重要意义。【前人研究进展】目前,已从海绵共附生微生物中发现的多个结构新颖、活性显著的次级代谢产物,具有抗菌、抗肿瘤、抗病毒、抗污损、抗炎、生物毒、细胞毒和酶抑制剂等生物活性[5-8]。如从海绵Xestospongia testudinaria共附生真菌 Aspergillus sp.中分离获得2个新的倍半萜二聚体类化合物disydonols A和C,对HepG 2和Caski癌细胞均有细胞毒活性[9]。从叶片山海绵上分离到2株具有显著抑制翡翠贻贝足丝分泌和5株具有显著抗污损活性的菌株[10]。【本研究切入点】广西斜阳岛海域地处亚热带,海底富含各式各样的海绵、珊瑚、海兔等海洋软体生物。目前,探讨该地区海绵 Pseudoceratina sp.中可培养共附生细菌的分离、物种多样性及其生物活性的研究鲜见报道。【拟解决的关键问题】本文系统地研究广西斜阳岛海域海绵 Pseudoceratina sp.的共附生细菌多样性,并展开其次级代谢产物对甘蔗鞭黑粉菌的活性筛选,旨在丰富海绵 Pseudoceratina sp.共附生细菌的资源,为开发农用生防菌肥提供参考依据。
1 材料与方法 1.1 材料 1.1.1 样本来源海绵 Pseudoceratina sp.于2016年6月采自广西北海市斜阳岛附近海域,水深约10 m。样品采集后,立即装入无菌袋,并暂存于冰盒,带回实验室后于4℃冷藏备用。
1.1.2 主要试剂和仪器培养基原料、TAE缓冲液、2×EasyTaq SuperMix、引物(27f和1492r)、DNA Marker、GoldView核酸染料等购自北京康为世纪生物科技有限公司,Chelex-100树脂购自美国BioRad公司,其他有机试剂均为国产分析纯试剂。
SW-CJ-2F型超净工作台(杭州佳滤设备有限公司),HH.B11-BS-Ⅱ型恒温培养箱(东莞市恒宇仪器有限公司),恒温振荡器(美国CRYSTAL),VB-55型高压灭菌锅(德国SYSTEC),MINIB-100型金属浴(杭州米欧仪器有限公司),MINI-6k型迷你离心机(常州市国旺仪器制造有限公司),Tgradient型PCR扩增仪(德国Biometra),电泳仪(美国BioRad),N1000型旋转蒸发仪(日本EYELA),凝胶成像仪(Carestream),VCX750细胞破碎仪(美国Sonics)。
1.1.3 供试菌的采集及保存甘蔗黑粉菌冬孢子于2017年6月初采自广西农业科学院试验田。采集新鲜黑穗病鞭子(冬孢子)时,轻轻敲打各鞭子上的冬孢子,装于封口袋中,4℃冰箱保存备用。
1.1.4 培养基(1) 固体培养基:M4、M5、M7、M9、M10、ISP4主要成分见表 1,此外每种培养基再添加10.0 mL复合盐母液(KNO3 1.0 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO4 0.5 g,NH4NO3 0.1 g,FeSO4 0.01 g,MnCl2·H2O 0.001 g,ZnSO4·7H2O 0.001 g,去离子水10 mL),13.0 g琼脂和1 000 mL去离子水,最后调整培养基pH值为7.2~7.4。
| 表 1 细菌分离培养基配方 Table 1 Formula of bacteria isolation media |
(2) 纯化培养基[11]:改良的ISP2固体培养基,其中麦芽提取物2.0 g、酵母提取物2.0 g、葡萄糖2.0 g、琼脂13.0 g、海水1 000 mL。
(3) 发酵培养基:改良的ISP2液体培养基。
(4) 指示菌培养基[12]:PDA固体培养基和YEPS液体培养基。
1.2 菌株的分离纯化与保藏在超净工作台中,用灭菌手术刀切取海绵组织1.0 g左右,先用无菌水冲洗多次,去除海绵中的杂质,再用75%乙醇多次喷淋海绵表面,最后用无菌水冲洗数次。将消毒好的海绵组织用研钵捣碎,研磨充分后,加入1 mL无菌水,即为样品原液。将原液稀释至10-3倍、10-4倍。吸取200 mL稀释样液涂布于M4、M5、M7、M9、M10和ISP4培养基上,每个样液梯度做2个平行板,28℃培养3周后,观察菌落的形态特征并记录详细的菌落大小、形态特征、数量等信息。将纯化好的菌株保存于20%(V/V)甘油管中,-80℃保藏。
1.3 分子生物学鉴定及系统发育树分析参照周双清等[13]的方法提取少量细菌的DNA。细菌16S rRNA基因序列扩增反应条件和反应程序均参照李菲等[14]的方法进行。扩增产物通过1%琼脂糖凝胶电泳检测是否合格。潜在新种BGMRC 2118的PCR扩增产物条带进行切胶回收,连接pEASY-T1克隆载体后,导入Top10感受态细胞中,挑选多个转化后的菌落,用PCR法验证克隆的片段大小,扩增样品均委托上海美吉生物医药技术有限公司广州分公司测序。测序结果经DNAStar软件整理,利用EzTaxon服务器(http://www.eztaxon.org/)[15]进行在线比对;选取同源性最高菌株的序列作为参比对象,运用MEGA5.0软件,采用Neighbor-Joining法构建系统树,Boostrap1000次检测各分支的置信值,并对各菌株的系统发育地位进行分析[16]。
1.4 抑菌活性筛选 1.4.1 细菌粗提物的制备配制180 mL发酵培养液置于500 mL锥形瓶中,将处于生长对数期的24株细菌分别接种至发酵液中,每株菌接种3瓶,置于180 r/min恒温振荡器,28℃培养7 d。发酵液离心分离菌体和发酵液,菌体加入少量去离子水,再用细胞破碎仪处理20 min。处理后的发酵液和菌体用1:1(V/V)乙酸乙酯进行萃取3次,萃取间隔20 min。浓缩干燥粗提物,置于干燥器中室温保存。
1.4.2 抑制甘蔗鞭黑粉菌担孢子及菌丝生长活性鉴定(1) 待试菌板的制备。参照李菲等[12]的方法,确定甘蔗鞭黑粉菌的冬孢子萌发后单倍体担孢子的配型(+、-)。分别挑取2种异型(+、-)担孢子接种于50 mL YEPS液体培养基中,置于28℃、180 r/min摇床中培育36 h,即为异型(+、-)担孢子菌悬液,记为A菌液和B菌液;取2种异型担孢子悬浮液等体积混合,制成复合型的初始菌悬液,记为C菌液。待灭菌后的PDA固体培养基冷却至55℃左右,按10%(V/V)的菌液量将A、B和C菌液分别加入3瓶PDA固体培养基中,充分摇匀,倒入平板后待其凝固,备用。
(2) 抑菌活性测定。采用牛津杯法[17]检测24株细菌抑制甘蔗鞭黑粉菌活性的情况。用3.0 mL DMSO溶解细菌粗提物,用一次性灭菌过滤器对24个样品进行过滤处理。以DMSO为空白对照,5 μg/mL啶酰菌胺溶液为阳性对照。每个牛津杯加入初始样液100 μL,置于28℃培养7 d后,用垂直十字交叉法测量各抑菌圈的直径。
2 结果与分析 2.1 细菌的多样性分析根据不同菌落的形态,如颜色、光泽、形状、边缘、状态和气丝等初步鉴定,从海绵 Pseudoceratina sp.中共分离到54株菌,详情见表 2。经16S rRNA基因测序比对后,获得24株细菌,其中变形菌门占45.83%(11株),厚壁菌门占37.50% (9株),放线菌门占16.67% (4株);优势菌属为Bacillus sp.。
| 表 2 海绵 Pseudoceratina sp.共栖细菌列表 Table 2 List of sponge-derived bacteria isolated from Pseudoceratina sp. |
经16S rRNA基因测序及比对结果分析,共获得细菌24株,隶属于13科14属。选择与其同源性最高的细菌序列构建Neighbor-Joining系统发育树(图 1)。其中,细菌BGMRC 2118(全长1 544 bp)与Bacillaceae科中有效发表菌株 Bacillus abyssalis SCSIO-15042T、Bacillus horikoshii DSM 8719T和 Bacillus soli NBRC 102451T系统发育最密切,相似率分别为96.46%、96.40%和96.26%。菌株BGMRC 2118与芽孢杆菌科中邻近的有效发表菌株构建Neighbor-Joining系统发育树(图 2)分析,菌株BGMRC 2118与 Bacillus abyssalis SCSIO-15042T能稳定地聚成一簇。采用的Maximum-Likelihood和Maximum-Parsimony法构建的系统发育树也获得相同结果。因此,菌株BGMRC 2118为Bacillaceae科中的一个潜在新分类单元。
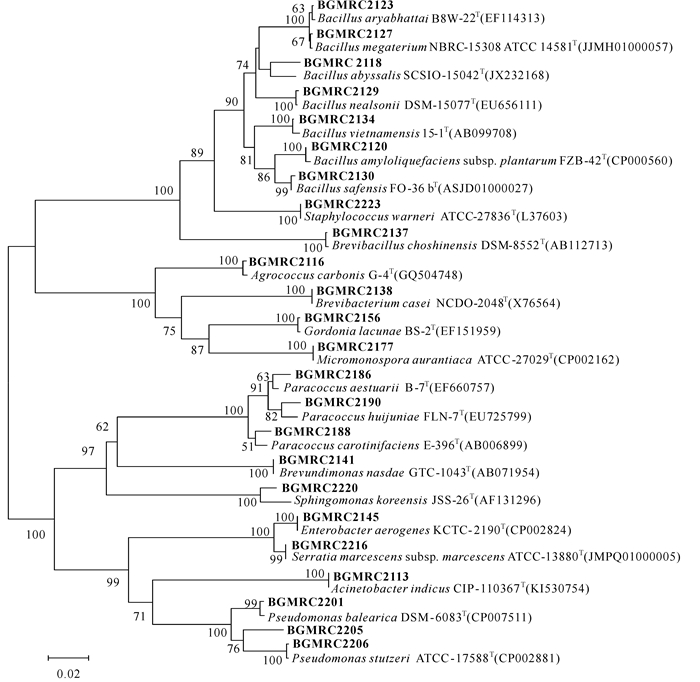
|
图 1 海绵 Pseudoceratina sp.共栖细菌的16S rRNA基因序列N-J系统发育树 Fig.1 The neighbour-joining phylogenetic tree of 16S rRNA gene sequence of sponge-derived bacteria isolated from Pseudoceratina sp. |
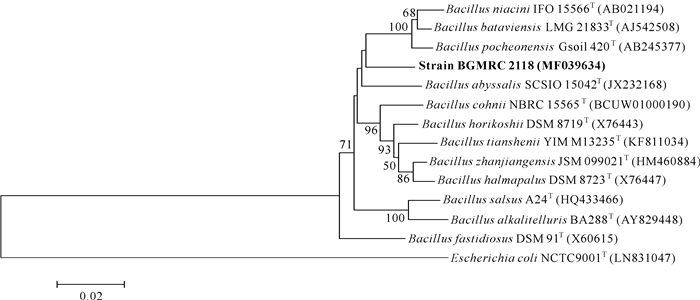
|
图 2 BGMRC 2118与芽孢杆菌科中邻近有效菌株的N-J系统发育树 Fig.2 The neighbour-joining phylogenetic tree of strain BGMRC 2118 and the adjacent effective strains in the family Bacillaceae |
采用6种分离培养基,从海绵 Pseudoceratina sp.中共分离出细菌54株,经16S rRNA基因测序比对后,获得24株细菌,各培养基的分离效果见图 3。由图 3可见,M9(含有少量精氨酸)上分离到的细菌种类最多,包含8个菌属;ISP4(含可溶性淀粉)分离到的细菌种类最少,包含4个菌属。由菌落数统计结果可知,M4、M5、M7、M9、M10和ISP4培养基上菌落数分别为1.3×105 cfu/mL、3.5×104 cfu/mL、2.2×104 cfu/mL、5.4×104 cfu/mL、1.6×105 cfu/mL和3.8×104 cfu/mL。M9培养基获得10株细菌,隶属于8属,其获得的菌株数和多样性均较高;而ISP4培养基获得4株细菌,其多样性和细菌数均较少。就新颖性而言,潜在新菌BGMRC 2118是从M7培养基上分离获得的。
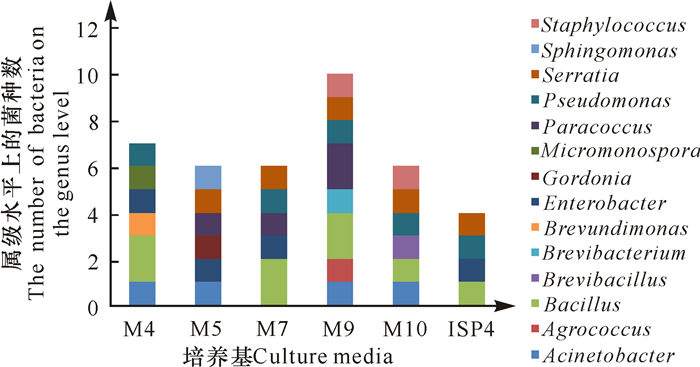
|
图 3 6种培养基的分离效果 Fig.3 Separation effect of 6 kinds of culture media |
选用24株细菌进行抑制甘蔗鞭黑粉菌的活性筛选,结果显示(图 4):6株细菌具有抑制菌丝生长活性,总阳性率为25.0%,抑菌圈直径6.5~19.0 mm;5株细菌抑制“+”型担孢子(培养7 d后呈花朵状记为“+”型担孢子),总阳性率为20.8%,抑菌圈直径为11.0~24.0 mm;3株细菌抑制“-”型担孢子(培养7 d后呈光滑圆形记为“-”型担孢子),总阳性率为12.5%,抑菌圈直径为10.5~15.5 mm。其中,有5株同时具有抑制2种或3种甘蔗鞭黑粉菌形态的活性(表 3)。阳性对照组(5 μg/mL啶酰菌胺溶液100 μL)出现明显抑菌圈,抑菌圈直径为(23.0±2.0)mm,阴性对照组未出现抑菌圈。
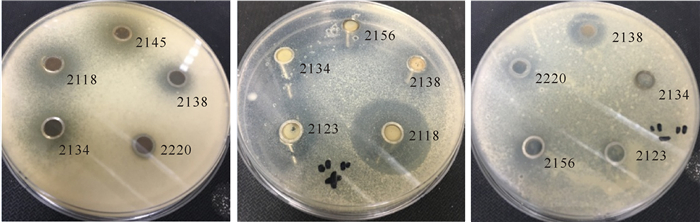
|
从左到右依次为细菌粗提物对甘蔗鞭黑粉菌菌丝、“+”型担孢子、“-”型担孢子的抑制作用 From left to right:Inhibiton effect of bacteria crude extract against Sporisorium scitamineum mycelium, plus type sporidia, minus type sporidia 图 4 抑菌活性筛选 Fig.4 Antibacterial activity screening |
| 表 3 抑菌活性菌株的筛选结果 Table 3 Screening results of antibacterial activities |
海绵作为一种滤食性动物,具有独特的内腔、管道和多孔结构,有利于摄取海水中的有机颗粒、微生物、藻类或原生动物等,使其成为海洋微生物的良好生长繁殖场所。大量的微生物附着在海绵表面、体内的细胞间、细胞内部及细胞的细胞核,可占到海绵鲜质量的50%~60% 。为了丰富广西斜阳岛海域海绵中共附生细菌的多样性和生物活性等信息,采用6种分离培养基,对海绵 Pseudoceratina sp.中可培养的共附生细菌进行定量分析,获得可培养细菌54株,隶属于13科14属24种。其中,32株γ-变形菌(占59.26%)、14株厚壁菌(占25.92%)、5株α-变形菌(占9.26%)及3株放线菌(占5.56%)。可见,海绵 Pseudoceratina sp.中占统治地位的是γ-变形菌,这与“γ-变形菌是海绵共生体的主要组成部分”的研究结论[20-21]相符合。
就新颖性而言,在广西斜阳岛海域海绵共附生细菌研究中,发现1株芽胞杆菌属的新种Bacillus sp.BGMRC 2118,值得对其进行新物种的多相分类鉴定研究。有研究指出,芽孢杆菌属的菌种可通过竞争营养空间、产生脂肽类抗生素、诱导植物系统抗性等作用,使其具有抗菌、抗肿瘤及抗炎症等广泛的生物活性[22]。鉴于新物种发现新型高效化合物的潜力相对较大[23],本文对BGMRC 2118开展抑菌活性研究,发现其具有对甘蔗鞭黑粉菌有抑制作用的活性物质。
采用牛津杯法对24株细菌进行抑制甘蔗鞭黑粉菌活性筛选,结果表明,8株细菌表现出显著的抑菌活性,总阳性率为33.33%。其中,4株为 Bacillus 属,1株为 Micromonospora 属,1株为 Gordonia 属,1株为 Brevibacterium 属,1株为 Enterobacter 属。然而,从海绵 Pseudoceratina sp.中分离到7株 Bacillus 属,其抑菌活性不尽相同,BGMRC 2118对甘蔗鞭黑粉菌的菌丝形态、“+”型担孢子和“-”型担孢子均有显著活性,BGMRC 2134和BGMRC 2123均对菌丝形态和“+”型担孢子有明显活性,BGMRC2220对“-”型担孢子有明显活性,芽孢杆菌属的其他菌株对甘蔗鞭黑粉菌均未表现出明显抑菌活性。可见,虽然活性菌株与非活性菌株隶属相同门级,相同科级,甚至是相同属级,但其抑菌效果不尽相同。这种差异在一定程度上说明生存环境是自然选择的一个动力,尽管生存环境相同,但菌株也会因结构和功能不同,而产生代谢的差异。
4 结论从海绵 Pseudoceratina sp.中共分离到可培养细菌54株,经16S rRNA基因序列对比后,获得24株细菌。其中,菌株BGMRC 2118与已发表有效菌株的16S rRNA基因序列的最高相似率为96.46%,可能为潜在新种。24株细菌中,有8株细菌的发酵粗提物对甘蔗鞭黑粉菌具有很强的抑菌活性。可见,广西斜阳岛海域的海绵存在着丰富的共附生细菌资源,具有广谱的抑菌活性,这对今后研究和开发新型生防菌肥具有积极的影响与借鉴。
| [1] |
李志勇, 何丽明, 蒋群. 海绵共附生细菌种群组成的PCR-DGGE基因指纹分析[J]. 生物技术通报, 2006(1): 61-64. LI Z Y, HE L M, JIANG Q. Study on the Sponge-associated bacterial community based on PCR-DGGE fingerprinting[J]. Biotechnology Bulletin, 2006(1): 61-64. |
| [2] |
张艳凤, 许勇, 陈雷, 等. 海绵内/共生稀有放线菌 Derm-acoccus sp.X4次级代谢产物分离纯化及结构解析[J]. 生物工程学报, 2016, 32(5): 599-609. ZHANG Y F, XU Y, CHEN L, et al. Isolation, identification and structural characterization of secondary metabolites from amarine sponge-derived rare actinobacterium Dermacoccus sp.X4[J]. Chinese Journal of Biotechnology, 2016, 32(5): 599-609. |
| [3] |
WANG G Y. Diversity and biotechnological potential of the sponge-associated microbial consortia[J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(7): 545-551. |
| [4] |
王宏梅, 赵心清. 可培养海洋放线菌生物多样性的研究进展[J]. 微生物学通报, 2007, 34(5): 996-1000. WANG H M, ZHAO X Q. Progress in the Bio-diversity studies of culturable marine actinobacteria[J]. Microbiology China, 2007, 34(5): 996-1000. |
| [5] |
宋恺, 胡洁, 林文翰, 等. 海绵共附生真菌多样性及其次级代谢产物的研究进展[J]. 生物技术通报, 2014(4): 36-42. SONG K, HU J, LIN W H, et al. Studies on diversity of sponges-associated fungi and their secondary metabolites[J]. Biotechnology Bulletin, 2014(4): 36-42. |
| [6] |
刘睿, 方玉春, 段琳, 等. 海绵共附生放线菌 Saccharopolyspora sp.nov中抗肿瘤活性成分的研究[J]. 中国抗生素杂志, 2006, 31(11): 646-649. LIU R, FANG Y C, DUAN L, et al. Antitumor active components of Saccharopoluspora sp.nov derived from Mycale plumose sponge[J]. Chinese Journal of Antibioties, 2006, 31(11): 646-649. DOI:10.3969/j.issn.1001-8689.2006.11.002 |
| [7] |
彭杰, 吴晓鹏, 张开山, 等. 海绵共附生放线菌 Streptom-yces sp.A01059抗稻瘟病活性物质的分离研究[J]. 中国农学通报, 2009, 25(9): 51-54. PENG J, WU X P, ZHANG K S, et al. Separation of active compounds against Pyricularia oryzae from sponge-associated actinobacteria Streptomyces sp.A01059[J]. Chinese Agricultural Science Bulletin, 2009, 25(9): 51-54. |
| [8] |
WRINGHT A E, MCCARTHY P J, SCHULTE G K. Sulfircin:A new sesterterpene sulfate from a deep-water sponge of the genus Ircinia[J]. Journal of Organic Chemistry, 1989, 54(14): 3472-3474. DOI:10.1021/jo00275a037 |
| [9] |
SUN L L, SHAO C L, CHEN J F, et al. New bisabolane sesquiterpenoids from a marine-derived fungus Aspergillus sp.isolated from the sponge Xestospongia testudinaria[J]. Bioorg Med Chem Lett, 2012, 22(3): 1326-1329. DOI:10.1016/j.bmcl.2011.12.083 |
| [10] |
陈志颖, 王祥, 苏培, 等. 叶片山海绵共附生细菌的防污活性研究[J]. 厦门大学学报:自然科学版, 2015, 54(3): 340-346. CHEN Z Y, WANG X, SU P, et al. Study on antifouling activity of bacteria associated with marine sponge mycale phyllophila[J]. Journal of Xiamen University:Natural Science, 2015, 54(3): 340-346. |
| [11] |
李小群, 李菲, 李家怡, 等. 海芒果可培养细菌的分离鉴定及其抑制海洋鱼类致病菌活性研究[J]. 广西科学院学报, 2017(2): 108-113. LI X Q, LI F, LI J Y, et al. Identification and inhibition activity inhibit fish pathogens of cultivated bacteria isolated from cerbera manghas[J]. Journal of Guangxi Academy of Sciences, 2017(2): 108-113. |
| [12] |
李菲, 高程海, 余炼, 等. 秋茄内生细菌多样性及抑制甘蔗黑穗霉菌活性研究[J]. 中国抗生素杂志, 2017(4): 318-327. LI F, GAO C H, YU L, et al. Diversity of endophytic bacteria isolated from Kandelia candel against Ustilago scitaminea Sydow in vitro[J]. Chinese Journal of Antibioties, 2017(4): 318-327. |
| [13] |
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010(2): 123-125. ZHOU S Q, HUANG X L, HUANG D Y, et al. A rapid method for extracting DNA from actinomycetes by Chelex-100[J]. Biotechnology Bulletin, 2010(2): 123-125. |
| [14] |
李菲, 高程海, 竺利波, 等. 茅尾海无瓣海桑内生细菌多样性及其细胞毒活性[J]. 微生物学报, 2016, 56(4): 689-697. LI F, GAO C H, ZHU L B, et al. Diversity and cytotoxic activity of endophytic bacteria isolated from Sonneratia apetala of Maowei Sea[J]. Acta Microbiologica Sinica, 2016, 56(4): 689-697. |
| [15] |
KIM K H, ROH S W, CHANG H W, et al. Nocardio-ides basaltis sp.nov., isolated from black beach sand[J]. Int J Syst Evol Microbiol, 2009, 59: 42-47. DOI:10.1099/ijs.0.65785-0 |
| [16] |
TAMURA K, PETERSON D, PETERSON N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [17] |
宫小明, 马荣桧, 孙军, 等. 黄曲霉毒素生物防控菌的筛选及鉴定[J]. 微生物学杂志, 2015(2): 103-108. GONG X M, MA R H, SUN J, et al. Screening and identification of aflatoxin bio-controlling bacterial strain[J]. Journal of Microbiology, 2015(2): 103-108. |
| [18] |
方玉春, 李凌绪, 朱天骄, 等. 海绵微生物的分离培养及一种活性代谢产物的初步研究[J]. 中国海洋大学学报, 2009, 39(4): 742-744. FANG Y C, LI L Z, ZHU T J, et al. Isolation, cultivation of a sponge-derived fungus and studes on its bioactive metabolites[J]. Periodical of Ocean University of China, 2009, 39(4): 742-744. |
| [19] |
张文龙, 陈名洪, 方东升, 等. 福建海绵放线菌多样性及其次级代谢产物合成能力[J]. 中国抗生素杂志, 2015, 40(6): 407-413. ZHANG W L, CHEN M H, FANG D S, et al. Diversity and secondary metabolite biosynthetic potential of actinomycetes associated with a marine sponge in Fujian[J]. Chinese Journal of Antibioties, 2015, 40(6): 407-413. |
| [20] |
HENTSCHEL U, FIESELER L, WEHRL M, et al. Microbial diversity of marine sponges[J]. Progress in Molecular & Subcellular Biology, 2003, 37: 59-88. |
| [21] |
TAYLOR M W, SCHUPP P J, DAHLLÖF I, et al. Host specificity in marine sponge-associated bacteria, and potential implications for marine microbial diversity[J]. Environmental Microbiology, 2004, 6(2): 121-130. DOI:10.1046/j.1462-2920.2003.00545.x |
| [22] |
唐金山, 高昊, 戴毅, 等. 环脂肽类成分研究进展[J]. 药学学报, 2008, 43(9): 873-883. TANG J S, GAO H, DAI Y, et al. Progress on the studies of cyclic lipopeptides[J]. Acta Pharmaceutica Sinica, 2008, 43(9): 873-883. |
| [23] |
TAKAHASHI Y, OMURA S. Isolation of new actinomycete strains for the screening of new bioactive compounds[J]. The Journal of General and Applied Microbiology, 2003, 49(3): 141-154. DOI:10.2323/jgam.49.141 |
 2018, Vol. 25
2018, Vol. 25 


