2. 江苏省水土保持与生态修复重点实验室,南京林业大学林学院,江苏南京 210037
2. Jiangsu Province Key Laboratory of Soil and Water Conservation and Ecological Restoration, College of Forestry, Nanjing Forestry University, Nanjing, Jiangsu, 210037, China
【研究意义】磷是植物生长必需的元素,土壤中磷元素的有效性直接影响植物的生长发育。据报道,我国74%的耕地土壤缺磷,土壤中95%的磷为难溶态磷,不能被植物吸收利用[1]。施入土壤中的磷肥大部分会与土壤中的Ca2+、Fe2+、Al3+等结合形成难溶性磷酸盐,当年的利用率仅10%~25%[2]。为满足农作物对磷元素的需求,农业生产过程中过量施肥也会导致潜在的环境风险。因此,如何有效利用土壤中被固定的无效态磷,并提高磷肥的使用效率,对减少农业生产中化肥的使用和资源的消耗,以及保护生态环境具有重要意义。广西石漠化地区土壤偏碱性,土壤中磷元素被矿物质紧密结合而导致其活性降低,成为植物生长的限制因子,石漠化土壤中有效磷的缺乏影响当地植被恢复和农业生产。因此,研究提高石漠化土壤磷元素有效性对石漠化植被修复具有积极意义。【前人研究进展】植物根际存在一类特殊的微生物,通过矿化作用或参与氧化还原反应,能将土壤中难溶性磷转化为能被植被吸收利用的可溶性磷,这类特殊的微生物被称为溶磷菌。溶磷菌可按分解底物分为两类:一类是能将土壤中植物难以吸收利用的无机磷酸盐转化为可以直接吸收利用形态磷的微生物称为解无机磷菌;另一类是能矿化有机磷化合物的微生物称为解有机磷菌。解磷微生物主要存在于土壤和植物根际中,由于植物根际有丰富的碳水化合物、氨基酸、维生素等物质,为根际微生物的繁殖提供了大量的能源,植物根际区域的微生物数量、种类以及代谢活性都远高于非根际区域,因此植物根际土壤是筛选解磷细菌的适宜生境[3]。目前已报道的解磷菌包括细菌、真菌和放线菌,其中细菌最多,约20个属。近年来,研究人员在不同地区植物根际土壤中筛选出多种高效解磷菌株,如徐欢等[4]从福建桉树(Eucalyptus robusta)根际土壤中筛选了26株解磷菌;郭艺鹏等[5]从新疆枣树(Ziziphus jujuba)根际筛选了4株解磷菌;杨艳华等[1]从河南茶树(Camellia sinensis)根际土壤筛选出解磷细菌36株;徐睿等[6]从海南降香黄檀(Dalbergia odorifera)根际土壤中筛选出19株解磷细菌。目前关于广西石漠化地区植物根际土壤解磷细菌筛选及解磷菌对植被促生效应的研究还未见报道。【本研究切入点】石漠化地区植被抗逆性差,造林成活率低,土壤养分有效性低是原因之一,因此,如果能筛选出乡土高效解磷菌株,并进一步研发适合石漠化地区植被修复的微生物菌剂,则对加快石漠化地区生态修复非常有帮助。【拟解决的关键问题】本研究通过平板筛选、摇瓶培养和盆栽接种植物试验,拟筛选出乡土高效解磷菌,以期通过微生物方法促进石漠化造林植物生长,为研制高效微生物肥料提供基础资料,为加快喀斯特石漠化地区植被恢复和生态治理提供技术支持。
1 材料与方法 1.1 材料根际土壤样品采集自广西平果县果化镇石漠化综合治理示范区,采集了青冈栎(Cyclobalanopsis glauca)、降香黄檀、任豆(Zenia insignis)、樟叶槭(Acer cinnamomifolium)、蒜头果(Malania oleifera)、顶果木、茶条木(Delavaya toxocarpa)、火龙果(Hylocereus undatus)、五节芒(Miscanthus floridulus)根际土壤。采集10~20 cm深土壤中植物根系,将根系表面附着的土壤轻轻抖落在无菌袋中,带回实验室置于4℃冰箱中保存。共采集27份土壤样品。
无机磷液(固)体培养基:葡萄糖10.0 g、Ca3(PO4)2 5.0 g、MgCl2·6H2O 5.0 g、MgSO4·7H2O 0.1 g、KCl 0.2 g、(NH4)2SO4 0.5 g、NaCl 0.2 g、MnSO4 0.03 g、FeSO4·7H2O 0.03 g,加蒸馏水至1 000 mL,pH值为7.0。制作无机磷固体培养基时,加入琼脂粉18 g。
有机磷液(固)体培养基:葡萄糖10.0 g、(NH4)2SO4 0.5 g、NaCl 0.3 g、KCl 0.3 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、MgSO4·7H2O 0.3 g、卵磷脂0.2 g、CaCO3 5 g、酵母膏0.4 g,加蒸馏水至1 000 mL,pH值为6.8~7.2。制作有机磷固体培养基时,加入琼脂粉18 g。
LB液体培养基:酵母膏5 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 000 mL,pH值为7.0。
1.2 方法 1.2.1 解磷细菌的初步筛选与培养基称取10 g土壤样品,放入盛有90 mL无菌水的三角瓶中,28℃、170 r/min振荡10 min,得到根际土壤悬浮液,采用梯度稀释法,获得浓度为10-2、10-3、10-4、10-5和10-6 g/mL的土壤悬液。利用涂布法,将10-4、10-5和10-6 g/mL的土壤悬液分别涂布在解磷固体培养基上,每个处理重复3次,28℃倒置培养3 d,挑出有透明圈的菌落进行纯化并保存。将纯化的初筛菌株接种到固体培养基上,28℃培养7 d后,分别测定解磷圈直径(D)和菌落直径(d),并计算溶磷圈直径和菌落直径的比值(D/d)。
1.2.2 菌株的16S rDNA基因扩增及分子鉴定以细菌菌液为DNA模板,用16S rDNA通用引物27F/1492R进行PCR扩增,正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系:DNA模板1 μL,引物(10 μmol/L)各1 μL,2×ES Taq MasterMix 12.5 μL,加超纯水补至25 μL。PCR反应条件:94℃变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环,终延伸2 min。纯化后的PCR产物由生工生物工程(上海)股份有限公司进行测序。将测定的序列在GenBank中用Blast软件与已知的16S rDNA基因序列进行同源性比对,选取同源性在99%以上、序列长度相当的16S rDNA序列,采用BioEdit 7.1进行Alignment后,用MEGA 5.0软件的Neighbor-Joining法构建系统发育树,自展数(Bootstrap)为1 000。
1.2.3 解磷菌解磷活性的测定将初步筛选的菌株分别接种在50 mL无机磷和有机磷液体培养基中,在28℃、170 r/min振荡3 d,然后转移至50 mL灭菌的离心管中,采样超声波破碎细胞20 min,然后在4 000 r/min离心20 min,取2.5 mL上清液于50 mL容量瓶中定容。以不接种菌株发酵液为对照,测定上清液OD值,计算出上清液中有效磷含量,以反应液中有效磷含量表示菌株解磷能力大小,每处理设置3个重复。
1.2.4 盆栽接种实验从筛选的菌株中,选取5株D/d>2.0,溶磷量>200 μg/mL的菌株作为试验菌株。用接种环将5株解磷菌分别接种至LB液体培养基中,30℃、180 r/min摇床培养至对数期,将菌悬液用无菌水洗涤3次后垂悬。用注射器在每盆植物根际土壤中加入5 mL菌悬液,每15 d接菌1次,接种终浓度为106CFU/g,对照组接种等量无菌水,每处理8次重复,随机区组排列,放置于温室条件下培养3个月。
供试土壤为石漠化地区采集的碳酸岩发育的土壤,自然条件下风干后去除石砾和根系,塑料花盆大小为13 cm×14 cm×15 cm,每盆装入土壤1.5 kg。土壤有机质含量为5.2%,全氮含量为1.8 g/kg,碱解氮为72 mg/kg,全磷为0.60 g/kg,速效磷为4.9 mg/kg,全钾为6.2 g/kg,速效钾为47.8 mg/kg。
供试苗木为顶果木,种子用3%次氯酸钠浸泡3 min,无菌水冲洗3次,催芽2 d后,播种于育苗盘,待幼苗长出3~4片真叶后,挑选大小、长势一致的幼苗移栽到装有试验基质的花盆中,移栽1株幼苗。
苗木培育90 d后,测量株高、地径和叶面积,并取出全株并清洗根系,将地上地下部分分别烘干称重计算生物量,利用H2SO4-H2O2消煮法测定植株全氮含量,利用钒钼黄吸光光度法测定全磷含量,利用火焰光度法测定植物全钾含量。采集根际土壤,利用碳酸氢钠—钼锑抗比色法测定土壤有效磷含量。
1.3 数据分析实验数据利用Excel2007和SPSS17.0软件进行处理,多重比较采用LSD法。
2 结果与分析 2.1 植物根际土壤解磷细菌的解磷活性利用解磷培养基进行初步筛选,发现石漠化地区植物根际土壤中存在大量解有机磷细菌和解无机磷细菌。溶磷圈直径(D)和菌落直径(d)的比值是初步判断解磷细菌相对解磷能力的指标,根据比值大小,筛选出D/d>1.0的解有机磷和解无机磷细菌共44株(表 1),其中解无机磷细菌20株,占45.5 %;解有机磷细菌24株,占54.5%。
| 表 1 石漠化地区植物根际土壤解磷细菌解磷活性 Table 1 Phosphorus solubilizing activity of phosphate solubilizing bacteria in rhizosphere soil of rocky desertification area |
通过测定44株解磷菌的解磷活性,发现解无机磷细菌解磷活性高于解有机磷细菌。24株解有机磷细菌中,解磷活性均小于100 μg/mL;其中,解磷活性大于50 μg/mL的有11株;20株解无机磷细菌解磷活性均超过100 μg/mL,其中,>200 μg/mL的有5株:IP-HLG1、IP-HLG23、IP-CTM11、IP-STG12、IP-JXHT15,这5株解磷细菌分别是采集自火龙果、茶条木、蒜头果和降香黄檀根际土壤,解磷活性分别为224.9 μg/mL、212.7 μg/mL、253.2 μg/mL、233.4 μg/mL和214.7 μg/mL。
由图 1可知,解有机磷细菌解磷磷活性与菌液pH值无显著相关,解无机磷细菌解磷活性与菌液pH值呈显著负相关关系。
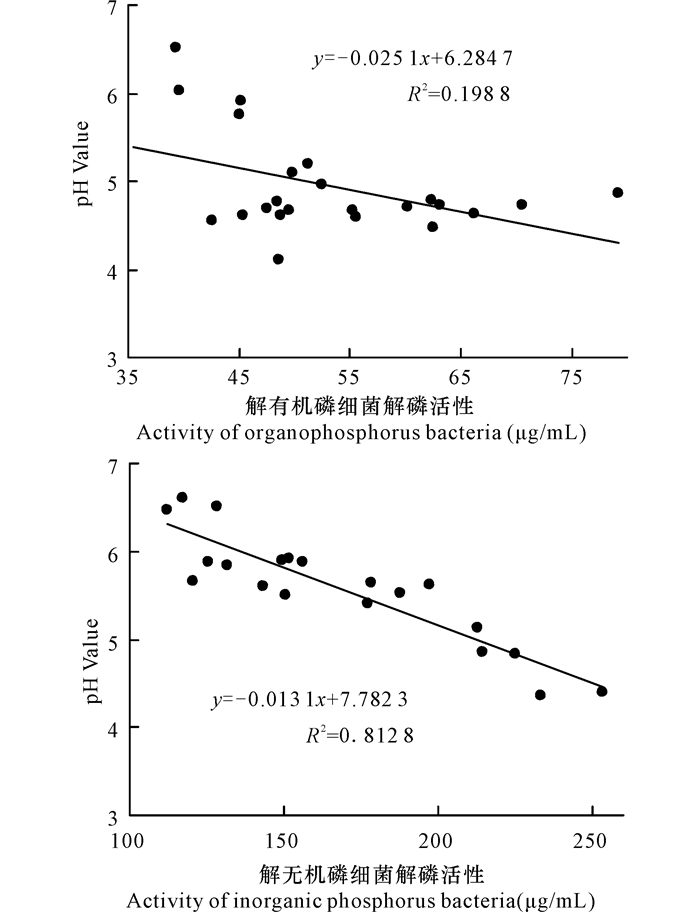
|
图 1 解磷菌解磷活性与培养液pH值相关性 Fig.1 Correlation between phosphate-solubilizing bacteria activity and pH value of culture medium |
通过基因序列分析,筛选的解磷细菌可以分为11个分类群(图 2),即假单胞菌菌属(Pseudomonas)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、不动杆菌属(Acinetobacter)、伯克氏菌属(Burkholderia)、鞘氨醇单胞菌属(Sphingomonas)、链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)、类芽孢杆菌属(Paenibacillus)、葡萄球菌属(Staphlococcus)和芽孢杆菌属(Bacillus)。其中,假单胞菌属为优势类群群,占50%,链霉菌属和肠杆菌属为次优势类群,各占11.4%。接种试验用的5个菌株IP-HLG1和IP-CTM11属于假单胞菌、IP-STG12和IP-JXHT15属于链霉菌属、IP-HLG23属于泛菌属。
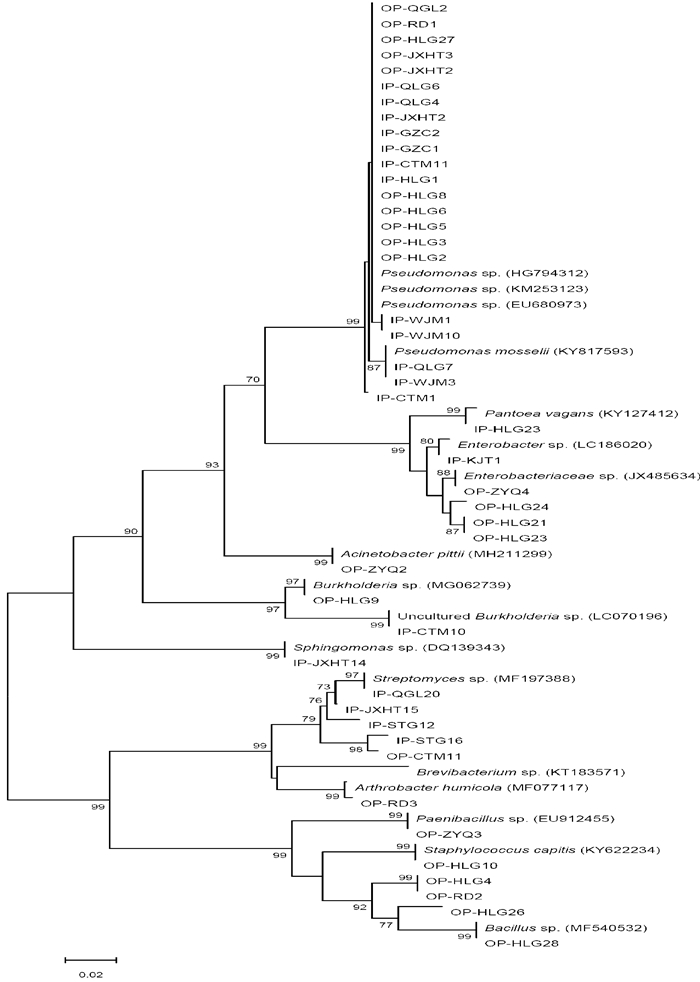
|
图 2 石漠化地区植物根际土壤解磷菌16S rDNA基因系统发育树 Fig.2 Phylogenetic tree based on the 16S rDNA sequences of phosphate solubilizing bacteria in rhizosphere soil in rocky desertification areas |
接种解磷菌剂对顶果木幼苗生长具有显著促进作用。与对照处理相比,接种IP-HLG1、IP-CTM11和IP-STG12处理植株株高分别增加13.1%、16.8%和9.8%,地径分别增加6.7%、15.6%和13.3%,而接种IP-JXHT15和IP-HLG23处理与对照处理无显著差异(表 2)。所有接菌处理植株的叶面积均显著提高,相比对照处理增加14.5%~56.2%。植株地上生物量与根系生物量类似,接菌处理均显著高于对照处理,地上生物量比对照增加14.5%~30.5%,根系生物量比对照增加27.6%~45.7%。接种IP-HLG1和IP-CTM11处理的植株氮、磷含量显著高于对照处理,分别比对照处理高9.3%、19.7%和24.6%、20.3%。同时,接种IP-HLG1和IP-CTM11处理的植株全氮、全磷含量也显著高于其他3种接种处理,与对照处理相比,接种处理植株全钾含量无显著增加。接种解磷菌剂处理土壤有效磷含量显著增加,与对照处理相比,接种处理土壤有效磷含量增加34.5%~69.1%(图 3)。其中,IP-CTM11和IP-HLG1处理土壤有效磷含量最高,分别达到9.3 mg/kg和8.7 mg/kg。

|
图 3 接种解磷菌对石漠化土壤有效磷含量的影响 Fig.3 Effect of phosphate solubilizing bacteria on the content of available phosphorus in rocky desertification soil |
| 表 2 解磷菌剂对顶果木生长和养分吸收的作用 Table 2 Effects of phosphate solubilizing bacteria on growth and nutrient uptake of Acrocarpus fraxinifolius seedlings |
本研究从广西石漠化地区常见植物根际土壤中筛选出44株解磷效果较好的解磷菌,包括20株解有机磷菌和24株解无机磷菌。筛选出的解磷菌分属于11个类群,其中假单胞菌属占50%。不同菌株解磷活性差异较大,解有机磷细菌溶解卵磷脂能力为35.4~79.2 μg/mL,解无机磷菌溶解磷酸三钙能力为112~253.2 μg/mL。用盆栽法进一步研究了5株解磷活性较强的解无机磷菌对顶果木幼苗的促生作用,结果表明,解磷菌对顶果木幼苗的叶面积和生物量具有显著促进作用,接种IP-HLG1、IP-CTM11和IP-STG12处理显著促进了幼苗株高和地径的生长,并且IP-HLG1和IP-CTM11菌株显著促进了植株对氮、磷元素的吸收。所有接菌处理土壤有效磷含量显著提高,比对照处理增加34.5%~69.1%。
解磷菌包括细菌、真菌和放线菌,目前报道的解磷细菌占20个属,解磷真菌约5个属,解磷放线菌以链霉菌为主[7-9]。对解磷细菌的研究中对解无机磷细菌研究较多[10-12]。解磷菌在土壤中的分布受土壤质地、类型等环境因素影响,并且具有明显根际效应[1, 13-14]。如在黑钙土中解磷细菌主要为芽孢杆菌属和假单胞菌属;黄棕壤和红壤中解磷细菌种类较为丰富,以芽孢杆菌属和类芽孢杆菌属为主[14]。本研究从石漠化常见植物根际土壤分离出的解磷分属11个类群,其中假单胞菌属占所筛选菌株总数的50%,表明石漠化土壤中解磷菌以假单胞菌属为优势类群。在调查的植物根际土壤中,从火龙果根际土壤中筛选的解磷细菌最多,占20%,这可能与火龙果根际土壤中施用农家肥较多有关。
目前常用溶磷圈直径与菌落直径比值(D/d)的大小来判断解磷细菌的解磷能力,但研究表明,D/d与解磷活性呈弱相关关系[4, 15]。本研究也有相似结果,如在解有机磷细菌中菌株OP-HLG23的D/d为3.7,解磷能力为63.2 μg/mL,而菌株OP-RD1的D/d为2.1,但解磷能力达到79.2 μg/mL。由于解磷菌对平板培养和液体培养两种方式的不同适应,有些菌株在液体培养方式下繁殖速度更快,解磷能力更强[16]。
溶磷菌的溶磷机制复杂多样,通常认为主要是有机酸释放的H+、磷酸酶、蛋白质、腐殖酸、H2S等多种途径的溶磷作用。Goldstein[17]研究认为一些解磷细菌分泌葡萄糖酸是解磷的主要机制,并认为细菌通过Glutamate dehydrogenase(GDH)途径,利用葡萄糖脱氢酶在细胞膜外将葡萄糖氧化成葡萄糖酸,从而溶解磷。虞伟斌等[18]研究K3菌株的溶磷机理,认为K3菌株在培养过程中并未产生葡萄糖酸,说明有些解磷菌株并非通过GDH途径解磷。有研究表明,菌株解磷活性与培养介质pH值具有显著负相关关系[19],即培养液pH值越低,培养液中有效磷含量越高。本研究表明,解有机磷细菌解磷能力与培养液pH值无显著相关(R2=0.198 8),而解无机磷细菌解磷能力与培养液pH值显著负相关(R2=0.812 8)。这与徐欢等[4]研究桉树根际土壤解磷细菌解磷能力结果相似。解无机磷菌在生长过程中分泌有机酸,释放H+降低介质pH值[20];而解有机磷细菌是通过分泌胞外磷酸酶等非有机酸类物质来分解有机磷脂,因此其代谢产物对培养液pH值无显著影响[4, 21]。
添加解磷菌处理的土壤有效磷含量是对照处理土壤的1.35~1.69倍,表明实验选取的5个解磷菌株均能有效活化石漠化土壤中难溶性磷元素,能显著提高根际土壤有效磷含量,从而促进顶果木幼苗对磷元素的吸收。解磷菌剂不仅对顶果木幼苗磷氮磷吸收有不同程度的促进效应,而且对顶果木株高、地径、生物量和叶面积也有显著提高作用,这可能是由于解磷菌在活化土壤中难溶性磷元素促的同时还释放了生长素(IAA)、细胞分裂素(CK)等物质促进植物生长[22],对解磷菌的促生特性还需要进一步深入研究。
4 结论本研究通过调查和实验研究表明,石漠化地区植物根际土壤存在大量解磷微生物,筛选的乡土解磷菌对提高石漠化造林植物生长具有显著促进作用,本研究筛选的解磷菌株不仅能将石漠化土壤中难溶性磷转化为可溶性磷,而且对植物的生长发育具有明显促进作用。本研究筛选的假单胞菌IP-HLG1和IP-CTM11对植物促生能力和土壤磷素活化能力表现较好,可以作为研发解磷微生物肥的潜在资源菌种。利用乡土优良解磷菌剂不仅促进乡土树种生长、改善土壤磷元素有效性,同时可以提高菌株在石漠化土壤中的定殖能力和活性,这将有助于加速修复石漠化地区生态环境。
致谢 试验得到了华南植物园博士生李艳琼以及长江大学本科生梁阳、舒华威的帮助,在此表示感谢!| [1] |
杨艳华, 李俊州, 臧睿, 等. 茶树根际土壤解磷细菌的筛选及解磷活性分析[J]. 河南农业科学, 2014, 43(9): 60-65. YANG Y H, LI J Z, ZANG R, et al. Screening and analysis of phosphate-solubilizing activity of phosphate-solubilizing bacteria from rhizosphere soil of tea plant[J]. Journal of Henan Agricultural Sciences, 2014, 43(9): 60-65. DOI:10.3969/j.issn.1004-3268.2014.09.014 |
| [2] |
鲁如坤, 时正元, 顾益出, 等. 土壤积累态磷研究Ⅱ.磷肥的表观积累利用率[J]. 土壤, 1995(6): 286-289. LU R K, SHI Z Y, GU Y C, et al. Study on accumulating phosphorus in soil Ⅱ.Apparent accumulation and utilization rate of phosphate fertilizer[J]. Soils, 1995(6): 286-289. |
| [3] |
解文科, 王小青, 李斌, 等. 植物根系分泌物研究综述[J]. 山东林业科技, 2005(5): 63-67. XIE W K, WANG X Q, LI B, et al. A review of plant root exudates[J]. Shandong Forestry Science and Technology, 2005(5): 63-67. DOI:10.3969/j.issn.1002-2724.2005.05.041 |
| [4] |
徐欢, 俞新玲, 林勇明, 等. 桉树根际土壤解磷细菌的分离、筛选及其解磷效果[J]. 福建农林大学学报:自然科学版, 2016, 45(5): 529-535. XU H, YU X L, LIN Y M, et al. Isolation, screening of phosphate solubilizing capacity of phosphate solubilizing bacteria in Eucalyptus species[J]. Journal of Fujian Agriculture and Forestry University:Natural Science, 2016, 45(5): 529-535. |
| [5] |
郭艺鹏, 李静, 杨越, 等. 枣根际解磷细菌解磷特性及影响因素分析[J]. 河南农业大学学报, 2018, 52(1): 96-103. GUO Y P, LI J, YANG Y, et al. Characteristics and influencing factors of phosphate solubilizing bacteria in jujube rhizosphere[J]. Journal of Henan Agricultural University, 2018, 52(1): 96-103. |
| [6] |
徐睿, 刘君昂, 周国英, 等. 降香黄檀-檀香根际土壤高效解磷细菌的分离筛选与鉴定[J]. 热带作物学报, 2015, 36(2): 281-288. XU R, LIU J A, ZHOU G Y, et al. Isolation, screening and identification of high-efficiency phosphate-solubilizing bacteria in rhizosphere of Dalbergia odorifera and sandalwood[J]. Chinese Journal of Tropical Crops, 2015, 36(2): 281-288. DOI:10.3969/j.issn.1000-2561.2015.02.011 |
| [7] |
CHANG C H, YANG S S. Thermo-tolerant phosphate-solubilizing microbes for multi-functional biofertilizer perparations[J]. Bioresour Technology, 2009, 100(4): 1648-1658. DOI:10.1016/j.biortech.2008.09.009 |
| [8] |
JEONG S, MOON H S, SHIN D, et al. Survival of introduced phospahte-solubilizing bacteria (PSB) and their impact on microbial community structure during the phytoextraction of Cd-contaminated soil[J]. Journal of Hazardous Materials, 2013, 263(P2): 441-449. |
| [9] |
韩丽珍, 邓兆辉, 朱春艳, 等. 茶树根际促生菌的筛选与促生特性的研究[J]. 山地农业生物学报, 2016, 35(1): 51-56. HAN L Z, DENG Z H, ZHU C Y, et al. Identification and characterization of plant growth-promoting rhizobacteria isolated from rhizosphere soils of tea trees[J]. Journal of Mountain Agriculture and Biology, 2016, 35(1): 51-56. |
| [10] |
OTEINO N, LALLY RD, KIWANUKA S, et al. Plant growth promotion induced by phosphate solubilizing endophytic Pseudomonas isolates[J]. Frontiers in Microbiology, 2015, 6: 745. |
| [11] |
GHOSH R, BARMAN S, MUKHERJEE R, et al. Role of phosphate solubilizing Burkholderia spp. for successful colonization and growth promotion of Lycopodium cernuum L.(Lycopodiaceae) in lateritic belt of Birbhum district of West Bengal, India[J]. Microbiological Research, 2016, 183: 80-91. DOI:10.1016/j.micres.2015.11.011 |
| [12] |
晋婷婷, 任嘉红, 刘瑞祥. 南方红豆杉根际解有机磷细菌的鉴定及其解磷特性和促生作用研究[J]. 西北植物学报, 2016, 36(9): 1819-1827. JIN T T, REN J H, LIU R X. Identification, characterization and growth-promoting effects of an organophosphate-solubilizing bacterium from Taxus chinensis var.mairei rhizosphere[J]. Acta Bot Boreal-Occident Sin, 2016, 36(9): 1819-1827. |
| [13] |
王光华, 赵英, 周德瑞, 等. 解磷菌的研究现状与展望[J]. 生态环境, 2003, 12(1): 96-101. WANG G H, ZHAO Y, ZHOU D R, et al. Review of phosphate-solubilizing microorganisms[J]. Ecology and Environment, 2003, 12(1): 96-101. DOI:10.3969/j.issn.1674-5906.2003.01.024 |
| [14] |
尹瑞龄. 我国旱地土壤的溶磷微生物[J]. 土壤, 1988(5): 243-246. YING R L. Phosphorus solubilizing microorganisms in dry land soil of China[J]. Soils, 1988(5): 243-246. |
| [15] |
叶震, 陈秀蓉, 杨淑君. 东祁连山高寒植被土壤解磷菌筛选及其解磷能力的初步研究[J]. 草原与草坪, 2010, 30(5): 6-10. YE Z, CHEN X R, YANG S J. Primary study on isolation and ability of phosphorus-solubilizing bacteria in soil of alpine vegetation in eastern Qilian Mountains[J]. Grassland and Turf, 2010, 30(5): 6-10. DOI:10.3969/j.issn.1009-5500.2010.05.002 |
| [16] |
CHEN Y P, REKHA P D, ARUN A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006, 34(1): 33-41. DOI:10.1016/j.apsoil.2005.12.002 |
| [17] |
GOLDSTEIN A H. Involvement of the quinoprotein glucose dehydrogenase in the solubilization of exogenous phosphates by gram-negative bacteria[M]//TORRIANI-GORINI A, YAGIL E, SILVER S. Phosphate in microorganisms: Cellular and molecular biology.Washington DC: ASM Press, 1994: 197-203.
|
| [18] |
虞伟斌, 杨兴明, 沈其荣, 等. K3解磷菌的解磷机理及其对缓冲容量的响应[J]. 植物营养与肥料学报, 2010, 16(2): 354-361. YU W B, YANG X M, SHEN Q R, et al. Mechanism on phosphate solubilization of Pseudomonas sp. K3 and its phosphate solubilization ability under buffering condition[J]. Plant Nutrition and Fertilizer Science, 2010, 16(2): 354-361. |
| [19] |
乔志伟, 洪坚平, 谢英荷, 等. 石灰性土壤拉恩式溶磷细菌的筛选鉴定及溶磷特性[J]. 应用生态学报, 2013, 24(8): 2294-2300. QIAO Z W, HONG J P, XIE Y H, et al. Screening, identification and phosphate-solubilizing characteristics of Rahnella sp.phosphate-solubilizing bacteria in calcareous soil[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2294-2300. |
| [20] |
贺梦醒, 高毅, 胡正雪, 等. 解磷菌株B25的筛选、鉴定及其解磷能力[J]. 应用生态学报, 2012, 23(1): 235-239. HE M X, GAO Y, HU Z X, et al. Screening, identification, and phosphate-solubilizing capability of phosphate-solubilizing bacterial strain B25[J]. Chinese Journal of Applied Ecology, 2012, 23(1): 235-239. |
| [21] |
李蓉, 周德明, 吴毅, 等. 杉木根际溶磷菌筛选及其部分特性的初步研究[J]. 中南林业科技大学学报, 2012, 32(4): 95-99. LI R, ZHOU D M, WU Y, et al. Selection and characteristics of phosphate-solubilizing bacteria in rhizosphere of Cunninghaimia lanceolata[J]. Journal of Central South Univerity of Forestry & Technology, 2012, 32(4): 95-99. DOI:10.3969/j.issn.1673-923X.2012.04.020 |
| [22] |
柯春亮, 李淑娟, 段雅婕. 解磷菌剂对香蕉幼苗生长及土壤理化因子的影响[J]. 海南大学学报:自然科学版, 2017, 35(3): 253-259. KE C L, LI S J, DUAN Y J. Effects of phosphate-solubilizing bacteria on the growth of banana seedlings and physical and chemical factors[J]. Natural Science Journal of Hainan University:Natural Science, 2017, 35(3): 253-259. |
 2018, Vol. 25
2018, Vol. 25 


