2. 广西友谊关森林生态系统定位观测研究站, 广西凭祥 532600;
3. 中国林业科学研究院热带林业实验中心, 广西凭祥 532600
2. Guangxi Youyiguang Forest Ecosystem Research Station, Pingxiang, Guangxi, 532600, China;
3. Experimental Center of Tropical Forestry, Chinese Academy of Forestry, Pingxiang, Guangxi, 532600, China
马尾松(Pinus massoniana)人工林是我国东部湿润亚热带地区分布最广、栽培面积最大的人工林生态系统之一[1-2]。然而,马尾松纯林普遍存在生态系统稳定性差、生物多样性低、病虫害多、养分循环受阻、土壤贫瘠等一系列的生态问题[3-5],严重影响马尾松人工林多目标可持续经营[5-6]。通过树种混交提高林分质量是我国近期实施的森林质量精准提升工程的重要途径,因此,研究和总结马尾松纯林改造成混交林后土壤微生物群落组成结构的变化,对深刻认识树种混交提高林分质量的机制无疑具有重要的意义。人工林的土壤质量退化与森林凋落物密切相关。研究发现,单一树种的人工纯林会出现凋落物不易分解或分解速度较慢,养分归还速率低[7],容易造成某些土壤养分元素的亏缺[8],引起土壤退化[9]。作为土壤和植物重要的营养元素来源,以及土壤微生物的栖息地和反应底物,凋落物在数量[10]和质量[11]上的改变,可以影响植物根系活动、土壤微生物群落组成结构和功能[10]。土壤微生物分解森林凋落物,参与土壤的养分调控,其群落结构、数量和酶活性强烈影响土壤功能多样性[12-13]。最近的研究还发现,土壤微生物组成结构和功能群的改变是导致人工林土壤质量退化的主要原因[14-15],特别是原有的植物-土壤微生物共存关系发生改变,导致人工林土壤关键微生物功能群丧失或微生物菌群关系失衡[16-17]。有研究表明,通过树种混交可以增加和改善凋落物的数量和质量[18-19],改善土壤微生物群落组成和结构[20],阔叶树与马尾松混交可以提高林分的质量和效益[18, 21-24],但对马尾松纯林改造成针阔异龄混交林后土壤微生物群落组成结构和功能的变化机制仍缺乏深入研究。本研究以60年生的马尾松纯林和马尾松×红锥(Castanopsis hystrix)异龄混交林为对象,重点研究由马尾松纯林改造成马尾松×红锥异龄混交林后土壤微生物群落结构和功能变化,这种变化是否有利于土壤肥力的改善,为精准提升马尾松人工林林分质量提供参考,进一步验证人工林异龄混交的作用。
1 材料与方法 1.1 研究区域概况研究区域位于广西凭祥市中国林业科学研究院热带林业实验中心伏波试验场,属南亚热带季风型气候区,具有春季多阴雨少日照,夏季炎热多雨,秋季干旱少雨,冬季温暖少霜的气候特点,年均降水量1 200~1 500 mm,年均气温21.5~22.2℃,≥10℃的活动积温为6 000~7 600℃,年均日照时数达1 419 h[25]。主要地貌类型为低山丘陵,土壤类型为砖红壤[26]。原生性植被为热带季雨林和雨林[27],但几乎荡然无存,已被人工林或各种人工植被所取代。
1.2 样地概况研究样地涉及马尾松纯林、马尾松×红锥异龄混交林。马尾松纯林系1958年对36 hm2草坡炼山整地后,挖穴造林;1983年结合林分间伐抚育,将36 hm2马尾松纯林中的一半(18 hm2)套种红锥,形成针阔异龄混交林。2017年,在上述马尾松纯林和混交林中分别设置5个20 m×20 m的样地。不同林分类型的样地概况见表 1。
| 林分类型 Stand type |
样地号 Plot No. |
平均胸径 Average DBH (cm) |
平均树高 Average height (m) |
林分密度 Stand density (Individual· hm-2) |
天然更新株数 Natural regenerating individuals (Individual· hm-2) |
胸高断面积 Basal area (m2·hm-2) |
海拔 Altitude (m) |
坡度 Slope (°) |
| 纯林 Pure plantation |
1 | 39.3 | 24.4 | 375 | 1700 | 48.2 | 540 | 27 |
| 2 | 39.1 | 29.0 | 350 | 2225 | 44.1 | 571 | 25 | |
| 3 | 45.7 | 24.9 | 375 | 2400 | 64.8 | 552 | 24 | |
| 4 | 36.1 | 21.2 | 400 | 900 | 37.8 | 551 | 25 | |
| 5 | 44.7 | 25.4 | 350 | 950 | 55.9 | 548 | 30 | |
| 混交林 Mixed plantation |
1 | 37.9/18.0 | 32.4/24.7 | 350/575 | 325 | 56.6 | 640 | 30 |
| 2 | 37.9/18.0 | 32.0/15.9 | 275/350 | 650 | 41.4 | 455 | 27 | |
| 3 | 38.0/19.5 | 31.5/22.8 | 325/575 | 325 | 57.4 | 464 | 30 | |
| 4 | 42.0/19.0 | 25.1/20.2 | 325/625 | 125 | 65.1 | 465 | 20 | |
| 5 | 47.1/20.0 | 29.2/18.4 | 325/475 | 75 | 61.9 | 457 | 32 | |
| 注:混交林“/”前数据为马尾松,“/”后数据为红锥 Note:Date before mixed plantation "/" comes from P.massoniana, date after "/" comes from C.hystrix |
||||||||
1.3 样品采集与分析
在对试验林分进行群落调查的基础上,于2017年7月在每个20 m×20 m的样地内采用9点取样法采集0~10 cm的土壤样品,混合后挑出石砾、根等杂质,过2 mm筛子,取3份样品,1份风干用于测定土壤理化性质,1份放入-18℃冰箱里保存,用于测定土壤酶活性,1份经冷冻干燥处理后用于磷脂脂肪酸的测定。
取10 g风干土样与去离子水(土:水=1:2.5,W/V)充分混匀,待土壤溶液澄清后,取上清液,用pH计(Starter2100, Ohaus, USA)测定土壤pH值;土壤水分含量(Soil moisture content, SMC)采用重量法测定;土壤全氮(Total nitrogen, TN)含量采用连续流动分析仪(AA3, Bran Luebbe公司)测定;土壤全磷(Total phosphorus, TP)含量采用氢氧化钠碱熔-钼锑抗比色法测定;土壤全钾(Total potassium, TK)含量采用氢氧化钠碱熔-火焰光度计法测定;土壤速效钾(Available potassium, AK)含量用乙酸铵浸提-火焰光度计法测定;土壤速效磷(Available phosphorus, AP)含量用双酸浸提-钼锑抗比色法测定;土壤有机质(Soil organic matter, SOM)含量采用重铬酸钾氧化-外加热法测定;土壤微生物生物量碳(Microbial biomass carbon, MBC)、氮(Microbial biomass nitrogen, MBN)测定采用氯仿熏蒸浸提法;称取10 g鲜土,用2 mol·L-1 KCl溶液提取后于全自动连续流动分析仪(SEAL AA3, Norderstedt, Germany)测定土壤铵态氮、硝态氮含量[28]。土壤有效氮(Available nitrogen, AN)含量为铵态氮、硝态氮含量之和。
参照Frostegård等[29]的方法测定PLFAs含量及分析土壤微生物群落结构。单个脂肪酸种类用nmol·g-1干土表示,每种脂肪酸的浓度基于19:0碳内标的浓度来计算。本研究中根据磷脂脂肪酸(PLFAs)的相对丰富度把微生物种类分为细菌、真菌、放线菌(Actinomycetes, Act)、丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF),细菌又可细分为革兰氏阳性菌(Gram-positive bacteria, GP)和革兰氏阴性菌(Gram-negative bacteria, GN)[30-32]。
通过测定土壤氧化还原酶类(过氧化物酶、酚氧化酶)及水解酶类(β-1, 4-葡萄糖苷酶和N-乙酰-β-氨基葡萄糖苷酶、脲酶、磷酸酶)的活性来评价土壤微生物功能。过氧化物酶活性(Phenol oxidase, PHE)和酚氧化酶(Peroxidase, PER)采用左旋多巴胺(L-DOPA)为底物进行测定[33]。β-1, 4-葡萄糖苷酶(β-1, 4-glucosidase, BG)和N-乙酰-β-氨基葡萄糖苷酶(N-acetyl-β-glucosaminidase, NAG)活性采用对硝基苯乙酰基氨基葡萄糖苷为底物进行测定[34-35]。脲酶(Urease, URE)活性采用次氯酸钠-苯酚钠比色法测定;酸性磷酸酶(Acid phosphatase, ACP)活性利用对-硝基酚磷酸钠溶液为底物测定[36]。
1.4 数据统计分析物种丰富度指数(Richness, R):每个土壤样品检测到的PLFAs标记种数。
香农威纳(Shannon-Wiener)指数(H)[37]:
| $ H=-\sum\limits_{i=1}^{s} P_{i} \ln P_{i}, $ |
式中Pi代表第i个PLFA标记的相对丰度,s为总的PLFAs标记种数。
Simpson指数(D)[38]:
| $ D=1-\sum\limits_{i=1}^{s} P_{i}^{2}, $ |
式中Pi代表第i个PLFA标记的相对丰度,s为总的PLFAs标记种数。
Pielou均匀度指数(J)[39]:
J=H/lnS,
式中H为Shannon-Wiener指数,S为总的PLFAs标记种数。
采用t检验对两林分土壤酶活性、土壤细菌、真菌、放线菌等PLFAs含量进行差异性检验,设置统计显著水平为P=0.05;采用Pearson相关分析进行土壤微生物群落与土壤酶活性和土壤理化性质间的关联分析;所有的统计分析及作图在R 3.5.1完成。
2 结果与分析 2.1 土壤微生物群落结构对两种林分土壤PLFAs含量大于0.01 nmol·g-1的标记种类和含量进行统计,共得到27种PLFAs标记(表 2)。从表 2可以看出,除革兰氏阴性菌中的16:0 2OH和革兰氏阳性菌中的16:1ω9c外,其余25种PLFAs标记含量均为纯林高于混交林。t检验结果表明,除革兰氏阴性菌中的cy19:0ω8c和16:0 2OH、革兰氏阳性菌中的a16:0和16:1ω9c,以及放线菌中的10Me19:0差异不显著(P>0.05)外,其余PLFAs均存在显著或极显著差异(P < 0.05,P < 0.01)。
| PLFAs标记 PLFAs markers |
PLFAs类群 PLFAs groups |
PLFAs含量 PLFAs content (nmol·g-1) |
F | t | P | |
| 纯林 Pure plantations |
混交林 Mixed plantations |
|||||
| cy19:0ω8c | GN | 7.05±0.67 | 6.68±1.01 | 2.721 | 0.690 | 0.509 |
| i15:0 | GP | 5.08±0.48 | 3.74±0.40 | 0.038 | 4.755 | 0.001 |
| 10Me16:0 | Act | 4.10±0.33 | 3.15±0.21 | 1.001 | 5.434 | 0.001 |
| 18:1ω9c | Fungi | 3.84±0.43 | 2.71±0.53 | 0.143 | 3.673 | 0.006 |
| i16:0 | GP | 3.25±0.40 | 2.11±0.32 | 0.001 | 4.928 | 0.001 |
| 18:1ω7c | GN | 1.92±0.18 | 1.32±0.19 | 0.000 | 5.122 | 0.001 |
| 18:2ω6, 9c | Fungi | 1.42±0.25 | 0.96±0.24 | 0.001 | 2.977 | 0.018 |
| a15:0 | GP | 1.15±0.10 | 0.85±0.07 | 1.021 | 5.303 | 0.001 |
| 16:1ω7c | GN | 1.04±0.10 | 0.82±0.08 | 0.191 | 3.907 | 0.004 |
| i17:0 | GP | 1.04±0.06 | 0.70±0.05 | 0.146 | 9.764 | 0.000 |
| 16:1ω5c | AMF | 0.85±0.12 | 0.60±0.07 | 1.060 | 4.088 | 0.003 |
| 16:1 2OH | GN | 0.82±0.16 | 0.53±0.06 | 2.178 | 3.826 | 0.005 |
| a17:0 | GP | 0.73±0.07 | 0.59±0.07 | 0.469 | 3.179 | 0.013 |
| cy17:0 | GN | 0.62±0.06 | 0.46±0.04 | 1.173 | 4.710 | 0.002 |
| 10Me17:0 | Act | 0.52±0.09 | 0.32±0.04 | 1.400 | 4.191 | 0.003 |
| 15:0 3OH | GN | 0.46±0.05 | 0.37±0.04 | 1.642 | 3.195 | 0.013 |
| 10Me18:0 | Act | 0.43±0.05 | 0.34±0.05 | 0.078 | 2.776 | 0.024 |
| 10Me19:0 | Act | 0.29±0.17 | 0.17±0.16 | 0.108 | 1.171 | 0.275 |
| 17:1ω8c | GN | 0.26±0.01 | 0.18±0.03 | 3.424 | 4.655 | 0.002 |
| 11Me18:1ω7c | Act | 0.15±0.02 | 0.11±0.02 | 0.006 | 2.438 | 0.041 |
| i14:0 | GP | 0.14±0.01 | 0.08±0.01 | 1.394 | 7.985 | 0.000 |
| i15:1 | GP | 0.09±0.01 | 0.05±0.01 | 0.311 | 7.349 | 0.000 |
| a19:0 | GP | 0.08±0.06 | 0.01±0.03 | 1.599 | 2.648 | 0.029 |
| 16:0 2OH | GN | 0.07±0.02 | 0.08±0.01 | 0.331 | -0.968 | 0.361 |
| i19:0 | GP | 0.03±0.01 | 0.01±0.02 | 28.543 | 3.033 | 0.030 |
| a16:0 | GP | 0.01±0.02 | 0.01±0.02 | 0.005 | 0.027 | 0.979 |
| 16:1ω9c | GP | 0.00±0.00 | 0.06±0.08 | 27.963 | -1.559 | 0.158 |
| 注:GN表示革兰氏阴性菌,GP表示革兰氏阳性菌,Act表示放线菌,Fungi表示真菌,AMF表示丛枝菌根真菌 Note:GN indicates Gram-negative bacteria,GP indicates Gram-positive bacteria,Act indicates Actinomycetes,Fungi indicates Fungi,AMF indicates Arbuscular mycorrhizal fungi |
||||||
研究结果显示,马尾松纯林土壤总PLFAs为(35.45±2.13) nmol·g-1,极显著高于异龄混交林(27.02±2.41) nmol·g-1(P < 0.01)(图 1a)。进一步分析表明,马尾松纯林土壤细菌、真菌、放线菌、丛枝菌根真菌、革兰氏阳性菌PLFAs均极显著高于异龄混交林(P < 0.01),革兰氏阴性菌显著高于异龄混交林(P < 0.05)(图 1b~h)。

|
| ns、*和**分别表示不显著、显著(P < 0.05)和极显著(P < 0.01);PP:马尾松纯林,MP:异龄混交林 ns, *, ** indicates non-significant, significant (P < 0.05)and extremely significant (P < 0.01) difference between the two plantations, respectively; PP:pure plantation of P.massoniana, MP:mixed plantation 图 1 纯林和异龄混交林不同土壤微生物类群的PLFAs含量 Fig. 1 PLFAs contents of different soil microbe groups in the pure and uneven-aged mixed plantations |
2.2 土壤微生物群落多样性
图 2显示出马尾松纯林土壤微生物群落的PLFAs多样性均高于异龄混交林。t检验结果表明,马尾松纯林和异龄混交林土壤PLFAs丰富度和均匀度指数差异不显著(P>0.05),而香农威纳指数、Simpson指数差异达到显著水平(P < 0.05)。
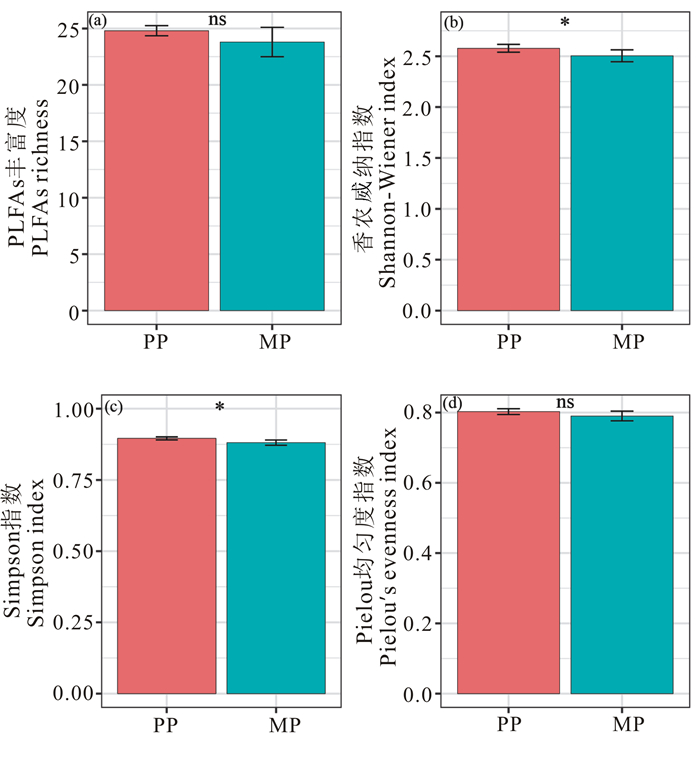
|
| ns、*和**分别表示不显著、显著(P < 0.05)和极显著(P < 0.01);PP:马尾松纯林,MP:异龄混交林 ns, *, ** indicates non-significant, significant (P < 0.05)and extremely significant (P < 0.01)difference between the two plantations, respectively; PP:pure plantation of P.massoniana, MP:mixed plantation 图 2 纯林和异龄混交林土壤微生物PLFAs多样性指数 Fig. 2 Soil microbe PLFAs diversity indices in the pure and uneven-aged mixed plantations |
2.3 土壤酶活性
马尾松纯林改造为异龄混交林后,土壤β-1, 4-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶、酚氧化酶、过氧化物酶活性均呈现不同程度的降低,其中N-乙酰-β-氨基葡萄糖苷酶、酚氧化酶活性降幅分别为11.99%、18.03%,与马尾松纯林相比,差异分别达极显著、显著水平(表 3)。异龄混交林能提高土壤酸性磷酸酶和脲酶活性,但前者与纯林差异不显著(P>0.05),后者差异达极显著水平(P < 0.01)。
| 变量 Variables |
β-1, 4-葡萄糖苷酶BG (nmol·g-1·h-1) | N-乙酰-β-氨基葡萄糖苷酶 NAG (nmol·g-1·h-1) |
酸性磷酸酶ACP (nmol·g-1·h-1) | 酚氧化酶 PHE (μmol·g-1·h-1) |
过氧化物酶 PER (μmol·g-1·h-1) |
脲酶 URE (mg N·g-1·h-1) |
| 马尾松纯林 Pure planta-tions of P.massoniana |
37.30±1.45 | 36.57±2.10 | 106.37±6.71 | 11.61±1.22 | 13.42±1.72 | 7.83±0.64 |
| 混交林 Mixed planta-tions |
35.94±1.50 | 32.19±1.54 | 110.36±5.53 | 9.52±0.67 | 12.08±1.44 | 9.07±0.32 |
| F | 0.109 | 0.117 | 0.071 | 0.830 | 0.234 | 1.555 |
| t | 1.453 | 3.759 | -1.024 | 3.350 | 1.338 | -3.852 |
| P | 0.184 | 0.006 | 0.336 | 0.010 | 0.218 | 0.005 |
2.4 土壤性质
表 4是2种林分土壤性质特征。由表 4可见,马尾松纯林改造成异龄混交林后,土壤有机质(SOM)和速效钾(AK)含量极显著降低,降幅分别为30.09%、29.95%;土壤速效磷(AP)含量也降低了12.65%,但差异不显著。异龄混交林土壤含水量(SWC)、全氮(TN)含量极显著高于马尾松纯林,增幅分别为42.96%、94.92%;土壤微生物生物量氮(MBN)含量则显著高于马尾松纯林,增幅为28.17%。此外,与马尾松纯林相比,异龄混交林提高了土壤pH值、全钾(TK)、有效氮(AN)、微生物生物量碳(MBC)含量,但差异不显著。土壤微生物生物量碳氮比(MBC:MBN)为马尾松纯林高于异龄混交林,差异未达到显著水平(P>0.05)。
| 变量 Variables |
pH value | 土壤含水量 SMC(%) |
土壤有机质含量 SOM(g·kg-1) |
土壤全氮含量 TN(g·kg-1) |
土壤全磷含量 TP(g·kg-1) |
土壤全钾含量 TK(g·kg-1) |
土壤有效氮含量 AN (mg·kg-1) |
土壤速效磷含量 AP (mg·kg-1) |
土壤速效钾含量 AK (mg·kg-1) |
土壤微生物生物量碳含量 MBC (mg·kg-1) |
土壤微生物生物量氮含量 MBN (mg·kg-1) |
土壤微生物生物量碳氮比 MBC:MBN |
| 马尾松纯林 Pure planta-tions P.massoniana |
4.04±0.12 | 20.43±1.75 | 82.92±10.13 | 1.45±0.31 | 0.27±0.07 | 3.51±0.21 | 61.69±4.67 | 11.18±3.35 | 51.46±7.77 | 351.71±99.30 | 33.34±3.62 | 10.45±1.99 |
| 混交林 Mixed planta-tions |
4.12±0.10 | 29.21±3.73 | 54.32±4.78 | 2.82±0.69 | 0.27±0.04 | 3.59±0.14 | 69.07±6.97 | 9.77±2.69 | 32.37±4.80 | 353.34±79.95 | 42.73±5.37 | 8.51±2.90 |
| F | 0.004 | 4.685 | 0.887 | 1.387 | 2.610 | 3.491 | 0.226 | 0.686 | 0.496 | 0.067 | 0.941 | 0.180 |
| t | -1.122 | -4.765 | 5.708 | -4.060 | -0.183 | -0.672 | -1.968 | 0.737 | 4.673 | -0.029 | -3.243 | 1.238 |
| P | 0.294 | 0.001 | 0.000 | 0.004 | 0.859 | 0.521 | 0.085 | 0.482 | 0.002 | 0.978 | 0.012 | 0.251 |
2.5 土壤微生物群落结构与土壤酶活性和土壤性质的相关性
由表 5可知,土壤不同微生物类群与土壤酶活性和土壤性质的相关关系不同。不同土壤微生物类群均与BG、NAG、PHE、PER呈正相关,与ACP和URE呈负相关。其中,土壤革兰氏阴性菌与BG的相关性达显著水平,不同微生物类群均与土壤NAG呈极显著正相关,细菌、放线菌、革兰氏阳性菌与PHE相关性达显著或极显著水平。不同土壤微生物类群均与土壤SOM、AK呈极显著正相关关系,与AP呈弱的正相关关系,而与pH值、SMC、TN、TP、TK、AN、MBC、MBN呈负相关关系。
| 变量 Variables |
总PLFAs Total PLFAs |
细菌PLFAs Bacteria PLFAs |
真菌PLFAs Fungus PLFAs |
Act PLFAs |
AMF PLFAs |
GN PLFAs |
GP PLFAs |
| BG | 0.508 | 0.497 | 0.564 | 0.370 | 0.599 | 0.695* | 0.313 |
| NAG | 0.904** | 0.900** | 0.812** | 0.892** | 0.799** | 0.841** | 0.849** |
| ACP | -0.161 | -0.170 | -0.126 | -0.166 | -0.025 | -0.198 | -0.135 |
| PHE | 0.675* | 0.679* | 0.481 | 0.803** | 0.587 | 0.541 | 0.704* |
| PER | 0.484 | 0.505 | 0.423 | 0.420 | 0.377 | 0.615 | 0.380 |
| URE | -0.684* | -0.703* | -0.493 | -0.769** | -0.496 | -0.551 | -0.734* |
| pH | -0.184 | -0.185 | -0.142 | -0.173 | -0.346 | -0.197 | -0.157 |
| SMC | -0.807** | -0.812** | -0.705* | -0.813** | -0.608 | -0.643* | -0.844** |
| SOM | 0.820** | 0.807** | 0.814** | 0.719* | 0.860** | 0.705* | 0.793** |
| TN | -0.647* | -0.659* | -0.551 | -0.640* | -0.506 | -0.530 | -0.679* |
| TP | -0.078 | -0.091 | -0.036 | -0.132 | 0.250 | -0.096 | -0.078 |
| TK | -0.103 | -0.121 | -0.040 | -0.115 | -0.031 | -0.022 | -0.175 |
| AN | -0.391 | -0.372 | -0.226 | -0.583 | -0.490 | -0.205 | -0.447 |
| AP | 0.324 | 0.320 | 0.209 | 0.431 | 0.323 | 0.158 | 0.396 |
| AK | 0.772** | 0.764* | 0.649* | 0.820** | 0.754* | 0.657* | 0.760* |
| MBC | -0.218 | -0.215 | -0.417 | 0.080 | -0.300 | -0.414 | -0.060 |
| MBN | -0.825** | -0.819** | -0.741* | -0.831** | -0.702* | -0.626 | -0.866** |
| MBC:MBN | 0.283 | 0.283 | 0.070 | 0.531 | 0.133 | 0.009 | 0.439 |
| 注:*表示显著(P < 0.05), **表示极显著(P < 0.01) Note:*indicates significant (P < 0.05), **indicates extremely significant (P < 0.01) |
|||||||
3 讨论 3.1 异龄混交林对土壤微生物群落结构和功能的影响
多数研究表明,混交林比纯林具有更高的土壤微生物多样性和土壤酶活性[22, 40-41]。邓娇娇等[41-42]的研究表明,油松侧柏混交林和油松蒙古栎混交林的土壤微生物多样性和土壤酶活性高于纯林。黄雅丽等[43]的研究指出剌槐和白蜡树混交改变了土壤细菌结构,提高了细菌多样性。罗达等[13]研究发现,旱季土壤微生物群落、细菌、真菌、放线菌PLFAs量均为马尾松人工林最高,混交林次之,格木林最低;而在雨季则是格木纯林高于混交林。本研究表明,将马尾松纯林改造成马尾松×红锥异龄混交林后土壤微生物群落、细菌、真菌、放线菌、革兰氏阳性菌和革兰氏阴性菌的PLFAs含量不但没有增加,反而显著降低(图 1),多样性指数的分析结果也表明,异龄混交林土壤微生物PLFAs的香农威纳指数、Simpson指数均显著低于纯林(P < 0.05)(图 2)。本研究还发现,将马尾松纯林改造成马尾松×红锥异龄混交林后,土壤β-1, 4-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶、酚氧化酶、过氧化物酶活性均呈现不同程度的降低,其中N-乙酰-β-氨基葡萄糖苷酶、酚氧化酶活性出现显著或极显著降低,而脲酶活性却极显著提高。本研究结果与前人的研究结果明显不一致,究其原因主要是前人的研究为同龄混交林且混交年限较短,通常在30年以内,而本文的研究林分年龄为60年,改造为异龄混交林后也超过30年。其次,由于早期研究的林分年龄较小,混交林的林分结构往往优于纯林,混交林下有较丰富的生物多样性、凋落物产量和质量较高、土壤有机质含量较高[44],而本文中的异龄混交林,林冠结构简单,为两层结构,上层为马尾松,下层为红锥,且下层林冠的覆盖度极高,超过90%,天然更新很弱(平均300株/hm2),林下灌草层缺失;相反,马尾松纯林林冠比较稀疏,林内天然更新发达,乔木层中天然更新的个体数平均达1 635株/hm2,是异龄混交林的5.45倍(表 1),且林下灌草层发育。第三,异龄混交林的植物多样性较低,其物种丰富度为15种,而纯林为45种,是异龄混交林的3倍(关于两类林分的植物多样性将在另文讨论),不同的植物凋落物和根系分泌物的理化性质不同,对土壤微生物的生长具有选择性刺激作用,进而影响微生物群落特征[13, 45]。由此可见,在研究混交效应时只考虑混交树种的作用而忽略天然更新的作用,未必能精准揭示树种混交效应。因此,在未来的研究中,要综合研究混交树种与天然更新物种对森林土壤微生物群落结构和功能的影响,以此来验证树种混交的土壤微生物效应。
3.2 土壤微生物群落组成结构和功能的主要影响因素土壤微生物群落组成结构和功能受植被类型、气候、土壤及人为活动等的影响[46-47]。在立地条件一致的情况下,不同植被类型是导致土壤微生物群落组成结构和功能分异的最关键因素[41]。凋落物作为土壤有机质的重要来源和土壤微生物的反应底物,林分组成和结构的变化改变了凋落物的组成和数量、有机质来源和土壤养分以及分解者的组成,从而影响土壤微生物群落结构和功能[48-49]。凋落物添加试验表明,凋落物的去除显著降低土壤微生物总量和土壤酶活性,而凋落物添加(加倍)却显著提高土壤微生物总量和土壤酶活性[50-51],但也有一些研究表明,土壤微生物总量和土壤酶活性对凋落物去除和添加的响应并不明显[49, 52]。不同的响应结果可能与研究区域、植被类型、凋落物去除时间、林分年龄、立地条件的不同有一定关系[10, 53-54]。土壤水分、pH值、空气、温度、团聚体、矿质元素和有机质均不同程度地影响着土壤酶的活性及稳定性[55]。通常,在土壤含水量较低时,土壤酶活性较低,但当土壤过湿时,酶活性也会受到抑制[55-58]。同水分因子一样,土壤微生物群落结构和功能与环境因子的关系都遵循“最小量定律”和“耐受定律”,只不过是不同的地域、林分类型、土壤状况可能取值范围不同而已。在本研究中,不同土壤微生物类群均与β-1, 4-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶、酚氧化酶、过氧化物酶呈正相关,与酸性磷酸酶和脲酶呈负相关;不同土壤微生物类群均与土壤有机质、有效钾呈极显著正相关关系,与速效磷、土壤微生物生物量碳氮比呈弱的正相关关系,而与pH值、土壤含水量、总氮、全磷、全钾、有效氮、土壤微生物生物量碳、土壤微生物生物量氮呈负相关关系。罗达等[13]对同一区域马尾松、格木纯林及其混交幼林的研究表明,土壤微生物群落结构组成受林分类型和季节的双重影响,旱季土壤微生物的PLFAs总量及各菌群的PLFAs量显著高于雨季。本研究的取样时间为雨季,异龄混交林的土壤水分含量过高,极显著高于纯林,相反,异龄混交林的土壤有机质又极显著低于纯林,这可能是异龄混交林的土壤微生物群落结构和功能不如纯林的主要原因。
4 结论本研究表明,在25 a生的马尾松林下引入红锥形成的异龄混交林对土壤微生物群落结构和功能的改善作用有限,因其林分组成、结构和土壤有机质不如经过60年近自然恢复的马尾松纯林,导致马尾松×红锥异龄混交林土壤微生物群落多样性和土壤酶活性明显低于马尾松纯林。因此,在今后的研究中,天然更新的作用应该得到足够重视。
| [1] |
中国植被编辑委员会. 中国植被[M]. 北京: 科学出版社, 1980.
|
| [2] |
罗应华, 孙冬婧, 林建勇, 等. 马尾松人工林近自然化改造对植物自然更新及物种多样性的影响[J]. 生态学报, 2013, 33(19): 6154-6162. |
| [3] |
周政贤. 中国马尾松[M]. 北京: 中国林业出版社, 2001.
|
| [4] |
陈小红, 赵安玖, 张健, 等. 不同林龄马尾松林下植物多样性与环境特征[J]. 四川农业大学学报, 2017, 35(2): 186-192, 233. |
| [5] |
刘世荣, 杨予静, 王晖. 中国人工林经营发展战略与对策:从追求木材产量的单一目标经营转向提升生态系统服务质量和效益的多目标经营[J]. 生态学报, 2018, 38(1): 1-10. DOI:10.3969/j.issn.1673-1182.2018.01.001 |
| [6] |
WANG H, LIU S R, WANG J X, et al. Mixed-species plantation with Pinus massoniana and Castanopsis hystrix accelerates C loss in recalcitrant coniferous litter but slows C loss in labile broadleaf litter in southern China[J]. Forest Ecology and Management, 2018, 422: 207-213. DOI:10.1016/j.foreco.2018.04.024 |
| [7] |
郭婧, 喻林华, 方晰, 等. 中亚热带4种森林凋落物量、组成、动态及其周转期[J]. 生态学报, 2015, 35(14): 4668-4677. |
| [8] |
EPRON D, MOUANDA C, MARESCHAL L, et al. Impacts of organic residue management on the soil C dynamics in a tropical eucalypt plantation on a nutrient-poor sandy soil after three rotations[J]. Soil Biology and Biochemistry, 2015, 85: 183-189. DOI:10.1016/j.soilbio.2015.03.010 |
| [9] |
WU Z, HAACK S E, LIN W X, et al. Soil microbial community structure and metabolic activity of Pinus elliottii plantations across different stand ages in a subtropical area[J]. PloS ONE, 2015, 10(8): e0135354. DOI:10.1371/journal.pone.0135354 |
| [10] |
SAYER E J. Using experimental manipulation to as-sess the roles of leaf litter in the functioning of forest ecosystems[J]. Biological Reviews, 2006, 81(1): 1-31. |
| [11] |
LIU P, HUANG J H, SUN O J, et al. Litter decomposition and nutrient release as affected by soil nitrogen availability and litter quality in a semiarid grassland ecosystem[J]. Oecologia, 2010, 162(3): 771-780. DOI:10.1007/s00442-009-1506-7 |
| [12] |
WANG W, ZHANG X Y, TAO N, et al. Effects of litter types, microsite and root diameters on litter decomposition in Pinus sylvestris plantations of northern China[J]. Plant and Soil, 2014, 374(1/2): 677-688. |
| [13] |
罗达, 史作民, 唐敬超, 等. 南亚热带乡土树种人工纯林及混交林土壤微生物群落结构[J]. 应用生态学报, 2014, 25(9): 2543-2550. |
| [14] |
RAIESI F, BEHESHTI A. Microbiological indicators of soil quality and degradation following conversion of native forests to continuous croplands[J]. Ecological Indicators, 2015, 50: 173-185. DOI:10.1016/j.ecolind.2014.11.008 |
| [15] |
MITCHELL P J, SIMPSON A J, SOONG R, et al. Biochar amendment and phosphorus fertilization altered forest soil microbial community and native soil organic matter molecular composition[J]. Biogeochemistry, 2016, 130(3): 227-245. DOI:10.1007/s10533-016-0254-0 |
| [16] |
ZECHMEISTER-BOLTENSTERN S, KEIBLINGER K M, MOOSHAMMER M, et al. The application of ecological stoichiometry to plant-microbial-soil organic matter transformations[J]. Ecological Monographs, 2015, 85(2): 133-155. DOI:10.1890/14-0777.1 |
| [17] |
LIANG C, BALSER T C. Microbial production of recalcitrant organic matter in global soils:Implications for productivity and climate policy[J]. Nature Reviews Microbiology, 2011, 9(1): 75. |
| [18] |
FORRESTER D I, BAUHUS J, COWIE A L, et al. Mixed-species plantations of Eucalyptus with nitrogen-fixing trees:A review[J]. Forest Ecology and Management, 2006, 233(2/3): 211-230. |
| [19] |
HU Y L, WANG S L, ZENG D H. Effects of single Chinese fir and mixed leaf litters on soil chemical, microbial properties and soil enzyme activities[J]. Plant and Soil, 2006, 282(1/2): 379-386. |
| [20] |
HUANG X, LIU S, YOU Y M, et al. Microbial community and associated enzymes activity influence soil carbon chemical composition in Eucalyptus urophylla plantation with mixing N2-fixing species in subtropical China[J]. Plant and Soil, 2017, 414(1/2): 199-212. |
| [21] |
MAISTO G, MARCO DE A, MEOLA A, et al. Nutrient dynamics in litter mixtures of four Mediterranean maquis species decomposing in situ[J]. Soil Biology and Biochemistry, 2011, 43(3): 520-530. DOI:10.1016/j.soilbio.2010.11.017 |
| [22] |
HUANG X M, LIU S R, WANG H, et al. Changes of soil microbial biomass carbon and community composition through mixing nitrogen-fixing species with Eucalyptus urophylla in subtropical China[J]. Soil Biology and Biochemistry, 2014, 73: 42-48. DOI:10.1016/j.soilbio.2014.01.021 |
| [23] |
郭文福, 蔡道雄, 贾宏炎, 等. 马尾松与红椎等3种阔叶树种营造混交林的生长效果[J]. 林业科学研究, 2010, 23(6): 839-844. |
| [24] |
陈诗, 海鑫, 叶永忠, 等. 伏牛山南北坡针阔混交林土壤养分对比分析[J]. 中南林业科技大学学报, 2018, 38(9): 65-71. |
| [25] |
温远光, 杨柳, 朱宏光, 等. 除草剂对桉树×降香黄檀混交林下植物功能群的影响[J]. 广西科学, 2015, 22(6): 578-585. DOI:10.3969/j.issn.1005-9164.2015.06.002 |
| [26] |
YOU Y M, HUANG X M, ZHU H G, et al. Positive interactions between Pinus massoniana and Castanopsis hystrix species in the uneven-aged mixed plantations can produce more ecosystem carbon in subtropical China[J]. Forest Ecology and Management, 2018, 410: 193-200. DOI:10.1016/j.foreco.2017.08.025 |
| [27] |
李治基. 广西森林[M]. 北京: 中国林业出版社, 2001.
|
| [28] |
鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000.
|
| [29] |
FROSTEGÅRD Å, TUNLID A, BÅÅTH E. Microbial biomass measured as total lipid phosphate in soils of different organic content[J]. Journal of Microbiological Methods, 1991, 14(3): 151-163. DOI:10.1016/0167-7012(91)90018-L |
| [30] |
MYERS R T, ZAK D R, WHITE D C, et al. Landscape-level patterns of microbial community composition and substrate use in upland forest ecosystems[J]. Soil Science Society of America Journal, 2001, 65(2): 359-367. |
| [31] |
CAO D, SHI F C, RUAN W B, et al. Seasonal changes in and relationship between soil microbial and microfaunal communities in a Tamarix chinensis community in the Yellow River Delta[J]. African Journal of Biotechnology, 2011, 10(80): 18425-18432. |
| [32] |
LIU L, ZHANG T, GILLIAM F S, et al. Interactive effects of nitrogen and phosphorus on soil microbial communities in a tropical forest[J]. PloS One, 2013, 8(4): e61188. DOI:10.1371/journal.pone.0061188 |
| [33] |
SINSABAUGH R L, ANTIBUS R K, LINKINS A E, et al. Wood decomposition:Nitrogen and phosphorus dynamics in relation to extracellular enzyme activity[J]. Ecology, 1993, 74(5): 1586-1593. DOI:10.2307/1940086 |
| [34] |
DENG S P, TABATABAI M A. Cellulase activity of soils[J]. Soil Biology and Biochemistry, 1994, 26(10): 1347-1354. DOI:10.1016/0038-0717(94)90216-X |
| [35] |
PARHAM J A, DENG S P. Detection, quantification and characterization of β-glucosaminidase activity in soil[J]. Soil Biology and Biochemistry, 2000, 32(8/9): 1183-1190. |
| [36] |
YOU Y, WANG J, HUANG X, et al. Relating microbial community structure to functioning in forest soil organic carbon transformation and turnover[J]. Ecology and Evolution, 2014, 4(5): 633-647. DOI:10.1002/ece3.2014.4.issue-5 |
| [37] |
SHANNON C E, WIENER W. The mathematical theory of communities[M]. Urbana: University of Illinois Press, 1965.
|
| [38] |
SIMPSON E H. Measurement of diversity[J]. Nature, 1949, 163(4148): 688. DOI:10.1038/163688a0 |
| [39] |
PIELOU E C. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology, 1966, 13: 131-144. DOI:10.1016/0022-5193(66)90013-0 |
| [40] |
YU S, SHE G, YE S, et al. Characteristics of soil microbial biomass and community composition in Pinus yunnanensis var.tenuifolia secondary forests[J]. Journal of Sustainable Forestry, 2018, 37(8): 753-770. DOI:10.1080/10549811.2018.1483250 |
| [41] |
邓娇娇, 周永斌, 殷有, 等. 油松和蒙古栎混交对土壤微生物群落功能多样性的影响[J]. 生态学杂志, 2017, 36(11): 3028-3035. |
| [42] |
邓娇娇, 朱文旭, 杨立新, 等. 辽西油松侧柏混交林对土壤微生物群落功能多样性的影响[J]. 沈阳农业大学学报, 2017, 48(1): 27-34. |
| [43] |
黄雅丽, 田琪, 秦光华, 等. 黄河三角洲刺槐白蜡混交对土壤细菌群落结构及多样性的影响[J]. 生态学报, 2018, 38(11): 3859-3867. |
| [44] |
孙新.马尾松林下套种阔叶树对森林凋落物及土壤的影响[D].福州: 福建农林大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10389-2005124337.htm
|
| [45] |
WAID J S. Does soil biodiversity depend upon metabiotic activity and influences?[J]. Applied Soil Ecology, 1999, 13(2): 151-158. DOI:10.1016/S0929-1393(99)00030-X |
| [46] |
BURTON J, CHEN C G, XU Z H, et al. Soil microbial biomass, activity and community composition in adjacent native and plantation forests of subtropical Australia[J]. Journal of Soils and Sediments, 2010, 10(7): 1267-1277. DOI:10.1007/s11368-010-0238-y |
| [47] |
吴则焰, 林文雄, 陈志芳, 等. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 2013, 37(5): 397-406. |
| [48] |
CROW S E, LAJTHA K, FILLEY T R, et al. Sources of plant-derived carbon and stability of organic matter in soil:Implications for global change[J]. Global Change Biology, 2009, 15(8): 2003-2019. DOI:10.1111/gcb.2009.15.issue-8 |
| [49] |
高强, 马明睿, 韩华, 等. 去除和添加凋落物对木荷林土壤呼吸的短期影响[J]. 生态学杂志, 2015, 34(5): 1189-1197. |
| [50] |
FISK M C, FAHEY T J. Microbial biomass and nitrogen cycling responses to fertilization and litter removal in young northern hardwood forests[J]. Biogeochemistry, 2001, 53(2): 201-223. |
| [51] |
SAYER E J, WRIGHT S J, TANNER E V J, et al. Variable responses of lowland tropical forest nutrient status to fertilization and litter manipulation[J]. Ecosystems, 2012, 15(3): 387-400. DOI:10.1007/s10021-011-9516-9 |
| [52] |
YAN K, SHAO H B, SHAO C Y, et al. Physiological adaptive mechanisms of plants grown in saline soil and implications for sustainable saline agriculture in coastal zone[J]. Acta Physiologiae Plantarum, 2013, 35(10): 2867-2878. DOI:10.1007/s11738-013-1325-7 |
| [53] |
LEFF J W, WIEDER W R, TAYLOR P G, et al. Experimental litterfall manipulation drives large and rapid changes in soil carbon cycling in a wet tropical forest[J]. Global Change Biology, 2012, 18(9): 2969-2979. DOI:10.1111/j.1365-2486.2012.02749.x |
| [54] |
WANG Q, WANG S L, HE T X, et al. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils[J]. Soil Biology and Biochemistry, 2014, 71: 13-20. DOI:10.1016/j.soilbio.2014.01.004 |
| [55] |
关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986.
|
| [56] |
CRIQUET S, FERRE E, FARNET A M. Annual dynamics of phosphatase activities in an evergreen oak litter:Influence of biotic and abiotic factors[J]. Soil Biology and Biochemistry, 2004, 36(7): 1111-1118. DOI:10.1016/j.soilbio.2004.02.021 |
| [57] |
KIVLIN S N, TRESEDER K K. Soil extracellular enzyme activities correspond with abiotic factors more than fungal community composition[J]. Biogeochemistry, 2014, 117(1): 23-37. |
| [58] |
朱同彬, 诸葛玉平, 刘少军, 等. 不同水肥条件对土壤酶活性的影响[J]. 山东农业科学, 2008(3): 74-78. DOI:10.3969/j.issn.1001-4942.2008.03.022 |



