铝氢化钠(NaAlH4)是一种典型的配位氢化物储氢材料,具有较高的质量储氢密度和体积储氢密度,理论氢含量高达7.4 wt%,能够满足移动车载对储氢材料的能量密度要求[1]。但是纯NaAlH4放氢温度高(>220℃),放氢产物很难再吸氢,达不到实际应用的要求[2]。掺杂催化是改善NaAlH4储氢性能的重要途径,Bogdanovic ′等[3]发现掺杂Ti(OnBu)4后的NaAlH4的起始放氢温度为160℃,两步反应的放氢量为3.5~4.0 wt%,在170℃,15 MPa氢压下可以实现逆向吸氢。但是在循环过程中Ti(OnBu)4会分解产生杂质气体,降低氢气的纯度。为了避免上述问题,研究人员提出添加稳定性更高的TiCl3[4]、TiF3[5]等,进一步的实验证实TiF3掺杂的NaAlH4的起始放氢温度降低至150℃,可逆储氢容量达4.2 wt%。随后研究发现ScCl3、CeCl3、PrCl3等[6]都可以降低NaAlH4的放氢温度,改善循环性能和吸放氢动力学。但是上述卤化物催化剂与NaAlH4反应生成没有吸放氢能力的NaF、NaCl等[7],导致可逆储氢容量下降。为此有人提出添加Ti单质以避免产生无储氢能力的副产物,实验表明Ti单质掺杂的NaAlH4没有明显的性能改善[8],原因是一般的球磨工艺无法实现Ti在基体中以细小颗粒弥散分布的效果。为了实现催化剂的弥散均匀地引入且不产生副产物,Wang等[9]提出了一种球磨制备Ti掺杂的NaAlH4的方法,即将NaH、催化剂、Al等按一定比例混合,然后在一定氢压下球磨合成NaAlH4。这样的原位制备过程既能促进催化剂在基体中的分散和提高两者间的耦合度,也不会产生惰性副产物,有利于提高有效储氢容量和提升动力学性能,因为相比于TiCl3、TiF3等,同样添加量的单质Ti等有更小的质量,不会因为较大的添加量导致容量明显下降。另外,也有以合金为催化剂的研究,如CeAl4[10]、SmAl3[11]等,这些合金在一般的球磨工艺下较难细化,难以达到均匀弥散分布。另外,目前以稀土单质为催化剂直接原位合成的研究很少。本文拟选择某些稀土元素单质为添加物,研究它们对合成NaAlH4的影响和对体系吸放氢性能的影响。我们选择前稀土元素Ce,Pr和中稀土元素Sm;考虑到稀土元素的质量数较高,这对体系储氢量提升不利,我们还选择质量数最小的类稀土元素Sc。中稀土元素中选择Sm的主要原因,是因为它在自然界中的含量较高而容易获取,价格也相对较低。相对而言这些单质比氢化物和铝合金更容易与基体反应,有可能加强催化剂与基体的作用,使得催化效果提升。本文以添加量低至2%摩尔百分含量的Sc,Ce,Pr,Sm单质为添加物,以两步原位球磨法合成催化剂-NaAlH4储氢体系,比较它们对NaAlH4合成与体系储氢行为的影响情况。
1 材料与方法 1.1 原位合成NaAlH4在实验过程中用到的原料有Al粉(≥99.5%,325目,Alfa Aesar),Ce粉(≥99.5%,325目,Alfa Aesar),Sc粉(≥99.5%,325目,Alfa Aesar),Sm粉(≥99.5%,325目,Alfa Aesar),Pr粉(≥99.5%,325目,Alfa Aesar),NaH(≥95%,Sigma)。所有样品的称量都是在充有Ar气体的手套箱中进行,水及氧含量低于0.000 01%,样品的预磨和加氢球磨都采用自制高能球磨机进行,球磨罐为自制特种陶瓷罐,这可以大大降低球磨时Al的粘连,使球磨效果和效率显著提高。
1.2 材料性能表征样品的结构表征使用的是Rigaku MinFlex 600型X-射线衍射仪,衍射线为Cu的Ka线。管电压为40 kV,管电流为15 mA,扫描范围为10°~90°,扫描步长为0.02°,扫描速度为10(°)·min-1。样品在测试过程中被隔膜保护,避免直接与空气接触而发生变质。样品的吸放氢测试在Sievert’s型设备上进行。变温放氢测试是在升温速率1 K·min-1,恒温吸氢则是在140℃,8 MPa条件下测量。
2 结果与分析 2.1 材料结构分析样品的摩尔比为Al:NaH:X(X=Sc, Ce, Sm, Pr)=1:1:0.02,4个样品经过预球磨后的XRD测试结果如图 1所示。从图 1中可以发现在预球磨后,添加类稀土Sc单质样品的XRD图谱中只有Al和NaH的衍射峰,没发现Sc的衍射峰;而另外添加稀土单质的3个样品都出现了相应的稀土氢化物的衍射峰。由于样品中只有NaH含氢,这说明稀土氢化物的形成是这些稀土元素单质夺取了NaH中的部分H,因为稀土单质添加量比NaH少很多。对NaH而言,失去部分H后,会有H空位形成,这会使得NaH自由能升高并有更好的扩散性能,即NaH从体内被活化。
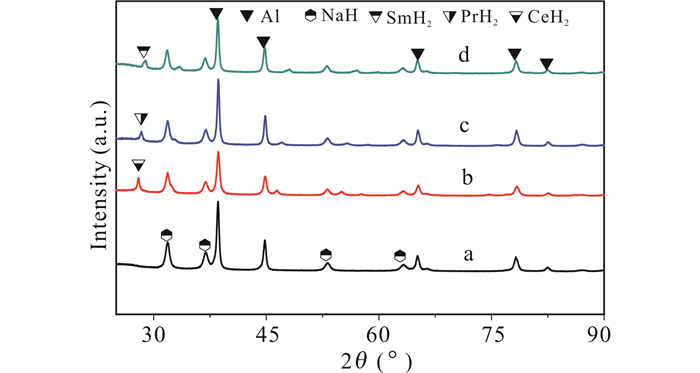
|
| a:添加Sc情况,b:添加Ce情况,c:添加Pr情况,d:添加Sm情况 a:Sc-doped situation, b:Ce-doped situation, c:Pr-doped situation, d:Sm-doped situation 图 1 预磨所得样品的XRD图谱 Fig. 1 XRD patterns of pre-milled samples |
从元素亲和性看,稀土元素与H及Al都有较好的亲和性,在贫氢的预球磨阶段有稀土氢化物形成;同时也可能有稀土与Al作用的产物,如稀土的铝合金,或铝的相应固溶体。有研究表明,Ce与H反应形成CeHx后,形成的CeHx会再与Al反应形成Ce-Al合金;这可能是放氢的贫氢环境下稀土与Al的亲和性更好[12]。因此,我们认为稀土单质在预球磨阶段在富Al环境下也有可能生成富Al的稀土-Al合金,或Al(X)(X=Ce, Pr, Sm)固溶体,或两者都有,两者都有可能性应该更大一些;通过XRD无法观察到只是由于它们的量太少。
在添加Sc单质情况下,没发现ScHx存在,可能是ScAlx形成的竞争力比ScHx高,形成ScAlx后还可能有部分Sc继续固溶到Al中形成Al(Sc)固溶体。推测该情况下Sc对Al的作用比其他3种情况更好,因为没有Sc与H作用而消耗掉,相对而言与Al作用的Sc量比其他3种添加物的量多。添加物与Al原位形成铝合金时,这些铝合金与Al有很好的耦合关系,它们通过界面接触使得Al表面被激活;如果形成的是能量更高的Al基固溶体,则添加物进入Al体内,Al体内区域也受到激活。因此,Ce、Pr、Sm能与NaH及Al同时反应,可以使Al、NaH同时被激活;而Sc主要激活Al,它对Al的激活程度相对更高。
从图 2可以发现添加Sc的样品在8 Mpa氢压下球磨20 h后就有物相Na3AlH6出现。当球磨时间达到40 h时,NaAlH4衍射峰出现,Al和Na3AlH6衍射峰下降。当球磨时间达到60 h,基本只看到NaAlH4衍射峰。此过程发生反应如下:
| $ {3{\rm{NaH}} + {\rm{Al}} + 3/2{{\rm{H}}_2} \to {\rm{N}}{{\rm{a}}_3}{\rm{Al}}{{\rm{H}}_6}, } $ | (1) |
| $ {{\rm{N}}{{\rm{a}}_3}{\rm{Al}}{{\rm{H}}_6} + 2{\rm{Al}} + 3{{\rm{H}}_2} \to 3{\rm{NaAl}}{{\rm{H}}_4}}。$ | (2) |
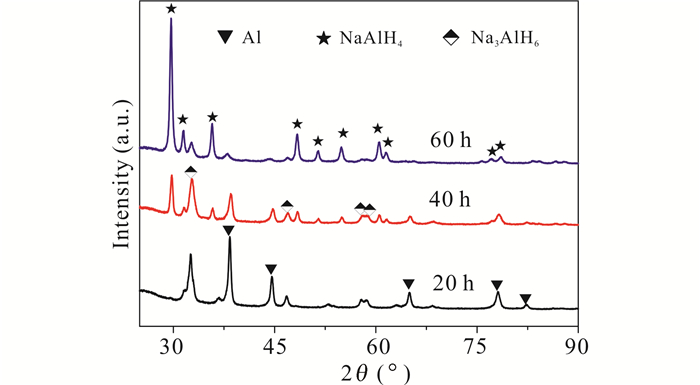
|
| 图 2 添加Sc样品在8 MPa氢压下球磨不同时间的XRD图谱 Fig. 2 XRD patterns of ball-milled samples under Sc-doped situation at different time under 8 MPa hydrogen pressure |
实验表明,如果不添加催化剂,在相同条件下球磨相同时间,反应(1)进行程度很低,反而(2)就基本无法进行。有研究表明,CeAl4对合成NaAlH4有很好的催化效果[10, 12];加Sc情况下NaAlH4合成程度很高,可能也是类似的催化效果[13]。
从图 3可以看出在加氢球磨60 h后,4个样品的主相都为NaAlH4,说明这3种情况下合成NaAlH4的程度都很高,而添加稀土单质的3个样品中仍然存在相应的稀土氢化物。Hu等[12]发现CeH2对NaAlH4吸放氢动力学有明显改善;Wu等[14]发现LaHx也对NaAlH4吸放氢有很好催化效果。因此,添加稀土元素的3种情况下,NaAlH4的合成应该有相应稀土氢化物催化作用的贡献。原位形成的稀土氢化物,与基体应该具有更好的耦合关系,比直接添加稀土氢化物情况有更好的催化效果。除此之外,稀土元素对Al的激活,也很可能是另外一个重要原因。因为从前面可知,在添加Sc情况下,没有ScHx合成,但也对NaAlH4的合成有很好催化效果,这很可能是Sc对Al激活的结果。
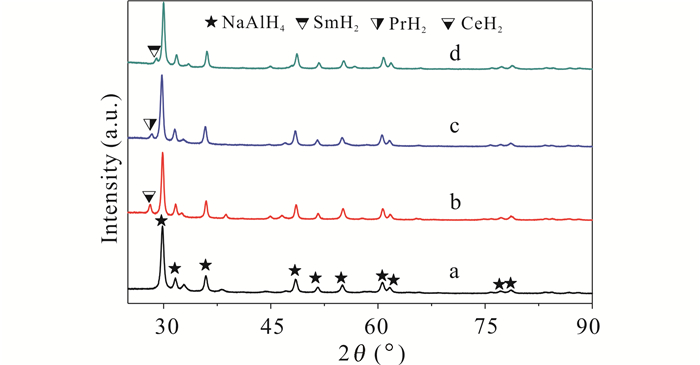
|
| a:添加Sc情况,b:添加Ce情况,c:添加Pr情况,d:添加Sm情况 a:Sc-doped situation, b:Ce-doped situation, c:Pr-doped situation, d:Sm-doped situation 图 3 4个样品在8 MPa加氢球磨60 h的XRD图谱 Fig. 3 XRD patterns of ball-milled samples under 8 MPa hydrogen gas for 60 h |
2.2 材料的吸放氢性能
图 4为4个样品的首次变温放氢曲线,从图 4中可以看出在添加Ce的情况下,样品的起始放氢温度最低,约为90℃,其次是添加Sc的情况,约为125℃,而添加Pr和Sm的两个样品的起始放氢温度接近,约为150℃,比另外两个明显低。首次放氢容量最高的是添加Sc情况,为5.20 wt%,约为该配比下扣除杂质后理论容量(简称:理论容量)的99%;最低的是添加Ce情况,为4.75 wt%,是理论容量的97%;添加Pr和添加Sm的分别为4.84 wt%和4.86 wt%,放氢量很接近,都约为理论容量的99%。添加Sc情况容量明显高于其他3种情况,与Sc的质量数明显小于其他3种稀土元素有很大的关系。从图 4中还可以发现添加Ce情况下,样品的两步放氢之间过渡期比其他3个大。添加Sc情况下,样品的放氢有2个过渡区,这与其他3个样品不同。从放氢动力学看,添加Ce情况效果最好,添加Sc情况其次,添加Pr情况第三,最后是添加Sm情况;对动力学的改善主要体现在起始放氢温度上。从放氢容量看,添加Sc情况最高,添加Pr和Sm情况其次,它们容量很接近;添加Ce情况最低。
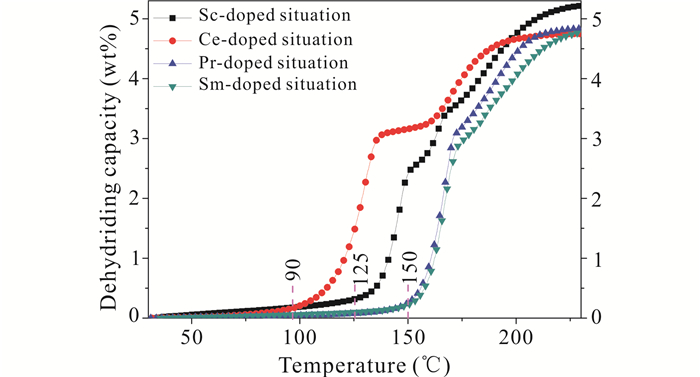
|
| 图 4 4个样品的首次变温放氢曲线 Fig. 4 The first variable temperature dehydrogenation curves of 4 samples |
图 5表示4个样品在140℃,8 MPa氢压下的恒温吸氢曲线。在前8 min内4个样品的吸氢速率相差很小,但是随后添加Pr和Sm的两个样品的吸氢速率逐渐变慢。这4个样品的吸氢容量达到4 wt%所用时间分别为50 min,83 min,176 min,228 min,可以看出添加Sc情况下有更好的吸氢动力学,在80 min左右就能完成吸氢,而添加Pr的吸氢动力学最慢,前者平均吸氢速率是后者的4倍以上。另外,这4个样品的第1次吸氢容量,都比第1次放氢量低,其中添加Sc的样品降低最大。
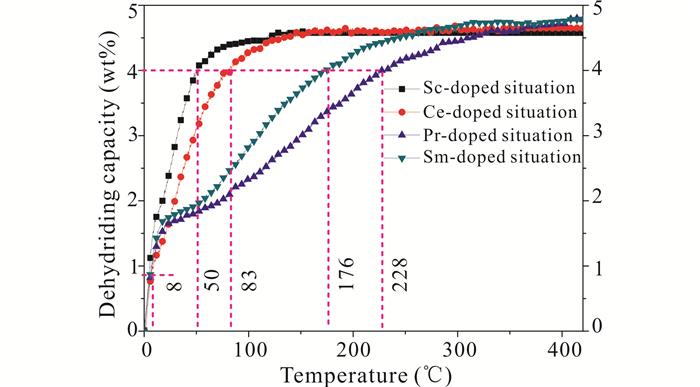
|
| 图 5 4个样品在140℃,8 MPa氢压下的恒温吸氢曲线 Fig. 5 The four isothermal hydrogenation curves at 140℃, under 8 MPa H2 |
从4个样品的5次放氢容量对比情况(图 6)可以看出,添加Sc情况的前3次容量衰减明显高于其他3个添加稀土单质的情况。仅从放氢容量保持率看,添加Sm情况是最高的,且从第2次开始,该样品的放氢容量就高于其他3种情况。添加Ce和添加Pr情况保持率很接近,但添加Pr的容量更高。
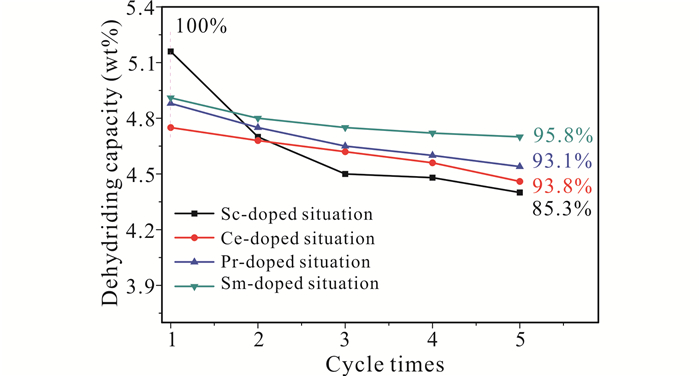
|
| 图 6 4个样品5次循环放氢容量曲线 Fig. 6 The dehydrogenation capacity curves of the four samples during 5 cycle times |
从4个样品在经过5次放氢后的XRD图谱(图 7)可以发现,主相依然是NaH和Al,在多次吸放氢后XH2(X=Ce,Pr,Sm)依然存在,放氢产物都没有发现相应的铝合金存在,和预球磨后的情况(图 1)很接近。4个样品都没发现有NaAlH4和Na3AlH6残留,说明放氢比较彻底。结合图 1和图 7的XRD数据,利用Scherrer's公式[15]计算预球磨和5次放氢后Al和NaH的平均晶粒尺寸,结果如表 1和表 2所示,从两个表中可以发现相比预球磨,第5次放氢所得样品的Al和NaH的平均晶粒尺寸都变大了。其中含Sc样品的变化最明显,Al和NaH的平均晶粒尺寸分别从17.9 nm、17.7 nm增加到48.1 nm、48.7 nm,约增大到原来的2.7倍;其他3种稀土元素的样品变化幅度远小于添加Sc情况,后来晶粒约是原来的1.2倍。添加Sc情况下,放氢后Al和NaH尺寸的大幅增加会使其自由能明显下降,反应活性也会随之下降,这是其容量保持率明显低于其他3种添加稀土元素情况(图 6)的一个重要原因。相比之下,3种添加稀土单质情况下,放氢产物中Al和NaH平均晶粒尺寸增幅较小,与容量保持率较高的结果(图 6)一致。
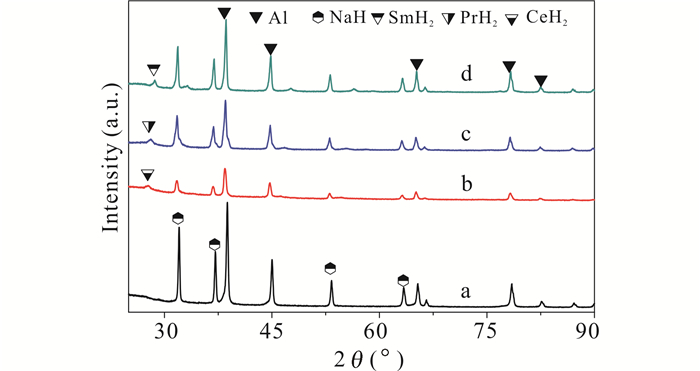
|
| a:添加Sc情况,b:添加Ce情况,c:添加Pr情况,d:添加Sm情况 a:Sc-doped situation, b:Ce-doped situation, c:Pr-doped situation, d:Sm-doped situation 图 7 经5次放氢后4个样品的XRD图谱 Fig. 7 XRD patterns of the four samples after 5 times of dehydrogenation |
| 样品 Samples |
预球磨 Pre-milling |
第5次放氢后 After the 5th dehydrogenation |
| Sc-doped situation | 17.9 | 48.1 |
| Ce-doped situation | 22.1 | 24.5 |
| Pr-doped situation | 23.8 | 25.8 |
| Sm-doped situation | 20.6 | 27.9 |
| 样品 Samples |
预球磨 Pre-milling |
第5次放氢后 After the 5th dehydrogenation |
| Sc-doped situation | 17.7 | 48.7 |
| Ce-doped situation | 22.7 | 24.7 |
| Pr-doped situation | 25.3 | 27.0 |
| Sm-doped situation | 20.0 | 28.1 |
从前面首次放氢动力学行为、吸氢动力学行为和5次循环放氢情况看,添加Sc情况下的首次放氢量最大,首次放氢起始温度排名第二,吸氢动力学性能最好,但容量保持率最低;最大优势是提升首次放氢量,其次是提升动力学,但对循环寿命改善能力较差。添加Ce情况样品的首次放氢起始温度最低,首次放氢量最小,容量保持率排名第二,吸氢动力学也排名第二;添加Ce最有利于降低放氢温度,其次有利于提升吸氢动力学,对提升容量保持率也不错,但不利于提升最大可逆氢量。添加Sm的情况首次放氢量排名第二,吸氢动力学排名第三,容量保持率和第五次容量最高,放氢动力学排名第三;添加Sm对提高循环容量和容量保持率最好。添加Pr和添加Sm的性能相对比较接近,添加Sm的综合性能更好。Sc,Ce和Sm这3种单质添加物没有一种是所有性能都居于最优的,这意味着需要将他们进行组合来进一步改善,比如可以考虑用Sc和Sm组成二元催化剂,通过调整他们的比例可能可以实现储氢量、吸放氢动力学和循环寿命的综合优化。
3 结论本文以X(X=Sc, Ce, Pr, Sm)为添加剂,基于预球磨和加氢球磨两步制备工艺,原位合成得到催化剂-NaAlH4储氢体系,得到以下主要结论:
1) NaAlH4的合成度很高,没Na3AlH6中间相明显残留,说明球磨时NaAlH4的合成受催化效果很好,基体受激活情况有所不同。添加稀土单质时,NaH和Al都受到激活;而添加Sc单质时,主要激活Al,但此时Al受激活程度相对更高。
2) 放氢时,没有NaAlH4残留,也没有Na3AlH6中间相残留,说明这些情况下催化剂对基体放氢的催化效果也很好。他们都使NaAlH4的起始放氢温度大大降低,其中添加Ce情况改善作用最明显,起始放氢温度为90℃,比纯NaAlH4降低了大约130℃,即使改善作用较弱的Pr和Sm,温度也降低至70℃左右。
3) 初始放氢量最高的是添加Sc单质情况,首次放氢量达到5.2 wt%,高达理论容量的99%;起始放氢温度最低的是添加Ce情况,起始放氢温度为90℃;吸氢动力学最好的是添加Sc情况;添加稀土单质情况下容量保持率明显高于添加Sc单质的情况,容量保持率和循环容量最高的是添加Sm情况。
| [1] |
SCHLAPBACH L, ZVTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414(6861): 353-358. DOI:10.1038/35104634 |
| [2] |
ORIMO S, NAKAMORI Y, ELISEO J R, et al. Complex hydrides for hydrogen storage[J]. Chemical Reviews, 2007, 107(10): 4111-4132. DOI:10.1021/cr0501846 |
| [3] |
BOGDANOVIĆ B, SCHWICKARDI M. Ti doped alkali metal Aluminium hydrides as potential novel reversible hydrogen storage materials[J]. Journal of Alloys and Compounds, 1997, 253/254: 1-9. DOI:10.1016/S0925-8388(96)03049-6 |
| [4] |
ANTON D L. Hydrogen desorption kinetics in transition metal modified NaAlH4[J]. Journal of Alloys and Compounds, 2003, 356/357: 400-404. DOI:10.1016/S0925-8388(03)00140-3 |
| [5] |
WANG P, KANG X D, CHENG H M. Dependence of H-storage performance on preparation conditions in TiF3 doped NaAlH4[J]. Journal of Alloys and Compounds, 2006, 421(1/2): 217-222. |
| [6] |
BOGDANOVIĆ B, FELDERHOFF M, POMMERIN A, et al. Advanced hydrogen-storage materials based on Sc-, Ce-, and Pr-doped NaAlH4[J]. Advanced Materials, 2006, 18(9): 1198-1201. DOI:10.1002/adma.200501367 |
| [7] |
朱敏. 先进储氢材料导论[M]. 北京: 科学出版社, 2015.
|
| [8] |
KANG X D, WANG P, CHENG H M. Electron microscopy study of Ti-doped sodium aluminum hydride prepared by mechanical milling NaH/Al with Ti powder[J]. Journal of Applied Physics, 2006, 100(3): 034914. DOI:10.1063/1.2221518 |
| [9] |
WANG P, JENSEN C M. Preparation of Ti-Doped sodium aluminum hydride from mechanical milling of NaH/Al with off-the-shelf Ti powder[J]. The Journal of Physical Chemistry B, 2004, 108(40): 15827-15829. DOI:10.1021/jp047002g |
| [10] |
FAN X, XIAO X, CHEN L, et al. Thermodynamics, kinetics, and modeling investigation on the dehydrogenation of CeAl4-doped NaAlH4 hydrogen storage material[J]. The Journal of Physical Chemistry C, 2011, 115: 22680-22687. DOI:10.1021/jp208576v |
| [11] |
FAN X, XIAO X, CHEN L, et al. Hydriding-de-hydriding kinetics and the microstructure of La- and Sm-doped NaAlH4 prepared via direct synthesis method[J]. International Journal of Hydrogen Energy, 2011, 36(17): 10861-10869. DOI:10.1016/j.ijhydene.2011.05.140 |
| [12] |
HU J, REN S, WITTER R, et al. Catalytic influence of various cerium precursors on the hydrogen sorption properties of NaAlH4[J]. Advanced Energy Materials, 2012, 2(5): 506-568. |
| [13] |
SAMOLIA M, KUMAR T J D. A first-principles study of hydrogen interaction and saturation on ScAl3[J]. Journal of Alloys and Compounds, 2013, 552: 457-462. DOI:10.1016/j.jallcom.2012.10.125 |
| [14] |
WU Z, CHEN L X, XIAO X Z, et al. Influence of lanthanon hydride catalysts on hydrogen storage properties of sodium alanates[J]. Journal of Rare Earths, 2013, 31(5): 502-506. DOI:10.1016/S1002-0721(12)60309-3 |
| [15] |
KIM J M, PARK J E, KIM Y H, et al. Decomposition of hydrogen iodide on Pt/C-based catalysts for hydrogen producation[J]. International Journal of Hydrogen Energy, 2008, 33(19): 4974-4980. DOI:10.1016/j.ijhydene.2008.05.092 |



