海洋中药是指在中医药学基本理论指导下可以防治疾病、生长在海洋中的天然药物[1],是中医药的重要组成部分。我国是世界上利用海洋药物最早的国家之一,早在春秋战国时期,已有不少海洋药物应用于临床。历代本草对海洋药物的功效、作用和毒副作用等进行较为详细的描述,如《黄帝内经》记载以乌贼骨为丸,饮以鲍汁治疗血枯;《神农本草经》里记载13种海洋药物,包括牡蛎、文蛤等;唐代出现官修本草,海洋药物记载增多,如《新修本草》记载海洋药物29种,对后世海洋药物的发展有重大影响。有些海洋药物品种沿用至今,成为中药中常用的品种,如瓦楞子、石决明、昆布、海螵蛸等。根据2015年版《中华人民共和国药典》记载,海洋中药主要包括海洋植物药、海洋动物药、海洋矿物药,大多性味咸寒,主要归肝、肾经。近年来,我国医药工作者对海洋中药中的海洋植物药进行化学成分及药理作用的研究。化学成分研究比较活跃,从海洋植物中分离得到丰富的生物活性物质,如多糖类、萜类、生物碱、黄酮类、甾醇等成分。现代药理研究表明这些物质大多数具有良好的抗菌抗炎、抗病毒、抗氧化、抗肿瘤、治疗心血管疾病以及免疫调节功能等功效。本文对海洋植物药主要的化学成分及药理作用进行综述,介绍海洋植物药的研究现状,为进一步开发利用中药资源提供借鉴。
1 化学成分现有文献报道海洋植物药中主要含有多糖类、萜类、生物碱、黄酮类、甾醇等成分。
1.1 多糖类多糖类成分主要存在于海藻类海洋中药中,是目前海藻研究较为深入和广泛的领域。海洋藻类如红藻、绿藻、褐藻等均含有海藻多糖。现已从各种海藻中分离提取得到琼胶、卡拉胶、螺旋藻多糖、紫菜多糖、海带多糖等多种多糖。
林聪等[2]从石莼属海藻中提取到一种硫酸多糖HP2S,主要是由鼠李糖组成的硫酸化多糖;卢睿春等[3]首次从广东福建特有的亨氏马尾藻中提取出马尾藻硫酸多糖,是一种水溶性的、含硫酸基的杂多糖;方旭波等[4]从海洋植物白骨壤的树枝中分离鉴定出中性糖蛋白HAM-3-Ⅱa和酸性多糖HAM-3-Ⅱb-Ⅱ,其中HAM-3-Ⅱa由阿拉伯糖、半乳糖和木糖组成,而HAM-3-Ⅱb-Ⅱ主要由半乳糖醛酸、阿拉伯糖、半乳糖和鼠李糖组成;杨玉玲[5]以珊瑚藻为原料,从中得到两种珊瑚藻硫酸多糖,均由半乳糖和木糖组成,但两者的摩尔比不同;张斌等[6]从红藻中分离获得5种不同分子量的多糖组分,主要由木糖、甘露糖、半乳糖和葡萄糖构成;Barros等[7]从红藻中得到一种分子量为250 kDa的多糖,主要由半乳糖构成;Gómez-ordóñez等[8]从红藻中分离获得5种不同分子量的多糖组分,主要由木糖、甘露糖、半乳糖和葡萄糖构成;Maciel等[9]对红藻进行研究,从中分离纯化获得一种粗多糖RP1,且红藻多糖RP1含硫酸基,是一种硫酸酯化多糖,其单糖组成为半乳糖和3,6-内醚半乳糖;Ciancia等[10]从绿藻Codium fragile中获得多糖M1与M2,从绿藻C.vermilara中获得多糖W1与W2。M1主要由半乳糖、阿拉伯糖、甘露糖和葡萄糖组成,M2主要由半乳糖、阿拉伯糖、甘露糖、葡萄糖和岩藻糖组成;W1主要由半乳糖、阿拉伯糖、甘露糖、葡萄糖、木糖和鼠李糖构成,而W2不含木糖和鼠李糖。Byankina等[11]从红藻Tichocarpus中分离纯化获得3种多糖组分HT、AE和AM,这3种多糖均由半乳糖和葡萄糖构成。
1.2 萜类目前为止,从海洋植物中分离得到的萜类物质已达近千种,主要来自于海藻等植物中。与陆地天然萜类一样,它们的碳架可以看成是以异戊二烯碳架为单元,首尾相联而形成的。国内外大量研究表明,凹顶藻类中有丰富的卤代萜,从中已分离出多种含卤倍半萜类化合物,是海洋萜类化合物的重要来源。
Takahashi等[12]从冲绳岛水域的凹顶藻提取物中得到2个连接有醌式结构的二聚倍半萜类化合物,即三萜类四环素醚及其衍生物;宫凯凯[13]对采自我国南海海域的拟海桑Sonneratia paracaseolaris进行系统的化学成分研究,从中分离得到17个三萜类化合物(1-17),2个倍半萜类化合物(18-19),均为首次从该种中分离得到;田敏卿等[14]从海漆甲醇提取物的石油醚相中分离、鉴定出6个三萜和3个甾体化合物,分别为蒲公英赛酮、β-香树脂醇乙酸酯、3β-[(2E, 4E)-6-oxo-decadienoy-loxy]-olean-12-ene、蒲公英赛醇、乙酰油酮酸、cycloart-22-ene-3β, 25-diol、β-sitostenone, (24R)-24-ethylcholesta-4, 22-dien-3-one和β-谷甾醇;王清吉等[15]从厚藤(Ipomoea pes-caprae(L.)Sweet)的乙酸乙酯提取物中分离萜类化合物β-香树素(20);Subrahmanyam等[16]在印度白骨壤的根部分离出7个二萜化合物;刘喜苹[17]对海南红树角果木(Cerops tagal)地上部分的化学成分进行研究,共分离鉴定23个单体化合物,包括13个二萜化合物,其中6个化合物为新化合物,分别鉴定为ent-8(14)-pimarane-15, 18-diol(21)、ent-8(14)-pimarane-16, 18-dihydroxy-15-one(22)、Tagalsin X(23)、Tagalsin Y(24)、Tagalsin W(25)、Tagalsin V(26)。以上各化合物的化学结构如图 1所示。
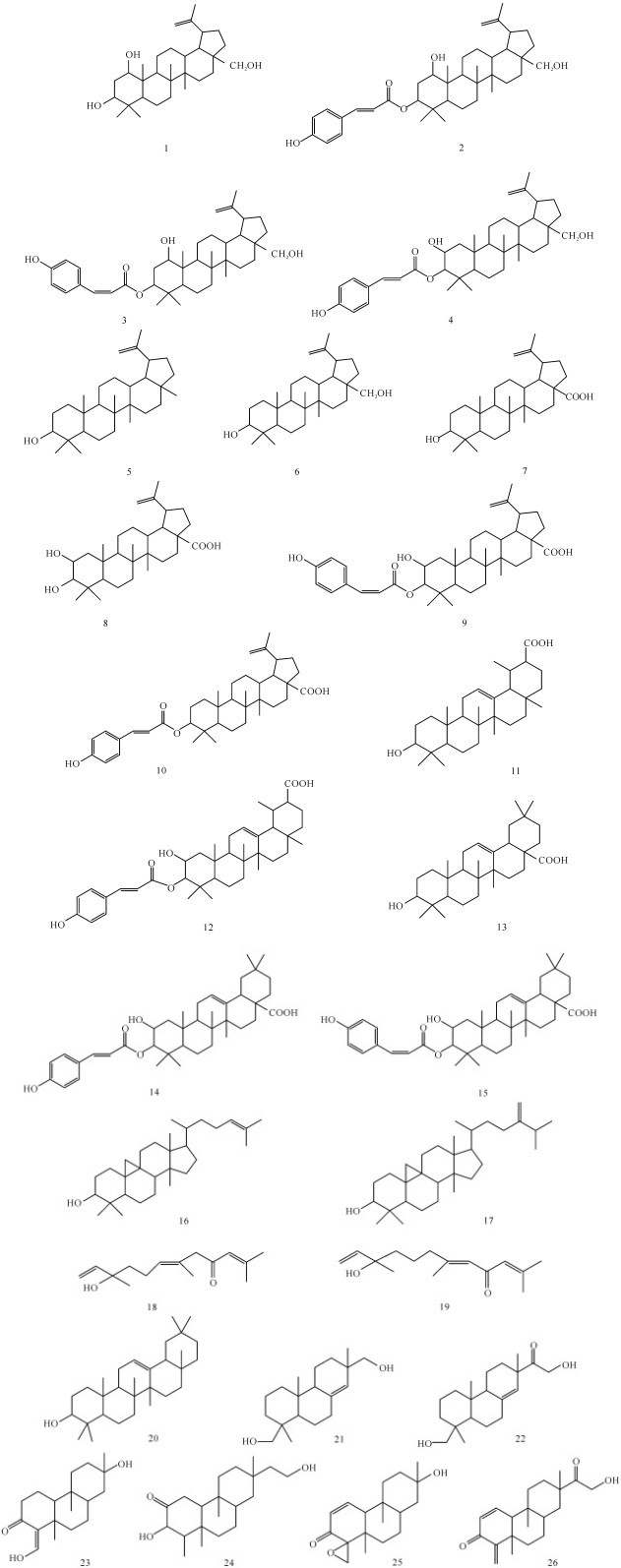
|
| 图 1 海洋植物中分离得到的萜类成分 Fig. 1 Terpenes isolated from marine plants |
1.3 生物碱类
生物碱是存在于自然界中的一类含氮碱性有机化合物,大多数有复杂的环状结构,氮素多包含在环内,有显著的生物活性。在海洋植物中存在着数量众多、生理活性特殊、结构复杂的生物碱类化合物。自1983年首次从红藻中分离出吲哚生物碱以来,越来越多海洋生物中的生物碱被发现。
高程海等[18]在白骨壤中分离出5个生物碱化合物分别为2(1H)-pyrazinone-3,4-dihydro-1,3,5-trimethyl(27)、尿苷(28)、尿嘧啶(29)、indole- 3-aldehyde(30)、miazole(31)。Blunden[19]从蕨藻属中的几个品系中提出双吲哚色素,并在多种褐藻及红藻中分离出数种具有抗真菌活性的化合物。陈志勇等[20]从广西北仑河口国家级自然保护区的红树木榄(Bruguiera gymnorrhiza)胚轴中分离获得1个生物碱类单体化合物,鉴定其化学结构,发现为新化合物,命名为Gymnorrhizin A(32)。化合物27-32的化学结构如图 2所示。
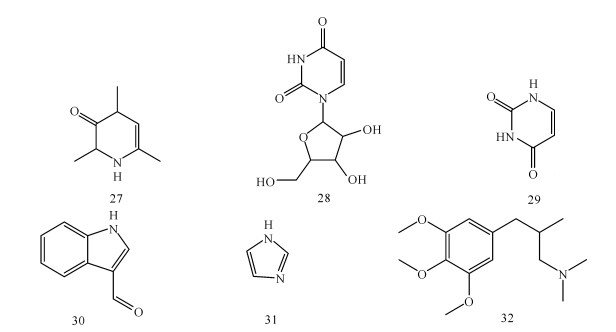
|
| 图 2 海洋植物中分离得到的生物碱类成分 Fig. 2 Alkaloids isolated from marine plants |
1.4 黄酮类
黄酮类化合物广泛分布于多种海洋植物中,是研究较为深入的一类具有广泛活性的重要化合物。有报道从海洋红树植物秋茄叶[21]、木榄叶[22]、白骨壤的叶片[23]及种子[24]中提取出总黄酮。
葛玉聪等[25]从厚藤中分离得到3-羟基-5,7,4′-三甲氧基黄酮(33)、3,7-二羟基-5,4′-二甲氧基黄酮(34)、3,7,4′-三羟基-5-甲氧基黄酮(35)等黄酮类化合物;冯妍等[26]从白骨壤中分离得到5,7-二羟基-3′,4′,5′-三甲氧基黄酮(36)、山柰酚(37)等黄酮类化合物;高越等[27]从木榄叶中分离鉴定出多种黄酮类化合物,即7,4′,5′-三羟基-5,3′-二甲氧基黄酮(38)、7,4′,5′-三羟基-5,3′-二甲氧基黄酮7-O-β-D-吡喃葡萄糖苷(39)、7,4′-二羟基-5-甲氧基黄酮7-O-β-D吡喃葡萄糖苷(40)、7,3′,4′,5′-四羟基-5-甲氧基黄酮(41)、7,4′-二羟基-5,3′-二甲氧基黄酮7-O-β-D-吡喃葡萄糖苷(42)、栎精3-O-β-D-吡喃葡萄糖苷(43)、芦丁、山柰酚3-O-芦丁糖苷(44)和杨梅黄素3-O-芦丁糖苷(45)。以上化合物结构见图 3。
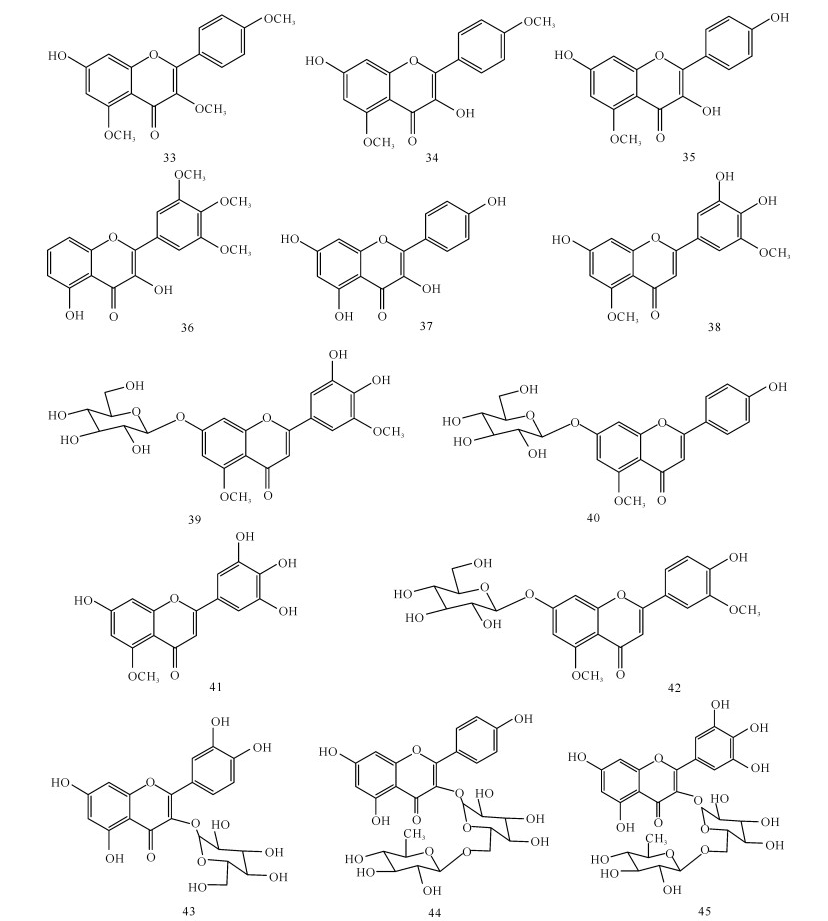
|
| 图 3 海洋植物中分离得到的黄酮类成分 Fig. 3 Flavonoids isolated from marine plants |
1.5 甾醇类
张道敬等[28]从桐花树树皮的乙醇提取物的醋酸乙酯萃取部位分离得豆甾醇(46)、α-菠甾醇(47)、岩藻甾醇(48)等甾醇类化合物;陈铁寓[29]从秋茄茎和叶的乙醇提取物中分离出β-谷甾醇(49)等甾醇类化合物;尚随胜[30]从广西红树林群落植物木榄皮中提取分离得到胆甾醇(50)和豆甾醇(51)等甾醇类化合物;王威等[31]对羊栖菜中的化学成分进行分离研究,从中得到6种甾醇类化合物,分别为岩藻甾醇、24R, 28R-环氧-24-乙基胆甾醇、24-氢过氧基-24-乙烯基胆甾醇、29-氢过氧基豆甾-5, 24(28)-二烯-3β醇、(24S)-5, 28-豆甾二烯-3p, 24-二醇和(24R)-5, 28-豆甾二烯-3p, 24-二醇和2种糖酯类化合物,并首次从羊栖菜中得到(24S)-5, 28-豆甾二烯-3p, 24-二醇和(24R)-5, 28-豆甾二烯-3p, 24-二醇两种异构体化合物。化合物46-51的结构如图 4所示。
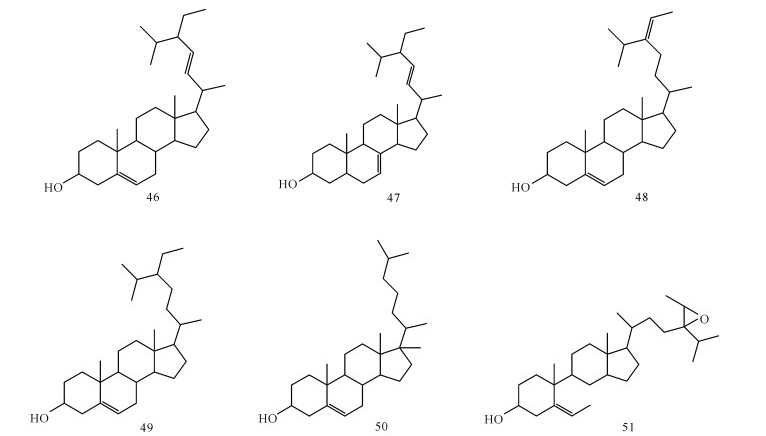
|
| 图 4 海洋植物中分离得到的甾醇类成分 Fig. 4 Sterols isolated from marine plants |
1.6 其他化学成分
海洋植物中还含有微量元素及挥发性物质等成分。陈耀祖等[32]对浙江沿海地区的药用海藻马尾藻科羊栖菜中的微量元素进行测定,结果表明该植物中富含人体所需的各种微量元素;彭全材等[33]对绿藻门和褐藻门8种大型海藻的脂肪酸组成进行研究,探究脂肪酸在海藻化学分类学中的应用;张敏等[34]采用气相色谱-质谱联用法测定鼠尾藻、浒苔、龙须菜和红毛菜等4种经济海藻的脂肪酸组成及含量;黄丽莎等[35]从白骨壤果实中的精油中分离出30多个化合物,其中数量较多的为酯类化合物。
2 药理作用由于海洋高压、高盐等特殊环境,造成海洋生物拥有与陆生生物不同的代谢途径,其体内所含特殊结构的化学成分,有着独特的生物活性,其主要药理作用包括抗菌抗炎、抗病毒、抗氧化、抗肿瘤、治疗心血管疾病以及免疫调节功能等。
2.1 抗菌抗炎尹鸿萍等[36]研究盐藻多糖在体内抑菌及抗炎作用时,发现其对小鼠致死性金黄色葡萄球菌感染引起的死亡具有显著的保护作用,能显著抑制巴豆油所致的小鼠耳廓炎性肿胀,并能减轻醋酸引起的小鼠腹腔通透性增加,说明该物质具有一定的体内抗菌和抗炎作用;师然新等[37]研究青岛沿海常见的9种海藻的抗菌能力,结果表明9种海藻的所有提取物对枯草芽孢杆菌都有明显的抑制作用;Kumar等[38]发现红树植物厚藤的甲醇提取物对大肠杆菌、伤寒沙门氏菌、副溶血性弧菌、奇异变形杆菌均有显著抑制作用;陶洪文[39]从厚藤根中分离得到的15个树脂糖苷类化合物具有较强抗菌活性,推测厚藤富含降低细菌耐药性的细菌外排泵抑制剂;孙雪萍等[40]发现白骨壤果实石油醚相具有良好的抗菌活性,其中脂肪酸类是主要抗菌活性物质;赵丰丽等[41]发现白骨壤叶95%乙醇提取液对4种病原菌都有较强的抑菌效果;黄燕等[42]研究发现广西6种药用红树植物的提取物对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌有不同强度的体外抑菌作用;牛荣丽等[43]采用人白细胞弹性蛋白酶体外筛选技术对39种海藻样品的甲醇提取物进行抗炎活性筛选,其中7种表现出较强的抑制活性;Pongprayoon等[44]从厚藤叶中分离出的丁香酚、4-乙烯基愈创木酚等苯丙素类成分可显著抑制前列腺素合成,其抗炎机制可能与抑制白细胞趋化性、防止白细胞产生氧自由基相关。
2.2 抗病毒Zhang等[45]研究发现南海7种海藻多糖对单纯疱疹Ⅰ型病毒和柯萨奇B组3型病毒均表现出一定的抗病毒活性;Lee等[46]研究发现裙带菜褐藻糖胶有明显的抗单纯疱疹病毒(HSV)活性;徐莹等[47]研究发现杜氏藻多糖具有体外抗病毒活性,其活性成分可能是相对分子质量在500 k左右的硫酸化多糖;于红等[48]研究发现顶螺旋藻多糖有抗单纯疱疹病毒的活性,提示钝顶螺旋藻多糖抗HSV-1及HSV-2病毒作用的机制与抑制病毒吸附和感染细胞内病毒的生物合成有关。
2.3 抗氧化冯珍鸽等[49]采用蛋氨酸光照法测定褐藻中岩藻聚糖对超氧离子的催化歧化作用,结果表明岩藻聚糖对超氧离子有一定的抑制作用;Lu等[50]研究海带多糖LJPA的抗氧化活性,包括对氧自由基吸收能力、ABTS自由基清除能力和还原力的考察,结果表明LJPA具有较显著的抗氧化能力;邵平等[51]从裂片石莼、亨氏马尾藻和海萝3种海藻提取获得粗多糖,这些多糖均具有抗氧化活性且呈量效关系;王凌等[52]研究发现绿色巴夫藻多糖降解产物的抗氧化活性明显高于原多糖,与抗氧化活性极强的维生素C相近,各组分多糖的抗氧化活性与分子质量大小成反比,与其糖醛酸含量呈正比;刘平怀等[53]研究发现厚藤茎叶提取物具有一定的抗氧化活性,且以乙酸乙酯为提取溶剂时效果最佳;易湘茜等[54]研究分析红树白骨壤果实中存在着具有强抗氧化活性成分。
2.4 抗肿瘤卢睿春等[55]研究表明从马尾藻中获得的硫酸化多糖能显著抑制小鼠艾氏腹水瘤、腹水型肉瘤S180的生长;王长振等[56]研究发现海藻硫酸多糖对小鼠S180肿瘤有抑制效果;Vishchuk等[57]从裙带菜中提取分离纯化得到的海藻多糖Sj-E和Up-E具有明显的抗肿瘤活性;张可等[58]研究了海藻硫酸多糖的分离纯化并发现其有显著的抗肿瘤作用;Sayed[59]从旋花滨和绿藻的次级代谢产物中,分离纯化得到具有多个抗肿瘤活性的化合物;YE等[60]从马尾藻中得到7种多糖,其中SP-3-1和SP-3-2能明显抑制HepG2细胞、A549细胞和MGC-803细胞的生长;Yu等[61]发现红树植物厚藤中脂溶性树脂糖苷成分与阿霉素联合应用时,具有一定的抗癌效果。
2.5 抗心血管疾病Zha等[62]从海带中分离纯化得到硫酸化多糖均一组分LJP61A,病理学研究显示其能显著抑制高脂饲料诱导的小鼠动脉粥样硬化的发生,并且呈量效关系;周慧萍等[63]研究发现紫菜多糖不仅具有明显的抗凝血活性,而且能降低血液粘滞度、降低高脂血症大鼠血清总胆固醇和甘油三酯的含量,并有预防高胆固醇引起的小鼠高胆固醇血症形成的作用;马葆琛等[64]研究发现藻酸双酯钠可以降低血浆中纤维蛋白原,抑制血小板聚集,降低胆固醇、甘油三酯和低密度脂蛋白,从而抑制缺血性心脏病的发作及恶化。
2.6 免疫调节林丽琴等[65]在研究紫球藻多糖活性时发现,该多糖可恢复药物所致免疫功能低下小鼠的免疫功能,具有正向免疫调节作用;Venkataraman等[66]研究发现厚藤对蛋白质变性有较强的抑制率,表明厚藤叶有较强的抗风湿活性;季宇彬等[67]研究报道羊栖莱多糖对荷瘤小鼠的红细胞免疫功能有促进作用,提示羊栖莱多糖的这些作用可能是其抗肿瘤作用的免疫学机理之一;黄震等[68]研究表明海藻多糖不仅能促进小鼠巨噬细胞的吞噬功能,而且能刺激细胞产生IL-1和IFN-γ;杨晓林等[69]研究从海带中提取得到的褐藻糖胶对小鼠免疫功能的影响;王春波等[70]研究发现盐藻β-胡萝卜素对非特异性免疫和体液免疫均有增强作用,对环磷酰胺(CTX)所致的免疫功能低下小鼠亦有明显保护作用;李龙[71]对坛紫菜多糖和龙须菜多糖的免疫调节功能进行研究,结果表明这两种多糖刺激免疫细胞分泌炎性因子IL-6、IL-1、IL-12;李应全等[72]研究褐藻中的甘糖酯可增强小鼠特异性和非特异性免疫功能。
3 展望海洋植物类中药的研究在经历了半个多世纪的发展,已获得了许多宝贵的经验和丰硕的研究成果。人类从陆生植物中挖掘药用资源已有悠久历史,相对来说,对海洋植物资源的探索工作还有不足的地方。海洋植物资源十分丰富,种类繁多,且海洋环境多变极端,植物为适应环境演化出独特的代谢途径,使得其天然产物结构有独特的地方。本文查阅1990-2018年的国内外文献,对海洋植物化学成分和药理作用等方面进行归纳总结,为海洋中药的研究应用提供参考。
丰富的海洋植物以及其中含有的活性物质向我们展现了一个巨大的海洋药物资源宝库,因此具有重要的药用价值。通过对其化学成分和药理作用的总结,有望帮助在中医药理论指导下进行海洋植物类中药的现代化研究,为新药开发提供了重要的来源,其研究和开发的前景十分广阔。
| [1] |
郭雪申, 李毅. 海洋中药[M]. 北京: 科学出版社, 2003.
|
| [2] |
林聪, 赵春琦, 李娜, 等. 1种绿藻硫酸多糖的化学组成及其结构表征[J]. 中国海洋药物, 2014, 33(4): 55-58. |
| [3] |
卢睿春, 刘婉乔, 候振建, 等. 酶法提取马尾藻硫酸多糖的研究[J]. 中国海洋药物, 1997(2): 10-13. |
| [4] |
方旭波, 江波, 陈小娥. 白骨壤酸性果胶多糖HAM- 3-Ⅱb-Ⅱ的结构分析[J]. 高等学校化学学报, 2010, 31(3): 492-496. |
| [5] |
杨玉玲.珊瑚藻硫酸多糖的提取、分离纯化、结构鉴定及部分生物活性的研究[D].合肥: 安徽大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10357-1012399910.htm
|
| [6] |
张斌, 陈家童, 白玉华, 等. 抗病毒红藻多糖的提取与测定[J]. 中草药, 1999, 30(12): 899-901. |
| [7] |
BARROS F C N, DA SILVA D C, SOMBRA V G, et al. Structural characterization of polysaccharide obtained from red seaweed Gracilaria caudate (J Agardh)[J]. Carbohydrate Polymers, 2013, 92(1): 598-603. DOI:10.1016/j.carbpol.2012.09.009 |
| [8] |
GÓMEZ-ORDÓÑEZ E, JIMÉNEZ-ESCRIG A, RUPÉREZ P. Bioactivity of sulfated polysaccharides from the edible red seaweed Mastocarpus stellatus[J]. Bioactive Carbohydrates and Dietary Fibre, 2014, 3(1): 29-40. DOI:10.1016/j.bcdf.2014.01.002 |
| [9] |
MACIEL J S, CHAVES L S, SOUZA B W S, et al. Structural characterization of cold extracted fraction of soluble sulfated polysaccharide from red seaweed Gracilaria birdiae[J]. Carbohydrate Polymers, 2008, 71(4): 559-565. DOI:10.1016/j.carbpol.2007.06.026 |
| [10] |
CIANCIA M, QUINTANA I, VIZCARGUENAGA M I, et al. Polysaccharides from the green seaweeds Codium fragile and C.vermilara with controversial effects on hemostasis[J]. International Journal of Biological Macromolecules, 2007, 41(5): 641-649. DOI:10.1016/j.ijbiomac.2007.08.007 |
| [11] |
BYANKINA A O, SOKOLOVA E V, ANASTYUK S D, et al. Polysaccharide structure of tetrasporic red seaweed Tichocarpus crinitus[J]. Carbohydrate Polymers, 2013, 98(1): 26-35. DOI:10.1016/j.carbpol.2013.04.063 |
| [12] |
TAKAHASHI Y, KUBOTA T, KOBAYASHI J. Nakijiquinones E and F, new dimeric sesquiterpenoid quinines from marine sponge[J]. Bioorganic & Medicinal Chemistry, 2009, 17(6): 2185-2188. |
| [13] |
宫凯凯.中国南海三种海洋生物化学成分及生物活性研究[D].青岛: 中国海洋大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014203961.htm
|
| [14] |
田敏卿, 鲍光明, 季乃云, 等. 红树林植物海漆中的三萜和甾体化合物[J]. 中国中药杂志, 2008, 33(4): 405-408. |
| [15] |
王清吉, 王友绍, 何磊, 等. 厚藤Ipomoea pes-caprae(L.) Sweet的化学成分研究(Ⅰ)[J]. 中国海洋药物, 2006, 25(3): 15-17. |
| [16] |
SUBRAHMANYAM C, KUMAR S R, REDDY G D. Bioactive diterpenes from the mangrove Avicennia officinalis Linn[J]. Indian Journal of Chemistry, 2006, 45B: 2556-2557. |
| [17] |
刘喜苹.海南红树角果木的化学成分研究[D].广州: 暨南大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10559-1016734161.htm
|
| [18] |
高程海, 张荣灿, 许铭本, 等. 红树白骨壤果实中生物碱类化学成分研究[J]. 广西科学院学报, 2014, 30(2): 104-106. |
| [19] |
BLUNDEN G. 来源于海藻的生物活性化合物[J]. 中国海洋药物, 1994(1): 54-56. |
| [20] |
陈志勇, 曲彩红, 卢静, 等. 木榄胚轴中一个新生物碱及其抗乙肝病毒活性研究[J]. 广西植物, 2016, 36(2): 236-239. |
| [21] |
王利花.温州海洋红树植物秋茄叶黄酮的提取及抗氧化活性研究[D].杭州: 浙江工业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10337-1015567894.htm
|
| [22] |
郑燕影, 张少华, 刘睿, 等. 影响木榄叶片总黄酮含量的主因素分析[J]. 中国天然药物, 2008, 6(5): 362-366. |
| [23] |
孙国强, 赵丰丽, 刘哲瑜, 等. 白骨壤叶黄酮提取及抗氧化活性研究[J]. 中国酿造, 2010(11): 95-100. |
| [24] |
熊拯, 钟秋平, 林美芳, 等. 白骨壤种子中总黄酮的提取及抗氧化性研究[J]. 食品研究与开发, 2012, 33(8): 81-84. |
| [25] |
葛玉聪, 罗建光, 吴燕红, 等. 厚藤化学成分研究[J]. 中药材, 2016, 39(10): 2251-2255. |
| [26] |
冯妍, 李晓明, 王斌贵, 等. 红树林植物海榄雌化学成分研究[J]. 中草药, 2007, 38(9): 1301-1303. |
| [27] |
高越, 郗砚彬. 从Bruguiera gymnorrhiza叶中分离得5-甲基醚黄酮糖苷类化合物[J]. 国际中医中药杂志, 2015, 37(7): 612. |
| [28] |
张道敬, 张偲, 吴军, 等. 桐花树化学成分研究[J]. 中草药, 2007, 38(11): 1601-1603. |
| [29] |
陈铁寓.红树植物秋茄化学成分和药理活性研究[D].南宁: 广西医科大学, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y903314
|
| [30] |
尚随胜.红树林植物木榄化学成分及生物活性研究[D].南宁: 广西医科大学, 2006. http://cdmd.cnki.com.cn/article/cdmd-10598-2006104589.htm
|
| [31] |
王威, 李红岩, 王艳艳, 等. 褐藻羊栖菜化学成分的研究[J]. 中草药, 2008, 39(5): 657-661. |
| [32] |
陈耀祖, 潘远江, 莫卫民. 东海药用海藻化学成份分析研究——(Ⅰ)羊栖菜中微量元素分析[J]. 浙江大学学报:自然科学版, 1996, 30(4): 471-473. |
| [33] |
彭全材, 宋金明, 张全斌, 等. 四种绿藻和四种褐藻脂肪酸组成的比较研究[J]. 海洋科学, 2014, 38(4): 27-33. |
| [34] |
张敏, 李瑞霞, 伊纪峰, 等. 4种经济海藻脂肪酸组成分析[J]. 海洋科学, 2012, 36(4): 7-12. |
| [35] |
黄丽莎, 朱峰, 黄美珍. 白骨壤果精油化学成分的GC/MS分析[J]. 精细化工, 2009, 26(3): 255-257. |
| [36] |
尹鸿萍, 盛玉青. 盐藻多糖体内抑菌及抗炎作用的研究[J]. 中国生化药物杂志, 2006, 27(6): 361-363. |
| [37] |
师然新, 徐祖洪. 青岛沿海九种海藻的类脂及酚类抗菌活性的研究[J]. 中国海洋药物, 1997, 16(4): 16-19. |
| [38] |
KUMAR A, PAUL S, KUMARI P, et al. Antibacterial and phytochemical assessment on various extracts of Ipomoea pes-caprae (L.) R. Br through FTIR and GC-MS spectroscopic analysis[J]. Asian Journal of Pharmaceutical & Clinical Research, 2014, 7(3): 134-138. |
| [39] |
陶洪文.厚藤、泽漆和肉豆蔻三种药用植物及厚藤共生真菌的活性次生代谢产物研究[D].青岛: 中国海洋大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10423-2009162552.htm
|
| [40] |
孙雪萍, 徐艳, 刘布鸣. 白骨壤果实抗菌活性部位筛选及低极性成分GC-MS分析[J]. 广西科学院学报, 2016, 32(4): 245-249. |
| [41] |
赵丰丽, 叶日娜, 孙国强. 白骨壤提取物抑菌活性研究[J]. 食品科技, 2010, 35(4): 182-185. |
| [42] |
黄燕, 乐宁, 李军芳, 等. 6种广西药用红树植物的体外抑菌作用研究[J]. 广西中医药大学学报, 2014, 17(3): 38-40. |
| [43] |
牛荣丽, 范晓, 韩丽君. 海藻提取物抗炎活性的筛选[J]. 海洋与湖沼, 2003, 34(2): 150-154. |
| [44] |
PONGPRAYOON U, BAECKSTROM P, JACOBS-SON U, et al. Compounds inhibiting prostaglandin synthesis isolated from Ipomoea pes-caprae[J]. Planta Medica, 1992, 57(6): 515-518. |
| [45] |
ZHANG Y, CEN Y Z, HUANG R M, et al. Preliminary study on antiviral activity of seaweed polysaccharides from the South China Sea[J]. Journal of Virology, 2006, 22(4): 282-285. |
| [46] |
LEE J B, HAYASHI K, HASHIMOTO M, et al. Novel antiviral fucoidan from sporophyll of Undaria pinnatifida (Mekabu)[J]. Chemical and Pharmaceutical Bulletin, 2004, 52(9): 1091-1094. DOI:10.1248/cpb.52.1091 |
| [47] |
徐莹, 王颖, 张弢, 等. 杜氏藻多糖生物活性研究[J]. 药物生物技术, 2008, 15(4): 289-292. |
| [48] |
于红, 吕锐, 张文卿. 螺旋藻多糖抗单纯疱疹病毒作用的实验研究[J]. 天然产物研究与开发, 2006, 18(6): 937-941. |
| [49] |
冯珍鸽, 王力, 吴永沛, 等. 褐藻中岩藻聚糖的化学成分及其对超氧离子的抑制作用[J]. 食品研究与开发, 2010, 31(3): 66-68. |
| [50] |
LU J, YOU L, LIN Z, et al. The antioxidant capacity of polysaccharide from Laminaria japonica by citric acid extraction[J]. International Journal of Food Science & Technology, 2013, 48(7): 1352-1358. |
| [51] |
邵平, 陈蒙, 裴亚萍, 等. 径向流色谱分离纯化海藻多糖及其抗氧化活性比较分析[J]. 核农学报, 2013, 27(5): 635-640. |
| [52] |
王凌, 孙利芹. 绿色巴夫藻多糖及降解产品的抗氧化和保湿性能[J]. 食品科学, 2012, 33(21): 87-90. |
| [53] |
刘平怀, 陈德力, 汪春牛, 等. 海滩植物厚藤(Ipomoea pes-caprae)抗氧化活性研究[J]. 精细化工, 2010, 27(9): 866-869. |
| [54] |
易湘茜, 谢文佩, 颜栋美, 等. 白骨壤果实中抗氧化活性成分研究[J]. 广西科学院学报, 2014, 30(4): 253-256. |
| [55] |
卢睿春, 侯振建, 刘婉乔. 亨氏马尾藻硫酸多糖抗肿瘤活性的研究[J]. 海洋科学, 1998, 22(3): 63-64. |
| [56] |
王长振, 丛建波, 先宏, 等. 海藻硫酸多糖的分离纯化及其抗肿瘤作用研究[J]. 解放军药学学报, 2010, 26(4): 283-286. |
| [57] |
VISHCHUK O S, ERMAKOVA S P, ZVYAGINT-SEVA T N. Sulfated polysaccharides from brown seaweeds Saccharina japonica and Undaria pinnatifida:Isolation, structural characteristics, and antitumor activity[J]. Carbohydrate Research, 2011, 346(17): 2769-2776. DOI:10.1016/j.carres.2011.09.034 |
| [58] |
张可, 牟玲. 海藻硫酸多糖的分离纯化及其抗肿瘤作用[J]. 中医临床研究, 2016, 8(18): 31-32. |
| [59] |
SAYED ASMAT ALI SHAH.从海藻和植物中发现抗菌和抗肿瘤活性化合物[D].杭州: 浙江大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018259065.htm
|
| [60] |
YE H, WANG K, ZHOU C, et al. Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweed Sargassum pallidum[J]. Food Chemistry, 2008, 111: 428-432. DOI:10.1016/j.foodchem.2008.04.012 |
| [61] |
YU B W, LUO J G, WANG J S. Pentasaccharide resin glycosides from Ipomoea pes-caprae[J]. Journal of Natural Products, 2011, 74(4): 620-628. DOI:10.1021/np100640f |
| [62] |
ZHA X Q, XUE L, ZHANG H L, et al. Molecular mechanism of a new Laminaria japonica polysaccharide on the suppression of macrophage foam cell formation via regulating cellular lipid metabolism and suppressing cellular inflammation[J]. Molecular Nutrition & Food Research, 2015, 59(10): 2008-2021. |
| [63] |
周慧萍, 陈琼华. 紫菜多糖的抗凝血和降血脂作用[J]. 中国药科大学学报, 1990, 21(6): 358-360. |
| [64] |
马葆琛, 范力. 藻酸双酯钠对缺血性心脏病血液流变学的影响[J]. 中华临床医学研究杂志, 2005, 11(6): 755-756. |
| [65] |
林丽琴, 刘丽平, 黄键, 等. 紫球藻及其胞外多糖对小鼠免疫功能的调节作用[J]. 天然产物研究与开发, 2011, 23(2): 236-239. |
| [66] |
VENKATARAMAN D, ATLEE W C, PRABHU P, et al. Evaluation of in-vitro anti-arthritic potential of aerial parts of Ipomoea pes-caprae (L.)R.brand estabilishment of its mechanism of action[J]. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 2013, 4(2): 1560-1565. |
| [67] |
季宇彬, 张海滨, 刘中海, 等. 羊栖菜多糖对荷瘤小鼠红细胞免疫功能的影响[J]. 中国海洋药物, 1995(2): 10-14. |
| [68] |
黄震, 迟秀文, 束振华, 等. 海藻多糖对小鼠巨噬细胞的免疫调节作用[J]. 辽宁中医药大学学报, 2011, 13(4): 253-254. |
| [69] |
杨晓林, 孙菊云, 许汉年, 等. 褐藻糖胶的免疫调节作用[J]. 中国海洋药物, 1995(3): 9-13. |
| [70] |
王春波, 蓝孝贞, 苏冬梅, 等. 盐藻β-胡萝卜素的免疫药理研究——Ⅰ对非特性免疫和体液免疫的影响[J]. 中国海洋药物, 1997(3): 9-13. |
| [71] |
李龙.坛紫菜和龙须菜多糖对巨噬细胞免疫调节作用的研究[D].厦门: 集美大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10390-1015350719.htm
|
| [72] |
李应全, 盛少虎, 侯琦, 等. 甘糖脂对小鼠免疫功能的影响[J]. 中国海洋药物, 1995(3): 14-16. |



