肥胖是由于不平衡的能量摄入和支出造成的,多余的能量储存在脂肪细胞里面造成了肥胖。肥胖易导致多种疾病,例如高血压、高脂血症、糖尿病和动脉硬化[1],减少脂肪的吸收是治疗肥胖的有效方法之一。脂肪的消化吸收过程起始于口,然后经胃肠道脂肪酶的水解作用,最后通过胰脂肪酶和辅脂酶的协同作用完成消化吸收过程[2]。其中胰脂肪酶是脂质吸收的关键酶,目前临床批准的唯一减肥治疗药物是奥利司他[3],它能有效地抑制胰脂肪酶的活性,但存在如大便失禁、腹泻、便秘[4]、肝毒性[5-6]等较为严重的副作用。天然来源的胰脂肪酶抑制剂具有毒性低、结构多样的特点,是目前的研究热点[7-8]。本文选取文献报道中广泛存在于广西中草药的具有一定减肥降脂效果的6种中药单体化合物(熊果酸、姜黄素、齐墩果酸、大黄酸、芒果苷、双氢杨梅素),以及姜黄素在碱性加热条件下产生的分解产物(反式阿魏酸、香草酸、香草醛)作为试验对象。其中,姜黄素[9-10]主要来源于姜黄和莪术,熊果酸[11-12]主要来源于枇杷叶和山楂,齐墩果酸[13]主要来源于女贞子和大果山楂,大黄酸[14]主要来源于掌叶大黄、唐古特大黄等,芒果苷[15]主要来源于知母和芒果叶、双氢杨梅素[16]主要来源于藤茶。采用对硝基苯酚法[17]以奥利司他为阳性对照样品,测定这些单体成分对胰脂肪酶抑制作用, 为降脂中药及其功能食品的开发提供科学依据。
1 材料与方法 1.1 材料熊果酸98%、姜黄素98%、齐墩果酸98%、大黄酸98%、芒果苷98%、双氢杨梅素98%、香草酸98%、反式阿魏酸98%、香草醛98%,以上天然植物单体均采购于南京曼赫医疗科技有限公司。
对硝基苯棕榈酸酯、对硝基苯酚、猪胰腺脂肪酶(Sigma公司)、脱氧胆酸钠、阿拉伯树胶粉、三氨基甲烷、异丙醇、二甲基亚砜、盐酸以上有机试剂均为分析纯。
1.2 仪器与设备全波长酶标仪(瑞士Tecan公司)、Sorvall ST 16台式高性能离心机(美国Thermo公司)、雷磁精密pH计(上海仪电科学仪器有限公司)、SQP分析天平(赛多利斯科学仪器有限公司)、电热恒温水浴锅(金坛市医疗器械厂)、微量移液器(美国Thermo公司)KQ5200B超声仪(昆山市超声仪器有限公司)。
1.3 方法 1.3.1 实验试剂的配制Tris-HCl缓冲液:配制50 mmol/L的三氨基甲烷Tris-HCl溶液,加入少量的阿拉伯树胶粉和脱氧胆酸钠(总量不超过0.5%)作为助溶剂再调节到pH值8.0。
底物溶液:称取对基苯棕榈酸酯(PNPP)0.001 9 g,先溶于500 μL异丙醇,再在45℃水浴条件下加热5 min使其充分溶解,最后用预热好的Tris-HCl缓冲液稀释配制成0.5 mmol/L的底物溶液,使异丙醇终浓度不超过5%。
抑制剂溶液:奥利司他、熊果酸、齐墩果酸这3种难溶于水的单体用DMSO的纯溶剂溶解,其余实验用单体用DMSO溶解之后再加入Tris-HCl缓冲液稀释,最终的反应体系DMSO量不超过10%。
1.3.2 胰脂肪酶溶液配制及酶活力确定称取0.025 g猪胰脂肪酶,用Tris-HCl缓冲液定容到10 mL,在室温下静置5 min制成2.5 mg/mL胰脂肪酶溶液,然后分装至10支2 mL离心管,-5℃、5 000 r离心5 min取上清液备用。胰脂肪酶活力测定采用对硝基苯酚法[17],其活力单位定义:在37℃、pH值8.0条件下,每克胰脂肪酶水解1 μmol对硝基苯棕榈酸酯,生成1 μmol对硝基苯酚为1个酶活力单位(U)。
1.3.3 有效单体的筛选与作用时间的确定以上述6种天然植物单体为抑制剂,37℃条件下预热5 min Tris-HCl缓冲液,加入DMSO使其充分溶解,最终配制成30 μmol/L的各抑制剂溶液。奥利司他配制浓度为1 μmol/L。称取一定量对基苯棕榈酸酯(pNPP)先溶于500 μL异丙醇在45℃水浴条件下加热5 min使其充分溶解,最后用预热好的Tris-HCl缓冲液稀释配制成0.5 mmol/L的pNPP底物溶液,使异丙醇反应体系终浓度不超过5%。加入20 μL的抑制剂溶液和50 μL的胰脂肪酶溶液,37℃条件下预热10 min,再加入100 μL的PNPP底物溶液起始反应,测定不同时间点的胰脂肪酶活性,计算其抑制率。以一定浓度下抑制率最大的天然植物单体为测试对象,当有效单体浓度增加、抑制率不再变化时的反应时间为最佳反应时间。
1.3.4 抑制剂浓度对胰脂肪酶的影响以1.3.3节筛选出来的有效单体(继续进行实验,以不同质量溶度的中药有效单体为抑制剂,测定最佳反应时间(30 min)时的胰脂肪酶活性(方法同1.3.3节),计算其抑制率。
1.3.5 有效单体抑制胰脂肪酶作用机理的确定以底物溶液、有效单体溶液、胰脂肪酶为原料配制3种反应体系。
反应体系1:有效单体溶液和胰脂肪酶混合37℃水浴加热下反应10 min,加入底物溶液进行反应;
反应体系2:底物溶液与胰脂肪酶溶液混合37℃水浴加热下反应10 min,加入有效单体溶液进行反应;
反应体系3:有效单体溶液和底物溶液混合37℃水浴加热下反应10 min,加入胰脂肪酶溶液进行反应。
分别测定3种反应体系的酶活力,计算其抑制率。
1.3.6 抑制率的计算IC50为50%抑制浓度即B/B0=50%时所对应的浓度,半数抑制是用来衡量抗体灵敏度的半数抑制越低, 说明抗体的灵敏度越高:
| $ 抑制率\left( \% \right) = \left[ {1 - \left( {{B_1} - {B_0}} \right)/\left( {{A_1} - {A_0}} \right)} \right]{\rm{ \times 100\% , }} $ |
其中,A1为未添加抑制剂酶活,A0是其空白对照;B1是加入抑制剂的酶活,B0是其阴性对照。
2 结果与讨论 2.1 抑制剂与酶作用时间的确定以预实验中抑制作用较强的姜黄素、熊果酸、双氢杨梅素为测试对象,其抑制率随着时间增长结果见图 1。在15~30 min内各中药有效单体对胰脂肪酶的抑制率随着时间增长逐渐加大,到30 min时抑制率趋于稳定后期随着加热时间的延长抑制率都无明显增加。这表明在反应进行到30 min时,各有效单体对胰脂肪酶的抑制作用趋于峰值,继续进行反应抑制率无明显变化,据此确定实验的最佳反应时间为30 min。

|
| 图 1 反应时间对有效单体抑制作用的影响 Fig. 1 Effect of reaction time on the inhibition of effective monomers |
2.2 中药单体及衍生物的胰脂肪酶抑制率的测定
通过预实验可知当中药单体的浓度达到400 μmol/L时,其抑制率最大,中药单体及衍生物的最大胰脂肪酶抑制率见表 1。
| 样品 Samples | 胰脂肪酶抑制率 Inhibition rate of pancreatic lipase (%) |
| 熊果酸 Ursolic acid | 63.31±0.73 |
| 姜黄素 Curcumin | 72.63±0.46 |
| 双氢杨梅素 Dihydromyricetin | 23.76±0.36 |
| 齐墩果酸 Oleanolic acid | 27.45±0.04 |
| 大黄酸 Rhein | 9.43±0.78 |
| 芒果苷 Mangiferin | 8.17±0.47 |
| 反式阿魏酸 Ferulic acid | 9.76±0.58 |
| 香草醛 Vanillin | 8.85±0.49 |
| 香草酸 Vanillic acid | 9.23±0.84 |
| 注:中药单体及衍生物的浓度为400 μmol/L Note:Concentration of Chinese medicine monomers and derivatives are 400 μmol/L | |
筛选结果表明,姜黄素和熊果酸抑制效果较好,因此选择这两种单体进行后续试验。
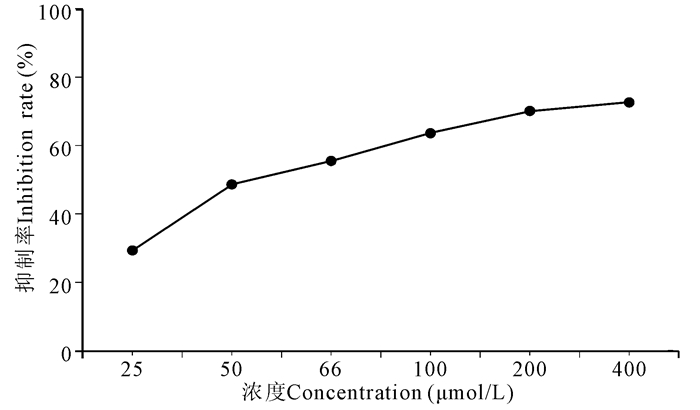
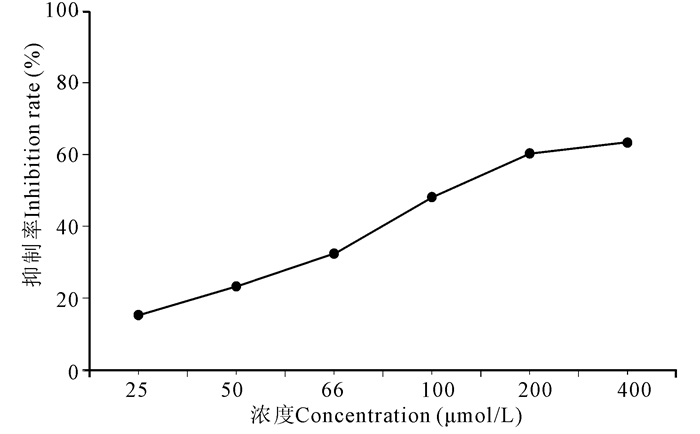
2.3 姜黄素和熊果酸的胰脂肪酶半数抑制浓度的测定选取抑制效果较好的中药单体化合物姜黄素、熊果酸,继续进行胰脂肪酶半数抑制浓度的测定。由实验结果(图 2~4)可知,姜黄素、熊果酸的半数抑制浓度(IC50)分别为27 μmol/L、100 μmol/L。其余样品由于抑制效果较低所以无法计算IC50值。作为目前上市最有效的胰脂肪酶抑制剂——奥利司他在相同的实验条件下IC50值为0.95 μmol/L。不同成分对胰脂肪酶的抑制效果从强到弱依次为奥利司他>姜黄素>熊果酸>齐墩果酸>双氢杨梅素。从筛选结果来看姜黄素、熊果酸在较低浓度时就有抑制效果显现,两者分别在75 μmol/L、150 μmol/L时抑制率的变化趋于稳定。
|
| 图 2 姜黄素浓度对抑制胰脂肪酶活性的影响 Fig. 2 Effect of curcumin concentration on the inhibition of pancreatic lipase activity |
|
| 图 3 熊果酸浓度对抑制胰脂肪酶活性的影响 Fig. 3 Effect of ursolic acid concentration on the inhibition of pancreat lipase activity |

|
| 图 4 奥利司他浓度对胰脂肪酶抑制活性的影响 Fig. 4 Effect of orlistat concentration on the inhibition of pancreatic lipase activity |
2.4 胰脂肪酶抑制作用机理的探讨
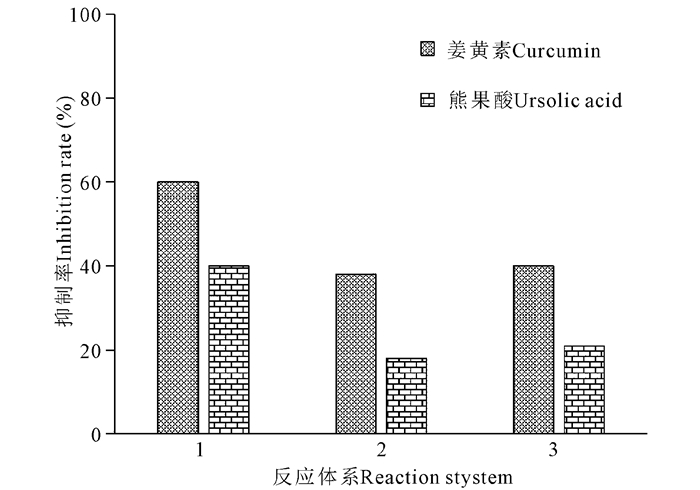
由图 5可知,反应体系2对胰脂肪酶的抑制率最低,反应体系3对胰脂肪酶的抑制率最高,反应体系3次于反应体系1。这表明两种中药单体化合物对胰脂肪酶的抑制作用主要是通过其与酶的相互作用,从而阻碍酶对底物的分解作用,属于非竞争性抑制作用。
|
| 反应体系1:抑制剂+酶+底物,反应体系2:底物+酶+抑制剂,反应体系3:底物+抑制剂+酶 Reaction system 1:Inhibitor + enzyme + substrate; reaction system 2:Substrate + enzyme + inhibitor; reaction system 3:Substrate + inhibitor + enzyme 图 5 反应物加入顺序对抑制作用的影响 Fig. 5 Effect of the order of reactant addition on the inhibition |
3 结论
本研究改良了文献[17]报道的胰脂肪酶抑制活性测试方法,测定了6种常见中药单体的脂肪酶抑制活性,结果表明姜黄素和熊果酸具有显著胰脂肪酶抑制作用,其作用机理属于非竞争性抑制,齐墩果酸和双氢杨梅素也有一定抑制作用,其余单体及姜黄素分解产物均无明显抑制作用。由于姜黄素和熊果酸广泛存在于广西中草药且含量高,是两种具有开发前景的脂肪酶抑制剂。本研究为广西中草药、功能食品开发及扶贫工作提供了重要的科学数据,具有较大的应用价值。
| [1] |
MIGUELGORRY P L, HENDRICKS E J. Pharmacotherapy for obesity and changes in eating behavior:A patient and physician's perspective[J]. Advances in Therapy, 2016, 33(7): 1262-1266. DOI:10.1007/s12325-016-0349-y |
| [2] |
ARMAND M. Lipases and lipolysis in the human digestive tract:Where do we stand?[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2007, 10(2): 156-164. DOI:10.1097/MCO.0b013e3280177687 |
| [3] |
GARGOURI Y, RANSAC S, VERGER R. Covalent inhibition of digestive lipases:An in vitro study[J]. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism, 1997, 1344(1): 6-37. DOI:10.1016/S0005-2760(97)81102-2 |
| [4] |
DRENT M L, VAN DER VEEN E A. Lipase inhibition:A novel concept in the treatment of obesity[J]. International Journal of Obesity, 1993, 17(4): 241-244. |
| [5] |
VINER R M, HSIA Y, TOMSIC T, et al. Efficacy and safety of anti-obesity drugs in children and adolescents:Syetematic review andmeta-analysis[J]. Obesity Review, 2010, 11(8): 593-602. |
| [6] |
FILIPPATOS T D, DERDEMEZIS C S, GAZI I F, et al. Orlistat-associatrd adverse effects and drug interactions[J]. Drug Safety, 2008, 31(1): 53-65. DOI:10.2165/00002018-200831010-00005 |
| [7] |
KAMMOUN J, RAHIER R, SELLAMI M, et al. Identification of a new natural gastric lipase inhibitor from star anise[J]. Food and Function, 2019, 10(1): 469-478. DOI:10.1039/C8FO02009D |
| [8] |
HERRERA T, DEL HIERRO J N, FORNARI T, et al. Inhibitory effect of quinoa and fenugreek extracts on pancreatic lipase and alpha-amylase under in vitro traditional conditions or intestinal simulated conditions[J]. Food Chemistry, 2019, 270: 509-517. DOI:10.1016/j.foodchem.2018.07.145 |
| [9] |
冯生光, 覃耿垚, 刘红霞, 等. 姜黄素降解产物的分离鉴定及姜黄素的稳定性考察[J]. 沈阳药科大学学报, 2009, 26(5): 361-365, 396. |
| [10] |
于冬青, 邓华聪. 姜黄素对糖尿病大鼠糖、脂代谢及氧化应激的影响[J]. 重庆医学, 2005, 34(1): 37-39. DOI:10.3969/j.issn.1671-8348.2005.01.015 |
| [11] |
JANG D S, LEE Y G, KIM J, et al. A new pancreatic lipase inhibitor isolated from the roots of Actinidia arguta[J]. Archives of Pharmacal Research, 2008, 31(5): 666-670. DOI:10.1007/s12272-001-1210-9 |
| [12] |
MORIKAWA T, XIE Y Y, ASAO Y, et al. Oleanane-type triterpene oligoglycosides with pancreatic lipase inhibitory activity from thepericarps of Sapindus rarak[J]. Phytochemistry, 2009, 70(9): 1166-1172. DOI:10.1016/j.phytochem.2009.06.015 |
| [13] |
徐莹.女贞子降血糖、降血脂活性及齐墩果酸衍生化研究[D].长春: 吉林农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016732626.htm
|
| [14] |
胡昌江, 马烈, 何学梅, 等. 九制大黄蒽醌衍生物对动物高血脂及血液流变学的影响[J]. 中成药, 2001, 23(1): 33-35. |
| [15] |
RAMÍREZ N M, TOLEDO R C L, MOREIRA M E C, et al. Anti-obesity effects of tea from Mangifera indica L.leaves of the Ubá variety in high-fat diet-induced obese rats[J]. Biomed Pharmacother, 2017, 91: 938-945. DOI:10.1016/j.biopha.2017.05.015 |
| [16] |
蒋才武.双氢杨梅素-聚乙二醇固体分散体的研制[C]//2006第六届中国药学会学术年会论文集.中国药学会: 中国药学会学术会务部, 2006: 6.
|
| [17] |
KIM J H, KIM H J, PARK H W, et al. Development of inhibitors against lipase and a-glucosidase from derivatives of monascus pigment[J]. FEMS Microbiology Letters, 2007, 276(1): 93-98. DOI:10.1111/j.1574-6968.2007.00917.x |



