重离子束辐射诱变技术作为植物种质创新的有力工具,目前已广泛应用到作物育种及功能基因的研究中。重离子束作为一种新的辐射源,与X射线、60Co-γ射线、电子束辐照等辐照技术相比,具有传能线密度(Linear Energy Transfer, LET)大、相对生物学效应(Relative Biological Effectiveness, RBE)高、损伤后修复效应小、能量沉积的空间分辨性好等生物学优势,因此可以在存活率较高的情况下得到较高的突变率。目前重离子束辐射诱变已涉及粮食作物如小麦、玉米、水稻等,经济作物如油葵、甜高粱、番茄等,以及观赏植物天竺葵、大丽花、白花紫露草等,并取得很大的进展。本文就重离子束辐照在植物育种中的应用进行简要概述。
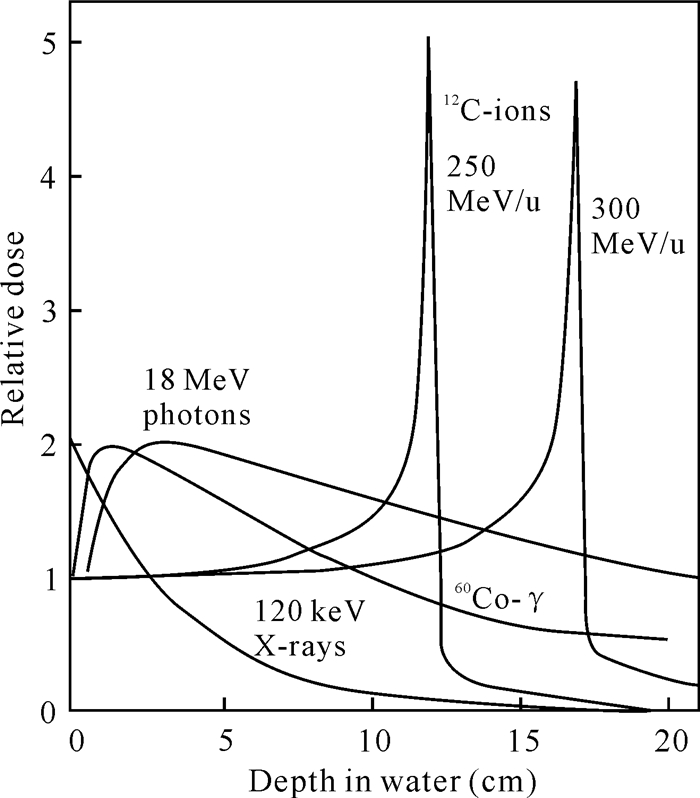
1 重离子束辐照的优势重离子是指氮、碳、硼、氖、氩等原子被剥掉或部分剥掉外围电子后的带正电的原子核。将重离子通过大型加速器装置加速而形成的具有能量的射线就是重离子束。相对于低能射线(X射线和γ射线),重离子束具有独特的深度-剂量曲线,形成布拉格(Bragg)峰(图 1),即重离子在入射坪区,吸收剂量相对保持恒定,坪区的长度取决于入射重离子的能量,快到射程末端时,剂量急剧升高,形成Bragg峰。Bragg峰会随着原子序数的增加而变窄,同时峰的高度也增加[1]。正是由于重离子的这种物理学特性,更有利于实现定点诱变,在植物育种过程中将需要诱变的部位设定在Bragg峰的范围内进行辐照,能达到辐射诱变的效果,进而筛选突变体进行后期的研究。
重离子束作为一种新的辐射源,与X射线、60Co-γ射线、电子束辐照等辐照技术相比,具有独特的生物学优势。(1)传能线密度(LET)大。LET是指直接电离粒子在其单位径迹上消耗的平均能量,一般用keV/μm表示,1 keV/μm=1.602×10-10 J/m。重离子束在穿越介质的过程中将其能量(单位路径上沉积的能量)以较快的速率沉积在粒子径迹上。而X射线、60Co-γ射线、电子束在单位径迹上沉积的能量较低,因此LET值也较低。故通常将X射线、60Co-γ射线、电子束等称为低能射线,而将重离子束称为高能射线。一般来说,LET值越高,其生物学效应也越大。(2)相对生物效应(RBE)高。电离辐射的生物效应,不仅取决于某一特定时间内吸收的总剂量,而且还受能力分布的制约。在剂量相同时,高LET辐射的生物效应大于低LET的辐射效应,这种差别一般用相对生物学效应来表示。故重离子的相对生物学效应高于其他低能射线。(3)损伤后修复效应小。(4)能量沉积的空间分辨性好。(5)氧效应小。已有研究表明,重离子束辐射引发的总突变效率要比通常的低能射线(X射线、60Co-γ射线和电子束)高出10倍左右[2],染色体突变重排和诱导点突变的效率比常见的低能射线高13-14倍。
因此,利用重离子束上述生物学特性,就可以在辐照剂量相对较小的情况下达到预期的生物学效应。这些优势在植物诱变育种工作中有很大的作用,为植物科学研究提供新的方向。
2 重离子辐照的植物诱变机理近年来,以重离子辐照诱变为基础的植物育种不断发展,对重离子诱变机理的研究也越来越受重视。
2.1 重离子辐照对植物表型的影响利用重离子束辐射产生的、在植株表型变化的突变类型主要包括叶色、叶型、花型、花色、株型、生长周期突变等。Du等[3]利用不同剂量的碳离子辐照拟南芥(Arabidopsis thaliana)干种子,获得了叶型、株型、花型、生长周期突变的拟南芥突变体,表现出比低能射线辐照更多的变异种类,总突变率为4.77%,其中叶型变异占总突变的2.33%,生长周期变化占总突变的1.57%。Okamura等[4]利用重离子辐照菊花(Dendranthema morifolium(Ramat.)Tzvel.)选育出重瓣突变体。此外,Luo等[5]通过碳离子束辐照百脉根(Lotus corniculatus Linn.)种子,其后代出现叶色、叶型、花型、产量、株型、分蘖以及花期等突变体,总突变率达5.14%。以上研究表明,重离子辐照对植物表型的影响是多样化的,利用重离子辐照技术可以拓宽和加速作物优良农艺性状的选育。
2.2 重离子束辐照对植物生理生化特征的影响重离子辐照植物所引起的生理生化方面的影响主要表现为生物体内活性氧和可溶性糖含量的增加[6],产生的机制包括两个方面:(1)重离子束辐照靶材料(如种子、愈伤组织、幼嫩枝条等)时,辐照可以使H2O分解为·OH和·H两种自由基,由于自由基自身极强的氧化或还原特性,进而引发各种反应,形成新的分子或其他类型的自由基以及活性氧分子。(2)重离子辐射造成植物染色体及细胞膜的破坏,促使植株进行自身修复,诱发体内活性氧及可溶性糖的增加。不同植物中,不同剂量辐照后对植株体内可溶性糖及活性氧相关酶活性的影响不同。李雪虎等[7]利用不同剂量的碳离子辐照大青叶,结果表明可溶性糖的含量随着辐照剂量的增加而降低,丙二醛(MDA)、SOD、POD的含量呈先升高后降低的趋势。薛林贵等[8]用12C6+离子束辐照紫苏种子,发现其当代的POD、CAT以及SOD三种酶活性均有不同程度的提高,但当辐射剂量过大时,酶活性反而降低。其进一步说明植物通过自我调节机制来增强细胞抗氧化酶活性来增强自身抗氧化和抵御逆境的能力,从而减轻逆境对植物的伤害,保证生理代谢的正常进行。
2.3 重离子束辐照对植物分子水平的影响重离子束辐射一方面改变了植株体内基因序列、DNA结构及表达方式,另一方面改变了植物体内甲基化、转座子以及蛋白结构,进而引起植株发生突变。Du等[9]利用重测序的方法检测了M3代拟南芥突变体,结果表明重离子束辐照引起的DNA碱基替换的数目远远多于插入/缺失,同时,单碱基缺失的数目多于大片段缺失。Zhao等[10]利用不同剂量碳离子辐照处理水稻后,发现DNA甲基化多态性水平在不同剂量处理后均有所提高,且高剂量辐射引起的DNA甲基化较低剂量辐射更加明显。此外,基因组DNA的甲基化与转座子的激活有着密切的联系,转座子不但是DNA甲基化作用的靶位点,还可以通过转座来影响其他位点甲基化的产生。利用N离子注入玉米种子,研究结果表明,玉米突变体TIRA和TIRB末端,CpG、CpHpG和CpHpH胞嘧啶位点较野生型均发生不同程度的甲基化,从而激活MuDR转座元件[11]。
3 重离子束辐射诱变技术在植物育种中的应用 3.1 重离子束诱变育种在国际上的应用重离子束在核物理方面的研究始于20世纪70年代日本、美国等国家加速器装置的建设。直至1993年,日本建立了世界上首个专门应用于生物学研究的回旋加速器环(RIKEN Ring Cyclotron,RRC),重离子束辐射效应的研究才被应用到植物的诱变育种中[12]。重离子通过加速器注入植物外植体内,同材料中的分子、原子发生碰撞,能在局部区域释放出高能量,显著诱导单链或双链DNA断裂、DNA交联改变、末端受损以及簇集损伤,从而导致DNA在复制过程中出现错配现象,使其不容易修复。同时,重离子束辐射也会引起染色体的变化,包括染色体结构和数目的变化,尤其是染色体数目的变化在植物育种中多倍体材料的选育具有重要的意义。因此,重离子束辐射是一种很有效的诱导植物改良的技术手段,可以有效地改变目标性状,能在不影响其他特征的基础上提供一个广谱的变异范围,从而获得很多新颖的表型[13]。
日本育种学家将重离子束辐照诱变技术与传统育种技术相结合(图 2),获得拟南芥、百脉根、水稻以及花卉等一系列突变材料[14]。模式植物方面,Tanaka等[15]利用重离子束辐照筛选出抗UV-B、UV-B敏感、紫红色斑点种皮以及叶绿素缺失的拟南芥突变体;豆科模式植物百脉根通过离子束辐照处理筛选到根部结瘤能力提高、维管组织和花器官发育异常的突变体[16]。粮食作物方面,水稻种子经重离子辐照后,获得种子中镉积累减少、早熟、矮化、白化的突变体[17-18]。花卉方面,2001年在广岛上市的大丽花(Dahlia pinnata Cav.)“World”品种,就是大丽花枝条经碳辐照后,选育的花型花色改变的大丽花新品种。马鞭草(Verbena)“Temari Coral Pink”的愈伤组织经1 890 MeV氮离子在10 Gy剂量下辐照后,筛选到花色变粉、花期延长且不育新品种“Temari Bright Pink”(2002年)[19]。同理获得的品种还有矮牵牛(Petunia hybrida (J.D.Hooker) Vilmorin)“Surfinia Rose Veined”(2003年)和“Surfinia Pure White”(2012年)两种新品种、夏堇(Torenia fournieri Linden.ex Fourn.)新品种“Summer Wave Pin”(2007年)等。此外,对这些突变材料进行重离子的二次辐照诱变,又筛选到一些新的突变材料。一些学者在遗传学和分子生物学层面分析了突变材料的变异机理,进而深入探索重离子束对植物诱变育种的机理[20-22]。

|
| (a)重离子束辐照诱变无性繁殖流程(b)重离子束诱变有性繁殖流程 (a)Mutants screening scheme by heavy ion beam irradiation with vegetative propagation (b)Mutants screening scheme by heavy ion beam irradiation with seed propagation 图 2 重离子束诱变植物选育流程[14] Fig. 2 Mutants screening scheme by heavy ion beam irradiation in plant breeding[14] |
3.2 重离子束诱变育种在国内的应用
重离子植物诱变育种在我国最先开展于粮食作物。1986年余增亮等[23]将氮离子注入水稻干种子,并进行生物学效应研究,提出离子注入能量沉积、质量沉积以及电荷转移引起生物学效应的假说,填补了我国重离子诱变育种领域的空白。安徽省农业科学院利用重离子束注入技术辐照水稻种子,育成抗病虫水稻S9042、优质水稻S9055、早熟高产中粳63和晚粳M3122等品种,取得巨大的社会和经济效益[24];随后又利用重离子辐照诱变小麦,培育出3个小麦新品种(皖麦32号、皖麦42号和皖麦32号),产量较对照均显著提高,综合性状和抗病性也有所改良[25]。罗红兵等[26]分别利用锂和碳离子束诱变玉米农大108种胚,从辐照当代植株中筛选出叶片黄化、雄性不育、早熟和无雄穗等突变材料,从M2代中筛选出多穗等突变体,扩大了玉米的种质资源,为新品种的选育提供了宝贵基础材料。此外,重离子束辐照技术在烟草、大豆、甘薯、番茄、西瓜中也得到应用并获得多种突变材料。
20世纪90年代开始,中国科学院近代物理研究所利用兰州重离子加速器(HIRFL)装置提供的重离子束开展一系列植物诱变育种工作,涉及作物[27-29]、中草药[30]和花卉[31]等方面。在作物方面,小麦干种子经重离子辐照后,经多代田间选育,育成高产、稳产、抗逆的小麦新品种“陇辐2号”[27];甜高粱干种子经碳离子辐照后,经多代田间筛选,获得高产、高糖以及生育期提前的甜高粱新品种“近甜1号”[32]。在中草药方面,利用重离子辐照当归、党参、黄芪等种子后,先后选育出当归新品种“岷归3号”、党参新品种“渭党2号”和“渭党3号”以及黄芪新品种“陇芪1号”[33-34]。在花卉方面,利用中能重离子束辐照矮牵牛干种子,种植后筛选到花瓣由单瓣变为双瓣的花型突变株以及花色由浅红变为深红的花色变异株;万寿菊干种子经低能N、C离子辐照后,出现了花盘增大的变异株[35];2005年,将大丽花花芽经碳离子辐照后,筛选出矮化、花期提前以及花色变化的变异单株,经过稳定性试验后获得“新兴红”和“新兴白”2个大丽花新品种[36];Wu等[31]利用80.55 MeV的碳离子辐照一串红干种子后,在100 Gy剂量下筛选出植株矮化、叶片变皱、花色变为深红色以及嵌合色变异植株。综上,重离子辐射诱变技术对提高作物诱变育种的效率及相应关键基因功能的研究具有重要的意义。
4 展望突变体创制在植物机理研究和作物育种研究中起到非常重要的作用,开发高效的诱导突变体技术是作物遗传育种及基因功能研究的基础。重离子辐射诱变技术因其突变谱广、操作简单、变异多等特点,已广泛应用于作物育种及关键基因的功能研究工作中。然而,重离子辐射诱变的机制复杂,不同类型的重离子和不同离子剂量产生的诱变效应不同,不同作物的耐受剂量也不同,因此,选择适宜的重离子及其剂量是高效创制突变体的关键。在诱变机理研究方面,随着测序技术的不断发展,将重离子辐射技术与基因重测序、转录组测序、蛋白质组等技术结合,可深入研究重离子辐射诱变后的分子机制,进一步阐明重离子辐射诱变的机理。
| [1] |
KRAFT G. Tumor therapy with heavy charged particles[J]. Progress in Particle and Nuclear Physics, 2000, 45: S473-S544. |
| [2] |
DU Y, LUO S W, YU L X, et al. Strategies for identification of mutations induced by carbon-ion beam irradiation in Arabidopsis thaliana by whole genome resequencing[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2018, 807: 21-30. |
| [3] |
DU Y, LI W J, YU L X, et al. Mutagenic effects of carbon-ion irradiation on dry Arabidopsis thaliana seeds[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2014, 759: 28-36. |
| [4] |
OKAMURA M, HASE Y, FURUSAWA Y, et al. Tissue-dependent somaclonal mutation frequencies and spectra enhanced by ion beam irradiation in chrysanthemum[J]. Euphytica, 2015, 202: 333-343. |
| [5] |
LUO S W, ZHOU L B, LI W J, et al. Mutagenic effects of carbon ion beam irradiations on dry Lotus japonicus seeds[J]. Nuclear Instruments and Methods in Physics Research B:Beam Interactions with Materials and Atoms, 2016, 383: 123-128. |
| [6] |
SEMSANG N, YU L D. Induction of antioxidant enzyme activity and lipid peroxidation level in ion-beam-bombarded rice seeds[J]. Nuclear Instruments and Methods in Physics Research B:Beam Interactions with Materials and Atoms, 2019, 307: 603-609. |
| [7] |
李雪虎, 陆锡宏, 辛志君, 等. 12C6+离子束辐照对大青叶生理生化特性的影响[J]. 激光生物学报, 2013, 22(6): 515-520. |
| [8] |
薛林贵, 徐俊泉, 张红, 等. 12C6+离子束辐照对紫苏生理特性的影响[J]. 核技术, 2011, 34(4): 267-272. |
| [9] |
DU Y, LUO S W, LI X, et al. Identification of substitutions and small insertion-deletions induced by carbon-ion beam irradiation in Arabidopsis thaliana[J]. Frontiers in Plant Science, 2017, 8: 1851. |
| [10] |
ZHAO Q, WANG W, GAO S, et al. Analysis of DNA methylation alterations in rice seeds induced by different doses of carbon-ion radiation[J]. Journal of Radiation Research, 2018, 59(5): 565-576. |
| [11] |
QIAN Y X, CHENG X, LIU Y, et al. Reactivation of a silenced minimal mutator transposable element system following low-energy nitrogen ion implantation in maize[J]. Plant Cell Report, 2010, 29: 1365-1376. |
| [12] |
BRADSHAW J E. Plant breeding:Past, present and future[J]. Euphytica, 2017, 213: 60. |
| [13] |
SHIKAZONO N, SUZUKI C, KITAMURA S, et al. Analysis of mutations induced by carbon ions in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2005, 56(412): 587-596. |
| [14] |
ABE T, KAZAMA Y, HIRANO T. Ion beam breeding and gene discovery for function analyses using mutants[J]. Nuclear Physics News:A Publication of NuPECC and EPS-NPB, 2015, 25: 30-34. |
| [15] |
TANAKA A, TANO S, CHANTES T. A new Arabi-dopsis mutant induced by ion beams affects flavonoid synthesis with spotted pigmentation in testa[J]. Genes & Genet Systems, 1997, 72(3): 141-148. |
| [16] |
ERIKA O K, KUMIKO T, KIN-ICHIRO M. Klavier (klv), a novel hypernodulation mutant of Lotus japonicus affected in vascular tissue organization and floral induction[J]. The Plant Journal:For Cell and Molecular Biology, 2005, 44(3): 505-515. |
| [17] |
PHANCHAISRI B, SAMSANG N, YU L D, et al. Expression of Os SPY and 14-3-3 genes involved in plant height variations of ion-beam-induced KDML105 rice mutants[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2012, 734(1/2): 56-61. |
| [18] |
ISHIKAWA S, ISHIMARU Y, IGURA M, et al. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of low-cadmium rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(47): 19166-19171. |
| [19] |
KANAYA T, SAITO H, HAYASHI Y, et al. Heavy-ion beam-induced sterile mutants of verbena (Verbena×hybrida) with an improved flowering habit[J]. Plant Biotechnology, 2008, 25: 91-96. |
| [20] |
KAZAMA Y, ISHⅡ K, HIRANO T, et al. Different mutational function of low- and high-linear energy transfer heavy-ion irradiation demonstrated by whole-genome resequencing of Arabidopsis mutants[J]. The Plant Journal, 2017, 92(6): 1020-1030. |
| [21] |
LI F, SHIMIZU A, NISHIO T, et al. Comparison and characterization of mutations induced by gamma-ray and carbon-ion irradiation in rice (Oryza sativa L.) using whole-genome resequencing[J]. G3-Genes Genomes Genetics, 2019, 9(11): 3743-3751. |
| [22] |
ICHIDA H, MORITA R, SHIRAKAWA Y, et al. Targeted exome sequencing of unselected heavy-ion beam-irradiated populations reveals less-biased mutation characteristics in the rice genome[J]. The Plant Journal, 2019, 98(2): 301-314. |
| [23] |
余增亮, 霍裕平. 离子注入生物学研究述评[J]. 安徽农业大学学报, 1994, 21(3): 221-225. |
| [24] |
黄群策, 李玉峰. 离子束生物技术在水稻育种中的应用前景[J]. 杂交水稻, 2002, 17(5): 5-8. |
| [25] |
司婧, 张红, 武振华. 离子注入技术在植物育种中的应用与研究进展[J]. 辐射研究与辐射工艺学报, 2012, 30(6): 321-327. |
| [26] |
罗红兵, 赵葵, 周文新. 重离子辐射诱导玉米雄性不育突变系的遗传研究[J]. 核农学报, 2008, 22(3): 296-299. |
| [27] |
赵连芝, 王勇, 甄东升, 等. 春小麦突变新品种——"陇辐2号"[J]. 核农学报, 2005, 19(1): 80. |
| [28] |
PENG X, LUO L, CUI H, et al. Characterization and fine mapping of a leaf wilt mutant, m3, induced by heavy ion irradiation of rice[J]. Crop Science, 2019, 59: 1-10. |
| [29] |
YANG G, LUO W, ZHANG J, et al. Genome-wide comparisons of mutations induced by carbon-ion beam and gamma-rays irradiation in rice via resequencing multiple mutants[J]. Frontiers in Plant Science, 2019, 10: 1514. |
| [30] |
阎侃, 李雪虎. 碳离子辐照对菘蓝药性品质和分子水平的诱变效应[J]. 西北植物学报, 2015, 35(5): 906-914. |
| [31] |
WU D L, HOU S W, QIAN P P, et al. Flower color chimera and abnormal leaf mutants induced by carbon heavy ions in Salvia splendens Ker-Gawl[J]. Scientia Horticulturae, 2009, 121(4): 462-467. |
| [32] |
DONG X C, LI W J. Biological features of an early-maturity mutant of sweet sorghum induced by carbon ions irradiation and its genetic polymorphism[J]. Advances in Space Research, 2012, 50(4): 496-501. |
| [33] |
李硕, 李成义, 李敏, 等. 离子辐射选育当归新品种安全性评价[J]. 中草药, 2018, 49(11): 2662-2670. |
| [34] |
汪淑霞, 宋振华. 党参新品种渭党3号选育报告[J]. 甘肃农业科技, 2015(11): 11-13. |
| [35] |
孔滢, 白锦荣, 尚宏忠, 等. 重离子束辐射技术在花卉育种中的应用[J]. 园艺学报, 2013, 40(9): 1837-1845. |
| [36] |
董喜存, 李文建, 余丽霞, 等. 用随机扩增多态性DNA技术对重离子辐照大丽花花色突变体的初步研究[J]. 辐射研究与辐射工艺学报, 2007, 25(1): 62-64. |