2. 广西科学院国家非粮生物质能源工程技术研究中心, 非粮生物质酶解国家重点实验室, 广西南宁 530007
2. National Engineering Research Center for Non-Food Biorefinery, State Key Laboratory of Non-Food Biomass and Enzyme Technology, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
真菌种类繁多、分布广泛、次级代谢产物新颖多样,是药物研发的主要来源之一。目前已从真菌中发现大量结构丰富、活性广泛的次级代谢产物,其中很多已经被成功开发为治疗不同疾病的药物,如抗细菌、抗真菌、降胆固醇药物以及免疫抑制剂等。与其他海洋微生物相比,真菌来源的次级代谢产物不仅数量占到整个微生物次级代谢产物的一半左右,还具有产量大、结构新颖、活性显著、“创新指数”和“类药性”高等优势,已经成为目前微生物研究的新亮点[1]。
真菌代谢产物的结构类型包括生物碱、聚酮、内脂、蒽醌类、萜类、肽类等。生物碱结构多样,多有复杂的含氮杂环结构,绝大多数具有显著的生物活性。生物碱类化合物中的吲哚生物碱是迄今发现最多的一类,不仅具有十分独特和复杂的化学结构,还表现出较强的抗肿瘤、抗病毒、抗菌和抗炎等多种生理活性,因此引起众多药物化学家和有机化学家的研究兴趣[2-5]。异戊烯基化的吲哚生物碱是一类同时含有芳香基团和类异戊二烯基团的天然产物,广泛存在于真菌类的曲霉属、麦角菌属和青霉菌属中,具有一定的药理学活性,与未异戊烯基化的前体相比具有明显高的生物活性。
生物碱二酮哌嗪类化合物(Diketopiperazines,DKPs)的基本结构是由2个氨基酸缩合而成的环二肽(DKP),因其骨架含有稳定的六元环结构,且有2个氢键给体和2个氢键受体,使得DKPs具有较强的生物活性和药理活性,在药物化学中成为一个重要的药效团。它不但可以作为活性先导化合物,还在寻找蛋白作用受点、药物靶点等方面扮演重要角色,因此在医药、食品及天然产物开发研究等众多领域中具有广阔的应用前景。近年来,人们从动植物及海洋微生物,尤其是海绵共栖细菌中提取分离到的二酮哌嗪类化合物种数逐年增加,由此掀起二酮哌嗪类化合物的研究热潮。DKPs如cyclo-(L-Pro-L-Tyr)和cyclo-(ΔAla-L-Val)首先从陆源微生物,诸如铜绿假单胞菌Pseudomonas aeruginosa、紫茉莉假单胞菌Pseudomonas mirabilis、弗氏柠檬酸杆菌Citrobacter freundii以及聚团肠杆菌Enterobacter agglomerans等革兰氏阴性细菌的培养上清液中提取到。此后,人们陆续从海洋微生物代谢产物中分离到具有活性的DKPs[6-7]。
含[2.2.2]-环二氮辛烷环结构单元的二酮哌嗪类化合物作为一类生物活性很强的化合物,其结构和活性具有稳定性、新颖性和独特性等特点,因此在生物合成、生物进化和医药方面具有重要研究价值。本文从结构及生物活性的角度综述自1968年以来,从曲霉属、青霉属和畸枝霉属中分离到的近50个含有[2.2.2]-环二氮辛烷环结构的异戊烯基吲哚生物碱。所包含的化合物家族包括malbrancheamides类、brevianamides类、chrysogenamides类、marcfortines类、paraherquamides类、asperparalines类、stephacidins类和notoamides类[8-11]。
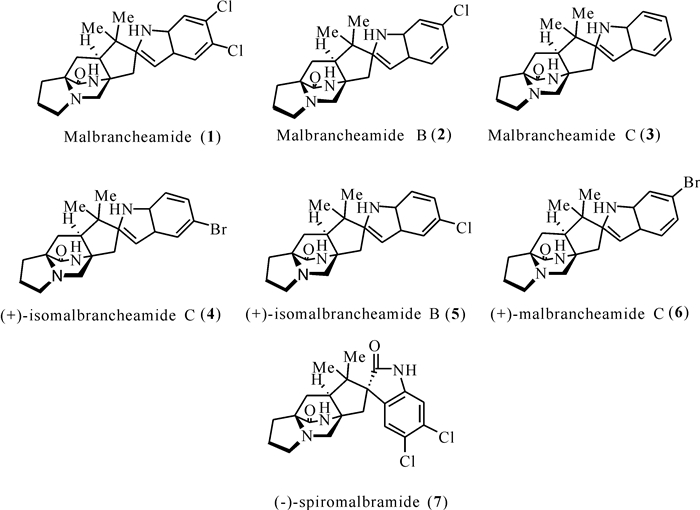
1 异戊烯基吲哚生物碱 1.1 Malbrancheamides类异戊烯基吲哚生物碱自2006年Martínez-luis等[12]首次从畸枝霉属Malbranchea中发现malbrancheamide和malbrancheamide B以来,到目前为止仅有7个天然来源malbrancheamides类化合物被发现[13-14]。Malbrancheamide和malbrancheamide B是从墨西哥洞穴蝙蝠鸟粪中的真菌Malbranchea aurantiaca RRC1813中分离得到的。在分离出malbrancheamide和malbrancheamide B后不久,Ding等[15]和Miller等[16]报道了malbrancheamide C的非卤化前体,后来被命名为premalbrancheamide。根据Watts等[17]的研究,(-)-spiromalbramide和(+)-isomalbrancheamide B来源于真菌Malbranchea graminicola,随后该菌株在富含溴盐的生长培养基培养,得到两个溴化类似物(+)-malbrancheamide C和(+)-isomalbrancheamide C (图 1)。
|
| 图 1 Malbrancheamides类化合物(1 — 7)的结构 Fig. 1 Structures of malbrancheamides (1 — 7) |
1.2 Brevianamides类异戊烯基吲哚生物碱
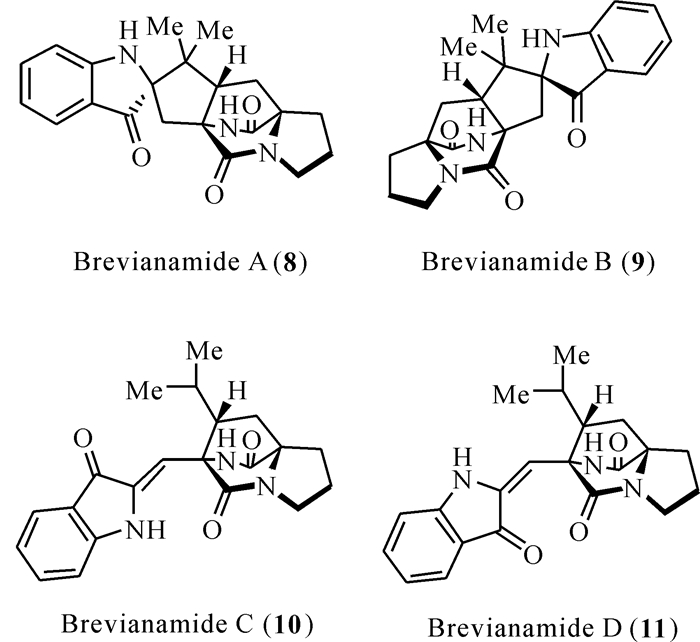
1969-1972年,研究者从Penicillium sp.中分离得到6个结构新颖的化合物[18-21],其中4个化合物brevianamides A-D含有独特的[2.2.2]-环二氮辛烷环结构。Brevianamide A主要来源于青霉菌P.brevicompactum和P.viridicatum。进一步研究发现brevianamide A和brevianamide B是一对非对映异构体,而brevianamide C和brevianamide D是在光照条件下合成的产物。在结构上,brevianamides类化合物的双环结构、螺-吲哚部分以及未经取代的吲哚环部分表现出反式构型。此外,brevianamide A和brevianamide D有非常显著的生物活性,对草地夜蛾(Spodoptera frugiperda)与烟芽夜蛾(Heliothis virescens)等鳞翅目昆虫的幼虫具有显著的抗虫活性(图 2)。
|
| 图 2 Brevianamides类化合物(8 — 11)的结构 Fig. 2 Structures of brevianamides (8 — 11) |
1.3 Chrysogenamides类异戊烯基吲哚生物碱
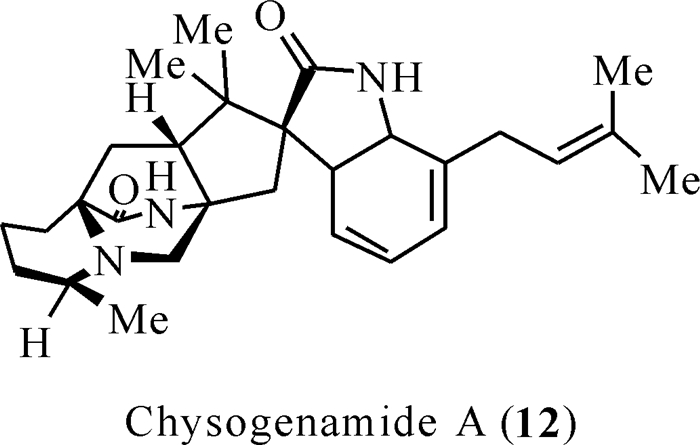
研究人员从沙漠植物肉苁蓉的根部筛选出3株对人神经母细胞瘤细胞(SH-SY5Y细胞)有神经保护作用的活性菌株[22-24],其中一株真菌菌株产黄青霉005号表现出明显的活性。经研究发现从产黄青霉005号中分离出的新型次级代谢产物chrysogenamide A[25](图 3)对神经系统有保护作用。从结构上看,这种新颖的次级代谢产物与马尔福丁密切相关,chrysogenamide A含有一个独特的[2.2.2]-环二氮辛烷环结构、一个螺-羟吲哚部分和一个具有C-17甲基化的哌啶酸单元。此外,chrysogenamide A在C-7吲哚位置上有异戊二烯单元所形成的桥环结构,显示出罕见的反式构型,与更常见的二噁英环和吡喃环相反。Chrysogenamide A是chrysogenamides类异戊烯基吲哚生物碱中第一个也是唯一的代谢产物,对神经细胞有保护作用,能防止氧化应激引起的神经细胞死亡。
|
| 图 3 Chrysogenamides类化合物(12) Fig. 3 Structures of chrysogenamides (12) |
1.4 Marcfortines类异戊烯基吲哚生物碱
1980年,Lin等[25]、Polonsky等[26]和Prange等[27]从青霉属Penicillium roqueforti中分离得到3个新的生物碱marcfortines A—C (图 4),青霉菌Penicillium roqueforti后来被命名为P.paneum,是一种用于生产多种蓝色奶酪的霉菌。从结构上看,这3个化合物均含有一个反式构型的[2.2.2]-环二氮辛烷环结构和一个单酮哌嗪环结构,结构上类似于chrysogenamides类化合物中的chrysogenamide A。此外,marcfortines A—C在C-6和C-7位置的吲哚环上均有取代基团,marcfortines A和B都含有一个二噁英环,而macfortine C含有一个半吡喃环。

|
| 图 4 Marcfortines类化合物(13 — 15)的结构 Fig. 4 Structures of marcfortines (13 — 15) |
1.5 Paraherquamides类异戊烯基吲哚生物碱
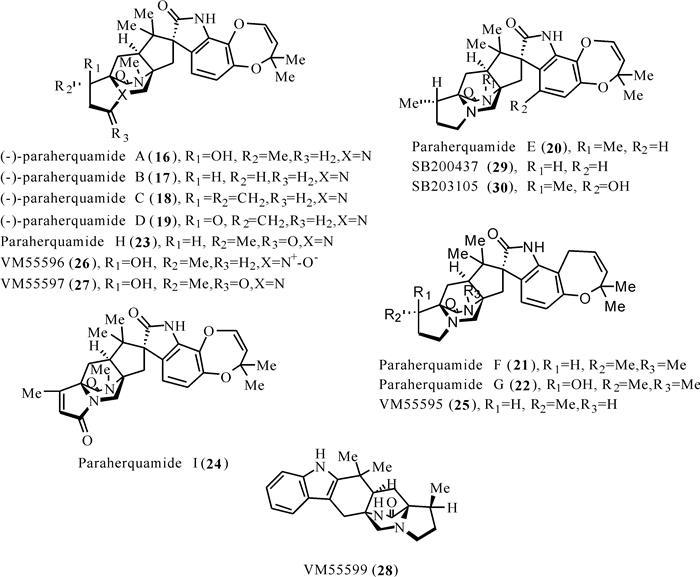
Paraherquamides类化合物是含有[2.2.2]-环二氮辛烷环结构的最大类群之一,首次从真菌Penicillium paraherquei中分离获得。Paraherquamide A是该类化合物中第一个被发现的,由Yamazaki等[28]分离所得,在随后的十几年间,先后报道了结构新颖的化合物paraherquamides B-I和化合物VM55595、VM55596、VM55597、VM55599、SB200437、SB203105[29-32]。在结构上,Paraherquamides类化合物虽然都含有[2.2.2]-环二氮辛烷环结构,但是这类化合物呈现出骨架多样性,例如paraherquamides不仅在脯氨酸环上而且在螺-羟吲哚部位上都有不同的取代和氧合,其中一些化合物还含有一个不寻常的二噁英环。在这类化合物家族中,只有VM55599和pre-paraherquamide这两个化合物不含螺-氧吲哚官能团或含氧吲哚环体系。这类化合物由于其强大的驱虫活性而引起人们的极大兴趣。随后的研究表明,paraherquamide A对抗广谱驱虫药的寄生虫株有效。然而,paraherquamide A被认为毒性太大,为减少毒性而又保持效力,科研人员合成几种paraherquamides类化合物的衍生物,并对其进行驱虫活性测定。其中,paraherquamide A的衍生物2-deoxyparaherquamide A,后来被命名为derquantel,在扭纹猴、钩球菌和雄性牡蛎模型中显示出显著的生物活性,同时又保持安全的毒性水平(图 5)。
|
| 图 5 Paraherquamides类化合物(16 — 30)的结构 Fig. 5 Structures of paraherquamides (16—30) |
1.6 Asperparalines类异戊烯基吲哚生物碱
1997年,Hayashi等[33]首次从真菌A.japonicus JV-23中分离得到含特殊桥环结构的吲哚生物碱类化合物asperparaline A,而在随后的研究中揭示产asperparalines类化合物的真菌为A.aculeatinus 和A.fijiensis。2000年,Hayashi等[34]从相同的真菌中再次发现两个新化合物asperparalines B和C。其中asperparalines A和B含有一个独特的β-甲基脯氨酸环,而asperparaline C是C-3-去甲基类似物。Asperparalines类化合物还包含一个独特的3-螺环-丁二酰亚胺环体系,取向与对位甲酰胺中存在的螺-羟吲哚环系统的相对构型一致。Asperparaline家族所有化合物都表现出某种形式的生物活性,asperparaline A在1 h内以10 μg/g饲料剂量对蚕有麻痹作用,经口给药后持续7-10 h,asperparalines B和C对蚕也显现出相同的作用[35-37](图 6)。
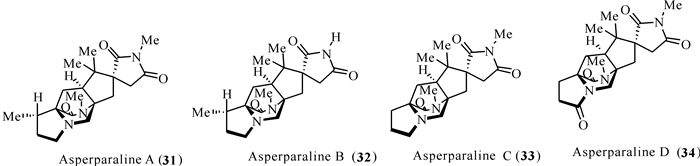
|
| 图 6 Paraherquamides类化合物(31—34)的结构 Fig. 6 Structures of paraherquamides (31—34) |
1.7 Stephacidins类异戊烯基吲哚生物碱
1999年,从陆地来源真菌Aspergillus ochraceus WC76466分离得到异戊烯基吲哚生物碱类化合物stephacidin A[38]和stephacidin B[39],从海洋来源真菌Aspergillus sp.CNC358和A .ochraceusCL41582中先后分离得到化合物avrainvillamide。这类化合物在结构上类似于paraherquamides类化合物,含有一个[2.2.2]-环二氮辛烷环、一个螺旋-氧化吲哚环、一个吡喃基以及一个未取代的脯氨酸环。但是,与paraherquamides类化合物不同的是,stephacidins类化合物保留了未还原的二氧哌嗪单元,并且还含有独特的C-10羟基。在生物活性方面,这些次生代谢产物具有杀虫、抗菌和细胞毒性的特性。Stephacidins A和B均显示出对人类多种肿瘤细胞系的细胞毒性,而stephacidin B表现出更有效和选择性的抗增殖活性,特别是对于睾丸激素依赖性LNCaP细胞[40-41](图 7)。
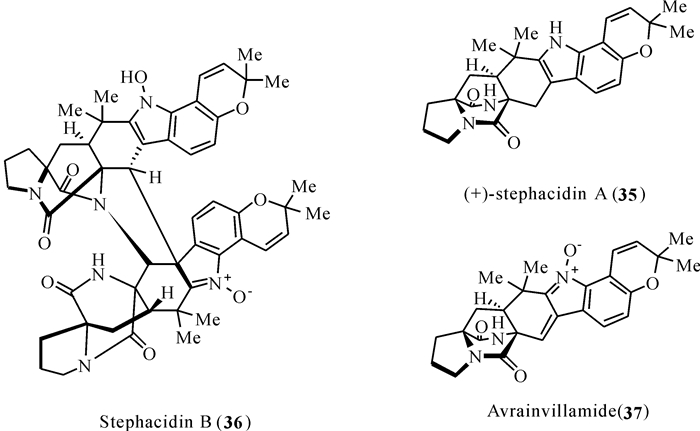
|
| 图 7 Stephacidins类化合物(35—37)的结构 Fig. 7 Structures of stephacidins (35 — 37) |
1.8 Notoamides类异戊烯基吲哚生物碱
2007年,Kato等[42]首次从一株海洋来源曲霉属真菌Aspergillus sp.MF297-2中发现4个具有细胞毒活性的新吲哚二酮哌嗪化合物notoamides A—D,菌株来源于日本石川县Note半岛海域采集到的贻贝Mytilus edulis样品。Notoamides A—D结构中含有吡喃吲哚环体系,其中notoamide A和notoamide B的结构中有特殊的[2.2.2]-环二氮辛烷环结构。从该菌株中也同时分离得到已知化合物notoamides E—R,部分化合物的结构中也有[2.2.2]-环二氮辛烷环结构。Notoamide O具有新颖的半缩醛/半缩醛胺酯结构,这类结构的产生代表着此类含异戊烯结构的吲哚生物碱在其生源途径中出现一个重要的氧化模式分歧点。在生物活性上,notoamides类化合物具有比较显著的生物活性,而结构上相关的norgeamides类异戊烯基吲哚生物碱都被证明能抑制多种癌症细胞系的生长,并且有不同的效果。初步生物学实验表明,notoamide A对几种癌细胞系的细胞毒性最大[43-48](图 8)。

|
| 图 8 Notoamides类化合物(38-47)的结构 Fig. 8 Structures of notoamides (38—47) |
2 展望
虽然从自然界分离到的含[2.2.2]-环二氮辛烷环结构的新颖二酮哌嗪类化合物种数在增加,但是目前的研究都还处于初级阶段,对其吸收、代谢机制、活性机制等方面还缺乏全面的认识,且还存在以下问题亟待解决:1)DKPs分子的生物合成路径;2)DKPs的吸收及代谢机制;3)随着研究的深入,许多学者发现二酮哌嗪类化合物可作为群体感应的诱导信号分子,并参与群体感应系统的调控,但对其作用机理还不明确。针对这些问题,今后应加强针对DKPs生物合成途径、吸收和代谢机制及群体感应调控机制等方面的工作。而随着科技的进步和研究的不断深入,真菌中产量丰富、结构独特、活性广泛的异戊烯基吲哚生物碱类化合物必将在药物先导化合物的发现中贡献更多的力量。
| [1] |
周荣丽, 穆军, 张翼, 等. 海洋真菌活性代谢产物最新研究进展[J]. 天然产物研究与开发, 2008, 20(4): 741-747. |
| [2] |
李庆欣, 史雪凤, 黄智, 等. 海洋真菌来源吲哚生物碱类化合物的结构和活性研究[J]. 热带海洋学报, 2013, 32(1): 35-47. |
| [3] |
YANG B, TAO H M, LIN X P, et al. Prenylated indole alkaloids and chromone derivatives from the fungus Penicillium sp.SCSIO041218[J]. Tetrahedron, 2018, 74(1): 77-82. |
| [4] |
吴世文, 杨盟权, 肖友利. 单萜吲哚生物碱的合成生物学研究进展[J]. 有机化学, 2018, 38(9): 2243-2258. |
| [5] |
陈越, 张青磊, 黄玉香, 等. 吲哚生物碱生物合成研究进展[J]. 世界科学技术-中医药现代化, 2016, 18(11): 1914-1920. |
| [6] |
WILLIAMS R M, STOCKING E M, SANZ-CERVERA J F, et al. Biosynthesis of prenylated alkaloids derived from Tryptophan[J]. Topics in Current Chemistry, 2000(209): 97-173. |
| [7] |
李文利, 夏娟. 二酮哌嗪类化合物生物合成研究进展[J]. 微生物学通报, 2014, 41(1): 111-121. |
| [8] |
杨加庚, 梅益勤, 裴月湖. 海洋真菌次级代谢产物化学成分及生物活性的研究进展[J]. 沈阳药科大学学报, 2013, 30(1): 72-82. |
| [9] |
KLAS K R, KATO H, FRISVAD J C, et al. Structural and stereochemical diversity in prenylated indole alkaloids containing the bicyclo[2.2.2] diazaoctane ring system from marine and terrestrial fungi[J]. Natural Product Reports, 2018, 35(6): 532-558. |
| [10] |
杨凯琳, 程文胜, 侯峰, 等. 海洋微生物次级代谢产物及其抑菌活性研究进展[J]. 中国海洋药物, 2013, 32(3): 71-81. |
| [11] |
FINEFIELD J M, FRISVAD J C, SHERMAN D H, et al. Fungal origins of the bicyclo[2.2.2] diazaoctane ring system of prenylated indole alkaloids[J]. Journal of Natural Products, 2012, 75(4): 812-833. |
| [12] |
MARTÍNEZ-LUIS S, RODRÁGUEZ R, ACEVEDO-A L, et al. Malbrancheamide, a new calmodulin inhibitor from the fungus Malbranchea aurantiaca[J]. Tetrahedron, 2006, 62(8): 1817-1822. |
| [13] |
LIN Z, WEN J, ZHU T, et al. Chrysogenamide a from an endophytic fungus associated with Cistanche deserticola and its neuroprotective effect on SH-SY5Y cells[J]. The Journal of Antibiotics, 2008, 61: 81-85. |
| [14] |
FIGUEROA M, GONZALES M, MATA R. Malbran-cheamides B and C, novel alkaloids from the fungus Malbranchea aurantiaca[J]. Planta Medica, 2008, 74(9): PB92. |
| [15] |
DING Y, GRESHOCK T J, MILLER K A, et al. Premalbrancheamide:Synthesis, isotopic labeling, biosynthetic incorporation, and detection in cultures of Malbranchea aurantiaca[J]. Organic Letters, 2008, 10(21): 4863-4866. |
| [16] |
MILLER K A, WELCH T R, GRESHOCK T J, et al. Biomimetic total synthesis of malbrancheamide and malbrancheamide B[J]. The Journal of Organic Chemistry, 2008, 73(8): 3116-3119. |
| [17] |
WATTS K R, LOVERIDGE S T, TENNEY K, et al. Utilizing DART mass spectrometry to pinpoint halogenated metabolites from a marine invertebrate-derived fungus[J]. The Journal of Organic Chemistry, 2011, 76(15): 6201-6208. |
| [18] |
BIRCH A J, WRIGHT J J. The brevianamides:A new class of fungal alkaloid[J]. Journal of the Chemical Society D:Chemical Communications, 1969(12): 644b-645. |
| [19] |
PATERSON R R M, SIMMONDS M S J, BLANEY W M. Mycopesticidal effects of characterized extracts of Penicillium isolates and purified secondary metabolites (including mycotoxins) on Drosophila melanogaster and Spodoptora littoralis[J]. Journal of Invertebrate Pathology, 1987, 50(2): 124-133. |
| [20] |
FRISVAD J C, RANK C, NIELSEN K F, et al. Metab-olomics of Aspergillus fumigatus[J]. Medical Mycology, 2009, 47: S53-S71. |
| [21] |
BARAN P S, HAFENSTEINER B D, AMBHAIKAR N B, et al. Enantioselective total synthesis of avrainvillamide and the stephacidins[J]. Journal of the American Chemical Society, 2006, 128(26): 8678-8693. |
| [22] |
HOUBRAKEN J, FRISVAD J C, SAMSON R A. Fle-ming's penicillin producing strain is not Penicillium chrysogenum but P.rubens[J]. IMA Fungus, 2011, 2: 87-95. |
| [23] |
FRISVAD J C, SMEDSGAARD J, LARSEN T O, et al. Mycotoxins, drugs and other extrolites produced by species in Penicillium subgenus Penicillium[J]. Studies in Mycology, 2004, 49: 201-241. |
| [24] |
FRISVAD J C, SAMSON R A. Polyphasic taxonomy of Penicillium subgenus Penicillium:A guide to identification of food and air-borne terverticillate Penicillia and their mycotoxins[J]. Studies in Mycology, 2004(49): 1-173. |
| [25] |
LIN Z, WEN J, ZHU T, et al. Chrysogenamide a from an endophytic fungus associated with Cistanche deserticola and its neuroprotective effect on SH-SY5Y cells[J]. The Journal of Antibiotics, 2008(61): 81-85. |
| [26] |
POLONSKY J, MERRIEN M A, PRANGÉ T, et al. Isolation and structure (X-ray analysis) of marcfortine A, a new alkaloid from Penicillium roqueforti[J]. Journal of the Chemical Society, Chemical Communications, 1980(13): 601-602. |
| [27] |
PRANGE T, BILLION M A, VUILHORGEN M, et al. Structures of marcfortine B and C (X-ray analysis), alkaloids from Penicillium roqueforti[J]. Tetrahedron Letters, 1981, 22(21): 1977-1980. |
| [28] |
YAMAZAKI M, OKUYAMA E, KOBAYASHI M, et al. The structure of paraherquamide, a toxic metabolite from Penicillium paraherquei[J]. Tetrahedron Letters, 1981, 22(2): 135-136. |
| [29] |
KAMINSKY R, BAPST B, STEIN P A, et al. Differences in efficacy of monepantel, derquantel and abamectin against multi-resistant nematodes of sheep[J]. Parasitology Research, 2011(109): 19-23. |
| [30] |
ONDEYKA J G, GOEGELMAN R T, SCHAEFFER J M, et al. Novel antinematodal and antiparasitic agents from Penicillium charlesii[J]. The Journal of Antibiotics, 1990, 43(11): 1375-1379. |
| [31] |
LÓPEZ-GRESA M P, GONZÁLEZ M C, CIAVATTA L, et al. Insecticidal activity of Paraherquamides, including paraherquamide H and paraherquamide I, two new alkaloids isolated from Penicillium cluniae[J]. Journal of Agricultural and Food Chemistry, 2006, 54(8): 2921-2925. |
| [32] |
BLANCHFLOWER S E, BANK R M, EVERETT J R, et al. Further novel metabolites of the paraherquaamide family[J]. The Journal of Antibiotics, 1993, 46(9): 1355-1363. |
| [33] |
HAYASHI H, NISHIMOTO Y, NOZAKI H. Asperparaline A, a new paralytic alkaloid from Aspergillus japonicus JV-23[J]. Tetrahedron Letters, 1997, 38(32): 5655-5658. |
| [34] |
HAYASHI H, NISHIMOTO Y, AKIYAMA K, et al. New paralytic alkaloids, asperparalines A, B and C, from Aspergillus japonicus JV-23[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(1): 111-115. |
| [35] |
LIESCH J M, WICHMANN C F J. Novel antinemato-dal and antiparasitic agents from Penicillium charlesii.Ⅱ.Structure determination of paraherquamides B, C, D, E, F, and G.[J]. The Journal of Antibiotics, 1990, 43(11): 1380-1386. |
| [36] |
NOONIM P, MAHAKARNCHANAKUL W, VARGA J, et al. Two novel species of Aspergillus section Nigri from Thai coffee beans[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(7): 1727-1734. |
| [37] |
PARENIKOVÁ L, SKOUBOE P, FRISVAD J C, et al. Combined molecular and biochemical approach identifies Aspergillus japonicus and Aspergillus aculeatus as two species[J]. Applied and Environmental Microbiology, 2001, 67(2): 521-527. |
| [38] |
QIAN-CUTRONE J, KRAMPITZ K D, SHU Y Z, et al. Stephacidin antitumor antibiotics[J]. US Patent, 2001(6): 291-461. |
| [39] |
QIAN-CUTRONE J, HUANG S, SHU Y Z, et al. Stephacidin A and B:Two structurally novel, selective inhibitors of the testosterone-dependent prostate LNCaP cells[J]. Journal of the American Chemical Society, 2002, 124(49): 14556-14557. |
| [40] |
MERCADO-MARIN E V, SARPONG R. Unified approach to prenylated indole alkaloids:Total syntheses of (-)-17-hydroxy-citrinalin B, (+)-stephacidin A, and (+)-notoamide I[J]. Chemical Science, 2015, 6(8): 5048-5052. |
| [41] |
KATO H, YOSHIDA T, TOKUE T, et al. Notoamides A-D:Prenylated indole alkaloids isolated from a marine-derived fungus Aspergillus sp.[J]. Angewandte Chemie International Edition, 2007, 46(13): 2254-2256. |
| [42] |
KATO H, YOSHIDA T, TOKUE T, et al. Notoamides A-D:Prenylated indole alkaloids isolated from a marine-derived fungus, Aspergillus sp.[J]. Angewandte Chemie International Edition, 2007, 46(13): 2254-2256. |
| [43] |
TSUKAMOTO S, KATO H, SAMIZO M, et al. Notoamides F-K, prenylated indole alkaloids isolated from a marine-derived Aspergillus sp.[J]. Journal of Natural Products, 2008, 71(12): 2064-2067. |
| [44] |
KAGIYAMA I, KATO H, NEHIRA T, et al. Taichunamides:Prenylated indole alkaloids from Aspergillus taichungensis (IBT 19404)[J]. Angewandte Chemie International Edition, 2016, 55(3): 1128-1132. |
| [45] |
KATO H, NAKAHARA T, SUGIMOTO K, et al. Isolation of notoamide S and enantiomeric 6-epi-stephacidin A from the fungus Aspergillus amoenus:Biogenetic implications[J]. Organic Letters, 2015, 17(3): 700-703. |
| [46] |
TSUKAMOTO S, KAWABATA T, KATO H, et al. Isolation of antipodal (-)-versicolamide B and notoamides L-N from a marine-derived Aspergillus sp.[J]. Organic Letters, 2009, 11(6): 1297-1300. |
| [47] |
TSUKAMOTO S, UMAOKA H, YOSHIKAWA K, et al. Notoamide O, a structurally unprecedented prenylated indole alkaloid, and notoamides P-R from a marine-derived fungus, Aspergillus sp.[J]. Journal of Natural Products, 2010, 73(8): 1438-1440. |
| [48] |
MCAFOOS T J, LI S, TSUKAMOTO S, et al. Studies on the biosynthesis of the stephacidins and notoamides[J]. Heterocycles, 2010, 82(1): 461-472. |



