2. 百色学院农业与食品工程学院, 广西百色 533000
2. College of Agriculture and Food Engineering, Baise University, Baise, Guangxi, 533000, China
华腺萼木Mycetia sinensis为茜草科多年生小灌木,是中国特有物种,为广西9种野生甜茶植物之一[1]。华腺萼木具有生津止渴、健身养颜的功效,可以开发成低能量、无毒、高甜度的天然甜味剂。甜茶类植物的化学成分研究表明,多糖和黄酮是甜茶类植物的主要有效成分。目前已经从其他品种的甜茶植物分离出多种糖类成分和黄酮类化合物,如从广西甜茶中分离出含有葡萄糖苷的化合物和丰富的黄酮类化合物[2-4],从多穗柯甜茶中分离鉴定出至少22种黄酮类成分和3种甜味成分[5-8]。许多研究表明,从甜茶类植物中分离出的黄酮类化合物具有抗衰老、抗氧化、降血压等多种药理功效[9],而多糖类化合物具有抗肿瘤、降血糖、降血脂等功效[10-12]。华腺萼木作为甜茶植物,在天然甜味剂开发和抗氧化药理功效等方面具有巨大的发展潜力。目前,华腺萼木的相关研究仅涉及形态学和植物组织培养方面[13-14],其他方面研究尚未展开。因此,本研究对华腺萼木总黄酮和总多糖的提取工艺进行研究,为有效开发华腺萼木这一天然甜茶资源提供理论指导。
1 材料与方法 1.1 材料供试材料:华腺萼木,于2018年10月采自广西植物研究所喀斯特药用植物园。取华腺萼木的茎和完整叶片,经过烘干、粉碎后过60目筛备用。
溶液:芦丁标准品、葡萄糖标准品、蒸馏水、苯酚、浓硫酸、乙醇、5%NaNO2、4%NaOH、10%Al(NO3)3,均为分析纯。
1.2 仪器TU-1901型双光束紫外可见分光光度计,ESJ200-4A和AE200型电子分析天平,DL-720E智能超声波清洗器,TGL-10B型高速台式离心机,B-260型恒温水浴锅。
1.3 方法 1.3.1 华腺萼木总黄酮提取工艺优化 1.3.1.1 华腺萼木总黄酮的标准曲线加水将配制好的芦丁标准品分别稀释成浓度为0.2, 0.4, 0.6, 0.8, 1.0, 1.2 mg·mL-1的芦丁溶液,备用。吸取不同浓度的芦丁溶液,置于25 mL容量瓶中,标记0-6号。加入1 mL的5% NaNO2溶液,摇匀,室温下放置6 min,加入1 mL 5% Al(NO3)3溶液,摇匀。再放置6 min之后加入10 mL的4% NaOH溶液,用30%乙醇定容,摇匀,静置15 min。在190-900 nm处进行光谱扫描后选用510 nm作为检测波长[15-16]。以吸光值为纵坐标(y),总黄酮浓度为横坐标(x),得标准曲线回归方程y=13.438x+0.0008 (R2=0.990 8)。在510 nm波长下测定芦丁标准品溶液的吸光值。
1.3.1.2 华腺萼木总黄酮的提取工艺称取华腺萼木粉末0.2 g,加入乙醇,水浴条件下超声波萃取,萃取结束后静置10 min,用高速冷冻离心机进行固液分离,取上清液定容至50 mL后取1 mL移至25 mL容量瓶中二次定容,按照1.3.1.1节的方法测定吸光值。根据1.3.1.1节的标准曲线方程求得样品的总黄酮含量,再根据下列方程计算总黄酮得率。公式中C为提取液中总黄酮的含量(mg/mL),V为提取液体积(mL),M为样品粉末质量(g)。
| $ \text { 总黄酮得率 }(\%)=C \times(V / M) \times 100 \% 。$ |
在超声波频率为低频(53 kHz)状态下,分别研究不同因素对华萼腺木总黄铜得率的影响。除提取条件不同外,试验过程均与1.3.1.2节的提取工艺相同。具体提取条件设置如下:
(1) 不同超声波功率:60,180,300,420,540 W;提取时间30 min,水浴温度60℃,料液比1:70,乙醇浓度40%。(2)不同料液比:1:60、1:70、1:80、1:90、1:100 (g:mL);提取时间30 min,水浴温度60℃,乙醇浓度40%,超声波功率300 W。(3)不同乙醇浓度:20%、40%、60%、80%、100%,提取时间30 min,水浴温度60℃,料液比1:70,超声波功率300 W。(4)不同提取温度(水浴温度):40,50,60,70,80℃,提取时间30 min,料液比1:70,乙醇浓度40%,超声波功率300 W。(5)不同提取时间:10,30,50,70,90 min,水浴温度60℃,料液比1:70,乙醇浓度40%,超声波功率300 W。
1.3.1.4 响应面试验设计参考其他甜茶类植物总黄酮提取的响应面优化试验设计[4, 11-12],结合华腺萼木总黄酮的单因素试验结果,选取功率(A)、料液比(B)、乙醇浓度(C)及提取时间(D)为因素,采用Box-Behnken试验设计,通过Design-Expert 8.0.6软件分析试验结果,因素及水平见表 1。
| 水平 Levels |
因素Fators | |||
| A:超声波功率 A:Ultrasonic power (W) |
B:料液比 B:Ratio of material and liquid (g:mL) |
C:乙醇浓度 C:Ethanol concentration (%) |
D:提取时间 D:Extraction time (min) |
|
| -1 | 180 | 1:80 | 60 | 30 |
| 0 | 300 | 1:90 | 80 | 50 |
| 1 | 420 | 1:100 | 100 | 70 |
1.3.2 华腺萼木总多糖提取工艺优化 1.3.2.1 华腺萼木总多糖标准曲线的绘制
精密称量无水葡萄糖标准品0.1 g,加蒸馏水定容,配成1.0 mg/mL的标准品溶液,再分别取2.5,5.0,10.0,15.0,20.0 mL,置于棕色瓶定容至100 mL,摇匀,即为葡萄糖标准品溶液。采用苯酚-硫酸法测定吸光值,以吸光值为纵坐标(y),总多糖浓度为横坐标(x),得到标准曲线的线性回归方程y=8.778x-0.0195, R2=0.999 1。
1.3.2.2 华腺萼木总多糖提取工艺及其含量测定总多糖提取工艺与总黄酮提取工艺相似,包括以下步骤:称取烘干后的华腺萼木粉末0.2 g,进行单因素试验,然后利用响应面试验优化提取工艺,得到多糖粗提液,将其用乙醇进行沉淀,测定总多糖含量。总多糖含量测定采用苯酚-硫酸法,步骤如下:取总多糖提取液1 mL于试管中,加入1 mL 5%苯酚溶液,摇匀,快速加入5 mL浓硫酸,振荡4 min后室温下放置30 min,然后于490 nm波长下测其吸光值。将吸光值代入1.3.2.1节的总多糖浓度标准曲线方程,计算得总多糖浓度[17]。再根据以下方程,计算总多糖得率:
| $ \begin{aligned} &\text { 总多糖得率 }(\%)=C \times V \times(\text { 稀释倍数 } / M) \times\\ &100 \%, \end{aligned} $ |
其中,C为测得的总多糖浓度(mg/mL),V为提取液体积(mL),M是原料的干重(g)。
1.3.2.3 总多糖单因素试验设计在超声波频率为低频(53 kHz)状态下,分别研究不同因素对华萼腺木总多糖得率的影响。(1)不同超声功率:120,240,360,480,600 W,提取时间30 min,提取温度60℃;(2)不同提取温度:40,50,60,70,80℃,超声波功率240 W,提取时间30 min;(3)不同提取时间:90,120,150,180,210 min,超声波功率240 W,提取温度70℃。因为不同料液比进行多次试验均呈显著性差异,所以本研究不对料液比进行单因素试验。
1.3.2.4 华腺萼木多糖响应面试验设计参考两种茶总多糖的响应面设计试验[18-19],结合本研究的单因素试验结果,利用Box-Behnken设计,选择超声波功率、提取温度、提取时间作为响应因子,以华腺萼木总多糖提取量为响应值,设计3因素3水平的响应面分析。试验因素水平设计见表 2。
| 水平 Levels |
因素Fators | ||
| A:提取时间 A:Extraction time (min) |
B:超声波功率 B:Ultrasonic power (W) |
C:提取温度 C:Extraction temperature (℃) |
|
| -1 | 150 | 120 | 60 |
| 0 | 180 | 240 | 70 |
| 1 | 210 | 360 | 80 |
2 结果与分析 2.1 华萼腺木总黄酮提取工艺优化 2.1.1 单因素试验结果
超声波功率对华腺萼木总黄酮提取的影响(图 1a):当超声波功率小于300 W时,总黄酮得率随着超声波功率的增加而逐渐增大,超声波功率为300 W时达到最大值2.24%,随后逐渐降低。原因可能是超声波功率较小时体系中溶解的总黄酮量较小,加大超声波功率能使更多的总黄酮溶出,但是当总黄酮溶出达到体系饱和值时,加大超声波的功率则会使更多杂质溶出,从而影响黄酮得率,所以选取超声波功率为300 W。

|
| 图 1 超声波功率(a)、料液比(b)、提取时间(c)、乙醇浓度(d)和提取温度(e)对总黄酮得率的影响 Fig. 1 Effects of ultrasonic power (a), ratio of material and liquid (b), extraction time (c), ethanol concentration (d) and temperature (e) on total flavonoids yield |
料液比对华腺萼木总黄酮提取的影响(图 1b):在料液比为1:90时,总黄酮得率达到最大值2.52%,但料液比继续增大后,总黄酮得率开始下降,原因可能是料液比小于1:90时,体系内少量溶剂无法将华腺萼木粉末完全浸湿导致其中的总黄酮溶出不完全,而当料液比达到1:90后,体系中的总黄酮溶出完全,之后总黄酮得率降低原因是体系中含有的过量乙醇会导致总黄酮损失,导致总黄酮得率下降,所以选取料液比为1:90。
提取时间对华腺萼木总黄酮提取的影响(图 1c):提取时间在10—50 min时,华腺萼木的总黄酮得率随提取时间增加而增大,在50 min时达到最大值2.24%,随后总黄酮得率逐渐降低。原因可能是时间过长超声波的空化效应和热效应[20]破坏了华腺萼木总黄酮结构的稳定性,导致总黄酮得率降低,所以选取提取时间为50 min。
乙醇浓度对华腺萼木总黄酮提取率的影响(图 1d):乙醇浓度为20%-80%时,总黄酮得率随着乙醇浓度的增加而增大,在乙醇浓度达到80%时达到最大值2.23%,随后总黄酮得率开始降低。原因可能是在60%—80%乙醇浓度条件下,华腺萼木总黄酮已经大部分溶出,如果乙醇体积分数过高,过量乙醇会将华腺萼木中的其他杂质成分溶出,导致总黄酮得率下降[21],所以选取乙醇浓度为70%。
提取温度对华腺萼木总黄酮提取的影响(图 1e):在40-60℃时,总黄酮得率随着提取温度增加逐渐增大,在60℃时达到最大值1.97%,随后温度升高,总黄酮得率逐渐下降。原因可能是前期随着温度升高,分子运动加速,细胞破裂加快有利于总黄酮的溶出,而60℃后继续升高温度,过高温度会破坏总黄酮的结构[22],造成提取率下降,所以选取提取温度为60℃。
2.1.2 响应面优化总黄酮提取工艺 2.1.2.1 响应面试验设计及响应值根据单因素试验结果,选取超声波功率、料液比、乙醇浓度和提取时间作为响应面设计的因变量,设计4因素3水平响应面试验,共计29个试验点(其中有5个零点),计算29个试验点的总黄酮得率(表 3)。
| 试验号 Test number |
因素Factors | 总黄酮得率 Total flavonoids yield (%) |
|||
| A:超声波功率 A:Ultrasonic power |
B:料液比 B:Ratio of material and liquid |
C:乙醇浓度 C:Ethanol concentration |
D:提取时间 D:Extraction time |
||
| 1 | 0 | 0 | 0 | 0 | 2.09 |
| 2 | -1 | -1 | 0 | 0 | 1.67 |
| 3 | 0 | 1 | -1 | 0 | 1.51 |
| 4 | 0 | 1 | 0 | -1 | 1.75 |
| 5 | 0 | -1 | -1 | 0 | 1.37 |
| 6 | 0 | 0 | 1 | -1 | 1.07 |
| 7 | 1 | 1 | 0 | 0 | 1.53 |
| 8 | 1 | 0 | -1 | 0 | 1.45 |
| 9 | -1 | 0 | 0 | 1 | 1.53 |
| 10 | 0 | -1 | 0 | 1 | 1.72 |
| 11 | 0 | 1 | 1 | 0 | 1.14 |
| 12 | 0 | 0 | 1 | 1 | 1.07 |
| 13 | 0 | 0 | 0 | 0 | 2.01 |
| 14 | -1 | 0 | 0 | -1 | 1.52 |
| 15 | 0 | 1 | 0 | 1 | 1.94 |
| 16 | 1 | 0 | 1 | 0 | 1.00 |
| 17 | -1 | 0 | 1 | 0 | 1.09 |
| 18 | 1 | 0 | 0 | 1 | 1.80 |
| 19 | -1 | 1 | 0 | 0 | 1.94 |
| 20 | -1 | 0 | -1 | 0 | 1.38 |
| 21 | 0 | 0 | -1 | 1 | 1.39 |
| 22 | 0 | -1 | 1 | 0 | 1.06 |
| 23 | 0 | 0 | 0 | 0 | 2.06 |
| 24 | 0 | 0 | 0 | 0 | 2.05 |
| 25 | 0 | -1 | 0 | -1 | 1.54 |
| 26 | 0 | 0 | -1 | -1 | 1.54 |
| 27 | 1 | -1 | 0 | 0 | 1.67 |
| 28 | 0 | 0 | 0 | 0 | 1.97 |
| 29 | 1 | 0 | 0 | -1 | 1.59 |
2.1.2.2 响应面模型的建立及分析
用Design-Expert 8.0.6软件拟响应面优化分析试验数据,得到华萼腺木总黄酮提取物的回归方程为Y=2.04-0.0075A+0.065B-0.18C+0.037D-0.1AB-0.04AC+0.05AD-0.015BC+0.0025BD+0.038371CD-0.22A2-0.13B2-0.61C2-0.18D2。
响应面回归方程不同系数的绝对值代表不同响应因子对响应值的影响程度[23-24]。对响应模型进行显著性分析可知(表 4),回归模型极显著(P < 0.01),失拟项不显著(P>0.05),矫正系数R2adj=0.910 9, 相关系数R2=0.955 5,说明模型拟合效果较好,试验值与拟合值具有高度相关性,可见该模型可以用于对华腺萼木总黄酮得率的准确预测和分析。一次项B、C和二次项A2、B2、C2具有显著性,交互项不具显著性。
| 方差来源 Source of variance |
平方和 Sum of squares |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significant |
| 模型 Model |
2.99 | 14 | 0.21 | 21.56 | < 0.000 1 | ** |
| A:超声波功率 A:Ultrasonic power |
0.000 675 | 1 | 0.000 675 | 0.068 | 0.742 1 | |
| B:料液比 B:Ratio of material and liquid |
0.051 | 1 | 0.051 | 5.12 | 0.040 6 | * |
| C:乙醇浓度 C:Ethanol concentration |
0.41 | 1 | 0.41 | 41.06 | < 0.000 1 | ** |
| D:提取时间 D:Extraction time |
0.016 | 1 | 0.016 | 1.63 | 0.222 8 | |
| AB | 0.042 | 1 | 0.042 | 4.24 | 0.058 6 | |
| AC | 0.007 | 1 | 0.007 | 0.65 | 0.435 1 | |
| AD | 0.009 | 1 | 0.009 | 1.01 | 0.332 2 | |
| BC | 0.008 | 1 | 0.008 | 0.091 | 0.767 6 | |
| BD | 0.009 | 1 | 0.009 | 0.002 52 | 0.960 7 | |
| CD | 0.006 | 1 | 0.006 | 0.57 | 0.436 7 | |
| A2 | 0.30 | 1 | 0.31 | 30.63 | < 0.000 1 | ** |
| B2 | 0.11 | 1 | 0.11 | 11.50 | 0.004 4 | ** |
| C2 | 2.38 | 1 | 2.38 | 238.62 | < 0.000 1 | ** |
| D2 | 0.21 | 1 | 0.21 | 21.22 | 0.000 4 | |
| 残项 Residual |
0.14 | 14 | 0.01 | |||
| 失拟项 Lack of fit |
0.13 | 10 | 0.013 | 5.97 | 0.054 9 | |
| 纯误差 Pure error |
0.009 | 4 | 0.002 | |||
| 总差 Total deviation |
3.13 | 28 | ||||
| 注:*表示具有显著性,P<0.05;**表示具有极显著性,P<0.01 Note: * means significant, P < 0.05; ** means very significant, P < 0.01 | ||||||
2.1.2.3 响应面交互因素分析
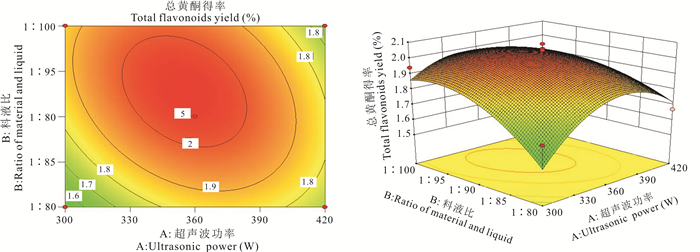
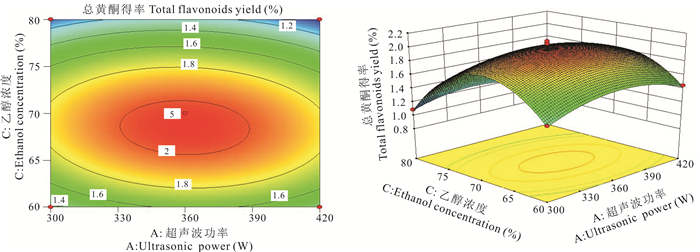
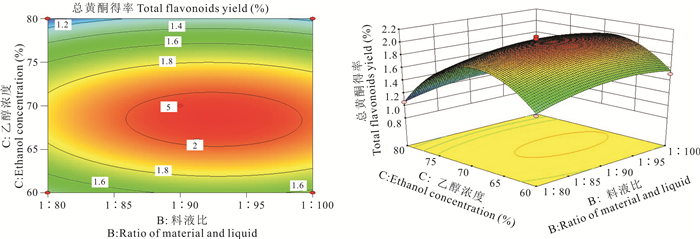
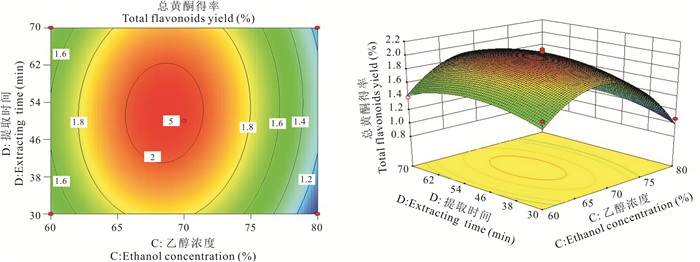
利用Design-Expert 8.0.6软件做出相应因素之间的交互作用分析图(图 2-6)。交互作用响应曲面图的坡度反应各交互因素对总黄酮得率的影响程度,坡度越大,说明交互作用的影响越大。AB、AC、BC、BD和AD交互项间的等高线均为椭圆形,说明其交互作用不具显著性,与表 4相符。分析图 2-6交互项间的陡峭程度可知,各影响因素的影响程度大小分别为B>A、C>A、C>B、A>D。因此这4个影响因素对总黄酮得率的影响大小分别为C>B>A>D,即乙醇浓度>料液比>超声波功率>提取时间。
|
| 图 2 交互作用AB对总黄酮得率的影响 Fig. 2 Effect of interactive AB on total flavonoids yield |
|
| 图 3 交互作用AC对总黄酮得率的影响 Fig. 3 Effect of interactive AC on total flavonoids yield |

|
| 图 4 交互作用AD对总黄酮得率的影响 Fig. 4 Effect of interactive AD on total flavonoids yield |
|
| 图 5 交互作用BC对总黄酮得率的影响 Fig. 5 Effect of interactive BC on total flavonoids yield |
|
| 图 6 交互作用CD对总黄酮得率的影响 Fig. 6 Effect of interactive CD on total flavonoids yield |
2.1.2.4 优化工艺验证试验结果
为获得最佳的提取工艺,继续采用Design-Expert 8.0.6对上述模型进行进一步分析,得到华腺萼木总黄酮提取工艺条件为超声功率291.6 W,料液比1:95.6,乙醇浓度77%,提取时间51.2 min,预测黄酮提取率为2.48%。根据实际操作的可行性将工艺条件调整为超声波功率为300 W,料液比1:95,乙醇浓度75%,提取时间50 min,在该工艺条件下进行5次重复性验证试验,得到修改后工艺的总黄酮得率为2.36%,可见,响应面拟合模型预测结果与试验结果较为接近,说明华腺萼木总黄酮提取工艺可以通过响应面法进行优化。
2.2 华腺萼木总多糖提取工艺优化 2.2.1 单因素试验结果超声波功率、提取温度和提取时间对华腺萼木总多糖提取的影响如图 7所示。在试验范围内,华腺萼木总多糖得率随超声波功率增大呈现先升高-降低-升高的趋势,在超声波功率为240 W时,总多糖得率达到最大值71.19%,随后降低(图 7a)。先升后降的原因可能是超声波功率增大有利于总多糖从溶液中溶出,但超声波功率过大时会导致其他的物质溶出,从而影响体系中的总多糖含量。
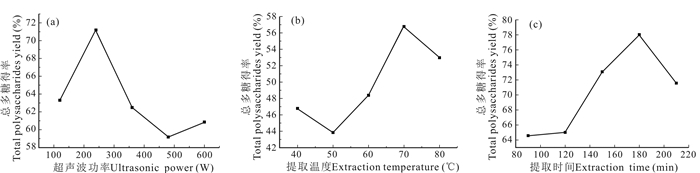
|
| 图 7 超声波功率(a)、提取温度(b)和提取时间(c)对总多糖得率的影响 Fig. 7 Effect of ultrasonic power (a), extraction temperature (b) and extraction time (c) on total polysaccharides yield |
华腺萼木总多糖得率在提取温度试验范围内呈现降低-升高-降低的趋势(图 7b),提取温度为70℃时总多糖得率达到最大值56.77%。在温度为40—50℃时,总多糖得率降低,原因可能是一开始体系中能溶解出较多的总多糖类物质,其他物质溶解得较少,当温度升高到50℃时其他物质溶解量增加,导致总多糖含量减少。随后温度上升,总多糖溶解增加,体系中总多糖含量增加。提取温度大于70℃后,温度过高导致体系中的多糖分子结构受损,总多糖含量降低。
华腺萼木总多糖得率在提取时间试验范围内呈现先增加后降低的趋势(图 7c),在提取时间为180 min时达到最大值78.03%,随后降低。原因可能是随着浸提时间增长,多糖分子被破坏和水解,同时也使一些水溶性杂质溶出,致使总多糖含量降低。
综上,选取超声功率240 W、提取温度70℃、提取时间180 min进行响应面优化试验。
2.2.2 响应面优化华腺萼木总多糖提取工艺 2.2.2.1 响应面设计及响应值根据单因素试验结果,选择提取时间、超声波功率和提取温度为自变量、华萼腺木总多糖提取率为响应值,通过Box-Benhnken进行试验设计优化华萼腺木总多糖提取工艺。利用Design-Expert 8.0.6软件分析实验结果(表 5)。
| 试验号 Test number |
因素Factors | 总多糖得率 Total polysaccharides yield (%) |
||
| A | B | C | ||
| 1 | 0 | -1 | -1 | 73.75 |
| 2 | 1 | -1 | 0 | 60.43 |
| 3 | 0 | 0 | 0 | 79.81 |
| 4 | -1 | -1 | 0 | 60.19 |
| 5 | 1 | 0 | -1 | 71.47 |
| 6 | 0 | 1 | 1 | 76.71 |
| 7 | -1 | 0 | 1 | 72.17 |
| 8 | 0 | 0 | 0 | 80.70 |
| 9 | -1 | 1 | 0 | 67.58 |
| 10 | 1 | 0 | 1 | 73.29 |
| 11 | 0 | 0 | 0 | 81.17 |
| 12 | 0 | -1 | 1 | 75.02 |
| 13 | 0 | 1 | -1 | 74.04 |
| 14 | 0 | 0 | 0 | 82.92 |
| 15 | -1 | 0 | -1 | 69.21 |
| 16 | 1 | 1 | 0 | 68.28 |
| 17 | 0 | 0 | 0 | 82.54 |
2.2.2.2 响应面模型的建立及分析
根据试验数据,利用Design-Expert 8.0.6软件拟合得到华萼腺木总多糖提取物的回归方程为Y=81.43+0.54A+2.15B+1.09C+0.11AB-0.28AC+0.35BC-10.33A2-9.68B2+0.43C2。
对响应模型进行显著性分析(表 6),模型具极显著性(P < 0.01),说明模型具有意义,失拟项不显著(P>0.05),说明模型理论值与试验值差异较小;R2adj=0.912 3,说明模型能解释91.23%的响应值的变化;相关系数R2=0.961 6,说明模型拟合效果较好,可以用方程代替试验结果进行预测和分析。一次项A达到显著水平,二次项A2和B2达到极显著水平,交互项未达到显著水平。
| 方差来源 Source of variance |
平方和 Sum of square |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significant |
| 模型 Model |
739.03 | 9 | 82.11 | 19.49 | 0.004 | ** |
| A | 2.33 | 1 | 2.332 8 | 0.55 | 0.481 0 | |
| B | 37.06 | 1 | 37.06 | 8.80 | 0.020 9 | * |
| C | 9.50 | 1 | 9.50 | 2.26 | 0.176 8 | |
| AB | 0.05 | 1 | 0.05 | 0.016 | 0.913 9 | |
| AC | 0.32 | 1 | 0.32 | 0.08 | 0.789 3 | |
| BC | 0.49 | 1 | 0.49 | 0.12 | 0.743 1 | |
| A2 | 449.00 | 1 | 449.00 | 106.59 | < 0.000 1 | ** |
| B2 | 205.23 | 1 | 205.23 | 48.72 | 0.000 2 | ** |
| C2 | 0.79 | 1 | 0.79 | 0.18 | 0.68 | |
| 残项 Residual |
29.49 | 1 | 4.21 | 0.55 | 0.48 | |
| 失拟项 Lack of fit |
22.81 | 3 | 7.60 | 4.56 | 0.088 7 | |
| 纯误差 Pure error |
6.68 | 4 | 1.67 | |||
| 总差 Total deviation |
768.52 | 16 | ||||
| 注:*表示具有显著性,P<0.05;**表示具有极显著性,P<0.01 Note: * means significant, P < 0.05; ** means very significant, P < 0.01 | ||||||
2.2.2.3 响应面交互因素分析
利用Design-Expert 8.0.6软件做出总多糖相应因素之间的交互作用分析图(图 8-10)。由图 8可知,当提取温度为70℃时,总多糖得率随提取时间和超声波功率的增加呈现先增后减的趋势,从曲面的陡峭度来看,提取时间对总多糖得率的影响大于超声波功率。由图 9可知,当超声波功率为240 W时,总多糖得率随提取时间和提取温度增加呈现先增后减的趋势,但坡度较小,从曲面陡峭度来看,提取时间的曲面稍微比提取温度陡峭一点,可见提取时间对总多糖得率的影响稍大于提取温度。由图 10可知,当提取时间为180 min时,总多糖得率随超声波功率和提取温度呈现先增后减的趋势,但坡度较小,从曲面陡峭度来看,提取温度对总多糖得率的影响大于超声波功率。因此,各因素对华腺萼木总多糖得率的影响强弱顺序为提取时间>超声波功率>提取时间。
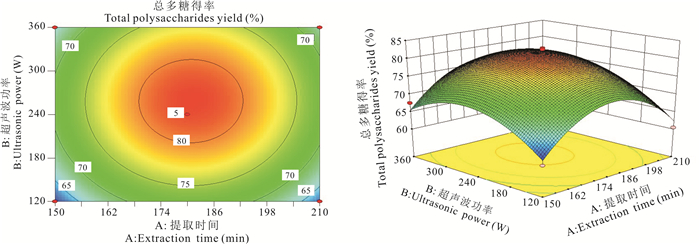
|
| 图 8 交互作用AB对总多糖得率的影响 Fig. 8 Effect of interactive AB on total polysaccharides yield |
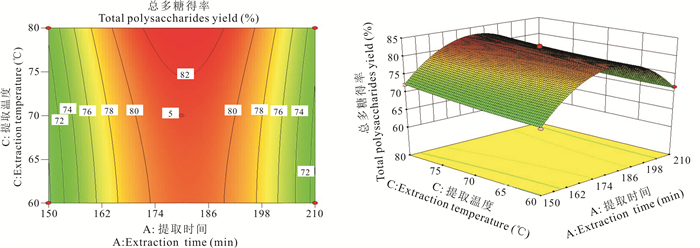
|
| 图 9 交互作用AC对总多糖得率的影响 Fig. 9 Effect of interactive AC on total polysaccharides yield |

|
| 图 10 交互作用BC对总多糖得率的影响 Fig. 10 Effect of interactive BC on total polysaccharides yield |
2.2.2.4 优化工艺验证试验结果
为获得最佳的总多糖提取工艺,继续采用Design-Expert 8.0.6对上述模型进行进一步分析,得到华腺萼木总多糖提取工艺条件为时间180.1 min,功率261.1 W,温度80℃,此时华腺萼木总多糖提取率的理论值为83.18%。根据实际操作的可行性将工艺条件修改为提取时间180 min,功率250 W,温度80℃,此工艺条件下重复试验5次,结果平均提取率为82.77%。试验表明,通过响应面优化得到最佳工艺的华腺萼木总多糖提取率,与最佳工艺条件下的理论值相差较小,说明响应面法优化的提取工艺适用于华腺萼木总多糖提取。
3 结论水提法、醇提法、酶解法和超声波法等提取方法对不同植物的总黄酮和总多糖提取效果具有显著性差异。不同种植物采用相同的提取工艺也会产生显著性差异,同种植物的总黄酮和总多糖的提取采用相同的方法进行提取,不同因素间的作用也不同。本研究采用单因素试验分析不同因素对华腺萼木总黄酮和总多糖提取的影响,发现两种物质所需要的条件不同,总黄酮提取的最佳单因素为超声波功率300 W,料液比1:90,乙醇浓度70%,提取时间50 min,提取温度60℃;总多糖提取的最佳单因素为超声波功率240 W,温度70℃,时间180 min。总多糖提取比黄酮提取工艺需要花费更长的时间,总多糖溶解所需的温度高于总黄酮,但超声波功率低于总黄酮。根据最佳因素设计响应面优化总黄酮提取和总多糖提取工艺,总黄酮提取工艺各因素间的影响力大小依次为乙醇浓度>料液比>超声波功率>提取时间,总多糖提取工艺各因素间的影响力大小依次为提取时间>超声波功率>提取温度,同种因素如提取时间对总黄酮提取的影响较小,而对总多糖提取的影响较大。通过单因素和响应面分析及操作的可行性最终确定总黄酮提取的最佳工艺为超声波功率300 W,料液比1:95,乙醇浓度75%,提取时间50 min,此时总黄酮得率为2.36%(理论值为2.48%);总多糖提取的最佳工艺为提取时间180 min,功率250 W,温度80℃,此时总多糖得率为82.77%(理论值为83.18%)。由此可见用响应面法优化华腺萼木总黄酮和总多糖的提取工艺,结果与理论值相差较小,表明利用响应面优化华腺萼木总黄酮和总多糖提取工艺的方法是可行的,可以为华腺萼木总黄酮和总多糖的进一步研究提供理论依据,为华腺萼木资源的开发提供技术支撑。
| [1] |
韦家福, 黄燮才. 广西甜茶原植物的鉴定[J]. 中药材, 1996, 19(1): 16-17. |
| [2] |
王剑霞, 吕华冲. 广西甜茶化学成分的研究[J]. 中药材, 2007, 30(7): 800-802. |
| [3] |
谭冬明, 石相莉, 罗星晔, 等. 广西甜茶化学成分、提取工艺及生物活性研究进展[J]. 中成药, 2017, 39(6): 1252-1255. |
| [4] |
闫志刚, 蒙淑洁, 韦荣昌, 等. 广西甜茶研究与应用现状[J]. 中草药, 2017, 48(12): 2572-2578, 2588. |
| [5] |
何春年, 彭勇, 肖伟, 等. 多穗柯甜茶的研究进展[J]. 时珍国医国药, 2012, 23(5): 1253-1255. |
| [6] |
杨大坚, 钟炽昌, 肖倬殷. 甜茶化学成分研究Ⅱ.黄酮类成分[J]. 中草药, 1991, 22(5): 198-201, 239. |
| [7] |
杨大坚, 钟炽昌, 肖倬殷. 甜茶化学成分研究Ⅰ.甜味成分[J]. 中草药, 1991, 22(3): 99-101, 143. |
| [8] |
李胜华, 伍贤进, 曾军英, 等. 多穗柯中黄酮类成分研究[J]. 中草药, 2010, 41(12): 1967-1969. |
| [9] |
高雅, 陈新梅, 赵元, 等. Box-Behnken响应面法优化昆仑雪菊总黄酮提取工艺及抗氧化研究[J]. 现代中药研究与实践, 2019, 33(5): 54-61. |
| [10] |
陈海芳, 舒昀, 张琛, 等. 中药及天然产物中酶抑制剂筛选的研究现状[J]. 中国新药杂志, 2018, 27(14): 1619-1624. |
| [11] |
张晓寒, 张程慧, 于文睿, 等. 药食同源类植物多糖降血糖功效的研究进展[J]. 食品安全质量检测学报, 2018, 9(14): 3699-3705. |
| [12] |
郭浩杰, 杨严格, 安乐, 等. 中药多糖的分子修饰及其药理活性研究进展[J]. 中草药, 2015, 46(7): 1074-1080. |
| [13] |
陆永林, 梁月群, 陈正华, 等. 华腺萼木形态发生研究初报[J]. 遗传, 1989, 11(2): 9. |
| [14] |
唐君海. 华腺萼木组织培养的简化[J]. 广西热作科技, 1998(1): 9-11. |
| [15] |
袁思文, 刘育辰, 刘刚, 等. 单因素试验结合Box-Behnken设计-响应面法优化甘草中黄酮类成分的提取工艺[J]. 中国药房, 2019, 30(3): 355-359. |
| [16] |
唐健民, 朱成豪, 高丽梅, 等. 响应面法优化多穗石柯总黄酮提取工艺及抗氧化活性研究[J]. 安徽农业科学, 2020, 48(1): 181-185. |
| [17] |
万阅, 齐计英, 曾红, 等. 响应面法优化香菇多糖的超声辅助提取工艺[J]. 生物技术通报, 2015, 31(1): 79-85. |
| [18] |
曾桥, 韦承伯, 韩国锋, 等. 桑叶茯砖茶多糖的响应面提取工艺优化及其体外抗氧化降血脂作用[J]. 食品工业科技, 2018, 39(18): 193-200. |
| [19] |
杨宇平, 许良, 徐春娜, 等. 响应面法优化提取安吉白茶多糖工艺[J]. 山西农业科学, 2019, 47(9): 1653-1658. |
| [20] |
杜若源, 谢晶, 王婷, 等. 超声波辅助提取银杏叶中总黄酮的工艺优化[J]. 食品与机械, 2015, 31(1): 167-170. |
| [21] |
赖红芳, 黄秀香, 陆俊宇. 超声波辅助提取山豆根中的黄酮和多糖工艺优化[J]. 食品与机械, 2014, 30(1): 196-198, 223. |
| [22] |
闫蕊, 赵桦. 黄花油点草总黄酮超声提取工艺的响应面优化及抗氧化性分析[J]. 食品工业科技, 2018, 39(10): 190-196, 203. |
| [23] |
肖卫华, 韩鲁佳, 杨增玲, 等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报, 2007, 12(5): 52-56. |
| [24] |
张意笠, 程汝滨, 黄真, 等.响应面法优化结香花总黄酮提取工艺及其抗氧化活性[J/OL].食品工业科技.(2020-04-08).https://kns.cnki.net/KCMS/detail/11.1759.TS.20200408.1638.043.html.
|



