黑老虎(Kadsura coccinea)是五味子科南五味子属藤本植物,别名冷饭团、过山龙藤,生于江西、福建、湖南、广东、广西、四川、贵州、云南等地。黑老虎茎、叶一年四季青绿,可用于绿廊、凉亭等园林配置[1]。其果型为聚合果,果大有光泽,表面纹理像菠萝,垂吊如灯笼,具有较高的观赏价值。黑老虎根可入药,活血行气,消肿止痛,治疗胃病,亦常用于妇科[2]。目前,市场上对黑老虎的关注度越来越高,而野生资源的过度采挖,致使黑老虎种群生存情况不容乐观[3]。国内外关于黑老虎化学成分、药理作用、挥发油成分、栽培技术的研究较多[4-13],但有关其遗传多样性的研究并不多见。为准确揭示黑老虎遗传多样性,急需建立其特定的多样性检测体系。ISSR是一种建立在PCR技术基础上的DNA分子标记,具有操作方便、低成本、遗传多态性高等特点,已广泛应用于种质资源鉴定、遗传多样性分析等研究领域[14-18]。每一个物种的ISSR-PCR反应体系最适宜的条件不同,黑老虎的最适宜条件需进一步摸索。本文运用正交设计及单因素试验相结合的方法,对Mg2+浓度、dNTPs浓度、引物浓度、Taq DNA聚合酶用量、DNA模板用量、扩增程序中退火温度及循环次数等黑老虎ISSR-PCR反应体系的关键参数进行系统研究,以期建立并优化黑老虎的ISSR-PCR反应体系,为其遗传多样性评价等深入研究奠定基础。
1 材料与方法 1.1 材料试验材料于2018年9月采自广西壮族自治区中国科学院广西植物研究所种质资源圃,采集生长良好、色泽亮丽、健康无虫害的新鲜叶片2—3片,保存于冰盒带回实验室后用液氮冷冻。样品经广西植物研究所漆小雪研究员鉴定为黑老虎(Kadsura coccinea)叶片。
1.2 仪器及药品药品试剂:ISSR引物、dNTPs、Mg2+、Taq DNA聚合酶、10×PCR buffer、DNA Marker S、琼脂糖,以上试剂都购于卓一生物技术有限公司。
实验仪器:PCR仪(美国BIO-RAD伯乐公司), DYCP-34型电泳槽(北京市六一仪器厂), TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司), 离心机(珠海黑马医学仪器有限公司), UVP凝胶成像系统, CDYY-6C型电泳仪(北京市六一仪器厂), -20℃冰箱, -4℃冰箱。
1.3 方法 1.3.1 黑老虎植物基因组DNA的提取采用CTAB法对黑老虎植物基因组DNA进行提取。用浓度为2%的琼脂糖凝胶电泳检验所提取基因组DNA的质量和完整性,用紫外分光光度计检测基因组DNA的纯度和浓度。
1.3.2 ISSR-PCR反应体系正交试验不同的物种有各自最佳的ISSR反应体系,要建立一个适于黑老虎的ISSR反应体系需要先对该体系进行优化。运用正交方案进行初步的筛选,随后利用单因素设计针对性地统一优化,优化的内容包括Mg2+浓度、dNTPs浓度、引物浓度、Taq DNA聚合酶用量、DNA模板用量、PCR扩增循环次数、退火温度等。
采用正交设计试验确定每个因素中扩增效果最好的条件。正交试验主要包括设计Mg2+、引物、Taq DNA聚合酶、DNA、dNTPs这5个试验因素的梯度差。每一个因素都设计4个浓度梯度差,如表 1、表 2所示。为避免偶然性发生,每个浓度设置3个重复。除此之外,这4个浓度梯度系列中,每个体系都加入2.5 μL 10× PCR Buffer,最后用灭菌后的ddH2O补足至20 μL。本次选用的引物为866(序列为5′-CTC CTC CTC CTC CTC CTC-3′)。退火温度为54℃。
| 水平 Levels |
因素 Factors |
||||
| Mg2+ (mmol/L) |
dNTPs (mmol/L) |
引物 Primer (μmol/L) |
Tap DNA聚合酶 Tap DNA polymerase (U) |
DNA (ng) |
|
| 1 | 1.0 | 0.1 | 0.2 | 0.5 | 10 |
| 2 | 1.5 | 0.2 | 0.4 | 1.0 | 30 |
| 3 | 2.0 | 0.4 | 0.6 | 1.5 | 50 |
| 4 | 2.5 | 0.5 | 0.8 | 2.0 | 70 |
| 编号 Number |
因素 Factors |
||||
| Mg2+ (mmol/L) |
dNTPs (mmol/L) |
引物 Primer (μmol/L) |
Tap DNA聚合酶 Tap DNA polymerase (U) |
DNA (ng) |
|
| 1 | 1.0 | 0.1 | 0.2 | 0.5 | 10 |
| 2 | 1.5 | 0.1 | 0.4 | 1.0 | 30 |
| 3 | 2.0 | 0.1 | 0.6 | 1.5 | 50 |
| 4 | 2.5 | 0.1 | 0.8 | 2.0 | 70 |
| 5 | 1.5 | 0.2 | 0.2 | 1.5 | 70 |
| 6 | 1.0 | 0.2 | 0.4 | 2.0 | 50 |
| 7 | 2.5 | 0.2 | 0.6 | 0.5 | 30 |
| 8 | 2.0 | 0.2 | 0.8 | 1.0 | 10 |
| 9 | 2.0 | 0.4 | 0.2 | 2.0 | 30 |
| 10 | 2.5 | 0.4 | 0.4 | 1.5 | 10 |
| 11 | 1.0 | 0.4 | 0.6 | 1.0 | 70 |
| 12 | 1.5 | 0.4 | 0.8 | 0.5 | 50 |
| 13 | 2.5 | 0.5 | 0.2 | 1.0 | 50 |
| 14 | 2.0 | 0.5 | 0.4 | 0.5 | 70 |
| 15 | 1.5 | 0.5 | 0.6 | 2.0 | 10 |
| 16 | 1.0 | 0.5 | 0.8 | 1.5 | 30 |
PCR扩增程序:在94℃条件下预变性5 min,94℃条件下变性30 s,54℃条件下退火50 s,72℃条件下延伸5 min,4℃保存。扩展结束后将PCR扩增产物用2%的琼脂糖凝胶电泳1.0—1.5 h,用溴化乙啶染色20—25 min,随后采用UVP凝胶电泳成像系统拍照备注保存。
1.3.3 ISSR-PCR反应单因素试验设计在正交试验基础上进行单因素试验。每个因素设计的水平如下:Mg2+浓度为0.5,1.0,1.5,2.0,2.5,3.0 mmol/L;dNTPs浓度为0.1,0.2,0.3,0.4,0.5,0.6 mmol/L;引物浓度为0.1,0.2,0.4,0.6,0.8,1.0 μmol/L;Taq DNA聚合酶用量为0.25,0.50,1.00,1.50,2.00,2.50 U;DNA模板用量为15,30,45,60,75,90 ng。
1.3.4 ISSR-PCR反应程序的优化根据正交试验及单因素试验结果,进一步确定反应体系后,继续对退火温度以及循环次数进行优化。退火温度设置为(Tm±5)℃,如(51±5)℃,那么PCR仪自动形成12个温度梯度:46.0,46.3,47.0,48.0,49.2,50.4,51.6,52.8,54.0,55.0,55.7,56.0℃。循环次数设置为25,30,35,40,45,50次。以上处理重复2次,避免偶然性存在。
1.3.5 ISSR反应体系的验证从黑老虎提取的DNA中随机选取2个样品,用前期试验确定的反应体系对样品进行扩增,以此检验扩增效果的稳定性。利用正交试验以及单因素试验确定的ISSR-PCR反应体系对引物进行筛选,从黑老虎的DNA样品中随机选择出2个样品作为ISSR-PCR反应体系的模板,对100条引物进行PCR扩增,从扩增效果好的条带中,选择出条带明亮、清晰、重复性好的引物进行ISSR分析。
2 结果与分析 2.1 ISSR反应体系正交试验结果由ISSR-PCR正交试验结果(图 1)可知,组合3,14,15部分重复没有条带出现,这些组合扩增效果最差。组合1,2,4,7,8,9,12,16有条带,但是条带不明显,模糊不清,很难辨别。组合5,6,10,11,13具有清晰明亮的条带,组合5的条带最具有层次性,清晰可辨,且3次重复具有正态性,因此选择该组合作为单因素试验点样的基础。
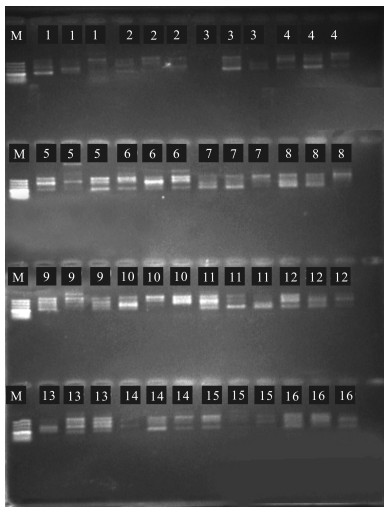
|
| 1—16分别对应正交试验组合1—16 1—16 correspond to orthogonal test combinations 1-16 respectively 图 1 ISSR-PCR正交试验扩增结果 Fig. 1 Amplification results of ISSR-PCR orthogonal test |
2.2 Mg2+浓度对ISSR-PCR扩增效果的影响
由图 2可以看出,Mg2+浓度低时ISSR-PCR扩增效果较差,条带模糊不清晰或缺失。随着Mg2+浓度的加大,条带越来越清晰;当浓度为2.5 mmol/L时,条带较为清晰,亮度最高。因此,选择Mg2+浓度为2.5 mmol/L作为下一步研究的条件。

|
| 1—6对应的Mg2+浓度分别为0.5,1.0,1.5,2.0,2.5,3.0 mmol/L 1—6 correspond to Mg2+ concentration of 0.5, 1.0, 1.5, 2.0, 2.5, 3.0 mmol/L 图 2 Mg2+浓度对ISSR-PCR扩增效果的影响 Fig. 2 Effect of Mg2+ concentration on ISSR-PCR amplification |
2.3 dNTPs浓度对ISSR-PCR扩增效果的影响
dNTPs对ISSR-PCR的影响如图 3所示。在20 μL体系中,dNTPs浓度为0.10 mmol/L时,条带最清晰;提高dNTPs浓度,扩增条带清晰度呈现下降趋势。因此,选择dNTPs浓度为0.10 mmol/L作为下一步试验的条件。

|
| 1—6表示dNTPs浓度分别为0.10,0.20,0.30,0.40,0.50,0.60 mmol/L 1—6 represents dNTPs concentration of 0.10, 0.20, 0.30, 0.40, 0.50, 0.60 mmol/L 图 3 dNTPs浓度对ISSR-PCR扩增效果的影响 Fig. 3 Effect of dNTPs concentration on ISSR-PCR amplification |
2.4 引物浓度对ISSR-PCR扩增效果的影响
不同的引物浓度对ISSR-PCR扩增效果的影响如图 4所示,引物浓度为0.6 μmol/L时最适合ISSR-PCR反应体系的扩增。其余条带的情况则表明,在20 μL体系时,其他的引物浓度不利于黑老虎的PCR扩增。故选择引物浓度为0.6 μmol/L进行下一步试验。
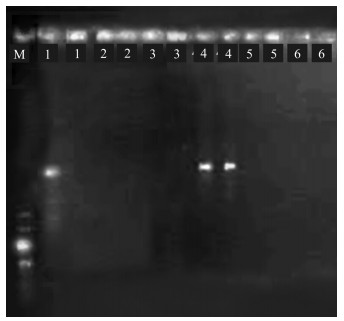
|
| 1—6表示引物浓度分别为0.1,0.2,0.4,0.6,0.8,1.0 μmol/L 1—6 represents primer concentration of 0.1, 0.2, 0.4, 0.6, 0.8, 1.0 μmol/L 图 4 引物浓度对ISSR-PCR扩增效果的影响 Fig. 4 Effect of primer concentration on ISSR-PCR amplification |
2.5 Taq DNA聚合酶用量对ISSR-PCR扩增效果的影响
Taq DNA聚合酶的用量会影响扩增产物,用量多则成本高,且容易扩增出非特异性产物,但用量少又会导致产物合成的效率低[16]。如图 5所示,在20 μL体系里,Taq DNA聚合酶用量为0.25—1.00 U时,几乎没有产物出现;Taq DNA聚合酶用量为1.50 U时(编号4),条带清晰、亮度高,故选择1.50 U作为下一步试验的Taq DNA聚合酶用量。

|
| 1—6表示Taq DNA酶用量分别为0.25,0.50,1.00,1.50,2.00,2.50 U 1—6 represents Taq DNA polymerase dosage of 0.25,0.50,1.00,1.50,2.00,2.50 U 图 5 TaqDNA聚合酶用量对ISSR-PCR扩增效果的影响 Fig. 5 Effect of Taq DNA polymerase dosage on ISSR-PCR amplification |
2.6 模板DNA用量对ISSR-PCR扩增效果的影响
如图 6所示,编号1,2,5,6产物所扩增的条带不够清晰明亮,背景模糊不清,表明生成的产物较少,因此模板DNA用量为15,30,75,90 ng时,ISSR-PCR扩增效果差。编号3的产物条带明亮清晰,故选择45 ng模板DNA用量进行下一步的试验。
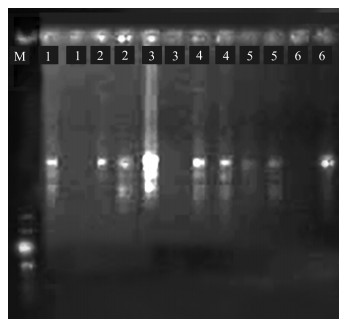
|
| 1—6表示模板DNA用量分别为15,30,45,60,75,90 ng 1—6 represents template DNA dosage of 15, 30, 45, 60, 75, 90 ng 图 6 模板DNA用量对ISSR-PCR扩增效果的影响 Fig. 6 Effect of template DNA dosage on ISSR-PCR amplification |
2.7 退火温度对ISSR-PCR扩增效果的影响
退火温度对ISSR-PCR扩增效果的影响如图 7所示,部分组合没有条带产生,表明该退火温度不适合黑老虎ISSR-PCR的扩增。退火温度在50.4℃时,条带的强度高,清晰明亮,副带也清晰,因此该引物的最佳退火温度确定为50.4℃,其他引物的退火温度也采用同样的退火温度梯度进行筛选。
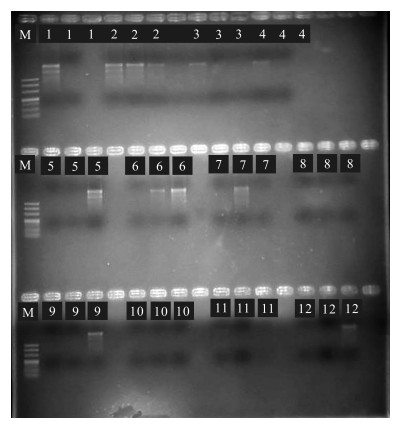
|
| 1—12代表退火温度分别为46.0,46.3,47.0,48.0,49.2,50.4,51.6,52.8,54.0,55.0,55.7,56.0℃ 1—12 represents annealing temperature of 46.0, 46.3, 47.0, 48.0, 49.2, 50.4, 51.6, 52.8, 54.0, 55.0, 55.7, 56.0℃ 图 7 退火温度对ISSR-PCR扩增效果的影响 Fig. 7 Effect of annealing temperature on ISSR-PCR amplification |
2.8 循环次数对ISSR-PCR扩增效果的影响
循环次数对ISSR-PCR扩增效果的影响如图 8所示,一共有6个循环组合,每个循环组合设立了6次重复试验。循环次数为25,30次时没有条带出现,表明该循环次数扩增效果不佳。循环次数为35,45,50次时有些许的条带出现,但条带模糊不清晰,强度弱,层次不分明,扩增产物较少,故不选择。循环次数为40次时,扩增产物较多,条带清晰,层次分明,强度高,条带的数目也明显更多。故而40次为最佳循环次数。

|
| 1—6表示循环次数为20,25,30,35,40,45次 1—6 represents cycle times of 20, 25, 30, 35, 40, 45 图 8 循环次数对ISSR-PCR扩增效果的影响 Fig. 8 Effect of cycle times on ISSR-PCR amplification |
3 讨论
单独采用单因素试验仅考虑单个因素不同水平对试验结果的影响,忽视了各个因素之间的相互作用,在优化试验组合时,会一定程度上降低最佳反应水平的可靠程度[19-20]。正交试验设计考虑多个因素水平的相互作用,利用最少的组合数考察因素和水平对结果的影响程度,得出最佳组合。本试验先用正交试验进行初步筛选,再通过单因素试验进行优化,极大地减少了试验次数和时间,快速建立黑老虎的ISSR-PCR反应体系。试验结果显示,黑老虎ISSR-PCR反应体系对Mg2+浓度要求严格,浓度过低时无法扩增出条带。这可能是由于反应体系中其他因素对Mg2+较为敏感,如Mg2+是Taq DNA聚合酶的必需激活剂,体系中Mg2+浓度过高,会出现Taq DNA聚合酶扩增出的特异性产物浓度降低,浓度过低会降低酶的效率。Mg2+可与其他因素结合,最终影响PCR扩增的效率和特异性。由以上的正交试验和单因素试验结果可知,在20 μL ISSR-PCR反应体系中,黑老虎的最佳反应条件为Mg2+浓度为2.5 mmol/L、dNTPs浓度为0.1 mmol/L、引物浓度为0.6 μmol/L、Taq DNA聚合酶用量为1.50 U、模板DNA用量为45 ng。扩增程序为在94℃预变性5 min;94℃变性30 s,50.4℃退火30 s,72℃延伸30 s,以上3个步骤循环40次;最后72℃延伸10 min。本试验首次研究建立黑老虎ISSR-PCR反应体系,并获得稳定可靠结果,可以适应于其他黑老虎品种,为今后黑老虎遗传多样性和遗传结构研究奠定基础。
| [1] |
胡熙明, 张文康, 朱庆生, 等. 中华本草:第二册[M]. 上海: 上海科学技术出版社, 1999.
|
| [2] |
龙世林, 高渐飞, 杨红梅, 等. 不同地区冷饭团单株雌花占比率调查初报[J]. 耕作与栽培, 2015(3): 39-40. |
| [3] |
梁忠厚, 范适, 宋光桃, 等. 黑老虎的研究进展[J]. 湖南生态科学学报, 2017, 4(3): 52-56. |
| [4] |
李贺然.黑老虎及胡桃枝皮的化学成分研究[D].北京: 中国协和医科大学, 2006.
|
| [5] |
LIU J S, QI Y D, LAI H W, et al. Genus Kodsura, a good source with considerable characteristic chemical constituents and potential bioactivities[J]. Plytomedicine, 2014, 21(8): 1092-1097. |
| [6] |
谢玮, 张贤贤, 平永良. 黑老虎果实化学成分和生理活性研究进展[J]. 农产品加工, 2017(1): 71-72, 74. |
| [7] |
张海平, 覃秀顺, 蒋振华. 特色水果黑老虎的栽培技术[J]. 果树实用技术与信息, 2019(11): 24-25. |
| [8] |
刘涛, 韦茜, 吴小波, 等. 野生水果冷饭团的研究现状及开发利用前景\[J]. 安徽农业科学, 2009, 37(23): 10971-10972. |
| [9] |
石焱芳, 陈海玲. 黑老虎的药理活性成份研究进展[J]. 海峡药学, 2013, 25(7): 67-69. |
| [10] |
付玉嫔, 司马永, 祁荣频, 等. 木质藤本植物黑老虎的居群结构与动态[J]. 东北林业大学学报, 2015, 43(9): 23-29, 51. |
| [11] |
吴智涛. 冷饭团特性及其栽培技术[J]. 中国园艺文摘, 2012(6): 190-192. |
| [12] |
卢圣栋. 现代分子生物试验技术[M]. 第2版. 北京: 中国协和医科大学出版社, 1999: 458-463.
|
| [13] |
邹喻苹, 葛颂, 王晓东. 系统与进化植物学中的分子标记[M]. 北京: 科学出版社, 2001: 36-41, 68.
|
| [14] |
赵孟良, 韩睿, 李莉, 等. 菊芋ISSR-PCR反应体系的建立[J]. 西南农业学报, 2012(25): 243-246. |
| [15] |
吴春妍, 杨冠松, 张爱丽, 等. 甜菜树ISSR-PCR反应体系的建立与优化[J]. 西南农业学报, 2014, 27(6): 2574-2579. |
| [16] |
周俊亚, 宾晓芸, 彭云滔, 等. 罗汉果ISSR-PCR反应体系的建立[J]. 广西师范大学学报:自然科学版, 2004, 22(3): 81-84. |
| [17] |
王彦华, 侯喜林, 徐明宇. 正交设计优化不结球白菜ISSR反应体系研究[J]. 西北植物学报, 2004, 24(5): 899-902. |
| [18] |
李长春, 阳天泉, 戴余军, 等. 正交设计优化莲藕ISSR-PCR反应体系研究[J]. 北方园艺, 2011(1): 121-123. |
| [19] |
向巧彦, 黄夕洋, 李虹, 等. 广西药用植物两面针遗传多样性的ISSR分析[J]. 广西科学, 2014, 21(5): 541-549. DOI:10.13656/j.cnki.gxkx.20140504.011 |
| [20] |
史艳财, 邹蓉, 朱成豪, 等. 极小种群喙核桃ISSR-PCR反应条件的建立与优化[J]. 广西科学院学报, 2020, 36(1): 78-82. DOI:10.13657/j.cnki.gxkxyxb.20200317.011 |



