藻红蛋白是一种具有高度荧光特性和光稳定性的藻胆蛋白,是极好的天然色素和荧光剂,可以广泛应用在医疗卫生、食品、化妆品以及染料等行业[1-4]。此外,藻红蛋白还可以作为优良的蛋白质来源,添加在食品、药品以及动物饲料中[1, 3]。在大多数红藻中,藻红蛋白可占藻胆蛋白的70%以上[5],其中以紫球藻(Porphyridium cruentum)的含量最高,因此紫球藻是生产藻红蛋白的优质材料。在紫球藻的类囊体膜上,藻红蛋白与其他3种藻胆蛋白聚合形成高度有序的超分子复合体,即藻胆体(Polyunsaturated Fatty Acids, PBSs)[6-9]。在自然状态下,PBSs结构完整,并与类囊体膜结合紧密,这时紫球藻呈现紫红色[10-12]。当受到外界胁迫时,作为储藏蛋白的藻红蛋白与连接器多肽分离并从PBSs上降解下来[6],用作氮源以供藻类生存。在此过程中,紫球藻开始褪色,严重时细胞呈现黄绿色。因此,普遍认为生长环境因素会影响紫球藻藻红蛋白的积累。有研究发现,氮盐含量对藻红蛋白的积累有显著的影响,高氮对其有抑制作用[13, 14];另外,低光条件下的细胞需要更多的藻胆蛋白用来吸收更多的光能,因此低光能刺激藻胆蛋白的合成与积累[15, 16]。
目前,实验室多采用摇瓶、充气等方式进行紫球藻的培养,但这些常用培养方式均存在平行性差、可控性不佳的缺点。小型普通机械搅拌式光照发酵罐是实验室常见发酵装置,可控性好、技术条件成熟,仅需对光源进行调整就可用来培养光合微生物,大大增加了设备的利用率。为避免实验室内培养紫球藻的一系列不良因素影响,本研究选用容量为10 L的小型机械搅拌式光照发酵罐作为培养紫球藻的光生物反应器,采用单因素法(分别以搅拌速率、光照强度、氮浓度、NaCl浓度作为单一变量因子)[17, 18],对紫球藻发酵生产藻红蛋白的条件进行优化,确定最佳生产条件,为紫球藻藻红蛋白的工业化生产提供基础数据。
1 材料与方法 1.1 材料紫球藻藻种由山东大学(威海)提供,由本实验室进行扩大培养。
微量元素营养液的配制参考文献[18-20],具体配方为2 mmol/L FeCl3·6H2O,7 mmol/L MnCl2,1 mmol/L ZnCl2,1 mmol/L CoCl2·6H2O,1 mmol/L CuSO4·5H2O,1 mmol/L (NH4)6Mo7O2,2 mmol/L EDTA-2Na。
人工海水培养基(Artificial Seawater, ASW)的配制参考文献[18-20],具体配方为0.74 g/L CaSO4,0.8 g/L KCl,2.6 g/L MgCl2·6H2O,1.9 g/L MgSO4,1 mL f/2维生素母液,1 mL微量元素营养液。
f/2维生素母液参考市面所售品牌MwVin的维生素溶液配方,具体配方为0.5 mg/L维生素B12,100 mg/L盐酸硫胺素,0.5 mg/L生物素。
1.2 方法 1.2.1 紫球藻培养共设置4组实验,每组实验均以ASW作为基础培养基,NaNO3作为氮源,用NaCl调整培养基盐度。各组的培养温度均为25℃,通气量为120 L/h。
搅拌速率组:本组培养基的氮浓度均为5 mmol/L,NaCl浓度为30‰,光照强度为5 000 Lx,以搅拌速率为可变条件设置5个实验小组,搅拌速率分别为50,100,150,200,250 r/min。
光照强度组:本组培养基的氮浓度均为5 mmol/L,NaCl浓度为30‰,搅拌速率为200 r/min,以光照强度为可变条件设置5个实验小组,光照强度分别为2 000,4 000,5 000,6 000,8 000 Lx。
氮浓度组:本组培养基的NaCl浓度均为30‰,光照强度为5 000 Lx,搅拌速率为200 r/min,以氮浓度为可变条件设置5个实验小组,氮浓度分别为2,4,6,8,10 mmol/L。
NaCl浓度组:本组培养基的氮浓度均为5 mmol/L,光照强度为5 000 Lx,搅拌速率为200 r/min,以NaCl浓度为可变条件设置5个实验小组,NaCl浓度分别为10‰、20‰、30‰、40‰、50‰。
1.2.2 藻红蛋白相对含量的测定方法迄今为止,已经从紫球藻中分离纯化出两种藻红蛋白,B-藻红蛋白和b-藻红蛋白,其中以B-藻红蛋白含量最多且最为稳定[19]。B-藻红蛋白和b-藻红蛋白均在545 nm处有一主要吸收峰[21],所以一般以藻体蛋白粗提液在545 nm处的吸光度代表藻红蛋白的相对含量。
测定方法参考文献[18]。每天固定时间取样一次,每次取不同实验组的藻液5 mL作为测试样品。样品于5 000 r/min条件下离心5 min,除去上清,藻细胞沉淀使用3 mL 0.01 mol/L磷酸盐缓冲溶液(pH值为7.0)进行悬浮。然后使用超声波细胞粉碎机进行藻细胞破碎,超声功率50 W,工作时间7 s,间歇时间5 s,循环30次。破碎完毕后,对样品进行离心(5 000 r/min,10 min),所得上清液即为藻红蛋白测试液。然后使用分光光度计测其在545 nm处的吸光度,最后以每107个细胞所对应的吸光度作为藻红蛋白相对含量的评定标准。
2 结果与分析 2.1 搅拌速率对紫球藻藻红蛋白含量的影响紫球藻可产生大量胞外多糖,具有一定的黏性,当搅拌速率过低时会导致藻体沉积,而速率过高时会对藻体造成机械损伤[22],所以搅拌速率过低和过高均会影响紫球藻生长和藻红蛋白的积累(图 1)。在培养期内,比较各组藻红蛋白的产量,大致呈现150 r/min组>100 r/min组>200 r/min组>50 r/min组>250 r/min组的趋势;在培养的4—7 d内,各组藻红蛋白的合成速率最快。在收获时(第9天),150 r/min组的藻红蛋白产量最高。另外,当设置搅拌速率为50 r/min时,前期培养过程中藻体易沉积,生长速度缓慢,氮源消耗也较缓慢,所以在后期其藻红蛋白产量较其他组有所上升;而搅拌速度过高时,藻红蛋白的积累会受到一定抑制。综上所述,在生产紫球藻藻红蛋白时,搅拌速率建议使用150 r/min。

|
| 图 1 搅拌速率对紫球藻藻红蛋白含量的影响 Fig. 1 Effects of agitation rate on the content of phycoerythrin |
2.2 光照强度对紫球藻藻红蛋白含量的影响
由图 2可知,紫球藻藻红蛋白的含量与光照强度呈反比。光照较弱时,紫球藻藻红蛋白的产量较高;光照较强时,其积累量却会相对降低。本实验中,各组藻红蛋白的积累量情况是2 000 Lx组>4 000 Lx组>5 000 Lx组>6 000 Lx组>8 000 Lx组,收获时,2 000 Lx组藻红蛋白产量最高。紫球藻为光合自养生物,藻红蛋白为其重要的捕光色素蛋白,当光照强度改变时,紫球藻自身会做出相应改变来适应环境变化。本研究中,当光照强度为2 000 Lx时,紫球藻藻红蛋白含量最高,此时藻体颜色最深;随着光强增加,藻红蛋白含量降低。卢晓等[23]、陈伟洲等[24]在研究红藻门的江蓠时也发现藻红蛋白随光强变化有相似的情况,这或许是因为低光下细胞需要更多的藻胆蛋白以便吸收更多的光能,所以更能刺激藻胆蛋白的合成与积累[14, 15]。
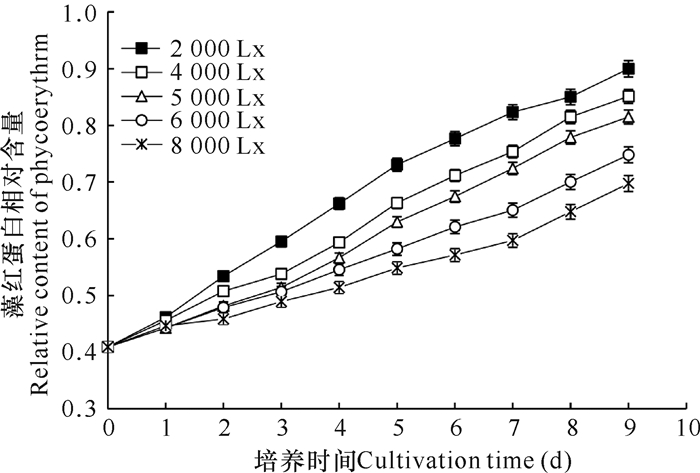
|
| 图 2 光照强度对紫球藻藻红蛋白含量的影响 Fig. 2 Effects of light intensity on the content of phycoerythrin |
2.3 氮浓度对紫球藻藻红蛋白含量的影响
由图 3可知,各实验组藻红蛋白含量总体呈现8 mmol/L组>10 mmol/L组>6 mmol/L组>4 mmol/L组>2 mmol/L组的变化趋势,在收获时8 mmol/L组藻红蛋白产量最高。在培养过程中,低氮组(2,4 mmol/L组)的藻红蛋白产量先增加,后因为氮源的消耗其含量逐渐降低(藻液颜色变浅);而6,8,10 mmol/L组藻红蛋白含量随培养时间逐渐升高(藻液颜色变深)。在一定氮浓度范围内(2—8 mmol/L),藻红蛋白含量与氮浓度成正比,但过高氮浓度(10 mmol/L)并不能有效提高藻红蛋白含量,该结果与前人已公布的研究结果[13-16]基本一致。因此,在以NaNO3为氮源生产紫球藻藻红蛋白时,其氮浓度建议使用8 mmol/L。
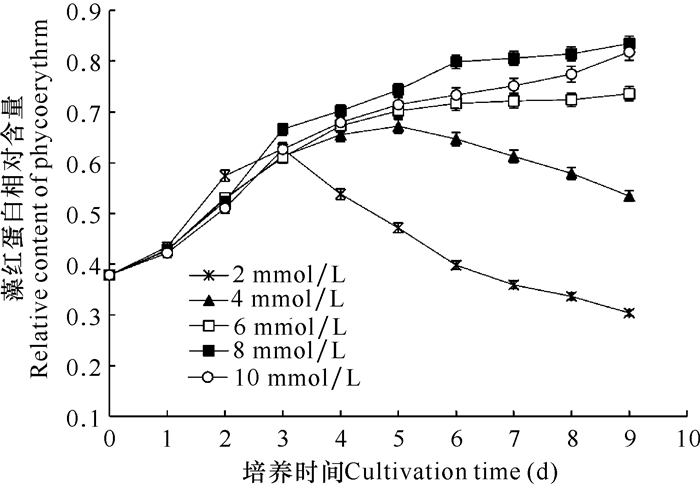
|
| 图 3 氮浓度对紫球藻藻红蛋白含量的影响 Fig. 3 Effects of nitrogen concentration on the content of phycoerythrin |
2.4 NaCl浓度对紫球藻藻红蛋白含量的影响
紫球藻对盐度适应性较强,淡水、海水中均能生长,但当前关于NaCl浓度对紫球藻藻红蛋白含量影响的研究较少。从本研究结果可以看出(图 4),在培养期内,各组藻红蛋白的产量从高到低依次为20‰组>10‰组>30‰组>40‰组>50‰组,收获时,20‰组藻红蛋白产量最高。这说明紫球藻生产藻红蛋白需要适宜的NaCl浓度,浓度过低或过高对其积累都有一定程度的抑制。因此,在生产紫球藻藻红蛋白时,NaCl浓度建议使用20‰。
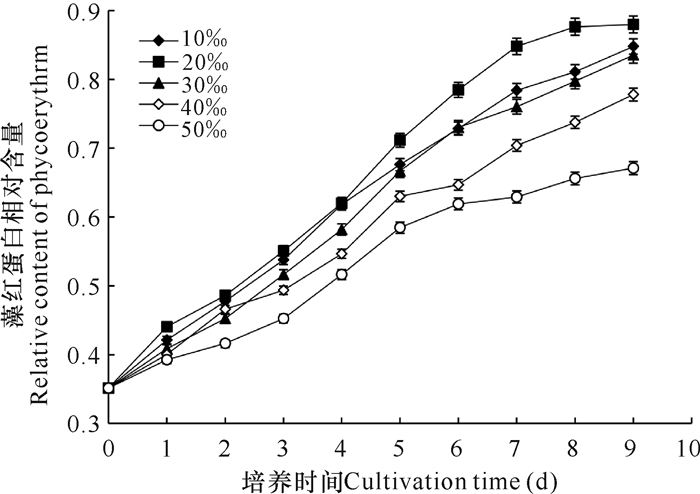
|
| 图 4 NaCl浓度对紫球藻藻红蛋白含量的影响 Fig. 4 Effects of NaCl concentration on the content of phycoerythrin |
3 结论
本试验利用搅拌式光照发酵罐培养紫球藻生产藻红蛋白时发现,以搅拌速率、光照强度、氮浓度和NaCl浓度作为单一变量因子,藻红蛋白分别在150 r/min的搅拌速率、2 000 Lx的光照强度、8 mmol/L的氮浓度、20‰的NaCl浓度条件下积累量达到最高值。此外,从成本效益上看,上述发酵条件也是较优的选择:20‰的NaCl减少了原料的使用,150 r/min的搅拌速率和2 000 Lx的光照强度使发酵过程中的能源损耗较低。本研究为单因素实验分析,为得到更加合理的生产方案,还需在此基础上进一步使用多因素分析,确定最佳生产条件,为紫球藻藻红蛋白的开发利用奠定基础。
| [1] |
SOBCZUK T M, CAMACHO F G, GRIMA E M, et al. Effects of agitation on the microalgae Phaeodactylum tricornutum and Porphyridium cruentum[J]. Bioprocess and Biosystems Engineering, 2006, 28(4): 243-250. DOI:10.1007/s00449-005-0030-3 |
| [2] |
GALLEGO R, MARTÍNEZ M, CIFUENTES A, et al. Development of a green downstream process for the valorization of Porphyridium cruentum biomass[J]. Molecules, 2019, 24(8): 1564. DOI:10.3390/molecules24081564 |
| [3] |
余佳, 王生, 许文琦, 等. 葛仙米藻胆蛋白粗提物、藻蓝蛋白和藻红蛋白的体外抗氧化活性比较研究[J]. 食品研究与开发, 2019, 40(23): 104-108. |
| [4] |
FORJÁN E, GARBAYO I, HENRIQUES M, et al. UV-A mediated modulation of photosynthetic efficiency, xanthophyll cycle and fatty acid production of Nannochloropsis[J]. Marine Biotechnology, 2011, 13(3): 366-375. |
| [5] |
GLAZER A N. Phycobiliproteins-A family of valua-ble, widely used fluorophores[J]. Journal of Applied Phycology, 1994, 6(2): 105-112. DOI:10.1007/BF02186064 |
| [6] |
臧帆, 秦松, 马丞博, 等. 藻类特有的捕光色素蛋白——藻红蛋白的结构、功能及应用[J]. 科学通报, 2020, 65(7): 565-576. |
| [7] |
ADIR N. Elucidation of the molecular structures of components of the phycobilisome:Reconstructing a giant[J]. Photosynthesis Research, 2005, 85(1): 15-32. |
| [8] |
ARTENI A A, LIU L, AARTSMA T J, et al. Structure and organization of phycobilisomes on membranes of the red alga Porphyridium cruentum[J]. Photosynthesis Research, 2008, 95(2/3): 169-174. |
| [9] |
ADIR N, BAR-ZVI S, HARRIS D, et al. The amazing phycobilisome[J]. Biochimica et Biophysica Acta, 2020, 1861(4): 148047. DOI:10.1016/j.bbabio.2019.07.002 |
| [10] |
SIX C, JOUBIN L, FRÉDÉRIC PARTENSKY, et al. UV-induced phycobilisome dismantling in the marine picocyanobacterium Synechococcus sp.WH8102[J]. Photosynthesis Research, 2007, 92(1): 75-86. |
| [11] |
王肖肖, 秦松, 杨革, 等. 藻胆体的结构与能量传递功能[J]. 海洋科学, 2017, 41(12): 139-145. DOI:10.11759/hykx20170627002 |
| [12] |
STADNICHUK I N, TROPIN I V. Phycobiliproteins:Structure, functions and biotechnological applications[J]. Applied Biochemistry and Microbiology, 2017, 53(1): 1-10. |
| [13] |
孙利芹, 王长海, 腾立. 培养条件对紫球藻B-藻红蛋白含量的影响[J]. 浙江大学学报:农业与生命科学版, 2007, 33(1): 40-44. |
| [14] |
陈超.红藻和蓝藻藻胆蛋白和藻胆体的体外组装特性及缺氮和恢复过程中藻胆体结构变化的动态过程分析[D].济南: 山东大学, 2004.
|
| [15] |
列别捷夫.植物生理学[M].杨汉金, 卫新中, 译.厦门: 厦门大学出版社, 1991: 92-116.
|
| [16] |
王长海, 李叙风, 鞠宝, 等. 紫球藻及其应用研究[J]. 海洋学报, 1998, 17(3): 79-85. |
| [17] |
关晓辉, 尹宗杰, 鲁敏, 等. 细菌纤维素发酵条件的优化及结构分析[J]. 中国酿造, 2010, 29(10): 68-71. |
| [18] |
陈晓倩.紫球藻藻红蛋白与EPA含量变化的相关性研究[D].威海: 山东大学, 2013.
|
| [19] |
王娟.紫球藻活性产物的代谢调控以及藻红蛋白的分离纯化[D].福州: 福建师范大学, 2005.
|
| [20] |
CHITLARU E, PICK U. Selection and characterization of Dunaliella salina mutants defective in haloadaptation[J]. Plant Physiology, 1989, 91(2): 788-794. |
| [21] |
周林, 胡金梅, 郭祀远. B-藻红蛋白在表面活性剂中的光谱性质[J]. 化学试剂, 2009, 31(6): 408-410, 443. |
| [22] |
陈必链, 梁世中, 王娟, 等. 搅拌式光生物反应器培养紫球藻的条件优化[J]. 福建师范大学学报:自然科学版, 2004, 20(2): 91-96. |
| [23] |
卢晓, 李美真, 王志刚, 等. 光照和温度对脆江蓠的生长和生化组成的影响[J]. 中国水产科学, 2014, 21(6): 1236-1243. |
| [24] |
陈伟洲, 钟志海, 刘涛, 等. 光照强度和温度对智利江蓠生长及生化组分的影响[J]. 海洋湖沼通报, 2015(1): 28-34. |



