右旋糖酐是一种大分子聚合物,主要由D-葡萄糖分子通过α-1, 6-糖苷键连接形成的主链,以及α-1, 2-糖苷键和α-1, 4-糖苷键形成的侧链构成[1]。因其安全无毒、生物相容性好、来源丰富等特性,右旋糖酐已被广泛应用在食品、医药等多个领域[2, 3]。天然的右旋糖酐分子量相对较高,必须经酸水解或酶水解形成小分子量右旋糖酐后才能加以应用。但是酸法生产的右旋糖酐含有氯离子,并且所得产物分子量不统一,不能满足临床需求,而酶法反应条件温和,所得产物分子量范围比较狭窄,并且能大大减少污染[4]。
右旋糖酐酶(E.C.3.2.1.11)是一种诱导酶,能够专一性水解右旋糖酐中的α-1, 6-糖苷键[5, 6]。生产右旋糖酐酶的微生物有很多,从一开始,真菌和细菌就被确定为能够水解葡聚糖的主要酶源,特别是真菌。来源于细菌的右旋糖酐酶相对较少,并且其酶活力相对较低,但是却具有良好的热稳定性[7, 8]。真菌来源的右旋糖酐酶大多稳定性好,酶活力较高,具有很高的研究价值和商业价值[9-13]。
Plackett-Burman (PB)实验设计可以从大量变量中筛选主要因素,响应面法是一种有效的实验工具,通过它可以确定多变量系统中的最优条件。因此,为了有利于工业化生产,本研究拟筛选能够高产右旋糖酐酶的真菌菌株,并利用响应面法对其发酵生产右旋糖酐酶的培养基进行优化,以期得到最优的发酵培养基,为其深入研究及工业化应用奠定基础。
1 材料与方法 1.1 材料右旋糖酐T70、T500、T2000及蓝色葡聚糖购自上海麦克林生化有限公司,常用化学试剂购自国药集团化学试剂有限公司,蛋白胨购自Sigma公司。
1.2 菌株筛选平板筛选培养基(g/L):右旋糖酐9,蓝色葡聚糖1,硝酸钠3,磷酸氢二钾1,硫酸镁0.5,硫酸锰0.01,氯化钾0.5,琼脂粉15-20,pH值为5.5-6.0。
基础发酵培养基(g/L):右旋糖酐10,蛋白胨3,磷酸氢二钾1,硫酸镁0.5,pH值为5.5-6.0。
取5 g土样,加入50 mL灭菌ddH2O,振荡30 min后静置沉淀,取上清分别稀释1×103-1×107倍后,取100 μL涂布到平板筛选培养基上,28℃静止培养5-7 d。挑选产生透明圈的菌株,转接到摇瓶发酵培养基中,28℃、180 r/min震荡培养5-7 d后,检测右旋糖酐酶活力[14]。
1.3 菌株鉴定 1.3.1 形态学鉴定在PDA平板上接种菌株,28℃静止培养,观察并记录菌落形态及颜色。
1.3.2 分子生物学鉴定收集发酵液中菌丝体,提取基因组DNA。以基因组DNA为模板,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物, 通过PCR扩增ITS rDNA序列。所得产物送至华大基因公司进行测序,将测序结果与NCBI数据库已有的ITS rDNA序列进行Blast比对,并利用MEGA的Neighbor-Joining软件构建系统发育树,Boot-strap分析重复设置为1 000。
1.4 右旋糖酐酶的活力测定取1 mL适当稀释的酶液,加入4 mL 3%的右旋糖酐T70 (0.02 mol/L的醋酸缓冲液配制,指定pH值),在指定温度下反应10 min后,利用3, 5-二硝基水杨酸(DNS)法检测还原糖量[15]。
一个酶活力单位(U)定义为每分钟释放1 μmol的还原糖所需的酶量。
1.5 培养基优化 1.5.1 单因素实验分别用葡萄糖、蔗糖、果糖、柠檬酸、玉米淀粉、糊精取代基础发酵培养基中的碳源。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,探索发酵产酶所需最佳碳源。
分别用酵母粉、尿素、硝酸钠、硫酸铵等取代基础发酵培养基中的氮源。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,探索发酵产酶所需最佳氮源。
在最佳碳源和最佳氮源组成的培养基中,分别添加不同的无机盐:硫酸镁、氯化钾、氯化钠、磷酸二氢钾、磷酸氢二钾、硫酸锰、硫酸亚铁、氯化钙等。接种筛选出的菌株于各培养基中,28℃、200 r/min震荡培养7 d后检测右旋糖酐酶活力,检测无机盐对筛选出的菌株发酵产酶的影响,以未添加无机盐的培养基作为对照。
1.5.2 响应面实验 1.5.2.1 Plackett-Burman实验根据单因素实验结果,选取6个因素进行PB实验设计,每个因素取两个水平:低水平“-1”和高水平“+1”。
1.5.2.2 最陡爬坡实验结合PB实验结果选出的显著因素,设计它们的变化方向和步长进行最陡爬坡实验,使各因素的取值更临近最佳值区域,为响应面实验做好准备。
1.5.2.3 Box-Benhnken Design (BBD)实验在最陡爬坡实验确定的实验因素中心点基础上,根据BBD中心组合设计原理,设计3因素3水平共15个实验点的响应面分析。
2 结果与分析 2.1 菌株筛选从土壤中筛选得到一株右旋糖酐酶产生菌株DJ72,该菌株能够在筛选平板培养基上形成明显透明圈,接种到基础发酵培养基培养7 d后,所产右旋糖酐酶活力达98 U/mL。
2.2 菌株鉴定 2.2.1 形态学鉴定将菌株在PDA平板培养基上培养3 d后,菌落生长整齐,显白色或淡黄色,呈绒毛状(图 1a),在显微镜下观察,菌丝有隔、分枝。小分生孢子呈纺锤状或卵圆形,大分生孢子呈梭形或月牙形(图 1b)
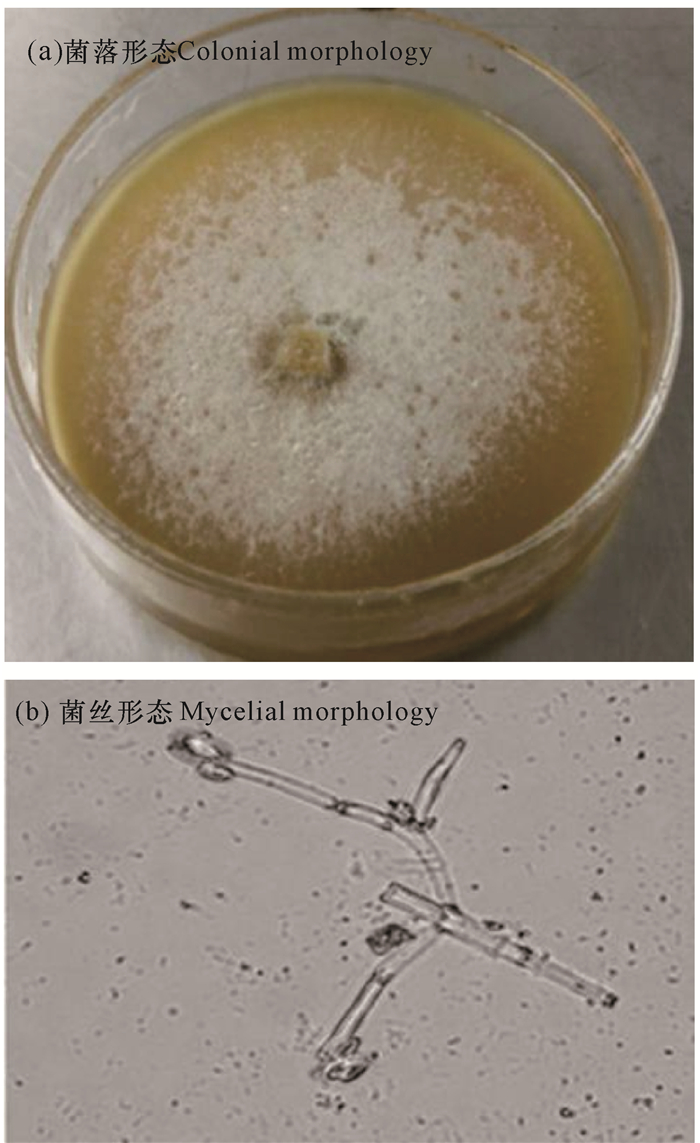
|
| 图 1 菌株DJ72的形态学特征 Fig. 1 Morphological characteristics of strain DJ72 |
2.2.2 分子生物学鉴定
提取菌株DJ72的总DNA并作为模板,应用通用引物ITS1和ITS4作为引物,克隆得到其ITS rDNA序列,经测序获得一条521 bp的核苷酸序列,同源性比对分析表明,其与腐皮镰刀菌(Fusarium solani)菌株的同源性最高,达100%(图 2)。

|
| 图 2 菌株DJ72的系统进化分析 Fig. 2 Phylogenetic analysis of strain DJ72 |
根据形态学及分子生物学鉴定结果,菌株DJ72为腐皮镰刀菌(Fusarium solani)。将DJ72保藏在中国微生物菌种保藏中心,保藏编号为CGMCC No.14542。
2.3 培养基单因素优化 2.3.1 碳源对DJ72发酵生产右旋糖酐酶的影响用不同的碳源取代基础发酵培养基中的右旋糖酐T500,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,右旋糖酐相比其他碳源更有利于右旋糖酐酶的发酵,其中以分子量更大的右旋糖酐T2000为碳源所产酶活力更高(图 3)。
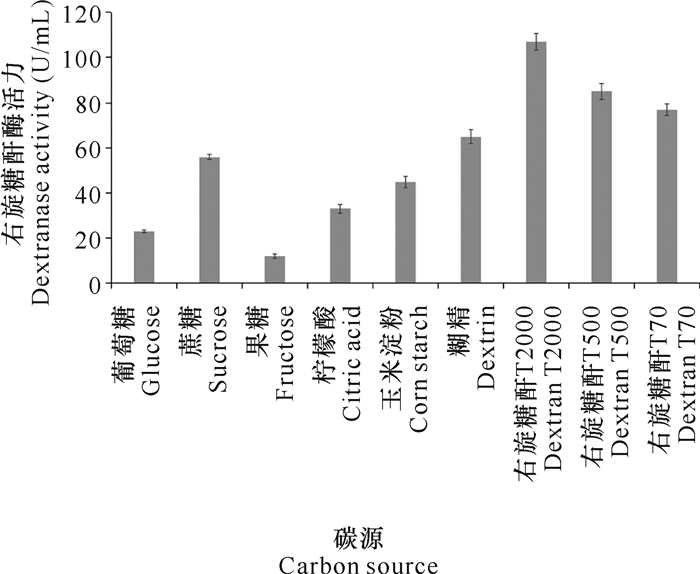
|
| 图 3 碳源对DJ72发酵生产右旋糖酐酶的影响 Fig. 3 Effect of carbon source on dextranase production by DJ72 fermentation |
2.3.2 氮源对DJ72发酵生产右旋糖酐酶的影响
用不同的氮源取代基础发酵培养基中的氮源,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,蛋白胨与尿素的组合最利于DJ72发酵生产右旋糖酐酶(图 4)。
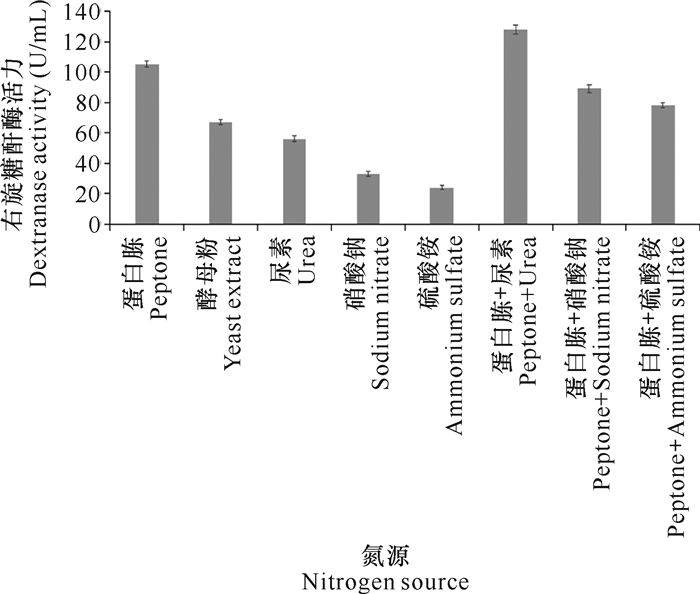
|
| 图 4 氮源对DJ72发酵生产右旋糖酐酶的影响 Fig. 4 Effect of nitrogen source on dextranase production by DJ72 fermentation |
2.3.3 无机盐对DJ72发酵生产右旋糖酐酶的影响
在最佳碳源和氮源的基础上添加不同的无机盐,经摇瓶震荡发酵7 d后检测右旋糖酐酶活力。实验结果表明,硫酸镁、磷酸氢二钾和硫酸亚铁有利于DJ72发酵生产右旋糖酐酶(图 5)。
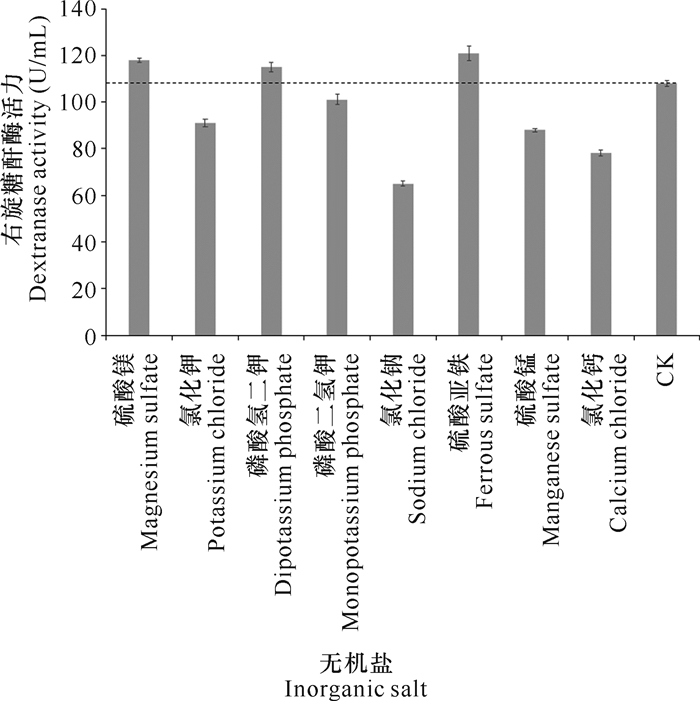
|
| 图 5 无机盐对DJ72发酵生产右旋糖酐酶的影响 Fig. 5 Effect of inorganic salts on dextranase production by DJ72 fermentation |
2.4 培养基响应面优化 2.4.1 Plackett-Burman实验结果
根据单因素实验结果,选取6个因素进行考察,采用试验次数N=12的PB进行设计。6个因素分别为右旋糖酐T2000、尿素、蛋白胨、磷酸二氢钾、硫酸镁、硫酸亚铁,分别对应表 1中A、B、D、E、G和H列。每个因素取两个水平:低水平“-1”和高水平“+1”。另设两个虚拟列,考察实验误差,分别为C和F列。具体实验设计和结果分析见表 1和表 2。
| 实验号 No. | A | B | C | D | E | F | G | H | 右旋糖酐酶活力 Dextranase activity (U/mL) |
| 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | 147 |
| 2 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 108 |
| 3 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 138 |
| 4 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 114 |
| 5 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 117 |
| 6 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 141 |
| 7 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | 99 |
| 8 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | 141 |
| 9 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | 132 |
| 10 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | 72 |
| 11 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 141 |
| 12 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 147 |
| 编码 No. | 因素 Factors | 水平Levels | 效应 Effect | 系数 Coefficient | F值 F value | P值 P value | 重要性排序 Importance ranking | |
| -1 | 1 | |||||||
| A | 右旋糖酐Dextran | 5.00 g/L | 15.0 g/L | -13.33 | -6.67 | 11.59 | 0.042 3 | 3 |
| B | 磷酸氢二钾 Dipotassium phosphate | 1.50 g/L | 2.5 g/L | 11.00 | 5.50 | 7.89 | 0.067 3 | 5 |
| D | 硫酸亚铁 Ferrous sulfate | 0.05 g/L | 0.1 g/L | -11.33 | -5.67 | 8.38 | 0.062 8 | 4 |
| E | 硫酸镁 Magnesium sulfate | 0.20 g/L | 0.4 g/L | 8.33 | 4.17 | 4.53 | 0.123 2 | 6 |
| G | 蛋白胨 Peptone | 5.00 g/L | 10.0 g/L | -22.00 | -11.00 | 31.57 | 0.011 1 | 2 |
| H | 尿素 Urea | 2.00 g/L | 5.0 g/L | -28.00 | -14.00 | 51.13 | 0.005 6 | 1 |
从表 2可以看出,在PB设计的两个水平范围内,尿素、蛋白胨和右旋糖酐对酶活力具有显著影响,影响力大小为尿素>蛋白胨>右旋糖酐。因此,对这3种因素开展更进一步研究。为节约成本,今后实验中其余成分取最低值。
2.4.2 最陡爬坡实验由PB实验结果选取尿素、蛋白胨以及右旋糖酐等3个因素进行最陡爬坡实验,根据这3个因素的效应大小比较,设定它们的变化方向和步长,结果见表 3。从实验结果可知,最佳发酵条件可能在实验3附近,因此以实验3的条件为响应面实验的中心点。
| 实验号 No. | 右旋糖酐 Dextran (g/L) | 蛋白胨 Peptone (g/L) | 尿素 Urea (g/L) | 右旋糖酐酶活力 Dextranase activity (U/mL) |
| 1 | 14 | 9 | 1 | 81 |
| 2 | 13 | 8 | 2 | 134 |
| 3 | 12 | 7 | 3 | 185 |
| 4 | 11 | 6 | 4 | 117 |
2.4.3 Box-Benhnken Design (BBD)实验结果
在PB实验及最陡爬坡实验结果的基础上,对右旋糖酐、蛋白胨及尿素3个变量对右旋糖酐酶发酵结果的影响进行考察,采用响应面法进行优化,实验结果如表 4。
| 实验号 No. | 右旋糖酐 Dextran | 蛋白胨 Peptone | 尿素 Urea | 右旋糖酐酶活力 Dextranase activity (U/mL) |
| 1 | 1 | -1 | 0 | 202 |
| 2 | 0 | 1 | 1 | 191 |
| 3 | -1 | 0 | 1 | 212 |
| 4 | 0 | 0 | 0 | 229 |
| 5 | 0 | 0 | 0 | 228 |
| 6 | -1 | 1 | 0 | 217 |
| 7 | 0 | 1 | -1 | 207 |
| 8 | 0 | -1 | -1 | 171 |
| 9 | 1 | 1 | 0 | 185 |
| 10 | 1 | 0 | 1 | 184 |
| 11 | 1 | 0 | -1 | 210 |
| 12 | 0 | -1 | 1 | 211 |
| 13 | -1 | 0 | -1 | 173 |
| 14 | -1 | -1 | 0 | 175 |
| 15 | 0 | 0 | 0 | 225 |
通过Design Expert软件对表 4中实验结果进行二次多元回归拟合,得到二次多元回归方程:Y=227.33+0.50A+5.13B+4.63C-14.75AB-16.25AC-14.00BC-16.42A2-16.17B2-16.17C2,其中Y为右旋糖酐酶活力。进一步对该模型进行方差分析,结果如表 5。
| 来源 Source | 平方和 Sum of squares | 自由度 Freedom | 均方和 Mean squares | F值 F value | P值 P value | 显著性 Significant |
| Model | 5 628.92 | 9 | 625.44 | 53.53 | 0.000 2 | ** |
| A | 2.00 | 1 | 2.00 | 0.17 | 0.696 2 | |
| B | 210.12 | 1 | 210.12 | 17.99 | 0.008 2 | ** |
| C | 171.13 | 1 | 171.13 | 14.65 | 0.012 3 | * |
| AB | 870.25 | 1 | 870.25 | 74.49 | 0.000 3 | ** |
| AC | 1 056.25 | 1 | 1 056.25 | 90.41 | 0.000 2 | ** |
| BC | 784.00 | 1 | 784.00 | 67.10 | 0.000 4 | ** |
| A2 | 995.10 | 1 | 995.10 | 85.17 | 0.000 3 | ** |
| B2 | 965.03 | 1 | 965.03 | 82.60 | 0.000 3 | ** |
| C2 | 965.03 | 1 | 965.03 | 82.60 | 0.000 3 | ** |
| 残差 Residual | 58.42 | 5 | 11.68 | |||
| 失拟项 Lack of fit | 49.75 | 3 | 16.58 | 3.83 | 0.214 1 | 不显著 Not significant |
| 纯误差 Pure error | 8.67 | 2 | 4.33 | |||
| 总和 Cor total | 5 687.33 | 14 | ||||
| 注:**代表极显著,*代表显著 Note: **means extremely significant,*means significant | ||||||
从表 5可以看到,该方程P值为0.000 2,失拟项P值为0.214 1,说明模型回归极显著,失拟度不显著;相关系数R2为0.989 7,表明相关性良好;校正系数Radj2为0.971 2,说明拟合程度良好,误差较小,该响应面97.12%的变化可以由此模型解释。
各因素之间交互作用及其对右旋糖酶活力影响如图 6所示,在3个因素的取值范围内,右旋糖酐酶活力均存在最大值。从图 6a可知,蛋白胨与右旋糖酐交互作用明显,在一定范围内随着蛋白胨和右旋糖酐取值不断增大,右旋糖酐酶活力不断增大,然后开始降低。从图 6b可知,尿素与右旋糖酐交互作用明显,过高或过低的取值都会使酶活力降低。从图 6c可知,尿素与蛋白胨对右旋糖酐酶活力影响极为显著,表现为陡峭的曲面。

|
| 图 6 各因素交互作用图 Fig. 6 Map of cross effect of each factors |
根据回归模型预测右旋糖酐酶活力最大为228 U/mL,此时右旋糖酐T2000用量为11.88 g/L,蛋白胨用量为7.15 g/L,尿素用量为3.14 g/L。根据预测结果进行验证实验,平行3次所得右旋糖酐酶活力分别为227,227,229 U/mL,平均值为227.66 U/mL,与预测结果基本一致。
因此,经过优化,确定腐皮镰刀菌DJ72发酵生产右旋糖酐酶的最佳配方为右旋糖酐T2000 11.88 g/L,蛋白胨7.15 g/L,尿素3.14 g/L,磷酸氢二钾1.50 g/L,硫酸镁0.20 g/L,硫酸亚铁0.05 g/L。
3 讨论提高右旋糖酐酶发酵产量的方法有很多,如Li等[16]采用补料分批发酵和两步发酵法提高了右旋糖酐酶的活力,分别为159.50和187 U/mL。吴敏等[17]通过基因工程的方法将右旋糖酐酶酶活力提高到240 U/mL。其中,响应面法是运用较多并且行之有效的培养基优化方法,如曹研研等[18]通过响应面法优化棘孢青霉菌的发酵条件,将右旋糖酐酶酶活力提高了88%。杨帆等[19]通过响应面法优化圆弧青霉发酵右旋糖酐酶的发酵培养基,将酶活力提高1.7倍。本研究通过响应面法优化腐皮镰刀菌DJ72发酵产右旋糖酐酶的培养基成分,与初始发酵培养基相比,右旋糖酐酶活力从98 U/mL提升至228 U/mL,酶活力提升1.3倍。
国际上有关右旋糖酐酶生产菌株的报道已有很多,但是有关腐皮镰刀菌生产右旋糖酐酶的报道较少,迄今为止仅见到Maksimov等[20]发表的一篇相关文章,类似的报道国内尚未见到。本研究是国内首次有关腐皮镰刀菌生产右旋糖酐酶的报道,该工作一方面扩充了国内有关右旋糖酶来源菌株的范围,另一方面也为研究人员深入研究右旋糖酐酶提供基础数据。
| [1] |
HOU D Z, HUANG S X, CHEN S. Biosynthesis of oligodextrans through synergistic catalysis of dextransucrase and dextranase in a recycle membrane bioreactor[J]. Sugar Tech, 2018, 20(5): 566-573. DOI:10.1007/s12355-018-0629-8 |
| [2] |
LI F J, ZHANG H Y, LI Y, et al. Simultaneous identification and quantification of dextran 20 and sucrose in lyophilized thrombin powder by size exclusion chromatography with ELSD[J]. Chromatographia, 2012, 75(3/4): 187-191. DOI:10.1007/s10337-011-2170-8 |
| [3] |
BEJAR W, GABRIEL V, AMARI M, et al. Characterization of glucansucrase and dextran from Weissella sp.TN610 with potential as safe food additives[J]. .International Journal of Biological Macromolecules, 2013, 52: 125-132. DOI:10.1016/j.ijbiomac.2012.09.014 |
| [4] |
常国炜, 林荣珍, 曾练强, 等. 右旋糖酐酸解与酶解产物比较[J]. 甘蔗糖业, 2012(6): 33-38. DOI:10.3969/j.issn.1005-9695.2012.06.008 |
| [5] |
JIMENEZ E R. Dextranase in sugar industry: A review[J]. Sugar Tech, 2009, 11(2): 124-134. DOI:10.1007/s12355-009-0019-3 |
| [6] |
THITARAM S N, CHUNG C H, DAY D F, et al. Isomaltooligosaccharide increases cecal Bifidobacterium population in young broiler chickens[J]. Poultry Science, 2005, 84(7): 998-1003. DOI:10.1093/ps/84.7.998 |
| [7] |
PLESZCZYNSKA M. Dextran and dextranase-microbial sources, properties and applications[J]. Biotechnologia, 1999(4): 45-61. |
| [8] |
焦豫良, 王淑军, 吕明生, 等. 产右旋糖酐酶埃氏交替单胞菌的筛选、鉴定及酶活分析[J]. 食品工业科技, 2013, 34(2): 171-174, 178. |
| [9] |
ABDEL-AZIZ M, TALKHAN J C, FATMA N, et al. Purification and characterization of dextranase from a new strain of Penicillium funiculosum[J]. Journal of Applied Sciences Research, 2007, 3(11): 1509-1516. |
| [10] |
EL-SHAMY A R, ATALLA S M. Immobilization of dextranase by Aspergillus penicillioides NRC 39 and its properties[J]. African Journal of Microbiology Research, 2014, 8(49): 3893-3900. |
| [11] |
BHATIA S, BHAKRI G, ARORA M, et al. Kinetic and thermodynamic properties of partially purified dextranase from Paecilomyces lilacinus and its application in dextran removal from cane juice[J]. Sugar Tech, 2015, 18(2): 204-213. |
| [12] |
VIRGEN-ORTIZ J J, IBARRA-JUNQUERA V, ESCALANTE-MINAKATA P, et al. Kinetics and thermodynamic of the purified dextranase from Chaetomium erraticum[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 122: 80-86. DOI:10.1016/j.molcatb.2015.08.020 |
| [13] |
ZHANG Y Q, LI R H, ZHANG H B, et al. Purification, characterization, and application of a thermostable dextranase from Talaromyces pinophilus[J]. Journal of Industrial Microbiology & Biotechnology, 2017, 44(2): 317-327. DOI:10.1007/s10295-016-1886-8 |
| [14] |
张洪斌, 吴定涛, 黄丽君, 等. 一株产右旋糖酐酶青霉的分离及酶的纯化和性质[J]. 微生物学报, 2011, 51(4): 495-503. |
| [15] |
WU D T, ZHANG H B, HUANG L J, et al. Purification and characterization of extracellular dextranase from a novel producer, Hypocrea lixii F1002, and its use in oligodextran production[J]. Process Biochemistry, 2011, 46(10): 1942-1950. DOI:10.1016/j.procbio.2011.06.025 |
| [16] |
LI K, LU H Q, HANG F X, et al. Improved dextranase production by Chaetomium gracile through optimization of carbon source and fermentation parameters[J]. Sugar Tech, 2017, 19(4): 432-437. DOI:10.1007/s12355-016-0476-4 |
| [17] |
吴敏, 张宇馨, 胡雪芹, 等. 棘孢青霉右旋糖酐酶基因克隆及其在毕赤酵母中的表达[J]. 食品科学, 2018, 39(18): 73-80. DOI:10.7506/spkx1002-6630-201818012 |
| [18] |
曹研研, 张洪斌, 李若菡, 等. 棘孢青霉菌发酵产右旋糖酐酶的条件优化[J]. 食品科学, 2015, 36(23): 215-220. DOI:10.7506/spkx1002-6630-201523040 |
| [19] |
杨帆, 张浩, 赵世光. 圆弧青霉产右旋糖酐酶培养基的优化[J]. 安徽工程大学学报, 2017, 32(2): 1-6. DOI:10.3969/j.issn.2095-0977.2017.02.001 |
| [20] |
MAKSIMOV V I, DANILOVA T I, KHASIPDZHEVA A D, et al. Stabilization of dextranase from Penicillium funiculosum and Fusarium solani during heating and freeze-drying[J]. Prikl Biokhim Mikrobiol, 1979, 15(6): 846-851. |


