2. 武汉科技大学, 感染免疫与肿瘤微环境研究所, 职业危害识别与控制湖北省重点实验室, 湖北武汉 430081
2. Hubei Province Key Laboratory of Occupational Hazard Identification and Control, Institute of Infection, Immunology and Tumor Microenvironments, Wuhan University of Science and Technology, Wuhan, Hubei, 430081, China
近年来,海洋来源的真菌逐渐成为天然产物研究的热点。与陆生真菌相比,海洋真菌长期处于高盐、高压、低温、缺乏营养的无光环境下,独特的生长条件使海洋来源真菌能够产生比陆生真菌更多的次生代谢产物[1, 2]。海洋来源真菌大多是从红树林、海洋无脊椎动物中分离得到,这些真菌的次生代谢产物具有细胞毒、杀虫和酶抑制等生物活性[3-5]。
木霉属Trichoderma sp.真菌是一种在世界范围内广泛存在的丝状真菌,常从近海土壤、腐烂的木材和其他植物有机物质中分离得到[6-8]。近年来木霉因其特有的生物活性而受到广泛关注,其中次生代谢产物的多样性是其应用潜力的主要来源。各项国内外药理活性实验证明,木霉属真菌的次生代谢产物具有抗植物病原菌、杀虫、细胞毒、抗菌、抗氧化等多种生物活性[9-11]。本文对2012-2021年海洋来源的木霉属真菌次生代谢产物的化学成分及其生物活性进行综述,并对木霉属真菌的应用前景进行展望。
1 木霉属真菌次生代谢产物化学结构与生物活性木霉属真菌次生代谢产物的种类主要包括聚酮类、肽类、萜类及其他类型化合物。
1.1 聚酮类聚酮(Polyketides)是由真核生物及原核生物产生的一类次级代谢产物,其来源广泛、种类繁多[12]。Khamthong等[13]从来源于海扇的黄绿木霉Trichoderma aureoviride PSU-F95中分离得到2个新的聚酮trichodermaquinone和trichodermaxanthone(1, 2),其中化合物1对耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)表现出微弱的抗菌活性,最低抑菌浓度(Minimum Inhibitory Concentration, MIC)值为200 μmol/L,结果表明,化合物结构与抗菌活性之间有着密切联系,蒽醌骨架中的C-3甲基和C-6羟基对于抗MRSA的抗菌活性是必需的。Chen等[14]对中国闵河河口的沉积物中三百多株真菌进行筛选,得到对A-375细胞系具有显著活性的桔绿木霉Trichoderma citrinoviride,并从中分离提取得到3个新的聚酮化合物trichoderiol C、citrinoviric acid和penicillenol D (3 - 5),其中化合物4和5对A-375细胞系表现出中等程度的细胞毒性作用,半抑制浓度(50% Inhibitory Concentration, IC50)值分别为85.7和32.6 μmol/L,该研究也是首次发现Trichoderma citrinoviride的细胞毒作用。Yamazaki等[15]对日本青森县的海水样本中的Trichoderma sp.TPU1237进行分离,得到2个新的聚酮化合物trichoketides A和B (6, 7),化合物6和7是C-8位(二氢呋喃环α位)的差向异构体,它们都对蛋白酪氨酸磷酸酶1B (PTP1B)表现出一定的抑制活性,IC50值分别为53.1和65.1 μmol/L。研究表明,PTP1B是胰岛素和瘦素信号级联的主要负性调节因子,它将成为治疗Ⅱ型糖尿病和肥胖药物的有效靶点。尽管化合物6和7对PTP1B的抑制活性并不显著,但由于它们具有新颖的结构,有开发成新药物的潜力。Zhao等[16]从来源于中国海南岛的红树林植物根茎内部组织的木霉属真菌Trichoderma harzianum D13中分离得到1个新的聚酮类物质nafuredin C (8),化合物8对稻瘟病菌具有明显的抗真菌活性,MIC值为8.63 μmol/L,该研究补充了海洋来源的木霉属真菌在农业方面的应用研究成果,为新型抗真菌农药的发现奠定了基础。聚酮类化合物1 - 8的结构如图 1所示。
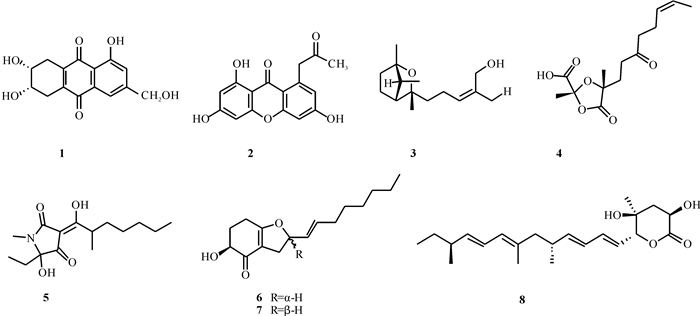
|
| 图 1 聚酮类化合物1 - 8 Fig. 1 Polyketide compounds 1 - 8 |
1.2 肽类
从木霉属真菌次生代谢产物分离出的肽类化合物主要包括哌珀霉素类和二嗪哌酮类。Zhao等[16]从来源于中国海南岛的红树林植物根茎内部组织的木霉属真菌Trichoderma harzianum D13中分离得到1个新的杂环二肽trichodermamide G (9),它具有新颖的硫桥环体系,而且对稻瘟病菌和苹果树腐烂病菌都表现出一定的抗菌活性,MIC值分别为17.4和16.7 μmol/L。Chen等[17]在寻找新型抗癌药物过程中,发现了一株对HL-60细胞系具有显著细胞毒活性的木霉Trichoderma asperellum,通过光谱方法、X射线衍射分析和化学衍生化方法确定了新化合物结构,得到2个新的肽类化合物asperelines G和H (10, 11),并首次发现了乙酰化C端和晶体结构。化合物10和11对癌细胞系的细胞都有细胞毒活性,但活性都比较微弱。Panizel等[18]从来源于以色列东地中海海岸海绵的木霉属Trichoderma atroviride中分离得到8个新的多肽(12 - 19),这些新化合物对以色列地中海沿岸分离的环境细菌都具有中等程度的抗菌活性, MIC值为12.5-200 μmol/L。肽类9 - 19的结构如图 2所示。
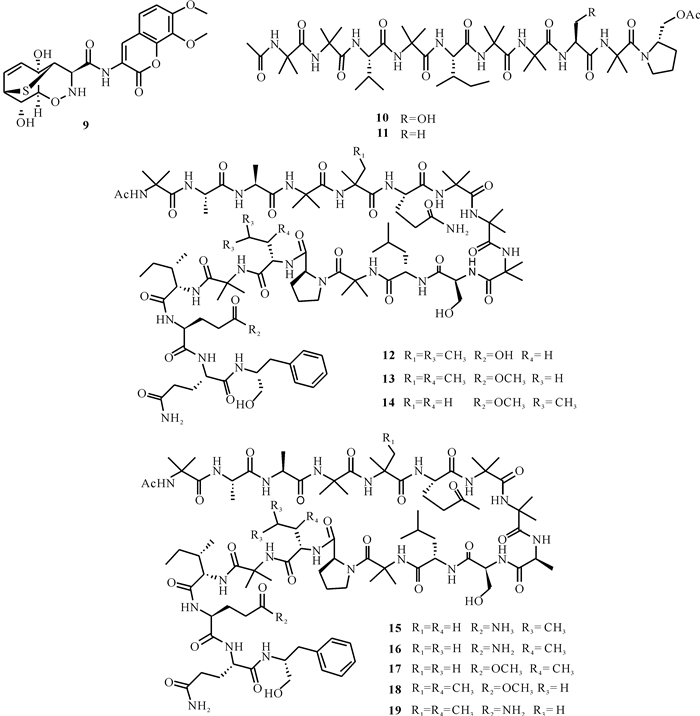
|
| 图 2 肽类化合物9 - 19 Fig. 2 Peptide compounds 9 - 19 |
1.3 萜类
萜类物质由多种挥发性和非挥发性次生代谢产物组成,是地球上最丰富的天然产物之一。海洋来源的木霉属真菌次生代谢产物中萜类占比最大,具有抗病毒、抗菌、抗癌等药理活性[19, 20]。近年来研究发现丝状真菌(包括木霉属真菌)能够产生大量的萜类物质。
Shi等[21]从中国南海西沙群岛珊瑚组织中的木霉属真菌T.harzianum XS-20090075中分离得到3个新的萜类化合物:cleistanthane diterpenoid, harzianolic acid A(20), harziane diterpenoid, harzianone E(21)和cyclonerane sesquiterpenoid, 3, 7, 11-trihydroxy-cycloneran(22)。这是首次从木霉属中获得刺五加二萜和非洲倍半萜,也是第一个氯化的刺五加二萜。在该研究中,使用组蛋白去乙酰化酶(HDAC)抑制剂导致其次级代谢物发生显著变化,并获得新的化合物[21],表明化学基因操作可能是从木霉中发现新次生代谢产物的有效方法。活性实验表明,化合物21对狭小发光杆菌有微弱的抑菌作用[21]。Zhang等[22]从来源于红树林植物木果楝属的内生真菌Trichoderma sp.Xy24的发酵物中分离得到2个新的二萜类化合物harzianelactone和(9R, 10R)-2H-harzianone (23,24)。化合物23含有独特的四环骨架,具有融合的四、五、六和七元碳环。化合物24对HeLa和MCF-7细胞系显示出细胞毒活性,IC50值分别为30.1 μmol/L和30.7 μmol/L。上述化合物新颖的结构骨架使木霉属真菌次生代谢产物的结构多样性增加。
Miao等[23]从一株来源于海藻内生真菌长枝木霉Trichoderma longibrachiatum次生代谢产物中分离得到1个新的萜类化合物Harzianone (25)。化合物25的抗细菌、抗真菌和卤虫毒性评估实验表明,在30 μg/disk的浓度下,它对大肠杆菌和金黄色葡萄球菌有抑制作用,抑制直径分别为8.3和7.0 mm。在卤虫毒性试验中,化合物25在浓度为100 μg/mL时对受试卤虫有82.6%的致死率,半致死浓度(50% Lethal Concentration, LC50)值为23.1 μmol/L。Qin等[24]从中国雷州半岛红树林中得到一株木霉属真菌,并从中分离得到1种新的倍半萜衍生物Ethyl hydroheptelidate (26),其对尖孢镰刀菌和炭疽病菌这2种植物病原真菌具有与阳性对照三唑酮相同程度的抗菌活性,MIC值分别为100和50 μmol/L,对禽致病性大肠杆菌也有着中等程度的抗菌活性,说明化合物26在农业防治方面有较好的应用前景,有成为新型农药的可能性。Cui等[25]从中国南海西沙群岛的一株海绵内生木霉属真菌Trichoderma sp.SM 16中分离得到3个新的卡丁烷倍半萜化合物:trichodermaloids A、B和C (27 - 29),结果没有表现出明显的抗菌活性,但化合物27,28对3种癌细胞系NCIH-460、NCIC-H929和SW620均显示出细胞毒性,IC50值为6.8-12.7 μmol/L。Yamazaki等[26, 27]在一株来源于帕劳海域的红藻中分离得到木霉属真菌Trichoderma cf.brevicompactum,并对其进行发酵分离提取后得到2个新的倍半萜化合物trichobreols D和E (30,31),随后又在含NaCl条件下培养得到3个新的倍半萜化合物(32 - 34)。侵袭性真菌感染是癌症、HIV、糖尿病的常见并发症,由白色念珠菌、烟曲霉、新生隐球菌和米根霉组成的机会性真菌病原体每年可造成100多万人死亡。化合物30对白色念珠菌和新生隐球菌这2种酵母样真菌有抑菌活性,MIC值为6.3 μmol/L;化合物31对这2种酵母样真菌的MIC值分别为12.5和25 μmol/L,有望成为新型抗感染药物的潜力。
Liu等[28]从中国威海红藻组织中的木霉属真菌Trichoderma citrinoviride A-WH-20-3中分离得到2个新的环己烷倍半萜化合物(10E)-isocyclonerotriol和(10Z)-isocyclonerotriol (35,36),这是首次发现环异构化旋风烷,活性实验结果表明,环异构化的结构对生物活性存在影响。Shi等[29]从海洋红藻表皮的内生真菌木霉Trichoderma virens Y13-3分离得到8个新型胡萝卜烷型倍半萜类化合物trichocarotins A-H(37 - 44)、1个新的杜松烷型倍半萜烯化合物(45),其中化合物37 - 44的发现丰富了胡萝卜烷型倍半萜类的结构多样性。Song等[30]从中国大连的海藻内生真菌Trichoderma virens RR-dl-6-8中分离得到1种新的倍半萜化合物Methylhydroheptelidate (46)。化合物31,36,37,42对海洋浮游植物(如海斑藻、赤潮异藻、威尼斯卡氏藻等有害藻类)都具有抑制作用,且对浮游动物的毒性较低,这一特性体现了木霉属真菌次生代谢产物在生物防治方面的应用前景,有望成为防治赤潮的有效手段。
Xie等[31]从中国三亚海洋地区的长棘海星内生真菌木霉T.erinaceum 011F1-1中分离得到1个新的二萜内酯化合物Trichodermaerin (47);Guo等[32]从中国三亚地区海星内部结构里的木霉属真菌Trichoderma erinaceum F1-1中分离得到4种新的萜类化合物harziandione A、cyclonerodiols A、cyclonerodiols B和trichodermaerin A (48 - 51)。萜类20 - 51的结构如图 3所示。
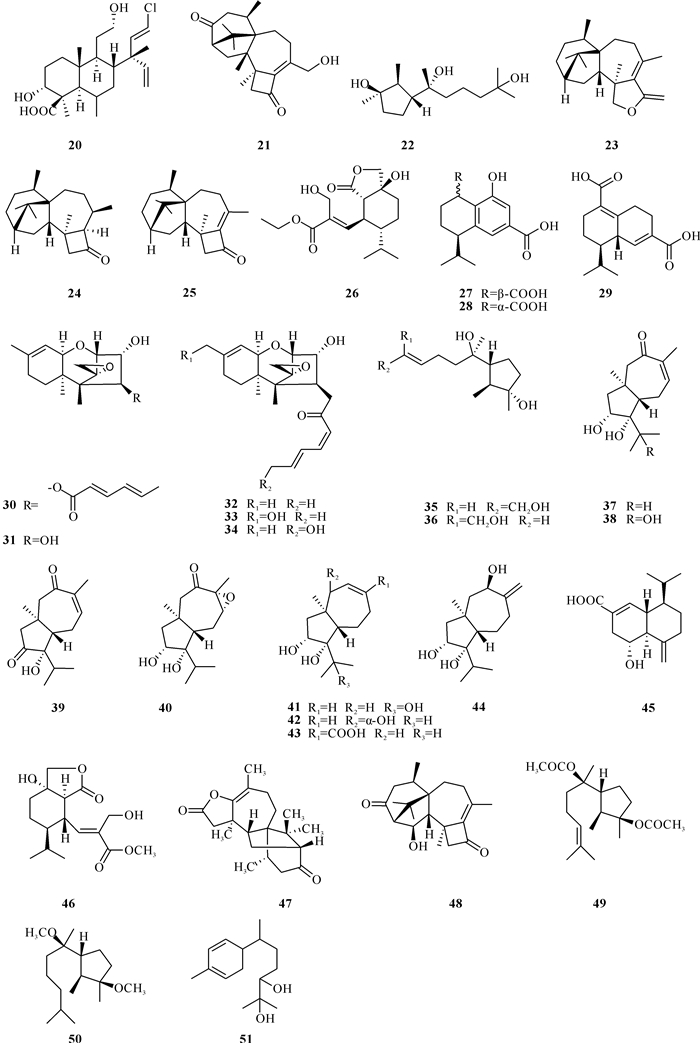
|
| 图 3 萜类化合物20 - 51 Fig. 3 Terpene compounds 20 - 51 |
1.4 其他类型化合物
除上述聚酮、肽类、萜类等化合物外,木霉属真菌次生代谢产物中还有一些其他结构类型新颖的化合物。
Rehman等[33]从中国南海的一株海洋海绵内生真菌T.reesei HN-2016-018中分离得到6种新的山梨醇类化合物:trichoreeseione A、trichoreeseione B、trichodermolide B、13-hydroxy-trichodermolide、24-hydroxy-trichodimerol和15-hydroxy-bisvertinol (52 - 57)。其中化合物52, 53中含萘三酮环,这是首次在山梨醇类化合物中发现该结构特征,化合物54, 55含有独特的双环内酯骨架。山梨醇类家族具有广泛的药理作用,包括细胞毒活性、抗菌活性。该研究发现的新化合物56对A549、MCF-7和HCT116细胞系有细胞毒活性,IC50值分别为5.1,9.5和13.7 μmol/L。Lan等[34]从中国南海珊瑚礁保护区的1个棘冠海星内部组织中分离得到一株内生木霉属真菌Trichoderma sp.(collection No.AF007),并从中提取得到2个新山梨醇化合物(4′Z)-sorbicillin和(2S)-2, 3-dihydro-7-hydroxy-6-methyl-2-[(E)-prop-1-enyl]-chroman-4-one (58, 59),其中化合物58是第一个在山梨基侧链中具有C-4′/C-5双键Z构型的实例,这说明可能仍有大量新的天然山梨醇青霉素有待进一步发现与探索。化合物59是一种不常见的环状山梨酰链的单分子山梨醇类化合物,对MCF-7癌细胞系有细胞毒活性,IC50值为7.82 μmol/L。Liang等[35]从渤海沉积物里的木霉属真菌Trichoderma harzianum R5中分离提取得到1种新的sordarin衍生物trichosordarin A (60),它具有独特的去甲二萜苷元结构,该化合物对海洋浮游动物卤虫具有毒性,LC50值为233 μmol/L。
Wu等[36]从格陵兰海的木霉属真菌Trichoderma sp.Strain MF106的固体发酵粗提物中分离得到2个新的吡啶酮类化合物trichodin A和trichodin B(61, 62)。活性测试表明, 这2种新化合物对4种人类致病性菌株(革兰氏阳性枯草芽孢杆菌、表皮葡萄球菌、金黄色葡萄球菌和白色念珠菌)均具有中等程度的抗菌活性,其中化合物61对这4种致病菌IC50值分别为(27.05±0.53),(24.28±3.90) μmol/L,IC50值>80和(25.38±0.41) μmol/L,化合物62对这4种致病菌IC50值分别为(5.28±0.42),(4.25±0.81),(4.40±0.14)和(26.25±0.14) μmol/L。Tang等[37]从中国福建地区红树林沉积物中木霉属真菌Trichoderma atroviride H548中分离得到3种新的环戊烯酮丙烯酸衍生物: trichodermacid A、trichodermester A和trichodermester B (63 - 65),化合物64具有较强的抗鼠疫菌活性,MIC值为125 μg/disc。Guo等[32]从中国三亚地区海星内部组织中分离出一株木霉属真菌Trichoderma erinaceum F1-1,并从中得到6种新的芳香族化合物(66 - 71),化合物67对人乳腺癌高转移细胞(MDA-MB-435)表现出微弱的细胞毒活性,IC50值为31.9 μmol/L。Shi等[38]从中国大连海洋红藻内生真菌Trichoderma brevicompactum ADL-92中分离得到8个新的三氯丙烯衍生物(72 - 79)和2个新的酮烯衍生物(80,81),化合物79是第一个含氨基糖基的毛癣菌烯,化合物72 - 74,77,78均表现出显著的抗真菌活性。通过分析它们的结构与对应活性高低,结果表明, C-16和C-4上的糖基化使抗真菌活性降低,说明环氧化物在抗真菌性能中发挥着重要作用。
Liu等[28]从中国威海的红藻组织分离出的木霉属真菌中分离得到1个新的异香豆素衍生物trichophenol A(82)。在结构上,trichophenol A是第一个发现的木霉3-苯基异香豆素衍生物;在活性上,它对浮游植物(海斑藻、赤潮异弯藻、威尼斯卡氏藻和东海原甲藻)具有抑制作用,IC50值分别为4.4,9.1,20.0和5.9 μmol/L。Zou等[39]从中国威海红藻组织的木霉属真菌Trichoderma longibrachiatum A-WH-20-2中分离得到1种新的哈兹内酯化合物harzianol A (83),该实验测试了它对4种浮游植物的抑制作用,结果表明, 该化合物对受试对象均有较强的抑制活性,IC50值为0.53-2.70 μmol/L。
Lu等[40]从中国南海地区红树林的深绿木霉Trichoderma atroviride G20-12中提取得到化合物40-(4, 5-dimethyl-1, 3-dioxolan-2-yl) methyl-phenol、(30-hydroxybutan-20-yl) 5-oxopyrrolidine-2-carboxylate和atroviridetide (84 - 86)。Rehman等[41]从中国南海的海绵内生真菌T.reesei HN-2016-018中分离得到1种新的三苯基糖苷gliocladinin D (87)。其他类型化合物52 - 87的结构如图 4所示。综上所述,海洋来源的木霉属真菌多从海绵、海藻中分离得到,详见表 1。
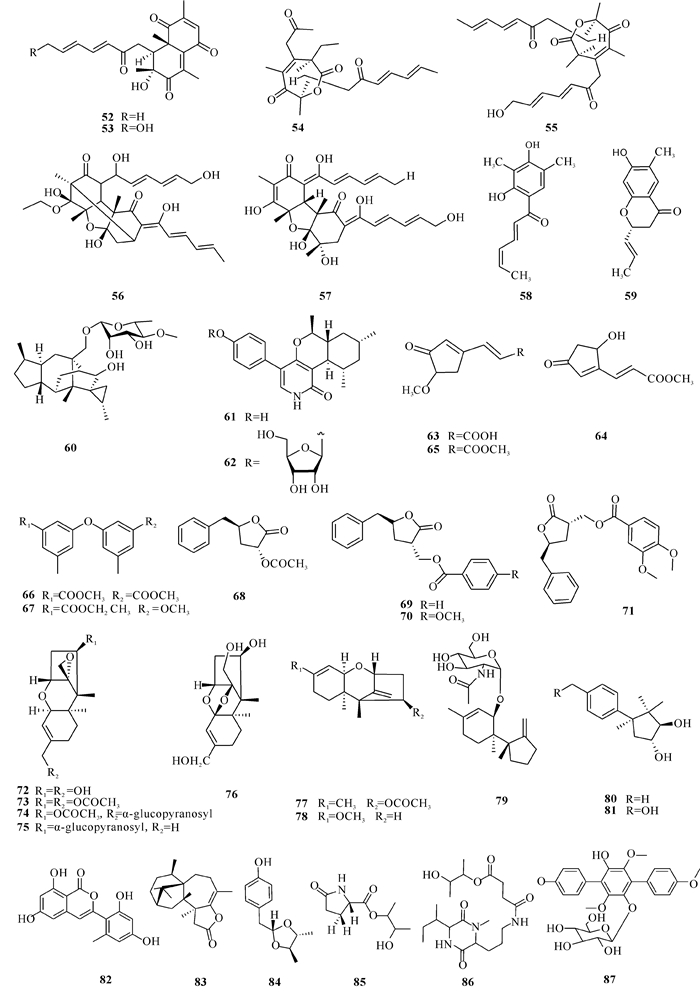
|
| 图 4 其他化合物52 - 87 Fig. 4 Other compounds 52 - 87 |
| 来源 Source |
地点 Place |
编号 No. |
菌株种类 Species of stains |
生物活性 Biological activity |
参考文献 References |
| 海扇 Sea fan |
/ | 1, 2 | Trichoderma aureoviride PSU-F95 | 抗菌活性 Antimicrobial activity |
[13] |
| 海绵 Sponge |
以色列东地中海海岸 East Mediterranean coast of Israel |
12-19 | Trichoderma atroviride | 抗菌活性 Antimicrobial activity |
[18] |
| 中国南海 The South China Sea |
27-29 | Trichoderma sp.SM 16 | 细胞毒活性 Cytotoxicity |
[25] | |
| 中国南海 The South China Sea |
52-57 | Trichoderma reesei (HN-2016-018) | 细胞毒活性 Cytotoxicity |
[33] | |
| 中国南海 The South China Sea |
87 | Trichoderma reesei (HN-2016-018) | / | [41] | |
| 珊瑚 Coral |
中国南海 The South China Sea |
20-22 | Trichoderma harzianum (XS-20090075) | 抗菌活性 Antimicrobial activity |
[21] |
| 海星 Star fish |
中国三亚 Sanya, China |
47 | Trichoderma erinaceum 011F1-1 | / | [31] |
| 中国三亚 Sanya, China |
48-51,66-71 | Trichoderma erinaceum F1-1 | 细胞毒活性 Cytotoxicity |
[32] | |
| 中国南海 The South China Sea |
58, 59 | Trichoderma sp.(collection No.AF007) | 细胞毒活性 Cytotoxicity |
[34] | |
| 海藻 Alga |
中国威海 Weihai, China |
35, 36,82 | Trichoderma citrinoviride A-WH-20-3 | 植物毒活性 Phytotoxicity |
[28] |
| / | 25 | Trichoderma longibrachiatum | 抗菌活性 Antimicrobial activity |
[23] | |
| 中国烟台 Yantai, China |
37-44 | Trichoderma virens Y13-3 | 植物毒活性 Phytotoxicity |
[29] | |
| 中国大连 Dalian, China |
46 | Trichoderma virens RR-dl-6-8 | 植物毒活性 Phytotoxicity |
[30] | |
| 帕劳海域 Palau waters |
30-34 | Trichoderma cf.brevicompactum | 抗菌活性 Antimicrobial activity |
[26, 27] | |
| 中国大连 Dalian, China |
72-81 | Trichoderma brevicompactum ADL-92 | 抗菌活性 Antimicrobial activity |
[38] | |
| 中国威海 Weihai, China |
83 | Trichoderma longibrachiatum A-WH-20-2 | 植物毒活性 Phytotoxicity |
[39] | |
| 红树林 Mangrove |
中国海南省 Hainan Province, China |
8, 9 | Trichoderma harzianum D13 | 抗菌活性 Antimicrobial activity |
[16] |
| 中国海南省 Hainan Province, China |
23, 24 | Trichoderma sp.Xy24 | 细胞毒活性 Cytotoxicity |
[22] | |
| 中国南海 The South China Sea |
26 | Trichoderma harzianum R1 | 抗菌活性 Antimicrobial activity |
[24] | |
| 中国南海 The South China Sea |
84-86 | Trichoderma atroviride G20-12 | / | [40] | |
| 沉积物 Sediment |
中国闵河河口 Min River Estuary of China |
3-5 | Trichoderma citrinoviride | 细胞毒活性 Cytotoxicity |
[14] |
| 中国闵河河口 Min River Estuary of China |
10, 11 | Trichoderma asperellum | 细胞毒活性 Cytotoxicity |
[17] | |
| 中国渤海 Bohai Sea of China |
60 | Trichoderma harzianum R5 | 杀虫活性 Insecticidal activities |
[35] | |
| 中国福建 Fujian, China |
63-65 | Trichoderma atroviride H548 | 抗菌活性 Antimicrobial activity |
[37] | |
| 其他 Others |
日本青森县 Aomori County, Japan |
6, 7 | Trichoderma sp.TPU1237 | PTP1B酶抑制活性 PTP1B inhibitory activities |
[15] |
2 展望
海洋来源木霉属真菌因其具有显著的药理活性和药用价值,近年来受到越来越多的关注,有成为产生具有生物活性的次生代谢产物的潜力海洋真菌来源。近十年来,木霉属真菌次生代谢产物主要是从海绵、红树林、海藻、珊瑚、海星、海洋沉积物中分离出来,其中海绵和红树林是海洋来源木霉属真菌的重要宿主。从木霉属真菌次生代谢产物中共分离出新化合物87个,包括萜类(36.7%)、肽类(12.3%)、聚酮(9.2%)。这些新化合物具有抗菌、抗病毒、细胞毒等多种生物活性,在抗微生物活性方面受到人们青睐,尤其是抗农业致病菌的应用(如稻瘟病菌、尖孢镰刀菌和炭疽病菌等)。此外,木霉属真菌次生代谢产物对有害海洋浮游植物有显著的抑制作用,说明木霉属真菌在生物防治方面有光明前景。
木霉属真菌的开发还存在一些尚需完善的问题:(1)木霉属海洋样本的来源较窄,需要扩大筛选,提高获得木霉属真菌的概率;(2)次生代谢产物的新颖成分仍有待进一步研究;(3)木霉属是生防菌中研究最多的植物病原拮抗真菌,医药领域的应用相对较少,并且次生代谢产物的活性研究不够深入。
综上所述,今后对木霉属真菌次生代谢产物的研究可从以下方面展开:(1)化合物的获得:通过改变培养方法、代谢组学分析方法、基因组激活沉默的基因簇和先导化合物结构修饰,以期获得更多化学结构新颖且具有特异活性的化合物,并对重要次生代谢产物生物合成相关的基因进行确认,以阐明生物合成途径;(2)计算机辅助药物筛选:对木霉属真菌次生代谢产物的构效关系进行计算机虚拟药物筛选,确定具体作用靶点;(3)药理筛选和新药研发:对木霉属真菌次生代谢产物的药理机制进行深入研究,抗菌和细胞毒活性是未来研究的重要领域。
| [1] |
易茜茜, 丁万隆, 李勇. 木霉菌及其对植物真菌病害的防治机制[J]. 中国农学通报, 2009, 25(20): 228-231. |
| [2] |
LI T T, DING T, LI J R. Medicinal purposes: Bioactive metabolites from marine-derived organisms[J]. Mini-Reviews in Medicinal Chemistry, 2019, 19(2): 138-164. |
| [3] |
SU D Q, DING L J, HE S. Marine-derived Trichoderma species as a promising source of bioactive secondary metabolites[J]. Mini-Reviews in Medicinal Chemistry, 2018, 18(20): 1702-1713. DOI:10.2174/1389557518666180727130826 |
| [4] |
SUN W W, WU W H, LIU X L, et al. Bioactive compounds isolated from marine-derived microbes in China: 2009-2018[J]. Marine Drugs, 2019, 17(6): 339. DOI:10.3390/md17060339 |
| [5] |
XU J Z, YI M Q, DING L J, et al. A review of anti-inflammatory compounds from marine fungi, 2000-2018[J]. Marine Drugs, 2019, 17(11): 636. DOI:10.3390/md17110636 |
| [6] |
YANG X L, LIU J P, MEI J H, et al. Origins, structures and bioactivities of secondary metabolites from marine-derived Penicillium fungi[J]. Mini-Reviews in Medicinal Chemistry, 2021, 21(15): 2000-2019. DOI:10.2174/1389557521666210217093517 |
| [7] |
HAN C Z. Advances in utilization of antagonistic Trichoderma spp.against plant pathogens[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(4): 946-952. |
| [8] |
CUMMINGS N J, AMBROSE A, BRAITHWAITE M, et al. Diversity of root-endophytic Trichoderma from Malaysian Borneo[J]. Mycological Progress, 2016, 15(5): 50. DOI:10.1007/s11557-016-1192-x |
| [9] |
ZHANG J L, TANG W L, HUANG Q R, et al. Trichoderma: A treasure house of structurally diverse secondary metabolites with medicinal importance[J]. Frontiers in Microbiology, 2021, 12: 723828. DOI:10.3389/fmicb.2021.723828 |
| [10] |
LI M F, LI G H, ZHANG K Q. Non-volatile metabolites from Trichoderma spp[J]. Metabolites, 2019, 9(3): 58. DOI:10.3390/metabo9030058 |
| [11] |
KESWANI C, MISHRA S, SARMA B K, et al. Unraveling the efficient applications of secondary metabolites of various Trichoderma spp[J]. Applied Microbiology and Biotechnology, 2013, 98(2): 533-544. |
| [12] |
庞子萱, 吴季恒, 严豪, 等. 聚酮类化合物研究进展[J/OL]. 食品与发酵工业: 1-13. [2021-6-23]. https://doi.org/10.13995/j.cnki.11-1802/ts.028069. DOI: 10.13995/j.cnki.11-1802/ts.028069.
|
| [13] |
KHAMTHONG N, RUKACHAISIRIKUL V, TAD-PETCH K, et al. Tetrahydroanthra quinone and xanthone derivatives from the marine-derived fungus Trichoderma aureoviride PSU-F95[J]. Archives of Pharmacal Research, 2012, 35(3): 461-468. DOI:10.1007/s12272-012-0309-2 |
| [14] |
CHEN L, ZHANG Q Q, HU X, et al. Novel cytotoxic metabolites from the marine-derived fungus Trichoder-ma citrinoviride[J]. Heterocycles, 2014, 89(1): 189-196. DOI:10.3987/COM-13-12874 |
| [15] |
YAMAZAKI H, SAITO R, TAKAHASHI O, et al. Trichoketides A and B, two new protein tyrosine phosphatase 1B inhibitors from the marine-derived fungus Trichoderma sp[J]. The Journal of Antibiotics, 2015, 68(10): 628-632. DOI:10.1038/ja.2015.44 |
| [16] |
ZHAO D L, ZHANG X F, HUANG R H, et al. Antifungal nafuredin and epithiodiketo piperazine derivatives from the mangrove-derived fungus Trichoderma harzianum D13[J]. Frontiers in Microbiology, 2020, 11: 1495. DOI:10.3389/fmicb.2020.01495 |
| [17] |
CHEN L, ZHONG P, PAN J R, et al. Asperelines G and H, two new peptaibols from the marine-derived fungus Trichoderma asperellum[J]. Heterocycles, 2013, 87(3): 645-655. DOI:10.3987/COM-12-12644 |
| [18] |
PANIZEL I, YARDEN O, ILAN M, et al. Eight new peptaibols from sponge-associated Trichoderma atroviride[J]. Marine Drugs, 2013, 11(12): 4937-4960. DOI:10.3390/md11124937 |
| [19] |
REINO J L, GUERRERO R F, HERNÁNDEZGALÁ-N R, et al. Secondary metabolites from species of the biocontrol agent Trichoderma[J]. Phytochemistry Reviews, 2008, 7(1): 89-123. |
| [20] |
CARDOZA R E, MALMIERCA M G, HERMOSA M R, et al. Identification of loci and functional characterization of trichothecene biosynthesis genes in filamentous fungi of the genus Trichoderma[J]. Applied and Environmental Microbiology, 2011, 77(14): 4867-4877. DOI:10.1128/AEM.00595-11 |
| [21] |
SHI T, SHAO C L, LIU Y, et al. Terpenoids from the coral-derived fungus Trichoderma harzianum(XS-20090075) induced by chemical epigenetic manipulation[J]. Frontiers in Microbiology, 2020, 11: 572. DOI:10.3389/fmicb.2020.00572 |
| [22] |
ZHANG M, LIU J M, ZHAO J L, et al. Two new dit-erpenoids from the endophytic fungus Trichoderma sp.Xy24 isolated from mangrove plant Xylocarpus granatum[J]. Chinese Chemical Letters, 2016, 27(6): 957-960. DOI:10.1016/j.cclet.2016.02.008 |
| [23] |
MIAO F P, LIANG X R, YIN X L, et al. Absolute configurations of unique harziane diterpenes from Trichoderma species[J]. Organic Letters, 2012, 14(15): 3815-3817. DOI:10.1021/ol3014717 |
| [24] |
QIN C, HU Z B, XIONG Y H, et al. A new sesquiterpene derivative from the mangrove endophytic fungus Trichoderma harzianum(Strain No.R1)[J]. Chemistry of Natural Compounds, 2021, 57(2): 312-314. DOI:10.1007/s10600-021-03355-5 |
| [25] |
CUI J, SHANG R Y, SUN M, et al. Trichodermaloids A-C, cadinane sesquiterpenes from a marine sponge symbiotic Trichoderma sp.SM16 fungus[J]. Chemistry & Biodiversity, 2020, 17(4): e2000036. DOI:10.1002/cbdv.202000036 |
| [26] |
YAMAZAKI H, YAGI A, TAKAHASHI O, et al. Antifungal trichothecene sesquiterpenes obtained from the culture broth of marine-derived Trichoderma cf. brevicompactum and their structure-activity relationship[J]. Bioorganic & Medicinal Chemistry Letters, 2020, 30(17): 127375. DOI:10.1016/j.bmcl.2020.127375 |
| [27] |
YAMAZAKI H, TAKAHASHI O, KIRIKOSHI R, et al. Epipolythiodiketopiperazine and trichothecene derivatives from the NaI-containing fermentation of marine-derived Trichoderma cf.brevicompactum[J]. The Journal of Antibiotics, 2020, 73(8): 559-567. DOI:10.1038/s41429-020-0314-5 |
| [28] |
LIU X H, HOU X L, SONG Y P, et al. Cyclonerane sesquiterpenes and an isocoumarin derivative from the marine-alga-endophytic fungus Trichoderma citrinoviride A-WH-20-3[J]. Fitoterapia, 2020, 141: 104469. DOI:10.1016/j.fitote.2020.104469 |
| [29] |
SHI Z Z, FANG S T, MIAO F P, et al. Trichocarotins A-H and trichocadinin A, nine sesquiterpenes from the marine-alga-epiphytic fungus Trichoderma virens[J]. Bioorganic Chemistry, 2018, 81: 319-325. DOI:10.1016/j.bioorg.2018.08.027 |
| [30] |
SONG Y P, SHI X S, WANG B G, et al. Cadinane and carotane derivatives from the marine algicolous fungus Trichoderma virens RR-dl-6-8[J]. Fitoterapia, 2020, 146: 104715. DOI:10.1016/j.fitote.2020.104715 |
| [31] |
XIE Z L, LI H J, WANG L Y, et al. Trichodermaerin, a new diterpenoid lactone from the marine fungus Trichoderma erinaceum associated with the sea star Acanthaster planci[J]. Natural Product Communications, 2013, 8(1): 67-68. |
| [32] |
GUO Y W, GONG B Q, YUAN J, et al. l-Phenylalanine alters the privileged secondary metabolite production in the marine-derived fungus Trichoderma erinaceum F1-1[J]. Journal of Natural Products, 2020, 83(1): 79-87. DOI:10.1021/acs.jnatprod.9b00710 |
| [33] |
REHMAN S U, YANG L J, ZHANG Y H, et al. Sorbicillinoid derivatives from sponge-derived fungus Trichoderma reesei(HN-2016-018)[J]. Frontiers in Microbiology, 2020, 11: 1334. DOI:10.3389/fmicb.2020.01334 |
| [34] |
LAN W J, ZHAO Y, XIE Z L, et al. Novel sorbicillin analogues from the marine fungus Trichoderma sp.associated with the seastar Acanthaster planci[J]. Natural Product Communications, 2012, 7(10): 1337-1340. |
| [35] |
LIANG X R, MA X Y, JI N Y. Trichosordarin A, a norditerpene glycoside from the marine-derived fungus Trichoderma harzianum R5[J]. Natural Product Research, 2020, 34(14): 2037-2042. DOI:10.1080/14786419.2019.1574782 |
| [36] |
WU B, OESKER V, WIESE J, et al. Two new antibiotic pyridones produced by a marine fungus, Trichoderma sp.strain MF106[J]. Marine Drugs, 2014, 12(3): 1208-1219. DOI:10.3390/md12031208 |
| [37] |
TANG X X, LIU S Z, SUN Y Y, et al. New cyclopentenoneacrylic acid derivatives from a marine-derived fungus Trichoderma atroviride H548[J]. Natural Product Research, 2021, 35(21): 3772-3779. DOI:10.1080/14786419.2020.1737053 |
| [38] |
SHI Z Z, LIU X H, LI X N, et al. Antifungal and antimicroalgal trichothecene sesquiter penes from the marine algicolous fungus Trichoderma brevicompactum A-DL-9-2[J]. Journal of Agricultural and Food Chemistry, 2020, 68(52): 15440-15448. DOI:10.1021/acs.jafc.0c05586 |
| [39] |
ZOU J X, SONG Y P, JI N Y. Deoxytrichodermaerin, a harziane lactone from the marine algicolous fungus Trichoderma longibrachiatum A-WH-20-2[J]. Natural Product Research, 2019, 35(2): 216-221. |
| [40] |
LU X, TIAN L, CHEN G, et al. Three new compounds from the marine-derived fungus Trichoderma atroviride G20-12[J]. Journal of Asian Natural Products Research, 2012, 14(7): 647-651. DOI:10.1080/10286020.2012.682256 |
| [41] |
REHMAN S U, WU J S, YANG L J, et al. One new terphenyl glycoside from a sponge-derived fungus Trichoderma reesei(HN-2016-018)[J]. Natural Product Communications, 2020, 15(2): 1934578X-20907753. DOI:10.1177/1934578X20907753 |


