2. 广西中药质量标准研究重点实验室,广西南宁 530022
2. Guangxi Key Laboratory of Traditional Chinese Medicine Quality Standards, Nanning, Guangxi, 530022, China
鬼画符(Breynia fruticosa)是大戟科植物黑面神的干燥全株,主要分布于广西、广东、浙江、福建、贵州等省区。《中华本草》中记载,鬼画符叶味微苦,性凉,有毒;鬼画符根味苦,性寒,有毒,有清热祛湿、化瘀消肿的功效[1]。传统主要用于治疗腹痛吐泻、扁桃体炎、疔毒、疮疖、湿疹、皮炎、跌打肿痛[2]。研究表明,鬼画符含有鞣质、酚酸、三萜类、黄酮类、甾体等化合物[3, 4]。现代药理学研究证实,鬼画符具有抗炎止痒、抑菌、免疫抑制、抗I型超敏反应及抗病毒等作用[5-7]。鬼画符是一些中成药品种的原料药材,有小毒,若不正确使用会损害人体重要的脏器功能,由于目前仍缺乏鬼画符药材相关的毒性研究,其具体毒性机制未明。
网络毒理学源自网络药理学,通过构建“毒性-毒性成分-毒性靶点”互作网络模型,分析网络中特定组分与毒理学的相关性,可用于中药药材毒性物质及机制的初步探讨,并通过动物和细胞水平的验证,阐释药材毒性的相关机制[8]。本研究中,为探究鬼画符致脏器毒性,拟开展长期毒性试验确认毒性靶器官,并通过网络毒理学和实验验证确认鬼画符的毒性机制,为鬼画符临床应用提供毒性剂量依据和靶器官毒性机制信息,为药物开发及临床应用提供药理学依据。
1 材料与方法 1.1 材料 1.1.1 动物及饲料SPF级雄性SD大鼠60只,体质量180-220 g,购自广西医科大学实验动物中心,动物生产许可证号SCXK(桂)2014-0002。普通饲料由北京科澳协力饲料有限公司提供。大鼠饲养环境室温保持在20-25℃,湿度55%左右,动物自由进食、进水,按每日12 h昼夜循环。
1.1.2 药物与试剂鬼画符冻干粉(批号: 20190901),黑褐色粉末,有吸湿性,密封袋装,每袋450 g,相当生药量为17.4 g生药/g冻干粉,由广西梧州制药(集团)股份有限公司提供,置5℃冰箱密封保存。苏木素伊红染液,购自北京雷根生物科技公司;诱导型一氧化氮合酶(iNOS)单克隆抗体、白介素1β (IL-1β)单克隆抗体、白介素6 (IL-6)单克隆抗体、缺氧诱导因子1α (HIF-1α)单克隆抗体、免疫组化试剂盒均购自武汉三鹰生物技术有限公司;谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒均购自深圳迈瑞生物医疗电子股份有限公司。
1.1.3 仪器Leica EG1150石蜡包埋机、RM2255组织石蜡切片机、DM2500光学显微镜,均购自德国徕卡仪器有限公司;BS-600全自动血液生化分析仪,购自深圳迈瑞生物医疗电子股份有限公司。
1.2 方法 1.2.1 受试药物的制备取鬼画符冻干粉14.5 g,用1 000 mL纯净水溶解混匀,浓度为0.014 5 g冻干粉/mL(相当于0.25 g生药/mL),即为高剂量组药液;取500 mL高剂量组药液稀释1倍,浓度为0.007 25 g冻干粉/mL(相当于0.125 g生药/mL),即为低剂量组药液。
1.2.2 分组及给药60只SD大鼠,经适应性饲养7 d后,按体质量随机分为3组,即对照组、高剂量组、低剂量组,每组20只,各组大鼠雌雄各半。其中高、低剂量组大鼠灌胃鬼画符水提物剂量分别为5 g生药/kg体质量、2.5 g生药/kg体质量(按生药材人临床日用量为15 g,以60 kg成人计算,鬼画符临床每日用量为0.25 g/kg,则大鼠高、低剂量分别相当于生药材人临床日用量的20倍和10倍),对照组大鼠给予等量纯净水,给药体积为20 mL/kg。给药期为3个月和6个月,观察给药后动物毒性反应及相应毒性靶器官的病理变化。
1.2.3 血清AST和ALT水平检测分别于给药3个月和给药6个月后,每组取10只大鼠经异氟烷麻醉,腹主动脉取血,于4℃ 3 500 r/min离心10 min,取血清,采用全自动血液生化分析仪检测大鼠血清中AST和ALT水平,评估大鼠肝损伤情况。
1.2.4 肝脏病理学检测动物麻醉取血后, 摘取肝脏组织,轻轻擦除表面血液,用10%中性福尔马林溶液固定,然后进行梯度乙醇脱水、二甲苯透明、浸蜡、包埋,再进行石蜡切片和HE染色[9],观察肝脏病理形态变化。
1.2.5 网络毒理学分析 1.2.5.1 鬼画符化学成分筛选鬼画符化学成分库的建立基于中医药整合药理学研究平台TCMIP (http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)以及中国知网(https://www.cnki.net/)公开发表的文献收集鬼画符的化学成分。
1.2.5.2 药物预测靶点筛选通过SwissTargetPrediction (http://www.swisstargetprediction.ch/)、中药系统药理学平台TCMSP (https://old.tcmsp-e.com/tcmsp.php)、中医药整合药理学研究平台TCMIP (http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)等在线数据库预测鬼画符中化学成分的作用靶标,构建鬼画符化学成分作用靶标信息。
1.2.5.3 肝毒性作用靶标的分析、筛选和构建在GeneCards数据库(http://www.genecards.org/)、基因组学毒理数据库CTD (http://ctdbase.org/)中输入关键词“肝毒性(Hepatoxicity)、肝损伤(Liver injury)”,筛选已报道的与肝损伤相关且标记有“marker/mechanism”的基因,去除重复基因和假阳性基因,得到肝毒性靶标数据库。
1.2.5.4 PPI网络的构建与分析将鬼画符成分预测靶点与肝毒性靶点进行交集,取交集部分靶点分别作为药物致肝损伤的预测靶标,并分别取上述交集靶点,基于STRING平台构建其蛋白质-蛋白质相互作用(PPI)网络,将其导入Cytoscape软件进行拓扑学分析,具体操作如下:将所获取的鬼画符致肝毒性的预测靶标分别导入STRING,选择“homo sapiens”,打分默认0.4,获取TSV格式结果,其中保留文件中node1、node2和Combined score信息并导入Cytoscape软件绘制药物成分-靶点-疾病网络相互作用网络图。利用Cytoscape中的“Network Analyer”功能对PPI网络进行拓扑学分析,以网络节点中的拓扑结构特征值度值(Degree)为重要参考,提取分析这些候选节点网络关系,计算节点的度值、接近中心性(Closeness Centrality,CC)和中介中心度(Betweenness Centrality,BC) 3个拓扑结构特征值。选取网络中≥degree值中位数的1.5倍的靶点作为鬼画符致肝损伤的关键靶标,用于后续基因本体论(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。
1.2.5.5 GO分析与KEGG通路富集分析GO通过生物过程(Biology process)、分子功能(Molecular function)、细胞组成(Cellular component) 3个维度对基因进行说明与注释。KEGG通路分析可以直观检测靶标参与的通路,借助于统计分析方法对靶标进行富集分析。利用Cytoscape软件的ClueGo插件和DAVID数据库(https://david.ncifcrf.gov/)对药物致肝损伤的关键靶标进行GO分析和KEGG通路富集分析,获得鬼画符致肝损伤的关键靶标蛋白在基因功能和信号通路中的富集结果。
1.2.6 肝脏免疫组化检测根据前期网络毒理学分析药物致肝毒性预测结果,针对肝毒性相关预测靶点及主要损伤机制进行验证,利用免疫组化技术,检测鬼画符对肝脏组织中HIF-1α、iNOS、IL-1β、IL-6蛋白表达的影响。取给药3个月和6个月后的大鼠肝脏组织石蜡块切片(3.5 μm),脱蜡后,切片浸入0.01 mol/L柠檬酸钠缓冲液进行高压加热修复,加入3%过氧化氢封闭10 min以灭活内源性过氧化物酶,以5%山羊血清封闭,再分别滴加不同蛋白的一抗并4℃孵育过夜,TBS洗涤3次后,滴加抗兔/鼠HRP标记聚合物100 μL,室温孵育30 min,TBS冲洗3次,滴加预制好的显色DAB工作液50-100 μL,室温孵育5 min,蒸馏水洗涤。苏木素复染3 min,然后蒸馏水冲洗。各级酒精(75%-85%-95%-100%)脱水后,置于二甲苯透明,中性树胶封片,显微镜观察。采用Image J图片分析软件对上述蛋白的阳性表达面积比率进行分析。
1.2.7 数据统计与分析数据以x±s表示,采用SPSS 16.0软件进行统计处理。多组样本均数的两两比较采用单因素方差分析,方差齐性采用Dunnett检验,方差不齐性采用非参数检验,P < 0.05为差异有统计学意义。
2 结果与分析 2.1 鬼画符诱导肝脏损伤HE染色结果显示(图 1),与对照组相比,给药3个月后,鬼画符高、低剂量组部分大鼠出现肝细胞水肿、变性,汇管区附近肝细胞变性,局部结缔组织增生。给药6个月后,鬼画符高、低剂量组部分大鼠出现肝细胞广泛变性水肿、空泡化变性,肝汇管区周围局灶性黑点状,肝细胞核固缩和纤维组织增生。由此可知,肝组织病变程度与鬼画符剂量有关,高剂量组病变程度较低剂量组严重。
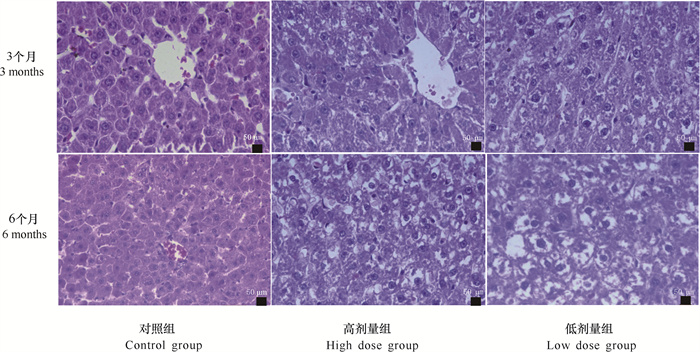
|
| 图 1 鬼画符对大鼠肝组织的病理改变 Fig. 1 Pathological changes of rat liver tissue caused by Breynia fruticosa |
血液生化检测结果可知,给药3个月后,与对照组相比,鬼画符高剂量组大鼠ALT水平显著降低(P < 0.05),AST水平虽出现一定幅度下调,但无统计学差异;给药6个月后,鬼画符高剂量组大鼠血清ALT、AST水平与对照组相比均下降,而低剂量组大鼠ALT、AST水平呈上升趋势,但无统计学意义(表 1)。
| 分组 Group |
给药3个月 Treatment for 3 months |
给药6个月 Treatment for 6 months |
|||
| AST (U/L) | ALT (U/L) | AST (U/L) | ALT (U/L) | ||
| 对照组 Control group |
169.94±49.467 | 55.96±15.122 | 163.74±31.000 | 53.59±20.583 | |
| 高剂量组 High dose group |
98.42±33.023 | 37.36±6.026# | 160.44±38.634 | 43.43±10.370 | |
| 低剂量组 Low dose group |
156.58±25.2 | 39.70±11.745 | 187.35±63.913 | 64.25±40.674 | |
| 注:#表示与对照组相比有显著性差异(P < 0.05) Note:#indicates significant differences compared with control group (P < 0.05) | |||||
2.2 鬼画符的活性化学成分
由表 2可知,从知网等数据库公开发表的文献中搜集鬼画符根、叶等部位的成分,共获得可用于靶标预测的17个化合物,主要为黄酮类、倍半萜类等成分,各成分分别以GHF-01-GHF-17命名,用于后续作图及分析。
| 序号 No. |
化合物名称 Name of compound |
代码 Label |
分子式 Molecular formula |
分子量 Molecular weight |
| 1 | 吐叶醇 Vomifoliol |
GHF-01 | C13H20O3 | 224.3 |
| 2 | 佛尔酮 Isophorone |
GHF-02 | C9H14O | 138.2 |
| 3 | 原儿茶醛 3, 4-dihydroxybenzaldehyde |
GHF-03 | C7H6O3 | 138.1 |
| 4 | 香草醛 Vanillin |
GHF-04 | C8H8O3 | 152.2 |
| 5 | 木犀草素 Luteolin |
GHF-05 | C15H10O6 | 286.2 |
| 6 | 槲皮素 Quercetin |
GHF-06 | C15H10O7 | 302.2 |
| 7 | 山奈酚 Kaempferol |
GHF-07 | C15H10O6 | 286.2 |
| 8 | 银椴苷 Tiliroside |
GHF-08 | C30H26O13 | 594.5 |
| 9 | (+)-南烛木树脂酚 (+)-lyoniresinol |
GHF-09 | C22H28O8 | 420.5 |
| 10 | (+)-异落叶松脂素 (+)-isolariciresinol |
GHF-10 | C20H24O6 | 360.4 |
| 11 | 荛花酚 (+)-nortrachelogenin |
GHF-11 | C20H22O7 | 374.4 |
| 12 | (+)-丁香树脂醇 (+)-syringaresinol |
GHF-12 | C22H26O8 | 418.4 |
| 13 | 羽扇烯酮 Lupenone |
GHF-13 | C30H48O | 424.7 |
| 14 | β-谷甾醇 Beta-sitosterol |
GHF-14 | C29H50O | 414.7 |
| 15 | Epibreynin D | GHF-15 | C40H56O23S | 936.9 |
| 16 | Aviculin | GHF-16 | C26H34O10 | 506.5 |
| 17 | 算盘子二醇 Glochidiol |
GHF-17 | C30H50O2 | 442.7 |
2.3 鬼画符化学成分作用靶标信息
17种药物成分的共有靶标情况如图 2所示。从SwissTargetPrediction、TCMSP、TCMIP等数据库中共收集到鬼画符成分预测靶点229个,其中槲皮素、山奈酚、(+)-南烛木树脂酚、木犀草素、香草醛、原儿茶醛等拥有共有靶标数量超过20个。
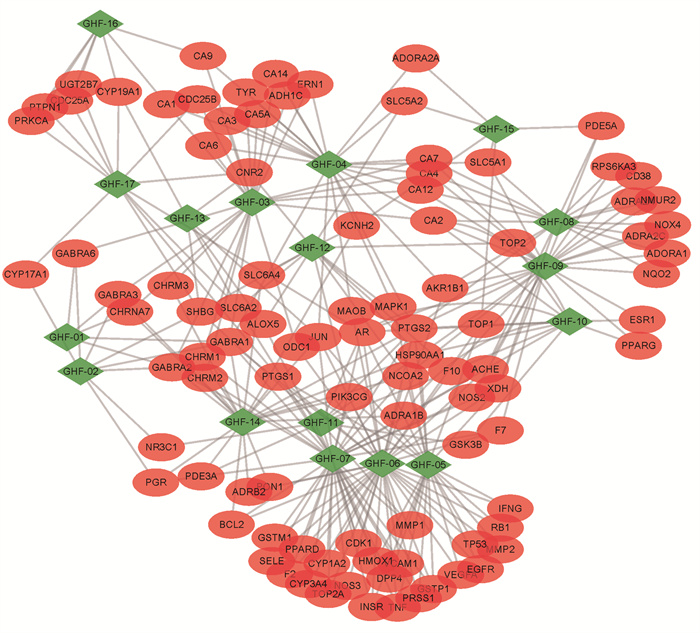
|
| 绿色菱形表示17种药物成分,红色椭圆形表示鬼画符致肝毒性的关键靶标 Green diamond shape indicates 17 components, red ellipse shape indicates key targets of hepatotoxicity caused by B.fruticosa 图 2 鬼画符成分的共有靶标 Fig. 2 Common targets of components from B.fruticosa |
2.4 鬼画符致肝损伤的预测靶标PPI网络构建以及关键靶点的筛选
利用STRING数据库进行上述预测靶标的PPI网络构建,如图 3所示。经数据库检索获得肝毒性靶点713个,对鬼画符成分预测靶点和肝毒性靶点取交集,获得74个共有靶标,作为药物致肝毒性的预测靶标。

|
| 图 3 鬼画符致肝毒性的预测靶标PPI网络图 Fig. 3 PPI network diagram of predicted targets in hepatotoxicity caused by B.fruticosa |
构建的鬼画符致肝毒性的药物-靶点-疾病网络中,所有节点的degree值中位数为20.5,选取degree值>30.75的靶标节点作为毒性关键靶标,共计17个。其中,degree值排前5位的靶标分别为白介素-6 (IL-6)、肿瘤蛋白p53 (TP53)、丝裂原活化蛋白激酶1 (MAPK1)、血管内皮生长因子A (VEGFA)、肿瘤坏死因子(TNF)。各个关键靶标的基本信息以及与鬼画符成分之间的映射关系如表 3所示,鬼画符致肝毒性的药物-靶点-疾病网络如图 4所示。
| 关键靶标 Key targets |
Degree值 Degree value |
关联的药物成分 Related medicine components |
| IL-6 | 48 | GHF-06 |
| TP53 | 46 | GHF-05、GHF-06 |
| MAPK1 | 44 | GHF-06 |
| VEGFA | 44 | GHF-05、GHF-06 |
| TNF | 43 | GHF-05、GHF-06、GHF-07 |
| 表皮生长因子EGF | 42 | GHF-06 |
| 转录因子JUN | 42 | GHF-04、GHF-05、GHF-06、GHF-07 |
| 环加氧酶2 PTGS2 | 41 | GHF-04、GHF-05、GHF-06、GHF-07、GHF-08、GHF-09、GHF-10、GHF-11、GHF-12、GHF-14 |
| 丝裂原活化蛋白激酶8 MAPK8 | 40 | GHF-07 |
| 表皮生长因子受体EGFR | 38 | GHF-05、GHF-06 |
| 雌激素受体1 ESR1 | 37 | GHF-09、GHF-10 |
| IL-1β | 36 | GHF-06 |
| CC类趋化因子配体2 CCL2 | 35 | GHF-06 |
| 内皮型一氧化氮合成酶NOS3 | 33 | GHF-06、GHF-07 |
| 过氧化物酶体增殖物激活受体γ PPARG | 33 | GHF-09、GHF-10 |
| 髓过氧化物酶MPO | 32 | GHF-06 |
| 血红素氧合酶-1 HMOX1 | 31 | GHF-05、GHF-07 |
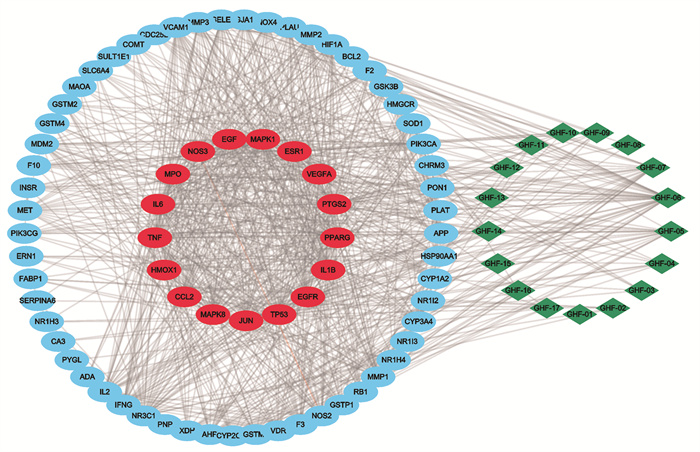
|
| 绿色菱形表示17种药物成分,红色椭圆形表示鬼画符致肝毒性的关键靶标,蓝色椭圆形表示鬼画符致肝毒性的预测靶标 Green diamond shape indicates 17 components, red ellipse shape indicates key targets of hepatotoxicity caused by B.fruticosa, blue ellipse shape indicates predicted targets of hepatotoxicity caused by B.fruticosa 图 4 鬼画符致肝毒性的药物-靶点-疾病网络 Fig. 4 Medicine-target-disease network of hepatotoxicity caused by B.fruticosa |
2.5 鬼画符致肝毒性的关键靶标KEGG分析和GO分析
选取上述筛选出的17个关键靶标(表 3),利用ClueGo插件将鬼画符致肝损伤的相关靶点进行生物功能富集及通路分析。选取通路富集分析排名前10的通路(P < 0.05)(表 4)。结果显示,鬼画符致肝毒性关键靶标主要富集于糖尿病并发症相关的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、IL-17信号通路(IL-17 signaling pathway)、TNF信号通路(TNF signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、HIF-1α信号通路(HIF-1α signaling pathway)等通路上,这些通路与炎症、氧化应激等病理生理过程密切相关。
| 富集的信号通路 Enriched signaling pathway |
关键靶标数量 Number of key targets |
关键靶标 Key targets |
| AGE-RAGE signaling pathway in diabetic complications | 9 | CCL2, IL1B, IL6, JUN, MAPK1, MAPK8, NOS3, TNF, VEGFA |
| Fluid shear stress and atherosclerosis | 9 | CCL2, HMOX1, IL1B, JUN, MAPK8, NOS3, TNF, TP53, VEGFA |
| Human cytomegalovirus infection | 9 | CCL2, EGFR, IL1B, IL6, MAPK1, PTGS2, TNF, TP53, VEGFA |
| IL-17 signaling pathway | 8 | CCL2, IL1B, IL6, JUN, MAPK1, MAPK8, PTGS2, TNF |
| TNF signaling pathway | 8 | CCL2, IL1B, IL6, JUN, MAPK1, MAPK8, PTGS2, TNF |
| Chagas disease (American trypanosomiasis) | 7 | CCL2, IL1B, IL6, JUN, MAPK1, MAPK8, TNF |
| HIF-1α signaling pathway | 7 | EGF, EGFR, HMOX1, IL6, MAPK1, NOS3, VEGFA |
| Rheumatoid arthritis | 6 | CCL2, IL1B, IL6, JUN, TNF, VEGFA |
| Toll-like receptor signaling pathway | 6 | IL1B, IL6, JUN, MAPK1, MAPK8, TNF |
| Bladder cancer | 5 | EGF, EGFR, MAPK1, TP53, VEGFA |
生物功能富集结果显示,鬼画符主要参与的生物学过程包括转录调控(Regulation of transcription)、血管新生(Angiogenesis)、一氧化氮合成(Regulation of nitric oxide biosynthetic)、MAPK信号通路(MAPK cascade)、ERK1/2信号通路(Regulation of ERK1 and ERK2 cascade)等过程;在分子功能上,鬼画符主要与酶、蛋白、染色质、转录因子结合以及细胞因子活性等相关;在细胞组分方面,其主要作用于细胞核、胞外空间、细胞质等(图 5)。
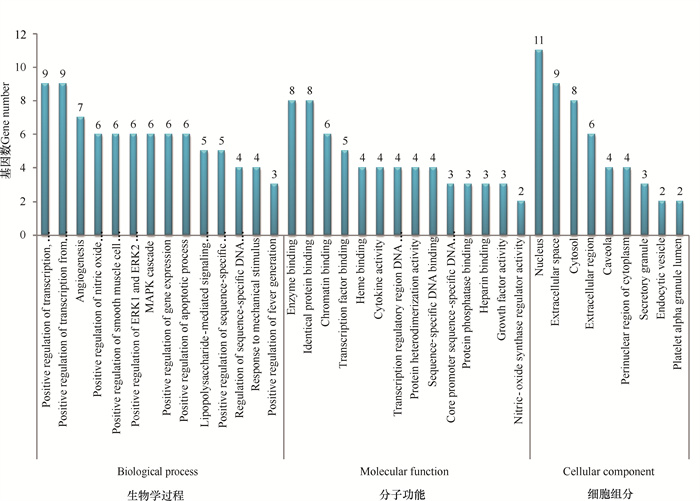
|
| 图 5 鬼画符致肝毒性的关键靶标GO分析 Fig. 5 GO analysis for key targets of hepatotoxicity caused by B.fruticosa |
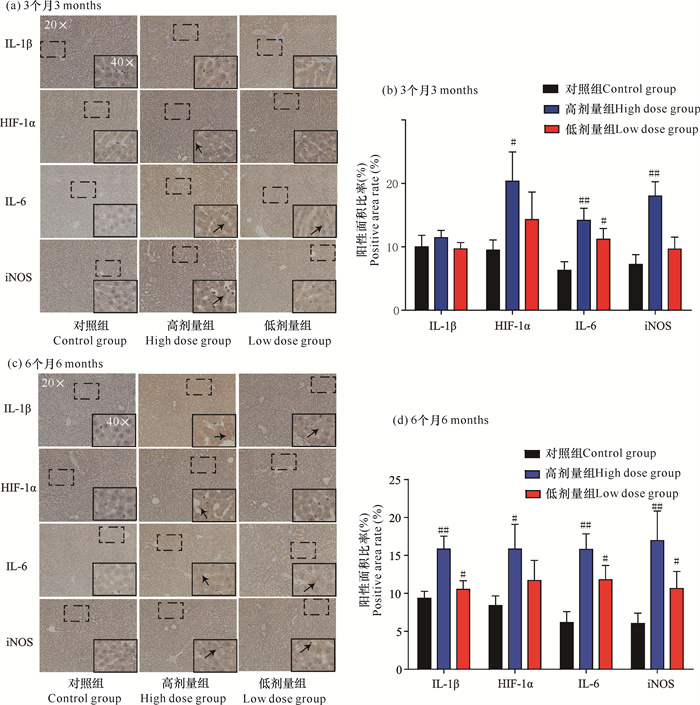
2.6 鬼画符对肝脏IL-1β、IL-6、iNOS、HIF-1α表达的影响
采用免疫组化技术对肝脏中iNOS、HIF-1α、IL-1β、IL-6蛋白表达进行验证,结果显示,与对照组相比,给药3个月后,高剂量组肝脏中IL-6、iNOS、HIF-1α蛋白阳性表达增加(P < 0.01,P < 0.05),低剂量组肝脏中IL-6阳性表达水平显著升高(P < 0.05);给药6个月后,高剂量组肝脏中IL-1β、iNOS、IL-6、HIF-1α表达水平显著升高(P < 0.05,P < 0.01),低剂量组能显著升高肝脏中IL-1β、IL-6、iNOS表达水平(P < 0.05)(图 6)。由此表明,长期给药后鬼画符高剂量可以显著诱导大鼠肝脏发生炎性反应及氧化应激损伤。
|
| 与对照组相比##P < 0.01,#P < 0.05 ##P < 0.01, #P < 0.05 compared with control group 图 6 鬼画符对大鼠肝脏IL-1β、HIF-1α、IL-6、iNOS蛋白表达的影响 Fig. 6 Effects of B.fruticosa on IL-1β, HIF-1α, IL-6, iNOS expressions in rat liver |
3 讨论
本研究通过长期毒性试验初步明确鬼画符具有肝脏毒性作用,并通过网络毒理学方式,初步揭示鬼画符中的香草醛、木犀草素、槲皮素、山奈酚、银椴苷、(+)-南烛木树脂酚、(+)-异落叶松脂素、荛花酚、(+)-丁香树脂醇、β-谷甾醇等化合物可能是诱导肝毒性发生的潜在成分。有报道称,β-谷甾醇、木犀草素等具有细胞毒作用,可以抑制肝癌细胞增殖和诱导肝癌细胞凋亡。研究显示,β-谷甾醇可诱导人SMMC-7721肝癌细胞和HepG2肝癌细胞发生细胞凋亡现象,可能与降低线粒体膜电位、加剧线粒体氧化应激状态、促进活性氧(ROS)释放有关[10, 11]。此外,也有研究证实,木犀草素(50 μmol/L)可以上调Bax水平、下调抗凋亡蛋白Bcl-2、活化caspase-3酶、降低线粒体膜电位、诱导SMMC-7721和Bel-7402肝癌细胞凋亡,或者通过诱导自噬继而促进HepG2肝癌细胞凋亡[12, 13]。
网络毒理学分析结果表明,鬼画符可能主要通过17个关键靶标参与肝损伤机制,主要包括TNF、IL-1β、IL-6、NOS3、MAPK1等。这些关键靶标分子主要富集于AGE-RAGE信号通路、IL-17信号通路、TNF信号通路、Toll样受体信号通路、HIF-1α信号通路等,上述信号通路及靶点与炎症、氧化应激等病理生理过程密切相关。研究显示,晚期糖基化终末产物(AGEs)与其受体RAGE结合,可激活多条信号通路诱导氧化应激反应、炎症反应和蛋白激酶C活化等[14]。Toll样受体是一类跨膜蛋白,参与识别病原体入侵,诱导机体免疫应答,在TNF-α、IL-1β等炎性因子的上调过程中发挥重要作用[15]。HIF信号通路参与线粒体功能障碍后引发的细胞氧化应激损伤过程[16]。机体内氧化应激损伤和炎症损伤已成为目前中药致肝毒性的重要因素。有研究显示,氧化应激状态可以诱导HIF-1α表达,造成肝脏糖酵解水平升高,进而诱导肝脏代谢紊乱和肝功能受损[17]。同时,肝脏氧化应激和炎症状态可以进一步诱导iNOS、IL-1β、IL-6等蛋白表达,加重肝脏炎症风暴和氧化应激损伤[18]。本研究中,鬼画符5 g/kg剂量连续给药6个月后,可以明显诱导肝细胞变性和纤维组织增生,同时升高肝脏中iNOS、HIF-1α、IL-6和IL-1β的表达水平,表明经鬼画符干预后大鼠肝脏可能发生了氧化应激和炎症损伤,这可能是鬼画符致肝毒性的关键机制。
鬼画符是两广常用的清热解毒药,是治疗跌打风湿类方剂的常用药材,如中华跌打丸。目前,鬼画符药材毒性研究仍然较少,具体靶器官不明确,其药材毒性也是制约中成药品种临床应用的重要因素。通过深入研究鬼画符药材毒性机制,可推进相关中成药品种二次开发过程中有关配伍、炮制工艺等关键技术的开发,为临床用药提供理论基础。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 4版. 上海: 上海科学技术出版社, 1999: 760-762.
|
| [2] |
钟鸣. 中国壮药学[M]. 2版. 南宁: 广西民族出版社, 2016: 277-278.
|
| [3] |
MENG D H, WU J, ZHAO W M. Glycosides from Bre- ynia fruticosa and Breynia rostrata[J]. Phytochemistry, 2010, 71(2/3): 325-331. |
| [4] |
MENG D H, CHEN W L, ZHAO W M. Sulfur-containing spiroketal glycosides from Breynia fruticosa[J]. Journal of Natural Products, 2007, 70(5): 824-829. DOI:10.1021/np0606300 |
| [5] |
彭伟文, 王英晶, 王书芹, 等. 黑面神嫩枝叶治疗小鼠慢性皮炎-湿疹有效部位的筛选[J]. 中国医院药学杂志, 2014, 34(24): 2095-2099. |
| [6] |
彭伟文, 戴卫波, 梅全喜, 等. 黑面神水提物免疫抑制作用实验研究[J]. 中华中医药学刊, 2013, 31(11): 2423-2424. |
| [7] |
彭伟文, 王英晶. 黑面神的药用历史及现代研究概况[J]. 今日药学, 2014, 24(7): 618-622. |
| [8] |
李晓凤, 曹旭焱, 刘津, 等. 中药药效物质基础及作用机制的研究思路探讨[J]. 广州中医药大学学报, 2020, 37(2): 366. |
| [9] |
赖克道, 李冬梅, 韦桂宁, 等. 基于CREB/BDNF通路探讨鸡血藤总黄酮对抑郁大鼠海马神经可塑性的影响[J]. 中国实验方剂学杂志, 2022, 28(5): 55-61. |
| [10] |
张忠泉, 邢煜君, 胡国强, 等. β-谷甾醇诱导人肝癌HepG2细胞凋亡机制研究[J]. 中国中药杂志, 2011, 36(15): 2145-2148. |
| [11] |
李庆勇, 姜春菲, 张黎, 等. β-谷甾醇、豆甾醇诱导人肝癌细胞SMMC-7721凋亡[J]. 时珍国医国药, 2012, 23(5): 1173-1175. DOI:10.3969/j.issn.1008-0805.2012.05.056 |
| [12] |
DING S X, HU A R, HU Y R, et al. Anti-hepatoma cells function of luteolin through inducing apoptosis and cell cycle arrest[J]. Tumor Biology, 2014, 35(4): 3053-3060. DOI:10.1007/s13277-013-1396-5 |
| [13] |
陈娟, 邓敏, 周焕, 等. 木犀草素抑制PKM2继而促进自噬诱导肝癌细胞凋亡[J]. 中国医院药学杂志, 2021, 41(11): 1103-1108. |
| [14] |
HUDSON B I, LIPPMAN M E. Targeting RAGE signaling in inflammatory disease[J]. Annual Review of Medicine, 2018, 69(2): 349-364. |
| [15] |
吴娅丽, 王晓艳, 张辉, 等. 基于网络药理学和细胞实验的甘草缓解补骨脂所致肝损伤的药效作用研究[J]. 中国中药杂志, 2022, 47(1): 176-187. |
| [16] |
GUZY R D, HOYOS B, ROBIN E, et al. Mitochondrial complex Ⅲ is required for hypoxia-induced ROS production and cellular oxygen sensing[J]. Cell Metabolism, 2005, 1(6): 401-408. |
| [17] |
LUO F, ZOU Z L, LIU X L, et al. Enhanced glycolysis, regulated by HIF-1α via MCT-4, promotes inflammation in arsenite-induced carcinogenesis[J]. Carcinogenesis, 2017, 38(6): 615-626. DOI:10.1093/carcin/bgx034 |
| [18] |
RAMYAA P, KRISHNASWAMY R, PADMA V V. Quercetin modulates OTA-induced oxidative stress and redox signalling in HepG2 cells-up regulation of Nrf2 expression and down regulation of NF-κB and Cox-2[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2014, 1840(1): 681-692. |



