宫颈癌是常见的妇科恶性肿瘤,其发病率位居全球女性恶性肿瘤第四位,是女性癌症死亡的第四大原因[1]。每年我国的宫颈癌新发病例大约有106 000例,我国与印度的新发病例约占全世界的1/3,是发达国家的6倍[2]。
大量研究已经证实,持续感染高危型人乳头瘤病毒(Human Papilloma Virus,HPV)是宫颈上皮内瘤变(Cervical Intraepithelial Neoplasia, CIN)及宫颈癌的主要原因。C-myc基因能够促进细胞增殖,是与肿瘤发生发展密切相关的原癌基因,它参与了多种恶性肿瘤(如乳腺癌、胃癌、结肠癌等)的发生发展[3],可能是宫颈癌的一种潜在标志物。E2F1蛋白在细胞周期调控方面发挥着重要作用,在多种肿瘤(如肺癌、乳腺癌、子宫内膜癌)细胞呈高表达,表现为促癌基因的作用[4]。目前,关于E2F1蛋白在宫颈癌中的具体作用机制尚不明确。宫颈癌的发生发展过程较长,约10-15 a,其处于CIN状态的时间较长,可以有很多机会发现病变。目前,发达国家通过有效的筛查方法和广泛的注射HPV疫苗,已使宫颈癌的发病率大大降低,但发展中国家仍面临着巨大的经济负担和社会负担。因此,临床上开展早期筛查、分流管理及适当干预治疗至关重要。
本研究通过检测高危型HPV(16,18,31,33,35,39) DNA、C-myc基因及E2F1蛋白在不同宫颈组织中的表达情况,探讨其与宫颈癌的相关性及联合检测对于筛查宫颈癌的临床应用价值,旨在进一步提高宫颈癌的早期确诊率,为患者病情评估及干预治疗提供参考。
1 材料与方法 1.1 临床资料选择2016年1月至2020年6月广西医科大学第二附属医院的活检及手术切除的宫颈组织石蜡标本100例,包括正常宫颈组织20例为对照组,患者年龄为35-65岁,平均为(46±12.3)岁;宫颈病变80例为实验组,包括CIN Ⅰ级20例,CIN Ⅱ-Ⅲ级30例,宫颈鳞状细胞癌30例,患者年龄为25-66岁,平均为(46±16.5)岁。其中,宫颈鳞状细胞癌中临床分期Ⅰ期20例,Ⅱ期10例;分化程度Ⅰ-Ⅱ级17例,Ⅲ级13例;淋巴结转移阴性11例,阳性19例。两组之间的一般资料差异无统计学意义(P>0.05)。病例纳入标准:(1)既往无宫颈物理治疗及手术史;(2)无其他恶性肿瘤病史;(3)未接受过放化疗及肿瘤药物治疗;(4)所有病理结果均经病理科两位高级职称医师审核确定。
1.2 主要试剂生物素标记的高危型HPV探针、原位杂交试剂盒购自福建泰普生物科学有限公司;C-myc和E2F1单克隆抗体购自广西卓一生物技术有限公司。
1.3 方法 1.3.1 固态石蜡标本制作组织标本离体后立即进行取材、固定、脱水、透明、浸蜡、包埋等步骤,制作石蜡标本并常温保存备用。
1.3.2 原位杂交技术检测将组织切成4 μm的薄片,APES处理后烤片,二甲苯脱蜡3次,每次10 min,分别于100%、95%、80%的乙醇溶液脱水3 min,用蒸馏水冲洗3 min,放入盛有杂交增强液的容器里,微波炉高温处理20 min,自然冷却至室温后,用蒸馏水冲洗2 min,擦干。然后再添加探针,盖上盖玻片,置于原位杂交仪上95℃变性5 min,37℃培养箱中杂交过夜。用PBS缓冲液浸片,盖玻片脱落后,用PBS缓冲液冲洗10 min。滴加适量一抗,放入湿盒中37℃孵育30 min,PBS缓冲液洗涤3次,每次2 min。滴加适量二抗,湿盒中37℃孵育30 min,PBS缓冲液冲洗3次,每次2 min。然后再添加DAB显色剂,PBS缓冲液终止显色。自来水充分冲洗,苏木精复染,盐酸乙醇分化,氨水反蓝,乙醇脱水,二甲苯透明,树胶封片。结果判定:高危型HPV DNA原位杂交阳性细胞为细胞核内棕黄色点、片状着色。
1.3.3 免疫组织化学法检测石蜡切片常规脱蜡、水化,放入盛有EDTA修复液的容器里,微波炉高温处理10 min后进行抗原修复。蒸馏水冲洗3次,每次1 min,放入3% H2O2溶液浸片10 min,蒸馏水冲洗3次,每次1 min,甩干擦净后,滴加3% BSA, 放入湿盒中封闭1 h。滴加一抗,4℃过夜,TBST冲洗4次,每次30 s。滴加二抗,37℃孵育30 min,TBST冲洗4次,每次30 s。滴加DAB液,蒸馏水充分冲洗,苏木精复染,梯度酒精及二甲苯脱水,树胶封片。结果判定:C-myc基因、E2F1蛋白免疫组织化学阳性细胞均为细胞核内棕黄色染色。
1.4 统计分析采用SPSS 19.0软件进行统计分析。计数资料以例数或百分率表示,组间比较采用χ2检验。相关性分析采用Spearman等级相关分析法,P < 0.05为差异有统计学意义。
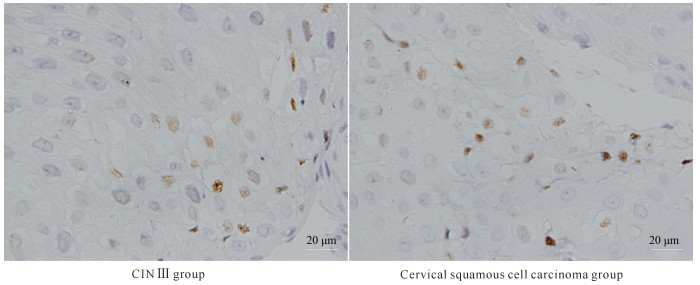
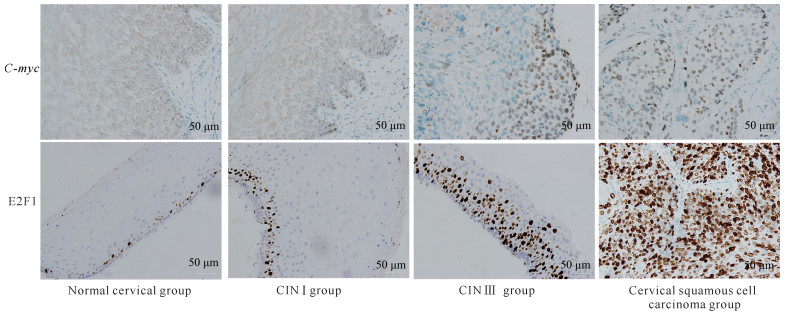
2 结果与分析 2.1 不同宫颈组织中HPV DNA、C-myc基因和E2F1蛋白的表达情况不同宫颈组织中HPV DNA、C-myc和E2F1的表达情况如表 1所示。HPV DNA在正常宫颈组织中的阳性率为5.0%,在CINⅠ、CIN Ⅱ-Ⅲ、宫颈鳞状细胞癌组织中的阳性率分别为15.0%、53.3%和80.0%,其阳性率呈明显升高的趋势,差异有统计学意义(χ2=36.012,P < 0.001)。C-myc基因在正常宫颈组织中无阳性表达;在CIN Ⅰ、CIN Ⅱ-Ⅲ组织中的阳性率分别为10.0%和36.7%,且表达强度增加;在宫颈鳞状细胞癌组织中的阳性率为80.0%,呈强阳性表达;阳性表达率显著增高,差异有统计学意义(χ2=41.799,P < 0.001)。E2F1蛋白在正常宫颈组织中阳性率为5.0%;在CIN Ⅰ、CIN Ⅱ-Ⅲ组织中的阳性率分别为25.0%、66.7%;在宫颈鳞状细胞癌组织中的阳性率为90.0%,且为强阳性表达;阳性表达率有明显增高的趋势,差异有统计学意义(χ2=43.530,P < 0.001)。病理染色结果如图 1、图 2所示。
| 组别 Group |
例数 Cases |
阳性率(%) Positive rate (%) |
||
| HPV DNA | C-myc | E2F1 | ||
| Normal cervical group | 20 | 5.0 | 0.0 | 5.0 |
| CIN Ⅰ group | 20 | 15.0 | 10.0 | 25.0 |
| CIN Ⅱ-Ⅲ group | 30 | 53.3 | 36.7 | 66.7 |
| Cervical squamous cell carcinoma group | 30 | 80.0 | 80.0 | 90.0 |
|
| 图 1 CIN Ⅲ、宫颈鳞状细胞癌HPV16/18原位杂交着色结果(40×) Fig. 1 In situ hybridization staining results of HPV16/18 in CIN Ⅲ and cervical squamous cell carcinoma (40×) |
|
| 图 2 C-myc、E2F1免疫组织化学染色结果(20×) Fig. 2 Immunohistochemical staining results of C-myc and E2F1 (20×) |
2.2 宫颈鳞状细胞癌中HPV DNA、C-myc基因和E2F1蛋白表达的相关性分析
Spearman相关性分析结果显示,HPV DNA与C-myc基因之间的表达呈明显正相关(r=0.621,P < 0.01), HPV DNA与E2F1蛋白之间的表达呈明显正相关(r=0.579,P < 0.01), C-myc基因与E2F1蛋白之间的表达呈明显正相关(r=0.555,P < 0.01)。
2.3 宫颈鳞状细胞癌中HPV DNA、C-myc基因和E2F1蛋白与临床病理的关系在宫颈鳞状细胞癌中HPV DNA、C-myc基因和E2F1蛋白的表达与临床病理参数(分期、分化程度、淋巴结转移情况)的关系见表 2。结果显示,C-myc基因的阳性表达率在分化程度Ⅲ级明显高于Ⅰ-Ⅱ级,差异有显著性(P < 0.05),而其余各项差异均无显著性(P>0.05)。
| 临床病理参数 Clinicopathological parameters |
例数 Cases |
HPV DNA | P | C-myc | P | E2F1 | P | ||||
| (+) | (-) | (+) | (-) | (+) | (-) | ||||||
| FIGO stage | Ⅰ | 20 | 17 | 3 | 0.372 | 16 | 4 | 1.000 | 17 | 3 | 0.532 |
| Ⅱ | 10 | 7 | 3 | 8 | 2 | 10 | 0 | ||||
| Differentiatd degree | Ⅰ-Ⅱ | 17 | 13 | 4 | 0.672 | 11 | 6 | 0.024* | 15 | 2 | 1.000 |
| Ⅲ | 13 | 11 | 2 | 13 | 0 | 12 | 1 | ||||
| Lymphatic metastasis | Negative | 11 | 8 | 3 | 0.641 | 7 | 4 | 0.156 | 9 | 2 | 0.272 |
| Positive | 19 | 16 | 3 | 17 | 2 | 18 | 1 | ||||
| Note: Fisher exact probability method is used for significance level, *P < 0.05 | |||||||||||
3 讨论
肿瘤的发生是一个复杂的过程,是由多种因素协同作用的结果。流行病学研究显示,近年来我国宫颈癌发病率呈逐渐上升的趋势,并且存在发病年龄年轻化的现象,20-30岁女性发病率上升[5]。宫颈癌最常见的病理类型为鳞状细胞癌,其次为腺癌,其他类型的比较少见。
持续的高危型HPV感染是CIN和宫颈癌发生发展的必需条件之一[6]。研究已发现持续感染HPV 16,18,31,33,35,39,45,51,52,56,58,59,68等高危类型病毒能引起CIN和宫颈癌,所以将这些HPV类型定义为“致癌”病毒类型[7]。高危型HPV感染后整合到宿主细胞基因组中,导致病毒癌基因E6和E7持续性表达,并与p53和Rb等抑癌基因结合使其失活,引发细胞异常增殖、凋亡,最终发生癌变。本研究证实,从正常宫颈组织到CIN各级病变,最终至宫颈鳞状细胞癌,HPV DNA的阳性表达率呈升高趋势,说明高危型HPV感染与CIN以及宫颈癌的发生进展有密切关系。
C-myc基因位于染色体8q24,是一种重要的核内癌基因,对多种恶性肿瘤均有特异性[8]。正常情况下C-myc基因由于受生长抑制信号和有丝分裂原的调控而处于低表达水平,从而维持正常的细胞活动。当高危型HPV持续感染宫颈细胞后,通过基因整合C-myc发生扩增或特异性重排,导致细胞中C-myc表达升高从而促进了宫颈癌的发生发展[9]。有研究证实,从CIN Ⅰ发展至CIN Ⅲ直至宫颈癌,C-myc基因表达率明显升高,并发现在接受化疗后其表达降低[10]。本研究发现,在正常宫颈组织中C-myc基因无表达,而在宫颈病变组织中其阳性率和表达程度明显增加,提示C-myc基因参与了宫颈癌的发生,其在CIN Ⅰ时被激活并逐渐积累,持续存在于整个癌变过程中,如C-myc基因异常表达,则患者可能已经存在CIN病变甚至是宫颈癌。该研究结果与Yang等[10]、卢建军等[11]的研究结果一致,提示C-myc基因与宫颈病变的进展情况密切相关,对宫颈病变的筛查具有一定的价值。乌守恒等[12]报道了C-myc基因的表达与宫颈癌临床分期、分化程度、淋巴结转移有关,其高表达可能促进肿瘤的侵袭和转移。本研究分析了C-myc基因与宫颈鳞状细胞癌病理参数的关系,发现其表达与分化程度有关,随着分化程度的增加而增加,提示C-myc基因表达检测对预测宫颈癌进展、观察病情有指导作用。
E2F1位于染色体20q11,是一种重要的转录促进因子,能够调节细胞周期、细胞增殖、细胞凋亡和细胞分化等生物过程[13]。研究发现,E2F1在多种肿瘤如肺癌、乳腺癌、卵巢癌等组织细胞中高表达,发挥促癌基因的作用[14]。HPV感染宫颈细胞后,HPV E7致癌蛋白和低磷酸化的Rb基因结合,破坏了Rb/E2F1复合物,从而使E2F1得以释放,促进组织细胞进入S期而加速细胞周期进程,导致细胞过度增殖,促进宫颈癌细胞增殖和肿瘤形成[15]。本研究结果显示,E2F1的阳性表达率在CIN Ⅱ-Ⅲ及宫颈鳞状细胞癌组织中明显升高,提示E2F1过度表达能加速细胞周期及细胞增殖,在宫颈癌的发生发展过程中发挥重要作用。另外,关于E2F1与肿瘤临床病理相关性的研究,其中在乳腺癌中E2F1与分化程度低及预后差密切相关;外阴癌中E2F1表达与FIGO分期有关;宫颈癌中E2F1与分期和肿瘤分化程度有关。本研究也分析了宫颈鳞状细胞癌组织中E2F1与病理参数的关系,结果显示E2F1与分期、分化程度、淋巴结转移情况均无表达差异,考虑为样本量较少所致。
宫颈癌的癌前病变期较长,有效筛查及处理是降低宫颈癌发病率的关键。目前,我国普遍使用液基薄层细胞学检查(Thinprep Cytologic Test,TCT)联合HPV的筛查方法,虽然能在早期筛查出宫颈病变,但是对于病变的进展和转归不能进行判断和预测。何志连等[16]研究发现,HPV16/18表达与C-myc表达情况呈明显正相关,推测C-myc基因是HPV16/18的靶基因。本研究发现,HPV DNA与C-myc基因、HPV DNA与E2F1蛋白、C-myc基因与E2F1蛋白之间的表达也存在密切的相关性,因此可作为宫颈病变早期筛查的生物学指标,联合检测对宫颈癌的诊断和评估具有重要的临床意义。
4 结论本研究表明,HPV DNA、C-myc基因及E2F1蛋白的表达均随着宫颈病变的加重而增强。相关性分析显示,HPV DNA与C-myc基因、HPV DNA与E2F1蛋白、C-myc基因与E2F1蛋白之间均呈正相关。C-myc基因在宫颈鳞状细胞癌中的表达随肿瘤分化程度的降低而增高,提示其与宫颈鳞状细胞癌关系密切。今后还需进一步通过联合检测增加宫颈病变及宫颈癌的早期诊断,对高风险患者进行分流管理,适时干预治疗,降低宫颈癌的发病率,这对于宫颈病变的诊断及监测具有重要意义。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ARBYN M, WEIDERPASS E, BRUNI L, et al. Estimates of incidence and mortality of cervical cancer in 2018: A worldwide analysis[J]. The Lancet Global Health, 2019, 8(2): 191-203. |
| [3] |
MIN J Q, HU J W, LUO C, et al. IFITM3 upregulates c-myc expression to promote hepatocellular carcinoma proliferation via the ERK1/2 signalling pathway[J]. BioScience Trends, 2019, 13(6): 523-529. DOI:10.5582/bst.2019.01289 |
| [4] |
FU D X, ZHANG Y N, CUI H B, et al. Long noncoding RNA CCAT2 is activated by E2F1 and exerts oncogenic properties by interacting with PTTG1 in pituitary adenomas[J]. American Journal of Cancer Research, 2018, 8(2): 245-255. |
| [5] |
刘小花, 龙红惠, 陈宇宁, 等. 高危HPV感染与宫颈病变的相关性分析[J]. 中国优生与遗传杂志, 2020, 28(8): 1008-1009, 1028. |
| [6] |
PARK G C, ROH J, CHO J, et al. 18F-FDG PET/CT vs. human papillomavirus, p16 and Epstein-Barr virus detection in cervical metastatic lymph nodes for identifying primary tumors[J]. International Journal of Cancer, 2017, 140: 1405-1412. DOI:10.1002/ijc.30550 |
| [7] |
DAS C R, TIWARI D, DONGRE A, et al. Deregulated TNF-Alpha levels along with HPV genotype 16 infection are associated with pathogenesis of cervical neoplasia in Northeast Indian patients[J]. Viral Immunology, 2018, 31: 282-291. DOI:10.1089/vim.2017.0151 |
| [8] |
FENG Y C, LIU X Y, TENG L, et al. C-Myc inactivation of p53 through the pan-cancer lncRNA MILIP drives cancer pathogenesis[J]. Nature Communications, 2020, 11(1): 4980. DOI:10.1038/s41467-020-18735-8 |
| [9] |
KATZENELLENBOGEN R. Telomerase induction in HPV infection and oncogenesis[J]. Viruses, 2017, 9(7): 180. DOI:10.3390/v9070180 |
| [10] |
YANG F, CUI Z F, LIAO Y D, et al. FHIT and CMYC expression in cervical histology and cytology as biomarkers for detecting high-grade intraepithelial neoplasia in human papillomavirus-positive women[J]. Cancer Biomarkers, 2020, 27(3): 303-312. DOI:10.3233/CBM-182232 |
| [11] |
卢建军, 张微, 李响, 等. 宫颈癌并发人乳头瘤病毒感染癌症组织FHIT和C-myc研究[J]. 中华医院感染学杂志, 2019, 29(21): 3293-3297. |
| [12] |
乌守恒, 曾晓峰, 王萍, 等. 宫颈癌组织中c-myc、bcatl的表达及其临床意义[J]. 四川大学学报(医学版), 2018, 49(5): 725-730. |
| [13] |
HU J, SHEN J W, SUN J. CDK4/RB/E2Fs axis as potential therapeutic target of endometrial cancer[J]. Biomedicine & Pharmacotherapy, 2020, 125(10): 109870. |
| [14] |
XI J, FENG J, ZENG S T, et al. Long noncoding RNA UFC1 is activated by E2F1 and exerts oncogenic properties by functioning as a ceRNA of FOXP3[J]. Cancer Medicine, 2018, 7: 3301-3310. DOI:10.1002/cam4.1556 |
| [15] |
WU Y L, LI H M, WANG H, et al. MSK2 promotes proliferation and tumor formation in squamous cervical cancer via PAX8/RB-E2F1/cyclinA2 axis[J]. Cellular Biochemistry, 2019, 120(7): 11432-11440. DOI:10.1002/jcb.28421 |
| [16] |
何志连, 余立群. C-myc、HPV16/18 DNA在宫颈癌及癌前病变中的表达及其相关性[J]. 肿瘤防治研究, 2010, 37(12): 1413-1415. DOI:10.3971/j.issn.1000-8578.2010.12.021 |


