2. 广西农业科学院,广西作物遗传改良生物技术重点实验室,广西南宁 530007;
3. 广西科学院,生态环境研究所,广西南宁 530007
2. Guangxi Crop Genetic Improvement and Biotechnology Laboratory, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi, 530007, China;
3. Institute of Eco-Environmental Research, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
在自然环境中,地上和地下植食性生物常通过共同的寄主植物发生复杂的相互作用,二者可通过直接途径(产生毒性物质)[1]或间接途径(如影响植物生长、代谢物及资源分配等)[2-5]产生相互影响,并对植物产生加性、协同或拮抗效应[6-8]。目前,地上-地下植食性生物间的互作及协同进化备受关注。例如,Kutyniok等[9]报道了甘蓝蚜(Brevicoryne brassicae)取食使拟南芥(Arabidopsis thaliana)地下甜菜孢囊线虫(Heterodera schachtii)的数量降低;Wurst等[10]研究证明,车前草(Plantago lanceolata)地下部的穿刺根腐线虫(Pratylenchus penetrans)侵染使其地上部桃蚜(Myzus persicae)的繁殖力降低;Kaplan等[11]发现,南方根结线虫(Meloidogyne incognita)促进了地上广食性昆虫粉纹夜蛾(Trichoplusia ni)的幼虫发育,而对专食性昆虫烟草天蛾(Manduca sexta)没有显著影响。因此,虽然目前对植食性生物进行了大量的研究,但大多数研究都集中在单一空间或生物种类,对地上-地下植食性生物间的互作研究相对较少[12-15],同一寄主植物介导的地上-地下生物互作理论尚未完善[12, 16]。
乌桕(Triadica sebifera)是一种大戟科(Euphorbiaceae)乌桕属(Triadica)的乔木,具有较高的观赏价值,同时也是一种应用前景广阔的油料作物[17]。在我国,乌桕害虫种类繁多,现已知的乌桕害虫有190种[18, 19]。其中,癞皮夜蛾(Gadirtha fusca)与南方根结线虫是严重危害乌桕叶片和根部的重要植食性生物[18, 20]。癞皮夜蛾属鳞翅目(Lepidoptera)夜蛾科(Noctuidae),是乌桕上的一种专食性害虫,其幼虫共6龄,初始龄期取食量较小,3龄后取食量大增,可食完整株乌桕叶片,对乌桕生长造成严重危害[21]。南方根结线虫作为世界上广泛分布的一种植物寄生线虫,是乌桕最为常见的地下病害之一[20]。前人研究表明,南方根结线虫侵染能显著抑制癞皮夜蛾在乌桕上的表现[14, 20, 22]。例如,Li等[14]研究发现,南方根结线虫与癞皮夜蛾间能产生拮抗效应,从而使乌桕受益;Yang等[15]研究认为,南方根结线虫与癞皮夜蛾的互作受地下线虫密度的影响较大。但这些研究只分析了南方根结线虫侵染对癞皮夜蛾幼虫的短期影响,未对幼虫各个龄期进行研究,其化蛹表现也尚未可知。
鉴于癞皮夜蛾大龄幼虫(3龄后)的暴食性及其对乌桕的危害性,本研究选用癞皮夜蛾3龄幼虫为研究对象,以被南方根结线虫侵染和未被侵染的乌桕植株作为处理组和对照组,分别取该植株叶片饲喂癞皮夜蛾幼虫,比较不同龄期幼虫生长发育和食物利用的差异,进而筛选出最大影响龄期,探究南方根结线虫与癞皮夜蛾间的互作效应,为深入研究癞皮夜蛾的生物防治提供理论基础,丰富地上-地下生物互作理论。
1 材料与方法 1.1 材料及处理将野外采集的乌桕种子浸泡于10 g/L洗衣液中2 d以去除外蜡质层,采用湿沙层积法处理2个月打破休眠[22]。在温室内以装有混合土壤(草炭土∶壤土=1∶1)的苗盘育苗。45 d后,选取大小相近的幼苗单独移栽至花盆(高为16 cm,直径为25 cm)中,定期浇水以保持土壤湿润,并用100目尼龙网罩住乌桕幼苗以隔绝其他昆虫[13]。2个月后,选取生长良好且长势一致的幼苗供试。
试验用癞皮夜蛾幼虫采集自野外,并置于实验室中饲养,多代繁殖后,取健康无病的3龄幼虫供试。接种所需的南方根结线虫在番茄苗上进行扩繁。
1.2 南方根结线虫接种参照刘维志[23]的方法配置1 000头·mL-1的2龄南方根结线虫幼虫悬浮液。用打孔器于乌桕根部钻5个约3 mm深的小孔,每个小孔注入2 mL的南方根结线虫悬浮液(10 000头·植株-1),对照组则注入2 mL无菌水,然后将小孔用土壤覆盖。30 d后,检查线虫侵染情况,挑选长势一致且有明显根结的植株开展生物测定。
1.3 生物测定采集乌桕顶端完全展开的第4-5片叶饲喂癞皮夜蛾幼虫,将3龄幼虫(M0)与乌桕叶片(M1)称重,放入垫有湿润滤纸的培养皿(直径为10 cm)中,以封口膜密封并置于室温下饲养,定期更换新鲜叶片、补充滤纸水分。实验设置两个处理(线虫侵染乌桕和未被侵染乌桕),每个处理重复15次。每24 h检查一次癞皮夜蛾幼虫的生长状况和叶片取食状况,观察幼虫是否蜕皮,记录幼虫各龄期发育历期(N)及化蛹情况。蜕皮当天称量幼虫体质量(Mt)并更换培养皿,收集剩余叶片及粪便,于60℃下烘干至恒重,得到剩余叶片干重(M2)及粪便干重(Mexc)。实验设置完全对照,以校正叶片质量(M1)和幼虫质量(M0、Mt),换算为干重。采用Waldbauer[24]的方法计算各龄期幼虫生长指标和食物利用参数,具体如下:
取食量Meat=M1-M2,
相对生长率=
食物利用率=
近似消化率=
食物转化率=
通过重复测量方差分析比较南方根结线虫侵染对癞皮夜蛾不同龄期生长指标(虫体质量、相对生长率、发育历期)及食物利用指标(取食量、食物利用率、近似消化率、食物转化率)的影响,以线虫侵染处理(线虫侵染、对照)作为组间变量,以龄期作为组内变量,并考虑二者的交互效应。不满足球形假设的结果,采用Huynh-Feldt对自由度进行校正。采用独立样本t检验分析线虫侵染对癞皮夜蛾化蛹率的影响。所有数据均采用SPSS 23.0进行统计分析,采用SigmaPlot 12.5软件作图。
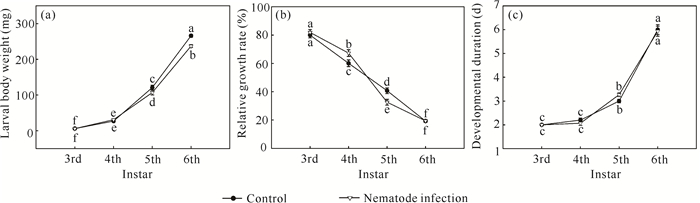
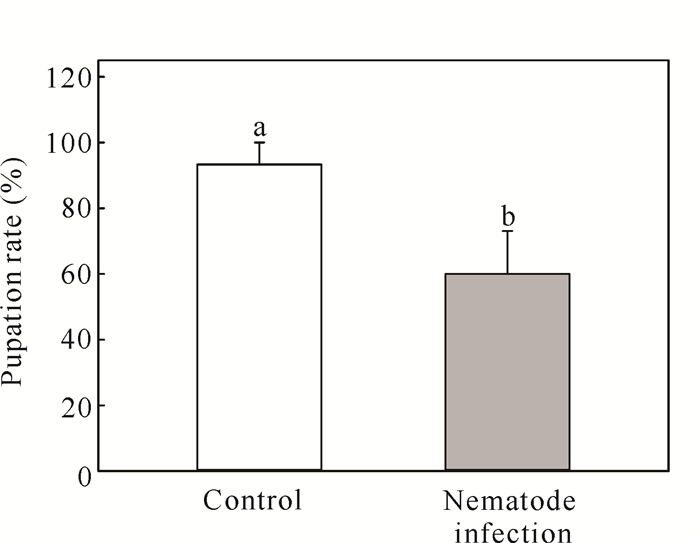
2 结果与分析 2.1 线虫侵染处理对不同龄期癞皮夜蛾生长发育的影响癞皮夜蛾幼虫的虫体质量、相对生长率及发育历期在不同龄期间存在极显著差异,龄期×线虫侵染处理互作对虫体质量和相对生长率产生显著的交互影响(表 1)。随着龄期的增加,幼虫虫体质量逐渐升高,发育历期逐渐变长,而相对生长率则逐渐降低(图 1)。与对照相比,南方根结线虫虽然显著提高了癞皮夜蛾4龄幼虫的相对生长率,但却显著降低了5龄和6龄幼虫的虫体质量以及5龄幼虫的相对生长率[图 1:(a)(b)]。此外,线虫侵染处理显著降低了癞皮夜蛾的化蛹率(t=2.269, P=0.034),线虫侵染处理下的化蛹率与对照相比降低了约33.3%(图 2)。
| 方差来源 Variance source |
df | 幼虫体质量(mg) Larval body weight (mg) |
df | 相对生长率(%) Relative growth rate (%) |
df | 发育历期(d) Developmental duration (d) |
||||
| F | P | F | P | F | P | |||||
| Within subjects |
Instar | 1.9, 52.8 | 1 781.53 | < 0.001** | 3, 84 | 335.55 | < 0.001** | 1.7, 46.4 | 420.26 | < 0.001** |
| Instar× Nematode infestation |
1.9, 52.8 | 8.16 | 0.001* | 3, 84 | 4.42 | 0.006* | 1.7, 46.4 | 0.95 | 0.379 | |
| Between subjects |
Nematode infestation | 1, 28 | 8.58 | 0.007* | 1, 28 | 0.06 | 0.814 | 1, 28 | 0.03 | 0.855 |
| Note: * indicates significant differences (P<0.05),** indicates extremely significant differences (P<0.001) | ||||||||||
|
| Different lowercase letters indicate significant differences (P < 0.05) 图 1 南方根结线虫侵染处理对不同龄期癞皮夜蛾幼虫生长发育的影响 Fig. 1 Effects of M.incognita infection treatment on the growth and the development of G.fusca larvae of different instars |
|
| Different lowercase letters indicate significant differences (P < 0.05) 图 2 南方根结线虫侵染处理对癞皮夜蛾化蛹率的影响 Fig. 2 Effects of M.incognita infection treatment on the pupation rate of G.fusca |
2.2 线虫侵染处理对不同龄期幼虫食物利用的影响
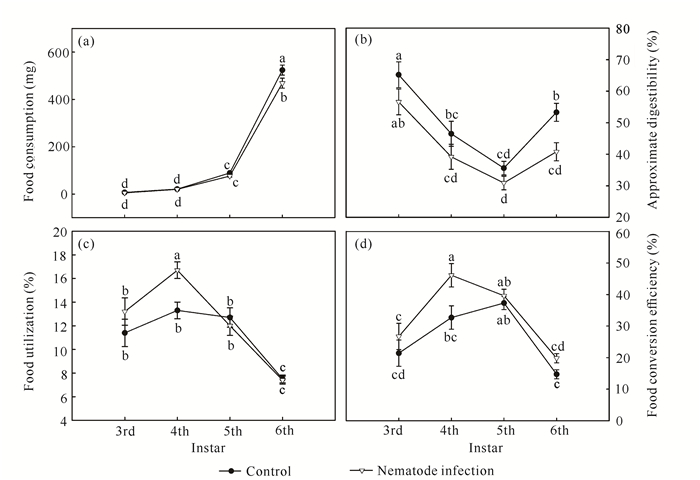
如表 2所示,癞皮夜蛾幼虫的取食量、食物利用率、近似消化率和食物转化率在不同龄期间存在极显著差异;线虫侵染处理能显著影响癞皮夜蛾幼虫的取食量、近似消化率和食物转化率;龄期×线虫侵染处理互作对癞皮夜蛾幼虫的食物利用率产生显著的交互影响。随着龄期的增加,幼虫取食量逐渐增大,近似消化率先降低后略微回升,食物利用率和转化率则先升高后降低(图 3)。与对照相比,线虫侵染处理使癞皮夜蛾4龄幼虫的食物转化率和食物利用率显著升高,但6龄幼虫的取食量和近似消化率却显著降低(图 3)。
| 方差来源 Variance source |
df | 取食量(mg) Food consumption (mg) |
df | 食物利用率(%) Food utilization efficiency (%) |
df | 近似消化率(%) Approximate digestibility (%) |
df | 食物转化率(%) Food conversion efficiency (%) |
|||||
| F | P | F | P | F | P | F | P | ||||||
| Within subjects |
Instar | 1.1, 31.4 | 959.71 | < 0.001** | 2.2, 60.8 | 34.50 | < 0.001** | 3, 84 | 26.95 | < 0.001** | 2.8, 78.3 | 5.79 | < 0.001** |
| Instar× Nematode infestation |
1.1, 31.4 | 2.96 | 0.091 | 2.2, 60.8 | 3.17 | 0.045* | 3, 84 | 0.52 | 0.669 | 2.8, 78.3 | 1.30 | 0.209 | |
| Between subjects |
Nematode infestation | 1, 28 | 5.13 | 0.031* | 1, 28 | 2.44 | 0.129 | 1, 28 | 8.21 | 0.008* | 1, 28 | 4.63 | 0.040* |
| Note: * indicates significant differences (P<0.05),** indicates extremely significant differences (P<0.001) | |||||||||||||
|
| Different lowercase letters indicate significant differences (P < 0.05) 图 3 南方根结线虫侵染处理对不同龄期癞皮夜蛾幼虫食物利用的影响 Fig. 3 Effects of M.incognita infection treatment on food utilization of G.fusca larvae of different instars |
3 讨论
通过比较不同龄期幼虫的生长发育指标,可以明确幼虫的生长和营养效应,评价食物对植食性生物的影响[25-27]。本研究发现,癞皮夜蛾幼虫的相对生长速率、取食量、消化率、食物利用率等指标在不同龄期间差异显著。申思等[27]研究虾钳菜披龟甲(Cassida piperata)幼虫也发现类似的现象。食物利用率可以反映昆虫摄取的食物转化为生物量的效率,是昆虫食物利用的一项重要指标,食物被转化为身体组成的比例越高,越有利于昆虫的生长发育[28]。本研究中,癞皮夜蛾6龄幼虫的取食量达到最高,但相对生长率、食物利用率和食物转化率却大幅度降低,可见6龄幼虫所摄取的大部分食物并未转化为生物量。此外,本研究还发现南方根结线虫侵染显著提高了癞皮夜蛾4龄幼虫的食物利用率和转化率。较高的食物转化率能在一定程度上补偿消化率降低所带来的不利影响,短暂地促进4龄幼虫的生长发育。该结果说明癞皮夜蛾幼虫具有一定的补偿和调节能力,可在一定程度上抵消不利环境因素的影响。这种较高的食物转化率可能是昆虫自身的一种生理调节结果,其目的是维持自身的生理平衡,其他昆虫如虾钳菜披龟甲[27]、斜纹夜蛾(Prodenia litura)[28]、稻纵卷叶螟(Cnaphalocrocis medinalis)[29]、甜菜夜蛾(Spodoptera exigua)[30]也发现有类似的现象。
空间分离的地上和地下植食性生物可通过相互影响对共同寄主植物形成加性、协同或拮抗效应,且地上-地下植食性生物间的互作受寄主植物种类[31]、植食性生物食性[20]、虫口密度[15]、取食顺序[32]、龄期[27]等诸多因素的影响。本研究中,癞皮夜蛾幼虫取食被南方根结线虫侵染乌桕植株的叶片后,与对照相比,其5龄、6龄幼虫的虫体质量显著降低,5龄幼虫的相对生长率以及6龄幼虫的取食量、近似消化率和化蛹率均显著降低,说明线虫侵染能抑制癞皮夜蛾化蛹,降低了化蛹的成功率,从而间接减少了乌桕上癞皮夜蛾的种群数量。前人研究也发现,南方根结线虫对癞皮夜蛾存在拮抗效应[14, 20, 22],主要是由于植食性生物胁迫能诱导植物在营养、次生代谢物质、挥发性物质等方面发挥作用[1-5, 33, 34]。Yang等[15]发现,南方根结线虫侵染显著提高了乌桕叶片中类黄酮和单宁的含量。刘亚珍等[35]发现,线虫侵染会显著降低乌桕的胞间CO2浓度、气孔导度和叶绿素含量。陈书霞等[32]也发现,南方根结线虫能提高黄瓜植株的过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)及总酚含量。以上因素均能影响昆虫的取食选择及对食物的吸收利用。
本研究虽然探讨了南方根结线虫对癞皮夜蛾不同龄期幼虫生长发育的影响,但并未考虑不同龄期幼虫生理代谢差异与其响应机制的相关性。植物与昆虫在长期的相互作用和共同进化过程中形成了复杂的适应机制[36],植食性生物为克服植物防御也相应地进化出一系列反防御策略[37, 38]。Ji等[39]发现,褐飞虱(Nilaparvata lugens)可通过β-1, 4-葡聚糖酶(NIEG1)降解植物细胞壁中的纤维素并规避茉莉酸(JA)和茉莉酸与异亮氨酸的偶联物(JA-Ile)介导的水稻防御反应。Yuan等[40]研究发现,解毒酶在美国白蛾(Hyphantria cunea)体内的解毒作用随着龄期的增加越来越显著。此外,朱香镇等[41]发现,绿盲蝽(Apolygus lucorum)受到不同浓度外源次生物质胁迫后,昆虫体内保护酶和解毒酶被激活的程度不同。因此,可以推测南方根结线虫与癞皮夜蛾不同龄期间的互作效应可能也与昆虫各龄期的生理代谢及植物次生代谢物浓度有关。后续将继续探究昆虫解毒酶及植物次生代谢物浓度在地上-地下植食性生物互作中的影响,以期进一步阐明不同空间植食性生物之间的互作机制,丰富地上-地下互作理论。
4 结论南方根结线虫侵染对癞皮夜蛾幼虫生长发育的影响因龄期而异,线虫侵染虽然显著提高了癞皮夜蛾4龄幼虫的相对生长率、食物利用率和食物转化率,但却抑制了其末龄幼虫的生长发育及化蛹。本研究结果表明,南方根结线虫与癞皮夜蛾间总体上形成一种拮抗效应,从而对乌桕植株形成加性效应,间接减轻了癞皮夜蛾对乌桕的危害。
| [1] |
SONG Y Y, ZENG R S, XU J F, et al. Interplant communication of tomato plants through underground common mycorrhizal networks[J]. PLoS One, 2010, 5(10): e13324. DOI:10.1371/journal.pone.0013324 |
| [2] |
SOLER R, ERB M, KAPLAN I. Long distance rootshoot signalling in plant-insect community interactions[J]. Trends in Plant Science, 2013, 18(3): 149-156. DOI:10.1016/j.tplants.2012.08.010 |
| [3] |
ROBERT C A M, ERB M, DUPLOYER M, et al. Herbivore-induced plant volatiles mediate host selection by a root herbivore[J]. New Phytologist, 2012, 194(4): 1061-1069. DOI:10.1111/j.1469-8137.2012.04127.x |
| [4] |
DE OLIVEIRA E F, PALLINI A, JANSSEN A. Herbivores with similar feeding modes interact through the induction of different plant responses[J]. Oecologia, 2016, 180(1): 1-10. DOI:10.1007/s00442-015-3344-0 |
| [5] |
WANG M G, BIERE A, PUTTEN W H V D, et al. Sequential effects of root and foliar herbivory on aboveground and belowground induced plant defense responses and insect performance[J]. Oecologia, 2014, 175(1): 187-198. DOI:10.1007/s00442-014-2885-y |
| [6] |
KAPLAN I, HALITSCHKE R, KESSLER A, et al. Constitutive and induced defenses to herbivory in above- and belowground plant tissues[J]. Ecology, 2008, 89(2): 392-406. DOI:10.1890/07-0471.1 |
| [7] |
ERWIN A C, ZVST T, ALI J G, et al. Above-ground herbivory by red milkweed beetles facilitates above- and below-ground conspecific insects and reduces fruit production in common milkweed[J]. Journal of Ecology, 2014, 102(4): 1038-1047. DOI:10.1111/1365-2745.12248 |
| [8] |
MUNDIM F M, ALBORN H T, VIEIRA-NETO E H M, et al. A whole-plant perspective reveals unexpected impacts of above- and belowground herbivores on plant growth and defense[J]. Ecology, 2017, 98: 70-78. DOI:10.1002/ecy.1619 |
| [9] |
KUTYNIOK M, MVLLER C. Crosstalk between above- and belowground herbivores is mediated by minute metabolic responses of the host Arabidopsis thaliana[J]. Journal of Experimental Botany, 2012, 63(17): 6199-6210. DOI:10.1093/jxb/ers274 |
| [10] |
WURST S, PUTTEN W H V D. Root herbivore identity matters in plant-mediated interactions between root and shoot herbivores[J]. Basic and Applied Ecology, 2007, 8(6): 491-499. DOI:10.1016/j.baae.2006.09.015 |
| [11] |
KAPLAN I, HALITSCHKE R, KESSLER A, et al. Physiological integration of roots and shoots in plant defense strategies links above- and belowground herbivory[J]. Ecology Letters, 2008, 11(8): 841-851. DOI:10.1111/j.1461-0248.2008.01200.x |
| [12] |
HUANG W, SIEMANN E, XIAO L, et al. Species-specific defence responses facilitate conspecifics and inhibit heterospecifics in above-belowground herbivore interactions[J]. Nature Communications, 2014, 5(1): 4851. DOI:10.1038/ncomms5851 |
| [13] |
LI X Q, GUO W F, SIEMANN E, et al. Plant genotypes affect aboveground and belowground herbivore interactions by changing chemical defense[J]. Oecologia, 2016, 182: 1107-1115. DOI:10.1007/s00442-016-3719-x |
| [14] |
LI X Q, GAO X, SIEMANN E, et al. Effects of above- and belowground herbivory of specialists and generalists on the growth and defensive chemicals of introduced and native Chinese tallow seedlings[J]. Plant and Soil, 2020, 455: 65-78. DOI:10.1007/s11104-020-04666-2 |
| [15] |
YANG S, GUO W F, TANG J, et al. Impact of caterpillars and plant-parasitic nematodes on Chinese tallow tree are more strongly affected by nematode density than by caterpillar identity[J]. Arthropod-Plant Interactions, 2022, 16(1): 119-128. DOI:10.1007/s11829-022-09883-3 |
| [16] |
MCCARVILLE M T, SOH D H, TYLKA G L, et al. Aboveground feeding by Soybean Aphid, Aphis glycines, affects Soybean Cyst Nematode, Heterodera glycines, reproduction belowground[J]. PLoS One, 2014, 9(1): e86415. DOI:10.1371/journal.pone.0086415 |
| [17] |
李冬林, 黄栋, 王瑾, 等. 乌桕研究综述[J]. 江苏林业科技, 2009, 36(4): 43-47. DOI:10.3969/j.issn.1001-7380.2009.04.013 |
| [18] |
张家亮, 王毅, 丁建清. 乌桕害虫名录[J]. 中国森林病虫, 2015, 34(5): 25-35. DOI:10.3969/j.issn.1671-0886.2015.05.006 |
| [19] |
洪承昊, 陈京元, 查玉平. 乌桕主要害虫及防治策略[J]. 湖北林业科技, 2010, 166(6): 65-67. DOI:10.3969/j.issn.1004-3020.2010.06.020 |
| [20] |
项瑶, 刘亚珍, 郭文锋, 等. 根结线虫对两种不同食性昆虫生长及营养利用的影响比较[J]. 环境昆虫学报, 2019, 41(3): 672-678. |
| [21] |
WANG Y, ZHU L, GU X, et al. Pre-release assessment of Gadirtha inexacta, a proposed biological control agent of Chinese tallow (Triadica sebifera) in the United States[J]. Biological Control, 2012, 63(3): 304-309. DOI:10.1016/j.biocontrol.2012.08.008 |
| [22] |
刘亚珍, 覃志伟, 项瑶, 等. 天敌互作对乌桕生长及生物量的影响[J]. 西南林业大学学报(自然科学版), 2018, 38(1): 196-201. |
| [23] |
刘维志. 植物病原线虫学[M]. 北京: 中国农业出版社, 2000.
|
| [24] |
WALDBAUER G P. The consumption and utilization of food by insects[J]. Advances in Insect Physiology, 1968, 5: 229-288. |
| [25] |
郭建国, 张海英, 刘永刚, 等. 新烟碱类杀虫剂拌种对马铃薯甲虫幼虫食物利用和生长发育的影响[J]. 昆虫学报, 2010, 53(7): 748-753. DOI:10.16380/j.kcxb.2010.07.009 |
| [26] |
唐庆峰, 房敏, 姚领, 等. 取食玉米不同组织对草地贪夜蛾生长发育及营养指标的影响[J]. 植物保护, 2020, 46(1): 24-27, 33. |
| [27] |
申思, 郭文锋, 覃海蓉, 等. 根结线虫侵染对虾钳菜披龟甲幼虫发育的影响[J]. 河南农业大学学报, 2021, 55(1): 52-56, 72. |
| [28] |
秦俊豪, 顾忱, 舒迎花, 等. ClO4-与As5+复合污染对斜纹夜蛾食物利用的影响[J]. 生态科学, 2013, 32(3): 338-344. DOI:10.3969/j.issn.1008-8873.2013.03.013 |
| [29] |
沈煜洋, 孟玲. 土壤添加生物质炭对稻纵卷叶螟幼虫生长和末龄幼虫食物利用效率的影响[J]. 南京农业大学学报, 2020, 43(2): 247-252. |
| [30] |
范锦胜, 张李香, 王贵强, 等. 甜菜夜蛾幼虫对寄主植物的选择及营养利用[J]. 中国农学通报, 2011, 27(30): 233-236. |
| [31] |
项瑶, 郭文锋, 荣慧, 等. 根结线虫侵染寄主对莲草直胸跳甲生长发育及食物利用的影响[J]. 中国植保导刊, 2020, 40(1): 60-66. |
| [32] |
陈书霞, 姜永华, 刘宏久, 等. AM真菌和根结线虫互作对黄瓜生长及生理特征的影响[J]. 植物保护学报, 2012, 39(3): 253-259. |
| [33] |
JOHNSON S N, HAWES C, KARLEY A J. Reappraising the role of plant nutrients as mediators of interactions between root- and foliar-feeding insects[J]. Functional Ecology, 2009, 23(4): 699-706. |
| [34] |
INBAR M, GERLING D. Plant-mediated interactions between whiteflies, herbivores, and natural enemies[J]. Annual Review of Entomology, 2008, 53(1): 431-448. |
| [35] |
刘亚珍, 项瑶, 郭文锋, 等. 乌桕对南方根结线虫与地上不同食性昆虫互作的光合生理响应[J]. 植物保护, 2019, 45(6): 222-228. |
| [36] |
禹海鑫, 叶文丰, 孙民琴, 等. 植物与植食性昆虫防御与反防御的三个层次[J]. 生态学杂志, 2015, 34(1): 256-262. |
| [37] |
VANDERMOTEN S, HARMEL N, MAZZUCCHELLI G, et al. Comparative analyses of salivary proteins from three aphid species[J]. Insect Molecular Biology, 2014, 23(1): 67-77. |
| [38] |
BOS J I B, PRINCE D, PITINO M, et al. A functional genomics approach identifies candidate effectors from the aphid species Myzus persicae (green peach aphid)[J]. Plos Genetics, 2010, 6(11): e1001216. |
| [39] |
JI R, YE W, CHEN H, et al. A salivary endo-β-1, 4-glucanase acts as an effector that enables the brown planthopper to feed on rice[J]. Plant Physiology, 2017, 173(3): 1920-1932. |
| [40] |
YUAN Y F, LI L S, ZHAO J F, et al. Effect of tannic acid on nutrition and activities of detoxification enzymes and acetylcholinesterase of the fall webworm (Lepidoptera: Arctiidae)[J]. Journal of Insect Science, 2020, 20(1): 1-7. |
| [41] |
朱香镇, 雒珺瑜, 张帅, 等. 植物源次生物质棉酚和芸香苷对绿盲蝽保护酶与解毒酶活性的影响[J]. 植物保护学报, 2018, 45(5): 1044-1053. |



