2. 广东海洋大学深圳研究院海洋医药研发中心, 广东深圳 518120;
3. 大连工业大学, 海洋食品精深加工关键技术省部共建协同创新中心, 辽宁大连 116034
2. Center for Marine Drugs Research & Development, Shenzhen Institute of Guangdong Ocean University, Shenzhen, Guangdong, 518120, China;
3. Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University, Dalian, Liaoning, 116034, China
微生物来源次级代谢产物是目前药物先导化合物的重要来源之一。传统研究主要集中在单一培养条件下微生物发酵液和菌丝体中活性化合物的提取分离,这导致经常重复发现已被研究过的化合物[1]。研究人员对多种真菌和细菌进行全基因组测序发现,能够编码化合物的基因数目非常庞大,真菌和细菌可产生的化合物远远超过目前被发现的化合物数量,表明微生物在单一培养条件下产生生物活性化合物的潜力被严重低估,很多基因可能处于沉默状态。现有研究发现,通过敲除、引入异源表达微生物基因、调节启动子、诱导突变或改变培养条件等方式挖掘微生物次级代谢产物的生物合成基因簇,也许会产生更多的次级代谢产物[2-4]。而添加前体物质是一种简单有效的策略,它是指在发酵培养基中添加一种在微生物生物合成过程中能易于或直接结合到最终化合物的物质,使某些次级代谢产物的产量有较大提高或可能产生新的化合物[5]。Valente等[6]研究在培养基中添加不同前体物质对内生真菌Penicillium crustosum次级代谢产物的影响,结果发现,添加ferulic/quinic acids和添加cinnami/3, 4-(methylenedioxy)能够产生新化合物5-hydroxy-7-methoxy-4-methylphthalide。Wang等[7]在对内生真菌Spicaria elegans KLA03培养过程中添加L-色氨酸和D-色氨酸,从其次级代谢产物中分离得到3种新的细胞松弛素,活性研究结果表明三者对A-549细胞系显示出细胞毒活性,半数抑制浓度(IC50)值分别为8.2 μmol/L、20.0 μmol/L和3.1 μmol/L。自然界中存在大量的微生物,但是目前添加前体物质对先导化合物影响的研究只涉及天然资源中的一小部分,尤其是内生微生物的研究中关于通过添加前体物质针对性改变菌株次级代谢产物的工作尚少,此方向具有巨大的研究潜力。
本研究在前期研究中发现,红树植物杨叶肖槿(Thespesia populnea)来源内生真菌Talaromyces sp.YX-001和Penicillium sp.YX-002中的次级代谢产物中可能具有丰富的生物碱和萜类化合物。通过查阅文献得知,这两类化合物的前体物质多为氨基酸和甲戊二羟酸[8, 9]。因此在前期研究的基础上[10, 11],本研究选取马铃薯葡萄糖液体(Potato Dextrose Broth,PDB)培养基和察氏(Czapek′s)培养基,分别添加2种前体物质(甲戊二羟酸和酪氨酸)对菌株YX-001与YX-002进行微量发酵,通过分析菌株次级代谢产物的产量、HPLC指纹图谱、乙酰胆碱酯酶(AChE)抑制活性、1, 1-二苯基-2-三硝基苯肼(DPPH)自由基清除和卤虫致死率的变化,探究添加前体物质对菌株次级代谢产物的影响,拟为进一步开展菌株Talaromyces sp.YX-001和Penicillium sp.YX-002次级代谢产物的研究及药物先导化合物的发现奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株内生真菌Talaromyces sp.YX-001和Penicillium sp.YX-002分别采集于广东湛江红树林国家级自然保护区的红树植物杨叶肖槿(Thespesia populnea)的根部和叶部,通过用真菌ITS引物ITS1和ITS4扩增真菌DNA序列,所得的碱基序列在Genebank中用Blast进行进化树相似性分析,分别鉴定为Talaromyces sp.(Genbank登录号:MN826194)和Penicillium sp.(Genbank登录号:MN826202),现均保存于广东海洋大学食品科技学院海洋药物研究所。
1.1.2 培养基PDB培养基:称取马铃薯汁500 mL、葡萄糖20 g、蛋白胨5 g和海盐20 g,加入纯水定容至1 L,置于高压灭菌锅灭菌30 min (1×105 Pa),备用。
Czapek′s培养基:称取蔗糖30 g、K2HPO4 1 g、KCl 0.5 g、MgSO40.5 g、FeSO40.01g、NaNO32 g和海盐20 g,加入纯水定容至1 L,调节pH值至7.2±0.2,置于高压灭菌锅灭菌30 min (1×105 Pa),备用。
1.1.3 试剂与仪器前体物质甲戊二羟酸以水为溶剂,酪氨酸以5%的稀盐酸为溶剂,均配制成10 mg/mL的溶液,经0.22 μm滤膜过滤后备用。
试剂:AChE(C3389)、碘代硫代乙酰胆碱(Acetylthiocholine Iodide, ATCI, DA0048)、牛血清蛋白(Bovine Serum Albumin, BSA, A1933)、DPPH(D9132)、海盐(S9883)均购自Sigma-Aldrich,5, 5′-二硫代二硝基苯甲酸(Dithiobisnitrobenzoic acid, DTNB, D8130)购自Ruibio公司,卤虫卵购自中国爱家水族馆,其他试剂均为国产分析纯。
仪器:WFH-201B多功能紫外透射仪(上海精科实业有限公司), 霉菌培养箱及生物安全柜(上海博讯实业有限公司医疗设备厂),1260 Infinity Ⅱ高效液相色谱仪(美国Agilent公司),Epoch2酶标仪(美国BioTek公司),R-300旋转蒸发仪(上海爱朗仪器有限公司),薄层层析板(GF254,青岛邦凯高新技术材料有限公司)。
1.2 方法 1.2.1 种子液的制备将待培养的2株海洋真菌放进霉菌培养箱中活化过夜(28℃、湿度80%),而后将活化的菌种接种到预先灭菌的PDB培养基(200 mL)中,置于霉菌培养箱(28℃)中摇床(转数120 r/min)培养3-4 d,待菌落孢子生长茂盛,备用。
1.2.2 前体物质的添加采用12孔板对菌株进行微量培养,每孔分别加入2 mL培养基(PDB培养基/Czapek′s培养基)和200 μL种子液,置于霉菌培养箱(28℃)培养3 d后,分别加入一定量的溶剂或前体物质(甲戊二羟酸/酪氨酸),使样品的终浓度为1 mg/mL,每组做3个平行,而后继续培养14 d。
前体组:2 mL培养基、200 μL种子液、245 μL前体溶液(甲戊二羟酸/酪氨酸)。
对照组:2 mL培养基、200 μL种子液、245 μL水。
盐酸组:2 mL培养基、200 μL种子液、245 μL 5%稀盐酸。
1.2.3 菌株次级代谢产物的产量及HPLC分析将上述培养好的菌株分别加入等体积的甲醇浸提3次后,离心15 min (3 000 r/min),取上层清液。减压浓缩获得粗提物的水溶液后,用乙酸乙酯萃取3次,再次减压浓缩,干燥得到粗浸膏,即为样品,称量并做好记录。
HPLC分析条件:样品用色谱纯甲醇溶解,配制成浓度为5 mg/mL的溶液,进样量为10 μL。洗脱条件为0-10 min,5%-95%的乙腈-水梯度洗脱;10-13 min,95%乙腈-水等度洗脱;13-17 min,95%-5%的乙腈-水梯度洗脱;17-20 min,5%的乙腈-水等度洗脱,流速为0.6 mL/min。DAD检测器信号采集波长为190-400 nm,本实验检测波长为210 nm。
1.2.4 菌株次级代谢产物的生物活性分析(1) AChE抑制活性测试。
采用优化的Ellmans比色法测定AChE的体外抑制活性[12]。称取一定量的样品,用甲醇溶解至10 mg/mL,在96孔板的每个孔中加入100 μL样品溶液,待样品中的有机溶剂挥发干,依次将1 μL二甲基亚砜(DMSO)、49 μL PBS、10 μL 0.2 U/mL AChE和20 μL DTNB加入每个孔中,置于培养箱保温10 min (37℃)。将孔板取出后再加入20 μL乙酰硫代胆碱(ATCh),继续孵育20 min (37℃,恒温恒湿),通过酶标仪测定λ=405 nm处的吸光度D405,以盐酸多奈哌齐作为AChE抑制活性测试的阳性对照。抑制率的计算公式如下:
| $ \begin{aligned} &抑制率(\%)= \\ & \frac{\left[\left(D_{\text {control }}-D_{\text {blank }}\right)-\left(D_{\text {sample }}-D_{\text {sample blank }}\right)\right]}{\left(D_{\text {control }}-D_{\text {blank }}\right)} \times \\ & 100 \% \end{aligned} $ |
其中,Dsample blank表示加入样品和BSA组的吸光度,Dsample表示加入样品和AChE组的吸光度,Dcontrol表示只加入AChE组的吸光度,Dblank表示只加入BSA组的吸光度。
(2) DPPH自由基清除活性测试。
采用Sharma等[13]描述的方法,在96孔板中测定DPPH自由基清除活性。样品用甲醇溶解至10 mg/mL,备用。各反应体系均为100 μL。将96孔板置于暗处30 min后,通过酶标仪测定λ=517 nm处各反应体系的吸光度A,以维生素C为阳性对照,每组设置3个平行。DPPH自由基清除率的计算公式如下:
| $ \begin{aligned} &清除率(\%)= \\ & \frac{\left[\left(A_{\text {control }}-A_{\text {blank }}\right)-\left(A_{\text {sample }}-A_{\text {sample blank }}\right)\right]}{\left(A_{\text {control }}-A_{\text {blank }}\right)} \times \\ & 100 \%, \end{aligned} $ |
其中,Asample表示含有50 μL DPPH和50 μL样品的DMSO溶液反应体系的吸光度,Acontrol表示含有50 μL DPPH和50 μL DMSO溶液的反应体系的吸光度,Asample blank表示含有50 μL甲醇和50 μL样品的DMSO溶液反应体系的吸光度,Ablank表示含有50 μL甲醇和50 μL DMSO溶液的反应体系的吸光度。
(3) 卤虫致死活性测试。
采用96孔板测试样品对卤虫的致死活性[14]。每孔加199 μL含卤虫幼体的溶液(每孔约含20只卤虫),制成测试培养板。样品以DMSO为溶剂,浓度为10 mg/mL,每个培养板孔中加入1 μL样品,终浓度为50 μg/mL,设3个平行样。在恒温培养箱中培养24 h(28℃,保持光照)后,统计各孔中卤虫的总数和死亡数,阴性和阳性对照分别为DMSO和秋水仙碱。卤虫致死率计算公式如下:
卤虫致死率(%)=[(样品组致死率-对照组致死率)/对照组存活率]×100%。
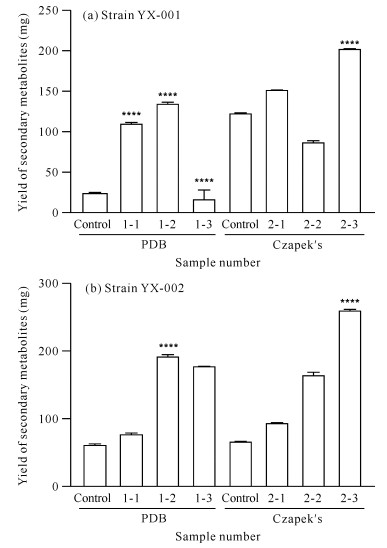
2 结果与分析 2.1 添加前体物质前后菌株次级代谢产物的产量和HPLC指纹图谱变化情况 2.1.1 产量变化情况对菌株YX-001[图 1(a)]而言,在两种培养基中添加甲戊二羟酸都可使菌株次级代谢产物的产量提高。在PDB培养基中添加酪氨酸,可使菌株YX-001的次级代谢产物的产量降低,而在Czapek′s培养基中添加酪氨酸,可使该产量提高。进一步分析可知,在PDB培养基中,酪氨酸前体组中菌株次级代谢产物的产量远低于盐酸组,表明菌株YX-001次级代谢产物的产量增加主要是由酸性环境引起,酪氨酸的加入反而会抑制菌株YX-001的代谢;在Czapek′s培养基中,盐酸组中菌株次级代谢产物的产量低于对照组,但酪氨酸前体组中菌株次级代谢产物的产量显著高于盐酸组,表明酸性环境可能会抑制菌株YX-001的代谢,但酪氨酸的加入可显著促进菌株YX-001的代谢。
|
| x-y is sample number, x represents medium (1 represents PDB medium, 2 represents Czapek′s medium), y represents added precursor or solvent (1 for mevalondihydroxy acid, 2 for hydrochloric acid and 3 for tyrosine).**** indicates comparison with the control group, P < 0.000 1 图 1 菌株YX-001和YX-002在不同培养条件下的产量 Fig. 1 Yield of strains YX-001 and YX-002 obtained under different media conditions |
对菌株YX-002[图 1(b)]而言,添加甲戊二羟酸和酪氨酸均可使菌株YX-002的次级代谢产物产量提高,尤其是盐酸组和酪氨酸前体组,其代谢产物显著增加(P<0.000 1)。进一步分析可知,在PDB培养基中,酪氨酸前体组中菌株次级代谢产物的产量低于盐酸组,表明菌株YX-002次级代谢产物的产量增加主要是由酸性环境引起;在Czapek′s培养基中,酪氨酸前体组中菌株次级代谢产物的产量显著高于盐酸组,表明酸性环境下,酪氨酸的加入可促进菌株YX-002的代谢。
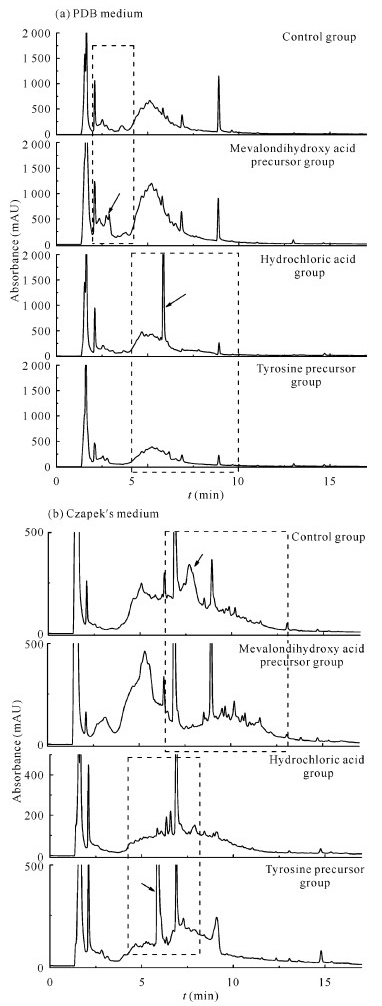
2.1.2 HPLC指纹图谱变化情况对菌株YX-001(图 2)而言,与对照组相比,在添加甲戊二羟酸和酪氨酸2种前体物质后,除在PDB培养基中酪氨酸前体组中菌株次级代谢产物的吸收峰减少外,其余各实验组中菌株次级代谢产物的吸收峰均有增加,表明这些条件下菌株YX-001可能产生了新的次级代谢产物。
|
| Dotted boxes indicate areas of change in emphasis, arrow points to newly added or disappeared absorption peak 图 2 添加前体物质前后菌株YX-001次级代谢产物的HPLC指纹图谱 Fig. 2 HPLC fingerprints of secondary metabolites of strain YX-001 before and after feeding precursor |
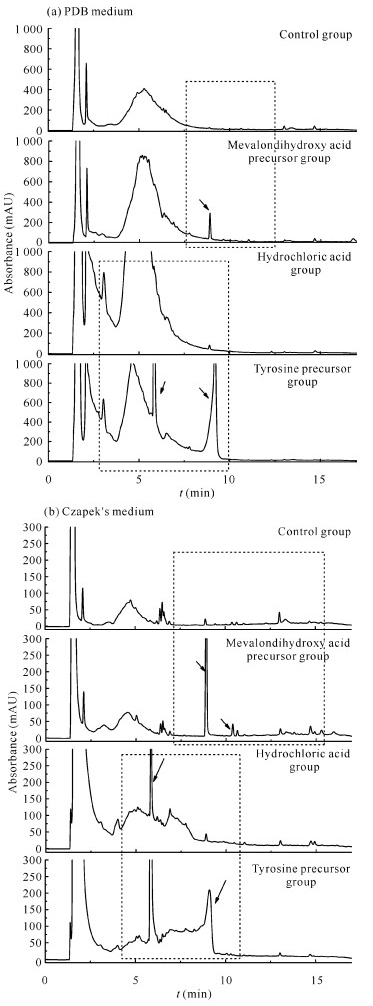
对菌株YX-002(图 3)而言,与对照组相比,在添加甲戊二羟酸和酪氨酸2种前体物质后,无论是PDB培养基还是Czapek′s培养基中菌株次级代谢产物的吸收峰都明显增多。与对照组相比,在保留时间tR=9.5 min处的新的吸收峰仅在甲戊二羟酸和酪氨酸前体组中出现,而盐酸组没有,表明该吸收峰可能是由于添加甲戊二羟酸和酪氨酸前体产生的。
|
| Dotted boxes indicate areas of change in emphasis, arrow points to newly added or disappeared absorption peak 图 3 添加前体物质前后菌株YX-002次级代谢产物的HPLC指纹图谱 Fig. 3 HPLC fingerprints of secondary metabolites of strain YX-002 before and after feeding precursor |
2.2 添加前体物质前后菌株次级代谢产物生物活性的变化情况 2.2.1 AChE抑制活性
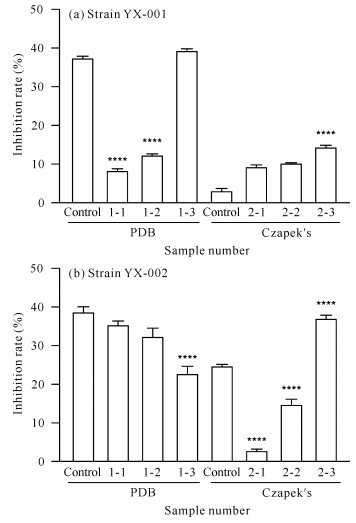
对菌株YX-001[图 4(a)]而言,在PDB培养基中,添加甲戊二羟酸可降低菌株次级代谢产物的AChE抑制活性,而添加酪氨酸可使该活性增加。由于盐酸组的AChE抑制活性低于对照组,表明在PDB培养基中,使AChE抑制活性增加的原因在于酪氨酸,而不是盐酸。在Czapek′s培养基中,添加甲戊二羟酸和酪氨酸均可增加菌株次级代谢产物的AChE抑制活性。
|
| x-y is sample number, x represents medium (1 represents PDB medium, 2 represents Czapek′s medium), y represents added precursor or solvent (1 for mevalondihydroxy acid, 2 for hydrochloric acid and 3 for tyrosine).**** indicates comparison with the control group, P < 0.000 1 图 4 菌株YX-001和YX-002次级代谢产物的AChE抑制活性 Fig. 4 AChE inhibitory activity of secondary metabolites of strains YX-001 and YX-002 |
对菌株YX-002[图 4(b)]而言,在PDB培养基中,添加甲戊二羟酸和酪氨酸均可降低AChE抑制活性,且酪氨酸的效果更为显著;在Czapek′s培养基中,添加甲戊二羟酸可显著降低菌株次级代谢产物的AChE抑制活性,而添加酪氨酸可使该活性增加。由于盐酸组的AChE抑制活性低于对照组,表明在Czapek′s培养基中,使菌株AChE抑制活性增大的原因在于酪氨酸,而不是盐酸。
2.2.2 DPPH自由基清除活性对菌株YX-001[图 5(a)]而言,在PDB培养基中,添加甲戊二羟酸和酪氨酸可增加菌株次级代谢产物的DPPH自由基清除活性。由于盐酸组的DPPH自由基清除活性低于对照组,说明使DPPH自由基清除活性增加的原因在于酪氨酸,而不是盐酸。在Czapek′s培养基中,添加甲戊二羟酸对菌株次级代谢产物的DPPH自由基清除活性无明显变化,而添加酪氨酸可增加DPPH自由基清除活性。盐酸组的DPPH自由基清除活性高于对照组,且与酪氨酸前体组效果基本一致。由此推测,在Czapek′s培养基中使DPPH自由基清除活性增加的可能是盐酸,而不是酪氨酸。
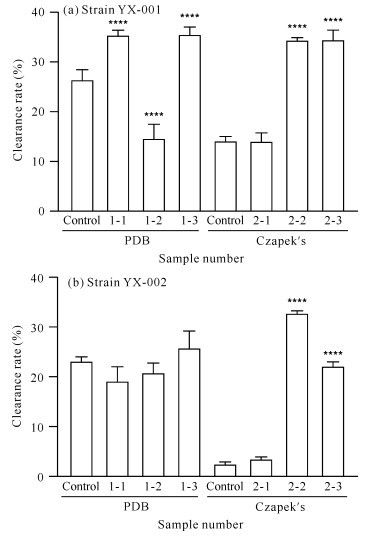
|
| x-y is sample number, x represents medium (1 represents PDB medium, 2 represents Czapek′s medium), y represents added precursor or solvent (1 for mevalondihydroxy acid, 2 for hydrochloric acid and 3 for tyrosine).**** indicates comparison with the control group, P < 0.000 1 图 5 菌株YX-001和YX-002次级代谢产物的DPPH自由基清除活性 Fig. 5 DPPH free radical scavenging activity of secondary metabolites of strains YX-001 and YX-002 |
对菌株YX-002[图 5(b)]而言,在PDB培养基中,添加甲戊二羟酸可降低菌株次级代谢产物的DPPH自由基清除活性,而添加酪氨酸可提高该活性。与对照组相比,盐酸组对菌株的DPPH自由基清除活性具有抑制作用,表明在PDB培养基中,使菌株YX-002 DPPH自由基清除活性增大的原因在于酪氨酸,而不是盐酸。在Czapek′s培养基中,添加甲戊二羟酸和酪氨酸均可增加菌株次级代谢产物的DPPH自由基清除活性。但盐酸组的DPPH自由基清除活性增加量大于酪氨酸组,由此推测该条件下使菌株YX-002 DPPH自由基清除活性增大的原因在于盐酸,而不是酪氨酸。
2.2.3 卤虫致死活性对菌株YX-001[图 6(a)]而言,在PDB培养基中,添加甲戊二羟酸和酪氨酸可增加菌株次级代谢产物的卤虫致死活性。由于盐酸组的卤虫致死活性低于对照组,说明酪氨酸的加入是卤虫致死活性增加的原因。在Czapek′s培养基中,添加甲戊二羟酸后菌株次级代谢产物的卤虫致死活性无明显变化,而添加酪氨酸可使该活性明显增加。综上表明,添加前体物质甲戊二羟酸和酪氨酸可能会增加菌株YX-001次级代谢产物的卤虫致死活性。
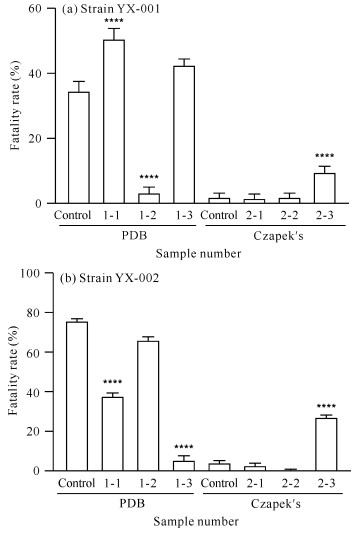
|
| x-y is sample number, x represents medium (1 represents PDB medium, 2 represents Czapek′s medium), y represents added precursor or solvent (1 for mevalondihydroxy acid, 2 for hydrochloric acid and 3 for tyrosine).**** indicates comparison with the control group, P < 0.000 1 图 6 菌株YX-001和YX-002次级代谢产物的卤虫致死活性 Fig. 6 Artemia lethal activity of secondary metabolites of strains YX-001 and YX-002 |
对菌株YX-002[图 6(b)]而言,在PDB培养基中,添加前体物质甲戊二羟酸和酪氨酸对菌株次级代谢产物的卤虫致死活性均具有一定的降低作用;在Czapek′s培养基中,添加甲戊二羟酸可降低菌株次级代谢产物的卤虫致死活性,添加酪氨酸可使卤虫致死活性显著增加。在Czapek′s培养基中,与对照组相比,盐酸组对菌株次级代谢产物的卤虫致死活性具有抑制作用,表明使菌株YX-002次级代谢产物卤虫致死活性增大的原因在于酪氨酸,而不是盐酸。
3 讨论自20世纪60年代末开始,海洋微生物次级代谢产物作为一种新的活性物质来源,其相关研究越来越受到国内外海洋科技工作者的重视,并且由于基因工程、DNA重组、发酵工程等生物技术的发展,使得近20年来从海洋微生物中分离得到的次级代谢产物逐年增加[15]。而作为海洋微生物重要组成部分的海洋真菌,因其种类繁多,次级代谢产物类型丰富等优势而受到广泛的关注[16]。2019年共报道了1 490个新化合物,其中来源于海洋真菌的新化合物占将近一半(47%),并且每年新发现的海洋真菌次级代谢产物数量仍在逐年上升,海洋真菌已成为海洋活性次级代谢产物的主力军[17]。据文献报道,产活性物质的真菌多来自青霉属Penicillium sp.、拟青霉属Paecilomyces sp.、曲霉属Aspergillus sp.、木霉属Trichoderma sp.、腐质霉属Humicola sp.、毛壳菌属Chaetomium sp.、链格孢属Alternaria sp.、枝孢属Cladosporium sp.等[17]。
目前对青霉属和蓝状菌属Talaromyces sp.真菌的研究主要集中于利用传统方式对其次级代谢产物的分离鉴定与生物活性初步筛选评价[18-21],而通过改变培养条件、化学诱导或基因敲除等方式挖掘微生物次级代谢产物的生物合成基因簇,使之产生更多具有较好活性的次级代谢产物的文献报道仍然较少。陈夏雨等[22]采用单菌多次级代谢产物(OSMAC)策略对1株采自南海深海沉积环境的白黄笋顶孢霉属真菌Acrostalagmus luteoalbus SCSIO F457进行化学多样性的初步研究,通过在不同培养基、pH与盐度条件下对菌株进行培养调控,筛选出2种适宜条件进行小规模发酵培养,最终从发酵产物中共新增分离鉴定11个单体化合物。陈海立[23]以两株三七内生真菌(Preussia isomera XL-1326和Talaromyces purpureogenus XL-025)为研究对象,分别使用8种不同培养基小规模发酵,通过比较其次级代谢产物的合成能力,选取下一步扩大发酵的最佳培养基,最终共分离得到30个具有较好抗植物病原真菌、抗耐药性致病细菌等药理活性的单体化合物。Wang等[24]在真菌Penicillium citreonigrum的发酵过程中添加浓度为50 μmol/L的DNA甲基化酶抑制剂5-azaC,结果发现菌丝体形态与对照组相比发生了很大变化,而且通过HPLC分析发现,激活后的菌株产生了10个新色谱峰,进一步对其次级代谢产物分离纯化后得到2个新的萜类化合物(atlantinone A和atlantinone B)。上述研究表明,通过改变培养条件或添加诱导剂等方式,可使目标菌株的次级代谢产物发生变化,使之产生更多活性丰富、结构独特的化合物。
杨叶肖槿由于具有强大的增强记忆功效和抗氧化、抗炎等活性,是潜在的AChE抑制剂先导化合物来源[25]。目前,国内外对红树植物杨叶肖槿的研究主要集中在植物本身的化学成分及药理活性上,尚未见对其来源内生真菌的次级代谢产物及生物活性的有关报道。本研究首次探究了添加不同前体物质对杨叶肖槿内生真菌Talaromyces sp.YX-001和Penicillium sp.YX-002的次级代谢产物的影响。研究结果表明,除菌株YX-001在PDB培养基条件下,添加酪氨酸前体后其次级代谢产物的产量和化学多样性降低外,其余情况均能增加2株菌株次级代谢产物的产量和化学多样性,但生物活性的变化有所不同。同时,本研究发现酸性环境可能会促进具有较好DPPH自由基清除活性的次级代谢产物的生成,但其具体机制还有待进一步研究。部分实验现象并没有达到明显变化的预期效果,可能有两种原因:(1)菌株前体物质选择不合适。由于次级代谢产物在生物体内合成途径的复杂性,其中可能含有多种结构类型的活性化合物,这些化合物并不是单纯的以甲戊二羟酸或酪氨酸为前体,而是以更复杂的组合形式或者由它们的复合途径作为前体,从而导致实验现象变化不明显,具体的结论有待后续进一步探索。(2)发生变化的次级代谢产物本身比较微量或者痕量,而主产物的产量过大,导致其实验现象变化不明显,因此在后期实验中可以考虑扩大规模培养或去除主产物,进而探究添加前体物质对那些微量次级代谢产物的影响。
4 结论本研究表明,添加甲戊二羟酸和酪氨酸前体物质对2株菌株次级代谢产物的产量和化学多样性整体具有较好的促进效果,但对AChE抑制活性、DPPH自由基清除活性和卤虫致死活性等生物活性在不同条件下的影响有较大差异。同时发现,酸性环境可能会促进具有较好DPPH自由基清除活性的次级代谢产物的生成,但其具体机制的确定还有待进一步研究。本研究为深入研究杨叶肖槿内生真菌Talaromyces sp.YX-001和Penicillium sp.YX-002的次级代谢产物奠定了基础。
| [1] |
杨康敏, 高向东, 顾觉奋. 激活沉默基因簇发掘微生物次级代谢产物的研究进展[J]. 中国医药生物技术, 2015, 10(1): 77-80. |
| [2] |
MEKALA L P, MOHAMMED M, CHINTALAPATI S, et al. Precursor-feeding and altered-growth conditions reveal novel blue pigment production by Rubrivivax benzoatilyticus JA2[J]. Biotechnology Letters, 2019, 41(6/7): 813-822. |
| [3] |
KUMAR K, KUMAR S R, DWIVEDI V, et al. Precursor feeding studies and molecular characterization of geraniol synthase establish the limiting role of geraniol in monoterpene indole alkaloid biosynthesis in Catharanthus roseus leaves[J]. Plant Science, 2015, 239: 56-66. DOI:10.1016/j.plantsci.2015.07.007 |
| [4] |
SELEGATO D M, FREIRE R T, PILON A C, et al. Improvement of bioactive metabolite production in microbial cultures-A systems approach by OSMAC and deconvolution-based 1HNMR quantification[J]. Magnetic Resonance in Chemistry, 2019, 57: 458-471. DOI:10.1002/mrc.4874 |
| [5] |
黄淑燕, 郑郁善. 前体物质对雷公藤组织培养不定根诱导及甲素含量的影响[J]. 亚热带植物科学, 2017, 46(3): 240-243. DOI:10.3969/j.issn.1009-7791.2017.03.008 |
| [6] |
VALENTE A M, FERREIRA A G, DAOLIO C, et al. Production of 5-hydroxy-7-methoxy-4-methylphthalide in a culture of Penicillium crustosum[J]. Anais da Academia Brasileira de Ciencias, 2013, 85(2): 487-496. DOI:10.1590/S0001-37652013005000024 |
| [7] |
WANG F Z, WEI H J, ZHU T J, et al. Three new cytochalasins from the marine-derived fungus Spicaria elegans KLA03 by supplementing the cultures with L- and D-tryptophan[J]. Chemistry & Biodiversity, 2011, 8(5): 887-894. |
| [8] |
刘秀玉, 罗凌龙, 马莹, 等. 植物天然产物途径创建[J]. 药学学报, 2021, 56(12): 3285-3299. DOI:10.16438/j.0513-4870.2021-1637 |
| [9] |
徐镇祥, 李美洁, 门潇, 等. 甲羟戊酸途径的代谢支路调控策略的研究进展[J]. 生物加工过程, 2020, 18(1): 44-51. DOI:10.3969/j.issn.1672-3678.2020.01.006 |
| [10] |
刘亚月, 梁健文, 薛欣怡, 等. 基于OSMAC策略的3株海洋真菌发酵条件筛选与优化[J]. 广东海洋大学学报, 2020, 40(3): 65-72. DOI:10.3969/j.issn.1673-9159.2020.03.009 |
| [11] |
刘亚月, 薛欣怡, 黎卓怡, 等. 化学诱导对2株海洋真菌次级代谢产物及其生物活性的影响[J]. 广东海洋大学学报, 2022, 42(1): 50-58. |
| [12] |
KAUFMANN D, DOGRA A K, WINK M. Myrtenal inhibits acetylcholinesterase, a known Alzheimer target[J]. Journal of Pharmacy and Pharmacology, 2011, 63(10): 1368-1371. DOI:10.1111/j.2042-7158.2011.01344.x |
| [13] |
SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113: 1202-1205. DOI:10.1016/j.foodchem.2008.08.008 |
| [14] |
SOLIS P N, WRIGHT C W, ANDERSON M M, et al. A microwell cytotoxicity assay using Artemia salina (brine shrimp)[J]. Planta Medica, 1993, 59(3): 250-252. DOI:10.1055/s-2006-959661 |
| [15] |
柏凤月, 倪孟祥. 海洋微生物来源的抗菌活性物质研究进展[J]. 化学与生物工程, 2016, 33(5): 15-19, 25. |
| [16] |
吴园涛. 海洋生物高值利用研究进展与发展战略思考[J]. 地球科学进展, 2013, 28(7): 829-833. |
| [17] |
CHEN S H, CAI R L, LIU Z M, et al. Secondary metabolites from mangrove-associated fungi: Source, chemistry and bioactivities[J]. Natural Product Reports, 2022, 39(3): 560-595. |
| [18] |
张鹏. 海洋植物来源内生真菌化学多样性及其生物活性研究[D]. 青岛: 中国科学院海洋研究所, 2015.
|
| [19] |
张涵. 三株海洋真菌次级代谢产物在新药开发中的应用研究[D]. 桂林: 桂林医学院, 2021.
|
| [20] |
ZHENG C J, LIAO H X, MEI R Q, et al. Two new benzophenones and one new natural amide alkaloid isolated from a mangrove-derived Fungus Penicillium citrinum[J]. Natural Product Research, 2019, 33(8): 1127-1134. |
| [21] |
XIAO Y W, LIANG W Z, LIU D, et al. Isolation and acetylcholinesterase inhibitory activity of asterric acid derivatives produced by Talaromyces aurantiacus FL15, an endophytic fungus from Huperzia serrata[J]. 3 Biotech, 2022, 12(3): 60. |
| [22] |
陈夏雨, 仲伟茂, 曾奇, 等. 基于OSMAC策略对深海来源真菌 Acrostalagmus luteoalbus SCSIO F457化学多样性的初步研究[J]. 中国海洋药物, 2020, 39(4): 7-15. |
| [23] |
陈海立. 基于"OSMAC"策略挖掘两株三七内生真菌次级代谢产物的合成潜能[D]. 重庆: 重庆大学, 2020.
|
| [24] |
WANG X R, SENA FILHO J G, HOOVER A R, et al. Chemical epigenetics alters the secondary metabolite composition of guttate excreted by an atlantic-forest-soil-derived Penicillium citreonigrum[J]. Journal of Natural Products, 2010, 73(5): 942-948. |
| [25] |
VASUDEVAN M, PARLE M. Pharmacological actions of Thespesia populnea relevant to Alzheimer's disease[J]. Phytomedicine, 2006, 13(9/10): 677-687. |



