2. 广西中医药大学海洋药物研究院,广西南宁 530200
2. Institute of Marine Drugs, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China
三角褐指藻(Phaeodactylum tricornutum)属于硅藻门(Bacillariophyta)羽纹纲(Pennatae),其体内富含活性物质,如二十碳五烯酸(EPA)、岩藻黄素和甘油脂等,是一种优质的蛋白饵料、药物与潜在的生物柴油原材料[1]。岩藻黄素是一类珍稀的含氧类胡萝卜素,不仅能与叶绿素a(chla)/叶绿素c(chlc)形成蛋白复合物,在光合系统的光捕获与光传递方面发挥重要作用,而且可作为药品或保健品,具有抗氧化、减肥、抗肿瘤、抗糖尿病、抗炎、保护视网膜光损伤、保肝等功效,还可以预防前列腺癌、结肠癌、脑胶质瘤等疾病[2, 3]。
氮元素是植物生长发育必需的元素之一,其参与了蛋白质、核酸等许多生物大分子的合成。硝酸盐作为一种常见的氮源,被藻细胞吸收后迅速还原成亚硝酸盐,然后被转运到叶绿体,同化为氨基酸与其他含氮化合物[4]。随着人们对硅藻氮代谢途径的深入研究,越来越多的研究人员开始关注三角褐指藻在氮胁迫条件下的生长状态,及其对海洋变暖导致的营养盐限制等环境变化的适应能力。大量研究表明,氮限制可抑制三角褐指藻的生长,降低其叶绿素a含量,并加剧其受光抑制程度,抑制岩藻黄素的合成,促进油脂的合成[4-6]。
一氧化氮(Nitric Oxide, NO)是防御反应中的关键信号分子,在参与植物对非生物胁迫的应答过程中发挥着十分重要的作用。NO对植物抗逆性的调控作用及机制一直以来都是植物学界研究的热点,但是目前研究的品种主要集中在花生、水稻、拟南芥等少数植物上,对海洋单细胞微藻的研究较少[7]。已有研究表明,一些藻类物种拥有不同于胚胎植物的保守一氧化氮合酶,可能存在不同的途径催化NO的合成[7]。在氮胁迫和高光条件下,褪黑素刺激雨生红球藻细胞产生NO与水杨酸(SA),两者相互作用促进岩藻黄素与脂肪酸的积累[8]。NO供体硝普钠(Sodium Nitroprusside, SNP)能自发释放NO,适当浓度(1.0 mmol/L)的SNP处理能缓解一定浓度的铝对花生根生长的毒害作用[9]。与单独盐胁迫(3.0 mol/L)相比,添加低浓度的SNP (0.5-1.0 μmol/L)能促进杜氏盐藻的生长,显著提高其叶绿素含量[10]。刘路平[11]发现SNP对小球藻生长的调节具有双重性,存在“低促高抑”现象,当SNP大于0.5 mmol/L时,小球藻的生长受到明显的抑制。因此,NO可能胁迫响应的内源调节因子,提高或降低抗逆性,但其发生作用方式可能与浓度及胁迫条件有关。
本研究以硅藻三角褐指藻为研究对象,通过添加外源NO供体SNP及NO清除剂[2-(4-carboxyphenyl)-4, 4, 5, 5-teramethylimidazoline-1-oxyl-3-oxide,cPTIO],探讨外源NO在调控三角褐指藻响应氮胁迫中的作用,研究结果将为阐释硅藻响应氮胁迫的作用机制提供直接证据,同时还可为今后通过改进硅藻的培养条件来提高生物量及目标产物的产量提供指导。
1 材料与方法 1.1 藻种与培养基本实验采用的三角褐指藻株系为GY-H9,来源于上海光语生物科技有限公司,于广西中医药大学药学院中药资源研究团队实验室保存。利用f/2培养基进行三角褐指藻的培养与保存。
1.2 仪器设备光学显微镜(Leica DM2000,德国徕卡仪器有限公司),全波长多功能酶标仪(Tecan Infinite 200 Pro,瑞士帝肯公司),便携式调制叶绿素荧光仪(PAM-2500,德国WALZ公司),倒置荧光显微镜(Leica DM2500,德国徕卡仪器有限公司),高效液相色谱仪(LC40,日本岛津公司)。
1.3 培养条件与处理将三角褐指藻置于恒温光照培养箱中静置培养,每天手动摇瓶3次。培养条件为光照强度100 μmol photons/(m2·s),光照周期为光照∶黑暗=12 h∶12 h,培养箱温度(20±1)℃。每6 d按照藻种∶f/2培养液=1∶1(V∶V)的比例进行扩大培养。
以NaNO3为氮源,初始浓度分别为0 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L、0.5 mmol/L、0.6 mmol/L、0.7 mmol/L、0.8 mmol/L,其中以0.8 mmol/L为适宜浓度(CK),初始接种藻细胞密度为1.00×106 cell/mL,连续培养6 d,每24 h利用光学显微镜与血球计数法[10]统计细胞数量,每个处理3次生物学重复。
选取在0.8 mmol/L NaNO3浓度下生长6 d的三角褐指藻细胞进行以下处理:①缺氮(N-);②缺氮+NO供体SNP,即N-+200 μmol/L SNP(N-+SNP);③缺氮+NO清除剂cPTIO,即N-+50 μmol/L cPTIO (N-+cPTIO);④氮正常(N,0.8 mmol/L);⑤氮正常+NO供体SNP,即N+200 μmol/L SNP (N+SNP);⑥氮正常+NO清除剂cPTIO,即N+50 μmol/L cPTIO (N+cPTIO)。初始接种藻细胞密度为1.00×106 cell/mL,黑暗处理12 h后,分别对细胞密度、叶绿素a(chla)与叶绿素c(chlc)含量、叶绿素荧光参数、岩藻黄素含量、油脂相对含量等指标进行测定与统计。每个处理3次生物学重复。
1.4 叶绿素含量测定采用全波长多功能酶标仪进行叶绿素含量的测定[12]。利用以下公式计算色素含量(mg/L):
| $ \begin{aligned} & \text { chla }=\left(11.47 \times O D_{664}-0.40 \times O D_{630}\right) \times \\ & V_1 / V_2, \\ & \text { chlc }=\left(24.36 \times O D_{630}-3.73 \times O D_{664}\right) \times \\ & V_1 / V_2, \end{aligned} $ |
其中,V1为丙酮用量(mL),V2为离心的藻样体积(mL)。
1.5 叶绿素荧光参数测量采用便携式调制叶绿素荧光仪PAM-2500测定三角褐指藻叶绿素荧光参数。测量前,先测定光适应下的最大荧光(Fm′)、初始荧光(F0′)与稳态荧光(Fs);再将样品放置于暗处适应10 min, 然后利用饱和脉冲法测量荧光诱导曲线,初始荧光F0用弱测量光[0.01 μmol/(m2·s)]测量,最大荧光Fm用饱和脉冲[4 000 μmol/(m2·s),持续时间为0.8 s] 激发,当达到稳定荧光时打开饱和脉冲,荧光又上升至光适应状态下的最大荧光Fm′。所有实验设定3个平行样,每个处理重复3次。获得以下叶绿素荧光参数:初始荧光F0、最大荧光Fm、光系统Ⅱ(PSⅡ)最大光化学量子产量Fv/Fm、PSⅡ实际光化学量子产量Yield、光化学猝灭系数qP和非光化学淬灭系数NPQ。利用不含藻的培养液进行调零,以消除溶液本身的本底荧光。
| $ \begin{aligned} & F v / F m=(F m-F 0) / F m, \\ & \text { Yield }=\Phi \text{PSII}=\left(F m^{\prime}-F s\right) / F m^{\prime} , \\ & q P=\left(F m^{\prime}-F s\right) /\left(F m^{\prime}-F 0^{\prime}\right) , \\ & \mathrm{NPQ}=\left(F m-F m^{\prime}\right) / F m^{\prime} 。\end{aligned} $ |
利用装配有C18反相柱(4.6 mm×250 mm)的高压液相色谱系统进行岩藻黄素含量测定。检测条件参考花汝凤等[15]的方法,并稍做修改。流动相包括甲醇(B)和水(D),程序:流动相(90%B,10%D),等度洗脱,流速1.2 mL·min-1,进样体积10 μL,检测波长450 nm,柱温35℃,检测时间30 min。
精密量取各处理的藻液30 mL,4 500 g低温离心8 min,去上清,精密称量藻细胞鲜质量,加入甲醇(5% BHT) 1 mL,涡旋2 min,避光超声5 min,4 500 g低温离心8 min,收集上清液;重复加入甲醇(5% BHT) 1 mL提取沉淀。合并两次上清液,经0.22 μm有机相滤膜过滤后进行高效液相色谱分析。岩藻黄素的标准曲线为Y=28525.4X(R2=0.999 6),根据标准曲线计算出岩藻黄素的含量。每个处理3次生物学重复。
1.7 油脂相对含量测定采用尼罗红[9-(diethyl amino) benzo[a]phenoxazin-5(5H)-one, Nile red]染色法测定三角褐指藻的油脂相对含量,具体操作参考陈若莹等[5]的方法。另取1 mL藻液,加入尼罗红染料20 μL进行染色,于倒置荧光显微镜下观察胞内油滴的大小。每个处理3次生物学重复。
1.8 数据分析采用Excel与SPSS 22.0软件进行数据统计分析,实验数据均进行正态检验和方差齐性检验,并以平均值±标准差的方式表示,组间比较采用单因素方差分析(one-way ANOVE),采用Duncan法进行多重比较。分析结果用GraphPad Prism 5软件进行作图。以P < 0.05为差异具有统计学意义,图中的小写字母表示在0.05水平上存在显著差异。
2 结果与分析 2.1 氮胁迫对三角褐指藻细胞生长的影响由图 1可知,在不同NaNO3浓度处理下,三角褐指藻的细胞密度存在差异。当NaNO3浓度为0 mmol/L时,三角褐指藻的生长受到严重抑制,至培养第6天时,细胞密度与对照(0.8 mmol/L NaNO3)相比减少了11.99×106 cells/mL,表明氮元素对三角褐指藻的生长是必需的,缺乏氮元素会导致藻细胞逐渐死亡。当三角褐指藻在NaNO3浓度为0.2 mmol/L中培养至第6天时,细胞密度仅为2.47×106 cells/mL,与对照相比藻细胞密度明显下降。当NaNO3浓度为0.3-0.6 mmol/L时,三角褐指藻的细胞密度仍明显低于对照;当NaNO3浓度为0.7 mmol/L时,细胞密度与对照相比差异不大。
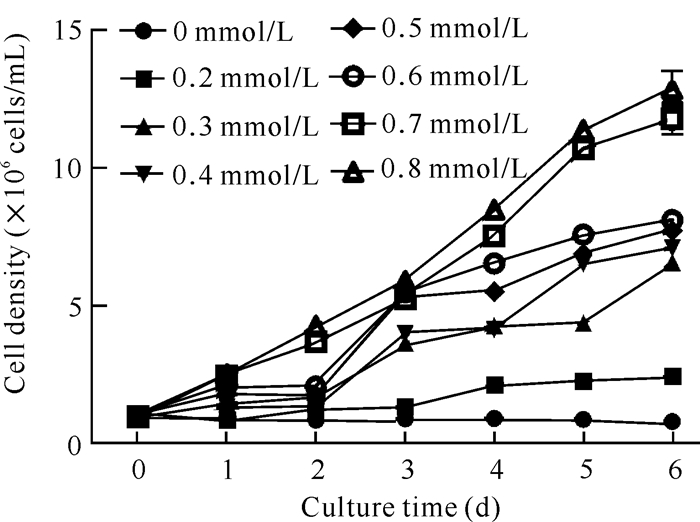
|
| 图 1 氮胁迫对三角褐指藻细胞密度的影响 Fig. 1 Effect of nitrogen stress on the cell density in P.tricornutum |
2.2 外源NO调控氮胁迫下三角褐指藻的细胞密度
在氮正常的情况下,添加NO供体SNP (200 μmol/L)与NO清除剂cPTIO (50 μmol/L)对三角褐指藻细胞密度影响不大;在缺氮条件下,三角褐指藻的生长受到严重抑制,与缺氮(N-)处理相比,N-+cPTIO处理的细胞密度无显著差异,但N-+SNP处理能显著增加缺氮条件下三角褐指藻的细胞密度(图 2),说明外源NO可有效缓解缺氮对三角褐指藻生长的抑制作用。
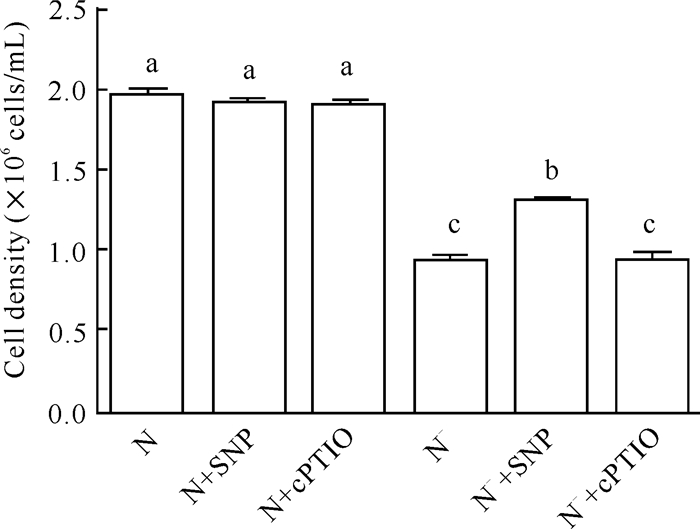
|
| Different lowercase letters represent significant differences 图 2 外源一氧化氮对三角褐指藻细胞密度的影响 Fig. 2 Effect of exogenous NO on the cell density in P.tricornutum |
2.3 外源NO调控氮胁迫下三角褐指藻的叶绿素含量
由图 3可知,在氮正常的情况下,添加200 μmol/L SNP与50 μmol/L cPTIO对chla含量无显著影响。缺氮会显著降低chla含量,与氮正常(chla含量为0.83 μg/mL)相比,chla含量为0.49 μg/mL,减少了40.96%。在缺氮条件下,chla与chlc含量均出现显著下降,但添加200 μmol/L SNP能显著提高chla含量(0.66 μg/mL),与缺氮(chla含量为0.49 μg/mL)相比提高了34.69%。类似于chla含量的变化趋势,N-+SNP处理的chlc含量与缺氮处理相比显著提高,chlc含量达到0.082 μg/mL。与缺氮处理(N-)相比,N-+cPTIO处理对三角褐指藻chla与chlc含量均无显著差异。表明缺氮对三角褐指藻叶绿素合成具有抑制作用,但外源NO可有效缓解氮胁迫对三角褐指藻合成叶绿素的抑制。
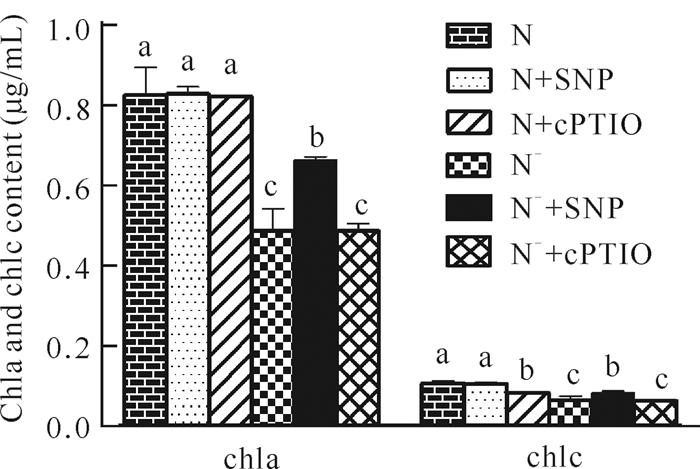
|
| Different lowercase letters represent significant differences 图 3 外源NO对氮胁迫下三角褐指藻叶绿素含量的调控作用 Fig. 3 Regulatory effect of exogenous NO on chlorophyll content in P.tricornutum under nitrogen stress |
2.4 外源NO调控氮胁迫下三角褐指藻的叶绿素荧光参数
在氮正常条件下,添加SNP (200 μmol/L)处理12 h能显著提高三角褐指藻PSⅡ的最大光化学量子产量(Fv/Fm),与氮正常处理(N)相比,Fv/Fm提高了10.05%。三角褐指藻在缺氮条件下培养12 h,Fv/Fm最低,而N+SNP处理的Fv/Fm与缺氮处理相比显著提高了68.14%,差异达到显著水平[图 4(a)]。在缺氮情况下,三角褐指藻PSⅡ实际光化学量子产量Yield值也受到抑制,加入200 μmol/L SNP后,Yield值显著提高,而添加50 μmol/L cPTIO处理对Yield值的影响不大[图 4(b)]。光化学淬灭系数qP是由光合作用引起的荧光淬灭,反映了PSⅡ反应中心的光合活性高低。不同组合处理的qP变化幅度不大[图 4(c)]。非光化学淬灭系数NPQ是耗散过剩光能为热量的能力,反映了光保护能力。在氮正常条件下,3个处理的NPQ比值差异不大,但在缺氮条件下添加SNP (200 μmol/L)能显著降低三角褐指藻的NPQ比值[图 4(d)]。综上所述,可以认为外源NO在一定程度上缓解缺氮胁迫对叶绿素荧光参数的抑制作用。

|
| Different lowercase letters represent significant differences 图 4 外源NO对氮胁迫下三角褐指藻PSⅡ最大光化学量子产量、实际光化学量子产量、光化学淬灭系数与非光化学淬灭系数的调控作用 Fig. 4 Regulatory effect of exogenous NO on Fv/Fm, Yield, qP, and NPQ in P.tricornutum under nitrogen stress |
2.5 外源NO调控氮胁迫下三角褐指藻的岩藻黄素含量
由图 5可知,在氮正常情况下,N与N+SNP两种处理之间岩藻黄素含量无显著差异;而在缺氮条件下,N-与N-+SNP两者之间岩藻黄素含量存在显著差异,说明SNP (200 μmol/L)可在一定程度上缓解氮胁迫对三角褐指藻岩藻黄素积累的抑制作用。加入cPTIO (50 μmol/L),岩藻黄素含量无显著差异,从而进一步证实了SNP的调控作用。
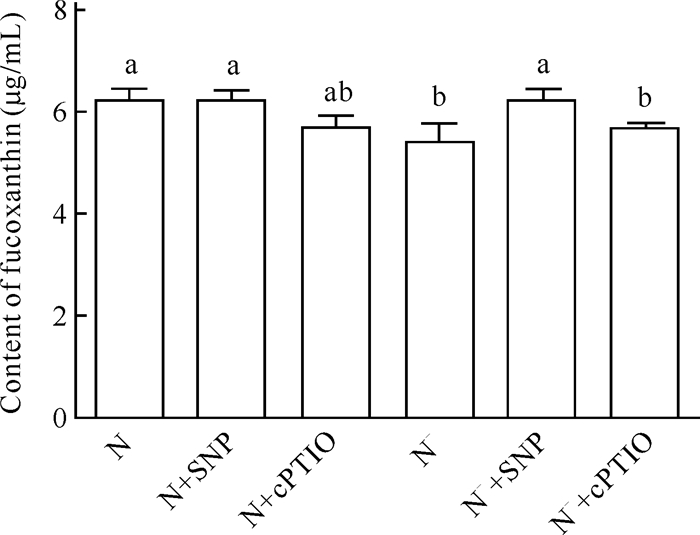
|
| Different lowercase letters represent significant differences 图 5 外源NO对氮胁迫下三角褐指藻岩藻黄素含量的调控作用 Fig. 5 Regulatory effect of exogenous NO on fucoxanthin content in P.tricornutum under nitrogen stress |
2.6 外源NO调控氮胁迫下三角褐指藻的油脂相对含量
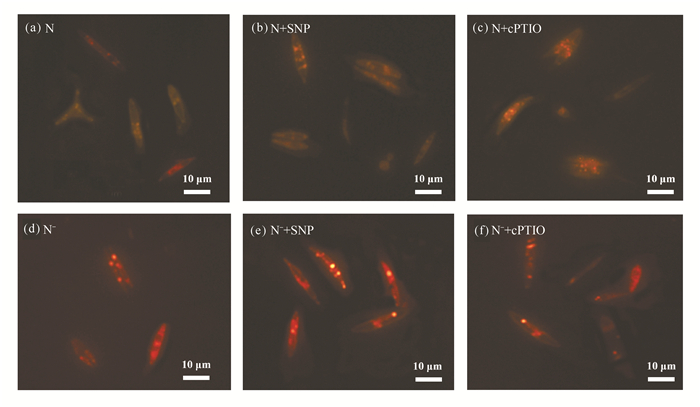
在氮正常情况下,添加200 μmol/L SNP与50 μmol/L cPTIO对油脂相对含量无显著影响。在缺氮条件下,油脂相对含量显著增加;与N正常处理相比,N-、N-+SNP与N-+cPTIO分别提高18.18%、41.99%与15.06%,说明缺氮有利于油脂相对含量的升高。在缺氮条件下,N-+SNP处理的油脂相对含量显著高于N-处理,相对荧光密度达638 a.u.,而N-处理与N-+cPTIO处理之间无显著差异(图 6),因此,可认为SNP (200 μmol/L)具有促进缺氮条件下三角褐指藻油脂积累的作用。尼罗红染色的油脂滴在蓝光激发下能发出特征性的黄色荧光,N-+SNP处理的三角褐指藻的油脂滴明显大于其他处理(图 7),这与油脂相对荧光密度值是一致的。

|
| Different lowercase letters represent significant differences 图 6 外源NO对氮胁迫下三角褐指藻油脂相对含量的调控作用 Fig. 6 Regulatory effect of exogenous NO on relative oil content in P.tricornutum under nitrogen stress |
|
| 图 7 尼罗红染色的三角褐指藻细胞 Fig. 7 P.tricornutum cells stained with Nile red |
3 讨论 3.1 外源NO可有效缓解缺氮对三角褐指藻生长的抑制作用
氮是三角褐指藻生长必需的基本元素之一,是构成藻体内蛋白质、核酸及色素的重要元素, 对藻类的生长发育有着重要的作用[16]。大量研究表明,氮限制会抑制三角褐指藻细胞的生长,且抑制程度会随着氮限制的增强而加剧[4-6]。陈若莹等[5]发现完全缺氮条件下的藻细胞密度比正常条件(氮浓度为896 μmol/L) 降低了49.7%。本研究也发现,在氮限制条件下,三角褐指藻细胞的生长密度会下降;当藻细胞在NaNO3为0 mmol/L中培养6 d时,与对照(0.8 mmol/L NaNO3)相比,细胞密度减少了11.99×106 cells/mL,这可能是由于细胞缺少主要的氮素来源,从而导致细胞正常的生长与代谢活动受阻,主要表现为细胞生长缓慢、衰老死亡严重。迄今尚未发现NO对缺氮条件下三角褐指藻调控作用的研究报道。已有研究显示1 mmol/L SNP能够产生2 μmol/L的NO[17],因此,研究人员利用SNP会主动释放NO这一特性来研究NO对三角褐指藻生长及成分积累的促进或抑制作用。对缺氧条件下生长6 d的三角褐指藻细胞进行外源NO处理12 h,其细胞密度与缺氮相比得到显著增加,说明外源NO可有效缓解缺氮对三角褐指藻生长的抑制作用,这与SNP能有效减轻铝对花生根生长的毒害作用[9],缓解盐胁迫引起的杜氏盐藻的生长抑制[10]等结果是一致的。类似于高等植物,外源NO的调控作用具有“双重效应”,在低浓度下对微藻起促进作用,高浓度下则起抑制作用[11]。然而,对于不同种类的微藻,NO的低浓度范围存在差别。本研究使用200 μmol/L SNP处理缺氮条件下的藻细胞,能在一定程度上缓解缺氮对藻细胞生长与岩藻黄素积累的抑制作用,说明200 μmol/L可能发挥着正调控的效应。
3.2 外源NO可有效缓解缺氮对三角褐指藻叶绿素积累及光合效率的抑制作用三角褐指藻的光合效率主要依赖于天线系统复合物岩藻黄素-叶绿素蛋白(Fucoxanthin Chlorophyll Proteins,FCP)复合体,FCP复合体结合的色素主要有岩藻黄素、chla、chlc1和chlc2[18]。大量研究表明,氮限制能显著降低三角褐指藻叶绿素a的含量[4-6],本研究也得到类似的结论。同时还发现在氮正常的情况下,添加200 μmol/L SNP对chla含量无显著影响,但能有效缓解缺氮条件对chla和chlc含量的影响,提示在氮缺乏的环境中,SNP的调控作用可能与提高光合效率和光能的转换效率有关,这与姜倩倩等[19]和朱营营等[20]的研究结果基本类似。
Fv/Fm反映了植物潜在的最大光合能力,Yield反映的是实际原始光能捕获效率。由于Fv/Fm在正常条件下变化较小,但在胁迫条件下变化较大,可作为反映微藻生长环境是否适宜的一个重要指标[21]。类似于姜倩倩等[19]和吴晓蕾等[22]分别在平邑甜茶和黄瓜上的研究结果,本研究发现在缺氮条件下添加SNP (200 μmol/L)处理12 h能显著提高Fv/Fm与Yield值,说明SNP (200 μmol/L)能有效缓解缺氮胁迫对三角褐指藻光合效率的抑制作用。然而,对于SNP如何发挥调控作用并影响三角褐指藻的光合效率,仍有待进一步研究。
3.3 外源NO可有效缓解缺氮对岩藻黄素积累的抑制并显著促进油脂的积累岩藻黄素属于硅藻次生代谢产物中的萜类物质,是一种参与光合作用、辅助采光色素的类胡萝卜素。已有研究显示,岩藻黄素的含量会随着三角褐指藻的生长而逐渐降低[23],且在氮限制时三角褐指藻的岩藻黄素积累会被抑制[4]。本研究也发现缺氮时三角褐指藻岩藻黄素含量较氮正常时显著减少,然而,关于外源NO对岩藻黄素合成的影响至今鲜有报道。本研究发现,在氮正常的条件下加入200 μmol/L SNP,三角褐指藻的岩藻黄素含量没有明显变化;在缺氮条件下,添加SNP (200 μmol/L)可有效缓解缺氮对三角褐指藻岩藻黄素积累的抑制作用。这可能是由于在氮限制的情况下,细胞为保护其结构和功能,迫使chla等合成下降,从而降低光捕获,进而可能直接影响关键蛋白FCP复合体的合成,导致其合成下降[5];而在缺氮条件下添加200 μmol/L SNP,可有效缓解缺氮对三角褐指藻岩藻黄素积累的抑制作用,究其原因可能是由于SNP能提供NO,而NO可促进藻细胞中天线系统复合物FCP复合体的合成,同时可有效减轻缺氮导致的光合系统损伤。对于SNP可有效调节三角褐指藻细胞中哪些抗氧化酶,以及哪些基因参与其中发挥作用,还有待进一步研究。
赵佩佩等[4]研究发现缺氮条件下三角褐指藻脂质合成增加,参与脂质合成、糖酵解和三羧酸(TCA)循环的关键蛋白在缺氮时上调,提示缺氮条件下糖酵解和TCA循环活性升高,为脂肪酸生物合成提供了大量的中间产物,如乙酰辅酶A和ATP等。在本研究中,油脂相对含量测定和尼罗红染色观察结果也表明了SNP (200 μmol/L)能促进缺氮条件下三角褐指藻的油脂积累。因此,在生产过程中,环境条件和培养水平等因素存在的多变性,可能会导致三角褐指藻的培养处于逆境条件,可以尝试添加适当浓度的SNP来缓解逆境条件对三角褐指藻生长的抑制作用或促进油脂的积累。
4 结论本研究通过添加外源NO供体SNP及NO清除剂cPTIO,探究外源NO对三角褐指藻响应氮胁迫的作用。结果表明,缺氮会抑制三角褐指藻细胞的生长,显著降低chla含量与光合效率,降低岩藻黄素含量,增加脂质合成。与氮正常情况下相比,在缺氮条件下添加200 μmol/L SNP,可在一定程度上缓解缺氮对三角褐指藻的生长、叶绿素含量、光合效率与岩藻黄素积累的抑制,并能显著促进油脂的积累。在缺氮条件下添加50 μmol/L cPTIO对三角褐指藻的生长、叶绿素含量、光合效率及物质积累影响不大。本研究可为探明外源NO调控三角褐指藻响应氮胁迫的作用机制提供基础数据,也为进一步提高三角褐指藻的生物量,促进成分积累量提供参考依据。
| [1] |
王培磊. 海洋微藻研究[M]. 济南: 山东人民出版社, 2015: 191.
|
| [2] |
隋吉槺, 汪辉, 刘天中. 硅藻岩藻黄素特性与其生物合成的研究进展[J]. 海洋科学, 2019, 43(12): 130-138. DOI:10.11759/hykx20190509001 |
| [3] |
MAYER C, CÔME M, BLANCKAERT V, et al. Effect of carotenoids from Phaeodactylum tricornutum on palmitate-treated HepG2 cells[J]. Molecules, 2020, 25(12): 2845. DOI:10.3390/molecules25122845 |
| [4] |
赵佩佩, 顾文辉, 伍松翠, 等. 氮限制有利于三角褐指藻脂质积累[J]. 科学通报, 2015, 60(23): 2196-2208. |
| [5] |
陈若莹, 徐润洁, 龚一富, 等. 氮元素对三角褐指藻岩藻黄素和油脂合成关键酶基因表达与代谢合成的影响[J]. 核农学报, 2019, 33(9): 1734-1741. |
| [6] |
徐兴莲, 宋熙坤, 岳瑞, 等. 氮限制对硅藻三角褐指藻光系统Ⅱ光化学反应的影响[J]. 生态学杂志, 2016, 35(1): 183-188. |
| [7] |
ASTIER J, ROSSI J, CHATELAIN P, et al. Nitric oxide production and signalling in algae[J]. Journal of Experimental Botany, 2021, 72(3): 781-792. DOI:10.1093/jxb/eraa421 |
| [8] |
DING W, ZHAO P, PENG J, et al. Melatonin enhances astaxanthin accumulation in the green microalga Haematococcus pluvialis by mechanisms possibly related to abiotic stress tolerance[J]. Algal Research, 2018, 33: 256-265. DOI:10.1016/j.algal.2018.05.021 |
| [9] |
詹洁, 王天菊, 何虎翼, 等. 硝普钠缓解花生铝毒害作用和影响AhSAG和AhBI-1基因表达[J]. 作物学报, 2011, 37(3): 459-468. |
| [10] |
卢雪景, 刘红涛, 柴玉荣, 等. 外源一氧化氮缓解盐胁迫下杜氏盐藻氧化损伤的初步研究[J]. 河南农业科学, 2009(5): 47-52. |
| [11] |
刘路平. 外源NO供体硝普钠(SNP)对小球藻生理参数的影响[J]. 绿色科技, 2016(14): 151-153. |
| [12] |
曾晓鹏, 徐锦涛, 邓子权, 等. 光强调控三角褐指藻对海洋酸化的生理学响应[J]. 水生生物学报, 2019, 43(1): 189-195. |
| [13] |
梁英, 陈书秀, 田传远, 等. 温度对三角褐指藻叶绿素荧光特性及生长的影响[J]. 中国海洋大学学报(自然科学版), 2008, 38(3): 377-383. |
| [14] |
何海锋, 闫承宏, 吴娜, 等. 施氮量对柳枝稷叶片叶绿素荧光特性及干物质积累的影响[J]. 草业学报, 2020, 29(11): 141-150. |
| [15] |
花汝凤, 周淑华. 高效液相色谱法测定海带浓缩制品中岩藻黄素的含量[J]. 食品安全质量检测学报, 2020, 11(19): 7114-7117. |
| [16] |
张文源, 高保燕, 李爱芬, 等. 不同培养条件对三角褐指藻生长及其生物活性成分积累的影响[J]. 海洋科学, 2016, 40(5): 57-65. |
| [17] |
DELLEDONNE M, ZEIER J, MAROCCO A, et al. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J]. Proceedings of the National Academy of Sciences, 2001, 98(23): 13454-13459. |
| [18] |
徐才哲, 王文达, 艾鹏飞, 等. 三角褐指藻岩藻黄素-叶绿素蛋白复合体的分离纯化和功能研究[J]. 水生生物学报, 2016, 40(1): 109-115. |
| [19] |
姜倩倩, 曹慧, 杨延红, 等. 硫化氢和一氧化氮在平邑甜茶幼苗抵抗镉胁迫中的作用[J]. 西北农林科技大学学报(自然科学版), 2021, 49(2): 120-128. |
| [20] |
朱营营, 张倩, 董元杰. 外源NO缓解花生盐胁迫的效果及机理[J]. 中国农业大学学报, 2020, 25(12): 30-39. |
| [21] |
李凤娇, 邹小红, 李科, 等. 不同氮浓度对油茶幼苗光合特性的影响[J]. 江西农业大学学报, 2020, 42(6): 1167-1175. |
| [22] |
吴晓蕾, 焦晓聪, 刘慧兰, 等. 硝普钠对低氧胁迫下黄瓜幼苗生长、光合及叶绿素荧光参数的影响[J]. 北方园艺, 2019(16): 23-28. |
| [23] |
郑小恽, 龚一富, 李申睿, 等. 光合作用抑制剂DCMU对三角褐指藻岩藻黄素含量和叶绿素荧光特征及关键基因表达的影响[J]. 核农学报, 2020, 34(8): 1705-1712. |



