2. 广西中医药大学附属瑞康医院神经内科,广西南宁 530011;
3. 广西中医药大学基础医学院,广西南宁 530200;
4. 广西中医药大学第一附属医院博士后工作站,广西南宁 530023
2. Neurology Department, Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning, Guangxi, 530011, China;
3. School of Basic Medicine of Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China;
4. Postdoctoral Workstation, the First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning, Guangxi, 530023, China
自闭症被视为除癌症、心脏病之外影响人类生命健康的又一杀手,社交障碍是自闭症的核心表现,社会行为改善是衡量自闭症治疗效果的重要指标。药物治疗是自闭症治疗的重要方式,但目前针对自闭症的治疗药物(包括抗精神药物[1]、免疫抑制剂[2]、抗生素类药物[3]、抗嘌呤类药物[4]以及各种受体激动剂与拮抗剂等[5-8]),都只能对症状有部分改善作用,仍达不到理想的治疗效果。因此,开发有效改善自闭症社会行为障碍的药物意义重大。玛卡作为外来引种药物,且引入后经研究被赋予了中医药性能[9],其所显示的药理作用可能对自闭症的防治有效,值得深入研究。因此本研究选择玛卡作为受试药物,探究其对小鼠自闭症样行为的具体作用,为开发玛卡治疗自闭症提供科学依据。
1 材料与方法 1.1 实验动物SPF级ICR及C57/BL6小鼠,雄性,8周龄,各60只,体质量(35±5) g,购于湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。所有小鼠饲养于广西中医药大学动物房,交替光照(12 h光照/12 h黑暗),室温(23±2)℃,自由进食饮水。
1.2 药物制备玛卡原药材来源于云南省农业科学院高山经济植物研究所。经广西中医药大学中药鉴定教研室滕建北副教授鉴定为十字花科植物玛卡独行菜(Lepidium meyenii Walp.)的干燥根茎。将原药材粉碎成粗粉浸泡过夜后,每次分别用10倍容量的纯水煎煮2.5 h,共3次,合并煎煮液滤过,浓缩挥干得到玛卡总浸膏,浸膏得率为50%,分装后置于-20℃冰箱中保存待用。
1.3 分组与给药将受试的两个种系动物随机各分为4组(4只/笼,每组数量n=15):空白对照组、玛卡高剂量组、玛卡中剂量组和玛卡低剂量组。将玛卡总浸膏溶于水,分别制备高剂量(5.0 g/kg)、中剂量(2.5 g/kg)和低剂量(1.0 g/kg)等浓度的水溶液用于灌胃;空白对照组予等容积(10 mL/kg)纯水灌胃。每日2次(8:00 AM,8:00 PM),持续10 d,行为学测试期间持续给药。
1.4 仪器设备与试剂高架十字迷宫实验设备、旷场实验设备、三腔实验设备(上海徕卡仪器有限公司),病理切片机(上海徕卡仪器有限公司,型号:RM2016),正置白光拍照显微镜(日本Nikon公司,型号:Eclipse Ci-L),抗c-Fos抗体(英国Abcam公司,批号:ab208942),HRP标记山羊抗小鼠IgG抗体(武汉Servicebio公司,批号:GB23301),组化试剂盒DAB显色剂(武汉Servicebio公司,批号:G1211),小鼠5-羟色胺(5-hydroxytryptamine,5-HT)酶联免疫分析试剂盒(美国SAB公司,批号:EK18305),小鼠多巴胺(Dopamine,DA)酶联免疫分析试剂盒(美国SAB公司,批号:EK18271)。
1.5 行为学测试 1.5.1 高架十字迷宫实验高架十字迷宫离地高40 cm,由两个对侧的开放臂(30 cm×5 cm)及两个由黑色亚克力玻璃板围起来的对侧闭合臂(30 cm×5 cm×15 cm)组成,中心为5 cm×5 cm×15 cm的开放区域[10, 11]。测试时将测试小鼠由中心区域面朝一侧开放臂放入,任其在高架内自由探索5 min,采用动物行为学分析软件ANY-maze记录小鼠进入开放臂及闭合臂的次数及持续时间。
1.5.2 旷场实验参照Wong等[12]方法进行改良,实验用边长为60 cm×60 cm、高为20 cm的木制正方形敞箱。将敞箱分成3个区域,分别为外区(outer zone)、中心区(inner zone)及中心盒子区(inner cage zone),inner zone平面大小为敞箱的1/4,inner cage zone平面尺寸为10 cm×8 cm。实验共有3个阶段。(1)适应性阶段。将测试小鼠从箱子的角落放入,让其在敞箱中自由探索10 min,用ANY-maze软件记录小鼠移动总距离及进入inner zone的次数及时间。(2)非社会性阶段。在inner cage zone固定一个透明带多气孔的亚克力盒子(平面尺寸为8 cm×6 cm),将测试小鼠从箱子的角落放入,让其自由探索10 min,用ANY-maze软件记录小鼠进入inner cage zone的次数及时间。(3)社会性阶段。在第2阶段的亚克力盒子中放入一只同系、同性别、同周龄的陌生鼠,将测试小鼠从箱子的角落放入,让其自由探索10 min,用ANY-maze软件记录小鼠进入inner cage zone的次数及时间。
1.5.3 三腔社交实验三腔社交实验参照文献[13-15]所述并进行改良,该实验于一自制的敞顶长方形黑色亚克力玻璃箱(60 cm×20 cm×20 cm)中进行,由2块黑色亚克力玻璃板将其分为均等的3个腔室,板的底部预留空间允许测试小鼠自由穿过。正式测试前,将受试小鼠由中间腔室放入,允许其在3个腔室间自由探索适应10 min。三腔社交实验分为3个阶段,分别为社交性阶段(session-1)、社交偏好阶段(session-2)和社交记忆阶段(session-3)。3个阶段依次进行测试,每只测试鼠结束测试后均用75%的酒精给实验箱清洁去味以排除干扰。session-1分别在两边腔室的角落放1只同种系、同性别、同周龄的陌生小鼠(陌生鼠1号)及1支50 mL试管,陌生鼠1号限定在带20个气孔的透明亚克力小盒子(10 cm×5 cm×5 cm)中, 将测试小鼠从中间腔室放入,自由探索10 min;session-2将session-1的50 mL试管换成陌生鼠2号,陌生鼠2号的固定方式同session-1中的陌生鼠1号,之后将测试小鼠从中间腔室放入,自由探索5 min;session-3将session-2中的陌生鼠2号取出,实验箱清洁去味后换成陌生鼠3号,陌生鼠1号保持不变,5 min后,将测试小鼠从中间腔室放入,自由探索5 min。所有行为均由ANY-maze软件追踪并记录,分析实验中测试小鼠进入两侧腔室的时间及次数,嗅探陌生鼠1,2,3号及试管的时间及次数。
1.6 样本采集与检测 1.6.1 血浆5-HT含量检测行为学测试结束后1-1.5 h内取样,用5%(m∶V)的水合氯醛将小鼠麻醉后,使用一次性真空采血管,心脏采血1 mL左右,将取得的血液样本进行离心,分装血浆置于-80℃冰箱中保存待用。小鼠血浆5-HT含量检测参照试剂盒说明书进行。
1.6.2 血浆DA含量检测血浆样本取得方式同1.6.1节,血浆DA含量检测参照试剂盒说明书进行。
1.6.3 c-fos免疫荧光染色c-fos免疫荧光染色参照文献[16, 17]方法进行,具体如下:行为学测试结束60 min后对小鼠进行麻醉,用磷酸盐缓冲液(PBS)经心脏灌流清除血液,然后用含4%多聚甲醛(PFA)的PBS灌注固定,取出脑组织,将脑组织浸泡于4% PFA中固定24 h,再置于-4℃冰箱中过夜,之后先后放置15%、30%蔗糖水中浸泡48 h脱水。切除嗅球及小脑部分后用切片机将小鼠大脑切成20 μm厚的冠状切片,选取15-20张切片在PBS溶液中冲洗后,将组织切片置于盛满EDTA抗原修复液(pH值9.0)的修复盒中于微波炉内进行抗原修复,切片放入3%双氧水溶液以阻断内源性过氧化物酶。在BSA封闭溶液中封闭30 min,然后加入抗c-fos抗体孵育过夜。在含有0.3% Triton X-100的PBS溶液中冲洗3次,并在室温下滴加与一抗相应种属的二抗(HRP标记)覆盖组织室温孵育50 min。再次冲洗切片,将切片固定于载玻片上脱水、显色、染色。显微镜镜检,采集分析图像。
1.7 统计学分析所有实验数据均用统计学软件SPSS 20.0分析。若方差齐,组内对比采用配对样本t检验,多组计量资料对比采用单因素方差分析(One-way ANOVA);若方差不齐,则采用秩和检验。所有数据均以x±s表示,P<0.05为差异具有统计学意义。
2 结果与分析 2.1 玛卡对C57/BL6小鼠行为学的影响 2.1.1 玛卡对C57/BL6小鼠高架十字迷宫实验的影响如图 1(a)(b)及图 1(c)所示,与空白对照组相比,玛卡对小鼠进入开放臂次数与时间以及进入闭合臂的次数无显著影响(P>0.05);如图 1(d)及图 1(e)所示,玛卡中剂量组与高剂量组显著减少了小鼠进入闭合臂的时间(P<0.01),但对小鼠进入开放臂的指数无明显作用(P>0.05)。结果显示,玛卡能显著减少C57/BL6小鼠进入闭合臂的时间,但对小鼠进入开放臂的时间与指数无影响。
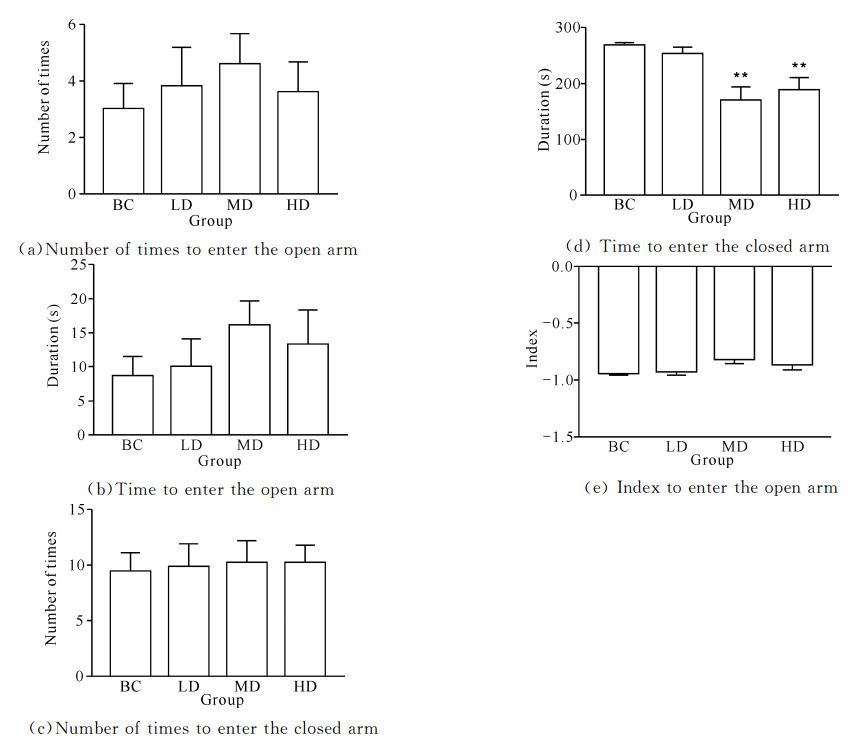
|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P < 0.05, **P < 0.01, ***P < 0.001 图 1 玛卡持续灌胃7 d后对C57/BL6小鼠高架十字迷宫实验的影响 Fig. 1 Effect of Maca on elevated plus maze experiment in C57/BL6 mice after continuous gavage for 7 d |
2.1.2 玛卡对C57/BL6小鼠旷场实验的影响
如图 2所示,与空白对照组相比,实验的适应阶段,玛卡中剂量组在旷场移动的总距离显著减少(P<0.01)。在非社会性阶段,玛卡组的小鼠进入中心的时长与空白对照组相比均无显著性差异(P>0.05);在社会性阶段,玛卡中剂量组与高剂量组进入中心的时长明显减少(P<0.05或P<0.01)。结果表明,玛卡减少了C57/BL6小鼠在旷场移动的总距离及社会性阶段进入中心的时长。
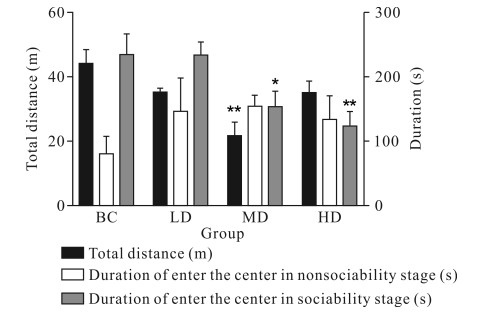
|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P<0.05, **P<0.01, ***P<0.001 图 2 玛卡持续灌胃14 d后对C57/BL6小鼠旷场实验的影响 Fig. 2 Effect of Maca on open field experiment of C57/BL6 mice after continuous gavage for 14 d |
2.1.3 玛卡对C57/BL6小鼠三腔社交实验的影响
如图 3(a)所示,持续灌胃14 d后,与空白对照组比较,在社会性阶段,玛卡低剂量组显著减少了与陌生鼠1互动的时间(P<0.05);图 3(b)显示在社会偏好阶段,与空白对照组比较,玛卡低、中、高剂量组与陌生鼠2互动时间无显著变化(P>0.05);图 3(c)显示在社会记忆阶段,与空白对照组比较,玛卡中剂量组与陌生鼠1互动时间减少,但差异无统计学意义(P>0.05)。图 3(d)中与空白对照组比较,玛卡低剂量组的社会性指数显著降低(P<0.05);图 3(e)(f)显示玛卡中剂量组的社会新颖性指数增高,社会记忆指数下降,但与空白对照组相比差异无统计学意义(P>0.05);图 3(d)(e)(f)中玛卡高剂量组社会性指数、社会新颖性指数及社会记忆指数与空白对照组差异均无统计学意义(P>0.05)。结果表明,玛卡对C57/BL6小鼠的社会性/社会新颖性及社会记忆均无显著影响。
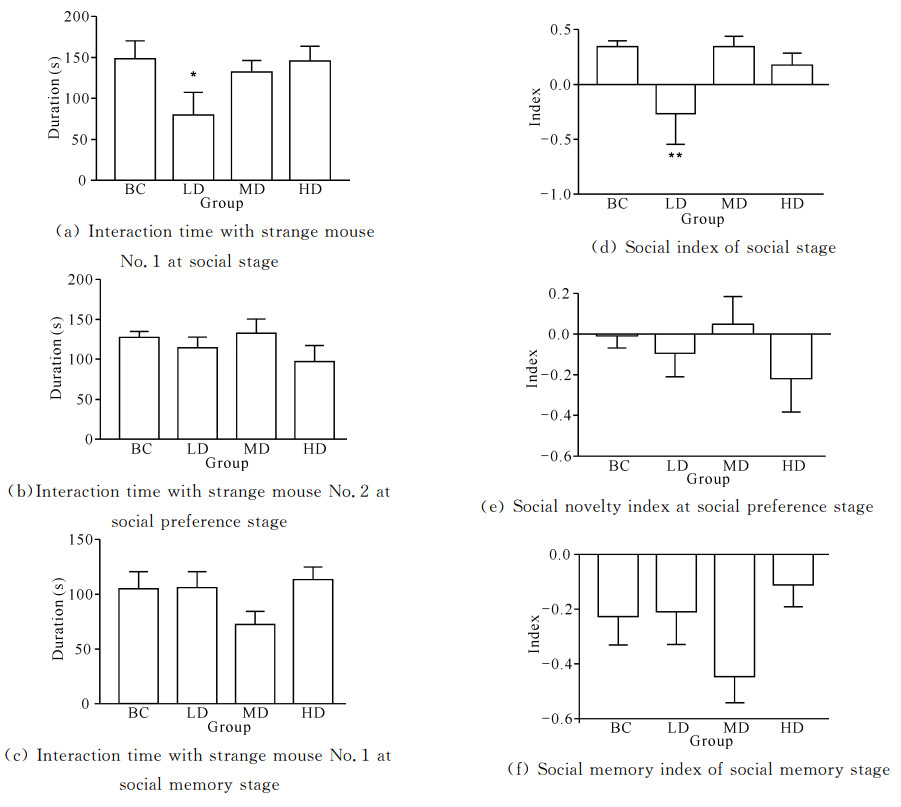
|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P < 0.05, **P < 0.01, ***P < 0.001 图 3 玛卡灌胃14 d后对C57/BL6小鼠三腔社交实验的影响 Fig. 3 Effect of Maca on three chambers social experiment of C57/BL6 mice after 14 d of gavage |
2.2 玛卡对ICR小鼠行为学的影响 2.2.1 玛卡对ICR小鼠高架十字迷宫实验的影响
如图 4(a)(b)所示,与空白对照组比较,玛卡低、中、高剂量组小鼠在开放臂中的时间与空白对照组比较均显著增多(P<0.01);低剂量组小鼠进入开放臂的次数明显增多(P<0.05)。图 4(c)(d)显示,与空白对照组比较,玛卡中剂量组在闭合臂中的时间显著降低(P<0.01),玛卡低剂量组与高剂量组有降低趋势但无明显差异(P>0.05);各剂量组小鼠进入闭合臂的次数有明显的下降(P<0.05或P<0.01或P<0.001)。如图 4(e)所示,总体上玛卡中剂量组进入开放臂指数显著增高(P<0.05)。

|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P < 0.05, **P < 0.01, ***P < 0.001 图 4 玛卡持续灌胃7 d后对ICR小鼠高架十字迷宫实验的影响 Fig. 4 Effect of Maca on elevated plus maze experiment in ICR mice after continuous gavage for 7 d |
2.2.2 玛卡对ICR小鼠旷场实验的影响
图 5显示,玛卡灌胃14 d后,在适应性阶段,与空白对照组比较,玛卡中剂量组与高剂量组在旷场中移动的总距离明显减少(P<0.05或P<0.01);非社会性阶段,与空白对照组比较,玛卡低、中、高剂量组进入旷场中心的时间有所增加,但无明显差异(P>0.05);社会性阶段,与空白对照组比较,玛卡低、中、高剂量组进入旷场中心的时间均有增高趋势,以中剂量组增高最为明显,但均无明显差异(P>0.05)。
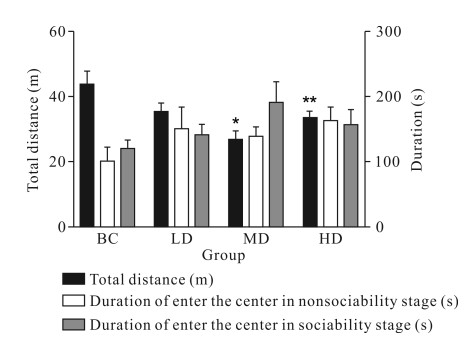
|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P<0.05, **P<0.01, ***P<0.001 图 5 玛卡持续灌胃14 d后对ICR小鼠旷场实验的影响 Fig. 5 Effect of Maca on open field experiment of ICR mice after continuous gavage for 14 d |
2.2.3 玛卡对ICR小鼠三腔社交实验的影响
结果如图 6(a)所示,与空白对照组比较,在社会性阶段,玛卡低、中、高剂量组与陌生鼠1互动的时间明显增加,差异具有统计学意义(P<0.001);图 6(b)显示在社会偏好阶段,玛卡低、中剂量组与陌生鼠2互动时间显著增加(P<0.05或P<0.01);在社会记忆阶段,如图 6(c)所示,玛卡低、中剂量组与陌生鼠1互动时间显著增加(P<0.05或P(P<0.05),社会性指数与社会记忆指数与空白对照组比较有增加趋势但差异无统计学意义(P>0.05)。
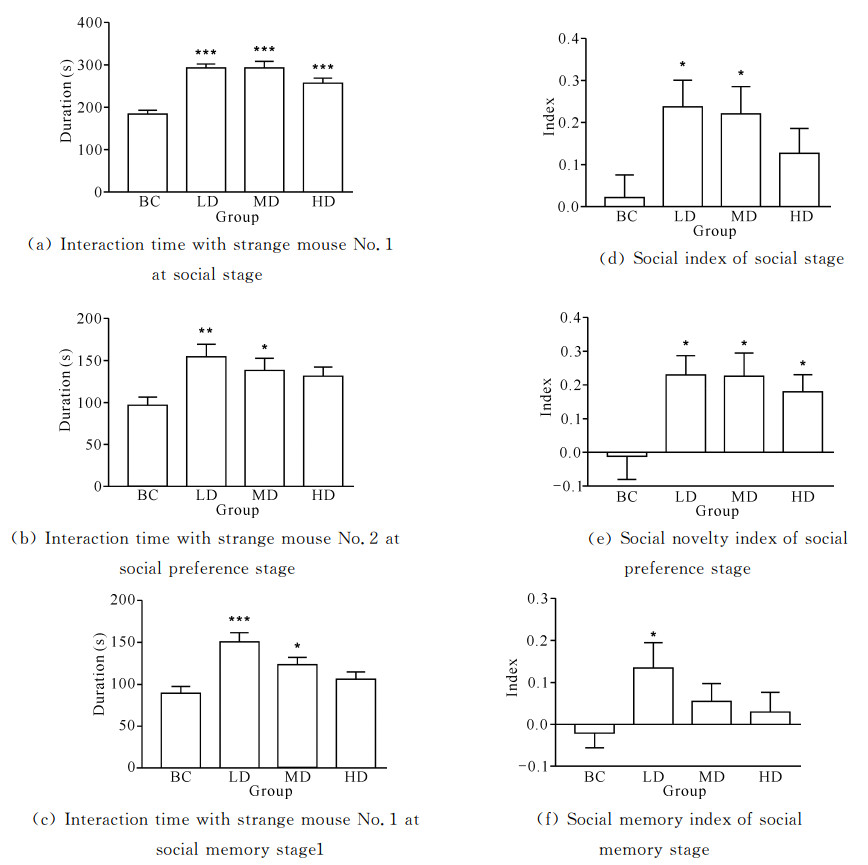
|
| BC: Blank control group; LD: Low dose group; MD: Medium dose group; HD: High dose group.Compared with the blank control group, *P<0.05, **P<0.01, ***P<0.001 图 6 玛卡灌胃14 d后对ICR小鼠三腔社交实验的影响 Fig. 6 Effect of Maca on three chambers social experiment of ICR mice after 14 d of gavage |
2.3 玛卡对ICR小鼠血浆5-HT及DA含量的影响
如表 1所示,与空白对照组相比,玛卡低剂量组及中剂量组小鼠血浆5-HT含量显著增加(P<0.01或P<0.001),玛卡高剂量组血浆5-HT含量与空白对照组对比有所增加,但未表现出显著性差异;玛卡低剂量组、中剂量组及高剂量组小鼠血浆DA含量均显著增加(P<0.05)。
| 组别Group | 剂量(g/kg) Dose (g/kg) |
血浆5-HT含量(ng/mL) 5-HT contents in plasma (ng/mL) |
血浆DA含量(ng/mL) DA contents in plasma (ng/mL) |
| Blank control group | - | 179.7±77.3 | 116.6±56.2 |
| Low dose group | 1.25 | 363.3±84.0*** | 320.7±116.6* |
| Medium dose group | 2.5 | 340.1±93.4** | 336.3±140.0* |
| High dose group | 5.0 | 221.9±81.7 | 327.2±186.7* |
| Note: "-" means no Maca.Compared with the blank control group, *P<0.05, **P<0.01, ***P<0.001 | |||
2.4 玛卡对ICR小鼠社会行为相关脑区c-fos阳性细胞的影响
从表 2可以看出,与空白对照组相比,玛卡低剂量组与玛卡高剂量组小鼠脑内腹侧被盖区(VTA)的c-fos阳性细胞数量显著增加(P<0.05或P<0.01),玛卡中剂量组也表现出增加的趋势;玛卡低剂量组、中剂量组及高剂量组腹侧苍白球(VP)、伏隔核(NAcc)和内侧视前区(mPOA)的c-fos阳性细胞数量,与空白对照组相比均显著增加(P<0.01或P<0.001);玛卡高剂量组杏仁核(amygdala)c-fos阳性细胞数量显著增多(P<0.05)。结果表明,玛卡可增加ICR小鼠VTA、VP、NAcc、mPOA及amygdala的c-fos阳性细胞数量。
| 组别Group | c-fos阳性细胞数量(mm2) Number of c-fos positive cells (mm2) |
||||
| 腹侧被盖区VTA | 腹侧苍白球VP | 伏隔核NAcc | 内侧视前区mPOA | 杏仁核Amygdala | |
| Blank control group | 81.2±32.2 | 28.3±14.9 | 50.5±8.5 | 78.8±32.3 | 46.8±11.3 |
| Low dose group | 261.2±89.9* | 213.2±33.2*** | 353.5±60.2*** | 191.1±18.2*** | 207.7±58.3 |
| Medium dose group | 184.6±100.2 | 213.2±60.3*** | 281.5±69.9*** | 201.2±28.0*** | 176.3±24.2 |
| High dose group | 304.0±34.3** | 171.1±68.1** | 397.5±17.1*** | 267.1±11.9*** | 312.6±174.8* |
| Note: Compared with the blank control group, *P<0.05, **P<0.01, ***P<0.001 | |||||
3 讨论
自闭症又称孤独症谱系障碍(Autism Spectrum Disorder,ASD),是一种多见于婴幼儿时期发病的、严重的广泛性发育障碍。由于自闭症发病机制的复杂性以及不确定性,使得自闭症的治疗困难重重,药物治疗是自闭症治疗的重要方式。玛卡属于引进的天然药物,蕴含多种化学成分,玛卡根干燥后含独有的新型物质——玛咖酰胺和玛咖烯,对平衡人体荷尔蒙分泌有显著的效果[18, 19]。玛卡中所含苄基芥子油苷和苄基异硫氰酸可以增强记忆力[18, 19]。同时玛卡具有抗疲劳、抗氧化、免疫调节、提高生育力、调节内分泌、增强记忆、抗抑郁及神经保护等功效[20]。在中医药理论指导下,研究发现玛卡性味辛、甘、温、无毒,归肾、肝、脾经,具有温肾壮阳,强筋壮骨,散寒、止痛、调血脉等功效[20]。中医理论认为自闭症病因病机为先天不足,肾精亏虚,心窍不通,神失所养,肝失条达,升发不利,其病位在脑,同心、肝、肾三脏有密切关系[21]。这些脏腑的失调都和自闭症发病相关,表明中医对自闭症有深刻认识[21]。由此可见,自闭症从心、肝、肾进行论治可能有效,玛卡可能是自闭症治疗的潜在药物。
在自闭症动物实验中以及自闭症动物的建模中,选择的小鼠种系多为C57/BL6及ICR小鼠[10, 22],因此,将这两种种系小鼠作为本研究的实验动物。高架十字迷宫实验是评估测试动物焦虑样行为的重要实验[23],广泛应用于大鼠、小鼠的焦虑行为学研究,其原理是基于实验动物对新环境的探索行为和对高悬开放臂的恐惧,形成一种矛盾冲突的状态,进而反映出动物的焦虑情绪[24]。实验动物进入开放臂的次数与时间增加,而进入闭合臂的次数与时间大幅度减少,说明实验动物对新环境的探索欲望增加及恐惧减少。本实验结果显示,玛卡能显著增加ICR小鼠进入开放臂的时间,缩短其进入闭合臂的时间,而中剂量组进入开放臂的指数在总体上出现了明显的增加。对于C57/BL6小鼠,玛卡虽然减少了小鼠进入闭合臂的时间,但是并未显著增加小鼠进入开放臂的时长与指数。从实验结果来看,玛卡能显著降低ICR小鼠的焦虑样情绪,但对C57/BL6小鼠的焦虑样行为无明显改善。旷场实验中的适应性阶段实验也是评估实验动物焦虑状态的一种经典行为学方式[25],实验中的总移动距离反映了小鼠的自主活动能力。从结果来看,玛卡显著地减少了ICR小鼠在旷场中活动的距离,并未提高ICR小鼠的自主活动能力,小鼠运动距离的减少可能与小鼠的重复行为减少有关,而小鼠的重复行为往往是焦虑的表现。而焦虑常常是自闭症的伴随症状及共病之一[26]。
在社交行为方面,本研究中旷场实验的社会性阶段实验可用来评价小鼠的社会性,在此阶段实验中,ICR小鼠增加了进入旷场中心与陌生鼠互动的时间,说明玛卡在一定程度上提升了ICR小鼠的社交能力。三腔社交实验也被广泛用来评估小鼠的社交行为[13],本研究中,在社会性实验阶段,小鼠更倾向于进入有陌生小鼠的腔室并频繁互动,社会性指数均为正向,说明小鼠具有一定的社交能力;在社会偏好阶段,小鼠花更多的时间与一个陌生鼠相处而非一个熟悉的同类,表明了实验小鼠存在社交新鲜感的偏好。从研究结果可以看到,玛卡给药后,ICR小鼠与陌生鼠的互动时间显著增加,社会性指数上升;与ICR小鼠空白对照组的社交新颖性指数为负数相比,玛卡组小鼠社会新颖性指数均为正,由此可见玛卡显著地提高了ICR小鼠的社交能力和社交新鲜感偏好;而C57/BL6小鼠在服用玛卡后,社会性指数下降,社会新颖性并无明显改善。除此之外,本实验在原有三腔社交实验上进行了改良,增加了社会记忆这一实验阶段用来评估小鼠的社会记忆,若实验小鼠在本阶段中更倾向于与原本熟悉的同类相处,则说明存在一定的社会记忆,从结果中发现,玛卡在ICR小鼠社会记忆的提升方面起着积极的作用。本研究结果证明在改善社会行为方面,玛卡对C57/BL6小鼠并未显示出明显的效果;而玛卡对ICR小鼠社会行为有显著的改善作用,以中剂量组最为明显。而玛卡对两种不同的实验小鼠在行为学实验中所产生的药效差异,可能是由小鼠的种属差异造成的,这有待将来进一步研究。
人类的社会行为受到大脑中的某些特定区域调控,这些区域统称为“社会大脑”,亦指在从事各种社会认知任务时,健康成年人的神经成像研究中显示出的、持续被激活的大脑区域,这些部位通过彼此之间的复杂联系共同负责调控人的社会行为,且社会大脑的损害与社会认知障碍有关。使用药物干预或杏仁核(Amygdala)损伤的研究表明,杏仁核参与非人灵长类动物[27]和啮齿动物[28]的社会行为和社会攻击。杏仁核在自闭症的发展中起着不可忽视的作用[29, 30],杏仁核功能障碍可能导致ASD的核心社会功能损害[31]。本研究中,行为学实验后玛卡组的小鼠脑袋内杏仁核c-fos阳性细胞数目增多,而相应的行为学实验也证实了在玛卡治疗后,小鼠的焦虑状态得到改善,并增加了社交行为,这很可能与激活了杏仁核对相关行为的正向调控有关。
腹侧苍白球(VP)是与抑郁症有关的动机和奖赏回路接口处的一个重要汇聚点[32, 33]。VP接收来自中脑边缘奖赏通路主要组成部分伏隔核(NAcc)的密集输入,并将此信息传递给下游靶区,如腹侧被盖区(VTA)和外侧缰核(LHb)[34]。内侧视前区(mPOA)不仅是大脑中负责调节社会交互行为的其中一个功能区域,也是神经系统中调节行为的一个重要节点[35],mPOA包含许多含有类固醇受体的神经元,接收来自多种感觉方式的社会信息,并在整个大脑中有广泛的投射,包括VTA[36-39]。类固醇敏感的mPOA神经元编码与行为学相关的刺激,并参与中脑奖赏回路,以促进对物种生存至关重要的亲社会行为[40]。与对杏仁核的研究结果一致,小鼠脑内的VP、NAcc、mPOA及VTA c-fos阳性细胞数目明显增多。研究结果表明,玛卡可作用于调节社会行为的部分相关脑区,激活“社会大脑”系统,对小鼠的社会行为有正向的调节作用。
多巴胺(DA)系统是运动活动、动机、注意力和奖赏处理的关键调节器[41-43],起源于黑质和腹侧被盖区(VTA)的DA能投射终止于纹状体,其失调与许多神经精神疾病有关。研究表明,自闭症的特征可能是由DA信号异常引起或加重的[44]。5-HT是一种存在于大多数动物门中的神经调节剂,无论是在脊椎动物还是无脊椎动物中,5-HT系统都能调节认知和行为功能,参与不同水平的应激反应和情绪障碍[45]。研究发现,杏仁核功能由富含5-HT的纤维进行支配[46],中缝背核的5-HT可通过对兴奋性神经元的直接抑制作用,或对γ-氨基丁酸(GABA)能神经元的激活作用来调节外侧杏仁核(LA)突触前平衡[47]。杏仁核兴奋/抑制平衡的破坏最近被认为是ASD中孤独症表型的一个原因[48]。此外,VP内的胆碱能神经元接收来自NAcc的GABA能输入[49],在VP内进行局部连接,并向前额叶皮质和基底外侧杏仁核进行外源性投射。本研究发现,在服用玛卡后,小鼠血浆中5-HT及DA的含量较空白对照组显著提高,且伴随着社会脑区c-fos阳性细胞数目的增多,由此推测玛卡对社会行为的改善可能是通过调节5-HT及DA水平而调控相关的脑区来实现的。
4 结论本研究证实了玛卡对ICR小鼠的自闭症样行为有显著的改善作用,该作用可能是通过调节相应的神经递质水平进而调控相关的脑区来实现的,为自闭症的防治提供了新的药物研究证据及机制作用研究方向。
| [1] |
THIBAUT F. New perspectives in autism spectrum disorders[J]. Dialogues in Clinical Neuroscience, 2017, 19(4): 323. DOI:10.31887/DCNS.2017.19.4/fthibaut |
| [2] |
WU H, WANG X, GAO J, et al. Fingolimod (FTY720) attenuates social deficits, learning and memory impairments, neuronal loss and neuroinflammation in the rat model of autism[J]. Life Sciences, 2017, 173: 43-54. DOI:10.1016/j.lfs.2017.01.012 |
| [3] |
KUAMR H, SHARMA B. Minocycline ameliorates prenatal valproic acid induced autistic behaviour, biochemistry and blood brain barrier impairments in rats[J]. Brain Research, 2016, 1630: 83-97. DOI:10.1016/j.brainres.2015.10.052 |
| [4] |
NAVIAUX R K, ZOLKIPLI Z, WANG L, et al. Antipurinergic therapy corrects the autism-like features in the poly (IC) mouse model[J]. PLoS One, 2013, 8(3): e57380. DOI:10.1371/journal.pone.0057380 |
| [5] |
BARONIO D, CASTRO K, GONCHOROSKI T, et al. Effects of an H3R antagonist on the animal model of autism induced by prenatal exposure to valproic acid[J]. PLoS One, 2015, 10(1): e0116363. DOI:10.1371/journal.pone.0116363 |
| [6] |
SILVERMAN J L, PRIDE M C, HAYES J E, et al. GABAB receptor agonist R-baclofen reverses social deficits and reduces repetitive behavior in two mouse models of autism[J]. Neuropsychopharmacology, 2015, 40(9): 2228-2239. DOI:10.1038/npp.2015.66 |
| [7] |
AGUILAR-VALLES A, MATTA-CAMACHO E, KHOUTORSKY A, et al. Inhibition of group Ⅰ metabotropic glutamate receptors reverses autistic-like phenotypes caused by deficiency of the translation repressor eIF4E binding protein 2[J]. The Journal of Neuroscience, 2015, 35(31): 11125-11132. DOI:10.1523/JNEUROSCI.4615-14.2015 |
| [8] |
MEHTA M V, GANDAL M J, SIEGEL S J. mGluR5-antagonist mediated reversal of elevated stereotyped, repetitive behaviors in the VPA model of autism[J]. PLoS One, 2011, 6(10): e26077. DOI:10.1371/journal.pone.0026077 |
| [9] |
王淳, 张建军, 王佳, 等. 玛咖的临床文献研究及其中药性能探讨[J]. 中华中医药杂志, 2017, 32(12): 5569-5573. |
| [10] |
WALF A A, FRYE C A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents[J]. Nature Protocols, 2007, 2(2): 322-328. DOI:10.1038/nprot.2007.44 |
| [11] |
HUYNH T N, SHAH M, KOO S Y, et al. eIF4E/Fmr1 double mutant mice display cognitive impairment in addition to ASD-like behaviors[J]. Neurobiology of Disease, 2015, 83: 67-74. DOI:10.1016/j.nbd.2015.08.016 |
| [12] |
WONG C T, BESTARD-LORIGADOS I, CRAWFORD D A. Autism-related behaviors in the cyclooxygenase-2-deficient mouse model[J]. Genes, Brain and Behavior, 2019, 18(1): e12506. DOI:10.1111/gbb.12506 |
| [13] |
NADLER J J, MOY S S, DOLD G, et al. Automated apparatus for quantitation of social approach behaviors in mice[J]. Genes, Brain and Behavior, 2004, 3(5): 303-314. DOI:10.1111/j.1601-183X.2004.00071.x |
| [14] |
KAIDANOVICH-BEILIN O, LIPINA T, VUKOBRADOVIC I, et al. Assessment of social interaction behaviors[J]. Journal of Visualized Experiments, 2011, 25(48): e2473. |
| [15] |
MAHDI S, ALMOSAWI S, BAKSH H, et al. Effect of chronic administration and withdrawal of caffeine on motor function, cognitive functions, anxiety, and the social behavior of BLC57 mice[J]. Intenational Journal of Health Sciences, 2019, 13(2): 10-16. |
| [16] |
YANAGIDA S, MOTOMURA K, OHASHI A, et al. Effect of acute imipramine administration on the pattern of forced swim-induced c-Fos expression in the mouse brain[J]. Neuroscience Letters, 2016, 629: 119-124. DOI:10.1016/j.neulet.2016.06.059 |
| [17] |
QUINTERO E, VARGAS J P, DIAZ E, et al. c-Fos positive nucleus reveals that contextual specificity of latent inhibition is dependent of insular cortex[J]. Brain Research Bulletin, 2014, 108: 74-79. DOI:10.1016/j.brainresbull.2014.08.008 |
| [18] |
姜立科, 董浩, 张仁堂, 等. 玛卡功能作用及开发利用研究进展[J]. 中国食物与营养, 2015, 21(6): 69-71. |
| [19] |
叶丽芳. 秘鲁特产玛卡的研究进展[J]. 科技与企业, 2015(11): 186. DOI:10.3969/j.issn.1004-9207.2015.11.175 |
| [20] |
李雪, 索柯柯, 张小苗, 等. 玛咖活性成分及其淀粉研究进展[J]. 食品科学, 2020, 41(19): 253-262. DOI:10.7506/spkx1002-6630-20200429-382 |
| [21] |
李诺, 刘振寰. 中医对自闭症的认识及治疗现状[J]. 中国中西医结合儿科学, 2009, 1(2): 150-152. DOI:10.3969/j.issn.1674-3865.2009.02.015 |
| [22] |
WEINSTEIN-FUDIM L, ERGAZ Z, TURGEMAN G, et al. Gender related changes in gene expression induced by valproic acid in a mouse model of autism and the correction by S-adenosyl methionine.does it explain the gender differences in autistic like behavior?[J]. International Journal Molecular Sciences, 2019, 20(21): 5278. DOI:10.3390/ijms20215278 |
| [23] |
SILIVERMAN J L, YANG M, LORD C, et al. Behavioural phenotyping assays for mouse models of autism[J]. Nature Reviews Neuroscience, 2010, 11(7): 490-502. DOI:10.1038/nrn2851 |
| [24] |
王维刚, 吴文婷, 周嘉斌, 等. 应用高架十字迷宫分析小鼠焦虑行为[J]. 中国细胞生物学学报, 2011, 33(5): 466-472. |
| [25] |
SEIBENHENER M L, WOOTEN M C. Use of the open field maze to measure locomotor and anxiety-like behavior in mice[J]. Journal of Visualized Experiments, 2015(96): e52434. |
| [26] |
刘春燕, 陈功香. 自闭症谱系障碍个体的焦虑: 发生机制、评估与治疗[J]. 心理科学进展, 2019, 27(10): 1713-1725. |
| [27] |
MACHADO C J, EMERY N J, CAPITANIO J P, et al. Bilateral neurotoxic amygdala lesions in rhesus monkeys (Macaca mulatta): Consistent pattern of behavior across different social contexts[J]. Behavioral Neuroscience, 2008, 122(2): 251-266. DOI:10.1037/0735-7044.122.2.251 |
| [28] |
SANDERS S K, SHEKHAR A. Anxiolytic effects of chlordiazepoxide blocked by injection of GABAA and benzodiazepine receptor antagonists in the region of the anterior basolateral amygdala of rats[J]. Society Biological Psychiatry, 1995, 37(7): 473-476. DOI:10.1016/0006-3223(94)00183-4 |
| [29] |
TSUCHⅡYA N, KAWASAKI H, OYA H, et al. Decoding face information in time, frequency and space from direct intracranial recordings of the human brain[J]. PLoS One, 2008, 3(12): e3892. DOI:10.1371/journal.pone.0003892 |
| [30] |
KENNEDY D P, GLÄSCHER J, TYSZKA J M, et al. Personal space regulation by the human amygdala[J]. Nature Neuroscience, 2009, 12(10): 1226-1227. DOI:10.1038/nn.2381 |
| [31] |
TODD R M, ANDERSON A K. Six degrees of separation: The amygdala regulates social behavior and perception[J]. Nature Neuroscience, 2009, 12(10): 1217-1218. DOI:10.1038/nn1009-1217 |
| [32] |
HABER S N, GROENEWEGEN H J, GROVE E A, et al. Efferent connections of the ventral pallidum: Evidence of a dual striatopallidofugal pathway[J]. The Journal of Comparative Neurology, 1985, 235(3): 322-335. DOI:10.1002/cne.902350304 |
| [33] |
SMITH K S, TINDELL A J, ALDRIDGE J W, et al. Ventral pallidum roles in reward and motivation[J]. Behavioural Brain Research, 2009, 196(2): 155-167. DOI:10.1016/j.bbr.2008.09.038 |
| [34] |
ROOT D H, MELENDEZ R I, ZABORSZKY L. The ventral pallidum: Subregion-specific functional anatomy and roles in motivated behaviors[J]. Progress in Neurobiology, 2015, 130: 29-70. DOI:10.1016/j.pneurobio.2015.03.005 |
| [35] |
O'CONNELL L A, HOFMANN H A. Evolution of a vertebrate social decision-making network[J]. Science, 2012, 336(6085): 1154-1157. DOI:10.1126/science.1218889 |
| [36] |
DULAC C, O'CONNELL L A, WU Z. Neural control of maternal and paternal behaviors[J]. Science, 2014, 345(6198): 765-770. DOI:10.1126/science.1253291 |
| [37] |
MCHENRY J A, RUBINOW D R, STUBER D D. Maternally responsive neurons in the bed nucleus of the stria terminalis and medial preoptic area: Putative circuits for regulating anxiety and reward[J]. Frontiers in Neuroendocrinol, 2015, 38: 65-72. DOI:10.1016/j.yfrne.2015.04.001 |
| [38] |
RILLING J K, YOUNG L J. The biology of mammalian parenting and its effect on offspring social development[J]. Science, 2014, 345(6198): 771-776. DOI:10.1126/science.1252723 |
| [39] |
PETRULIS A. Chemosignals and hormones in the neural control of mammalian sexual behavior[J]. Frontiers in Neuroendocrinol, 2013, 34(4): 255-267. DOI:10.1016/j.yfrne.2013.07.007 |
| [40] |
MCHENRY J A, OTIS J M, ROSSI M A, et al. Hormonal gain control of a medial preoptic area social reward circuit[J]. Nature Neuroscience, 2017, 20(3): 449-458. DOI:10.1038/nn.4487 |
| [41] |
SURMEIER D J, DING J, DAY M, et al. D1 and D2 dopamine-receptor modulation of striatal glutamatergic signaling in striatal medium spiny neurons[J]. Trends in Neurosciences, 2007, 30(5): 228-235. DOI:10.1016/j.tins.2007.03.008 |
| [42] |
DOUGLAS A J, JOHNSTONE H A, WIGGER A, et al. The role of endogenous opioids in neurohypophysial and hypothalamo-pituitary-adrenal axis hormone secretory responses to stress in pregnant rats[J]. The Journal of Endocrinology, 1998, 158(2): 285-293. DOI:10.1677/joe.0.1580285 |
| [43] |
ONAKA T, TAKAYANAGI Y. Role of oxytocin in the control of stress and food intake[J]. Journal of Neuroendocrinology, 2019, 31(3): e12700. |
| [44] |
RODRIGUIZ R M, CHU R, CARON M G, et al. Aberrant responses in social interaction of dopamine transporter knockout mice[J]. Behavioural Brain Research, 2004, 148(1/2): 185-198. |
| [45] |
HAMON M, BLIER P. Monoamine neurocircuitry in depression and strategies for new treatments[J]. Progress in Neuro-psychopharmacol & Biological Psychiatry, 2013, 45: 54-63. |
| [46] |
O'ROURKE H, FUDGE J L. Distribution of serotonin transporter labeled fibers in amygdaloid subregions: Implications for mood disorders[J]. Biological Psychiatry, 2006, 60(5): 479-490. |
| [47] |
STUTZMANN G E, LEDOUX J E. GABAergic antagonists block the inhibitory effects of serotonin in the lateral amygdala: A mechanism for modulation of sensory inputs related to fear conditioning[J]. The Journal of Neuroscience, 1999, 19(11): RC8. |
| [48] |
MARIN O. Interneuron dysfunction in psychiatric disorders[J]. Nature Reviews Neuroscience, 2012, 13(2): 107-120. |
| [49] |
ZABORSZKY L, CULLINAN W E. Projections from the nucleus accumbens to cholinergic neurons of the ventral pallidum: A correlated light and electron microscopic double-immunolabeling study in rat[J]. Brain Research, 1992, 570(1/2): 92-101. |



