心力衰竭是心血管疾病常见的最终结果,具有高致死率和高复发率的特点,持续过度的心肌重构是心衰发生的基本病理过程。大量研究表明,心肌细胞凋亡是心肌重构的关键环节,抑制心肌细胞凋亡是改善心脏功能的治疗策略之一[1, 2]。骨形态发生蛋白(Bone Morphogenetic Protein,BMP)属于转化生长因子-β (TGF-β)超家族的成员,广泛分布于骨骼和心脏等组织和器官。BMP可通过调控心肌纤维化、心肌炎症反应和心肌细胞凋亡等过程参与心肌重构的发生和发展[3]。研究显示,心肌组织中含量最丰富的骨形态发生蛋白7(Bone Morphogenetic Protein 7, BMP7)具有显著的抗缺血效应[4, 5],并可抑制心肌纤维化从而发挥心脏保护作用[6]。然而,BMP7对缺血所致心衰心脏功能的影响及其机制尚不清楚。本研究旨在利用心梗后心衰大鼠模型,探究早期应用BMP7治疗对心梗后心衰的作用及其机制,为临床防治心梗后心衰提供新的思路和科学依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠22只,体质量为230-250 g,由广西医科大学实验动物中心提供,动物合格证号为SYXK(桂)2020-0004。动物饲养于温度(32±2)℃、湿度50%-60%的环境中,每日交替进行12 h光照和12 h黑暗,自由进食饮水。
1.1.2 主要药物和试剂重组人骨形态发生蛋白7(BMP7),购自北京博奥森生物科技有限公司;免疫组化试剂盒购自上海碧云天生物技术有限公司;TUNEL试剂盒购自瑞士罗氏公司;B淋巴细胞瘤-2(Bcl-2)抗体,购自英国Abcam公司;B淋巴细胞瘤因子相关X (Bax)蛋白抗体、活化的天冬氨酸特异性半胱氨酸蛋白酶3(Cleaved caspase-3)抗体、磷酸化的核转录因子-κB p65 (p-NF-κB p65)均购自美国CST公司。
1.1.3 仪器与设备动物呼吸机(ALC-V9,上海奥尔科特生物科技有限公司),生物机能实验系统(BL-420F,四川成都泰盟科技有限公司),多普勒超声诊断仪(sonos7500,荷兰Philips公司),荧光显微镜(IX70,日本Olympus公司),多功能酶标仪(Varioskan LUX,美国Thermo公司),电泳凝胶成像系统(ChemiScope 3300,上海勤翔科学仪器有限公司)。
1.2 方法 1.2.1 心衰模型制备及动物分组大鼠禁食12 h后,采用2% 3 mL/kg戊巴比妥钠腹腔内麻醉后,在ALC-V9动物呼吸机的支持下,于左侧胸部备皮并切开皮肤,打开胸腔及心包,充分暴露心脏,并在左心耳根部下方2-3 mm处用6-0号缝合针永久结扎,且保证梗死面积大于30%[7],以结扎瞬间心前区心肌由红变白、心脏运动减弱和心电图出现ST段弓背向上抬高的特征性表现作为心肌缺血造模成功的标志。术毕观察数分钟心电图后,用钝头注射器抽出胸腔气体形成胸腔负压,并逐层缝合胸壁及皮肤。再次观察大鼠的呼吸状况,并用体温计监测肛温,同时利用加热灯使其体温保持在(37±0.5)℃,接着在肌肉内注射2.5×104 U青霉素预防感染。
术后12 h成功存活的大鼠按随机数字法分为心肌梗死(MI)组和心肌梗死+BMP7(MI+BMP7)组,每组8只。其中,MI+BMP7组尾静脉注射BMP7(35 μg·kg-1)[6],MI组尾静脉注射与BMP7等体积的0.9%生理盐水,每周1次。另外选取6只正常SD大鼠作为假手术(Sham)组,尾静脉注射与BMP7等体积的0.9%生理盐水,并接受同样的手术操作,但不结扎左前降支。各实验大鼠从术后第2天开始给予药物或生理盐水连续4周,其中Sham组全部存活,MI组存活6只,MI+BMP7组存活7只。手术4周后经超声心动图检测显示实验组大鼠左室射血分数(LVEF) < 45%,即心力衰竭大鼠造模成功[8]。
1.2.2 心脏超声检测待各组干预4周后行超声心动图检查。采用2%戊巴比妥钠腹腔内麻醉并固定,左侧胸部备皮,使用彩色多普勒超声诊断仪检测大鼠左室舒张末期内径(LVEDD,mm)、左室收缩末期内径(LVESD,mm)、左室射血分数(LVEF,%)、左室短轴缩短率(LVFS,%),所有数据均测量3次取平均值。
1.2.3 血浆NT-proBNP含量测定超声检测结束后,剪开大鼠腹腔,腹主动脉取血置于抗凝采血管中,随后3 000 r/min离心15 min,吸取血浆,于-80℃低温保存待测。按照试剂盒说明书进行操作,检测大鼠血浆NT-proBNP的表达情况。
1.2.4 心肌组织病理检测采血结束后,剪开大鼠胸腔,将心脏迅速取出并放入10%氯化钾溶液中,使心脏停搏于舒张期。用预冷的生理盐水反复冲净心脏中的血液,并剔除非心肌组织,用4%多聚甲醛溶液固定、脱水、石蜡包埋、切片,然后按照说明书进行染色,光学显微镜观察并拍照。
1.2.5 细胞凋亡率检测切片脱蜡水化后,按照TUNEL试剂盒说明书进行操作,并在镜下观察心肌细胞的凋亡情况,绿色荧光即为TUNEL阳性细胞,然后每张切片在缺血部位选取3个高倍镜视野,分别计算凋亡指数(AI), 即AI=(凋亡心肌细胞数/心肌细胞总数)×100%。
1.2.6 p-NF-κB p65、Bcl-2、Bax和Cleaved caspase-3蛋白表达测定取100 mg缺血部位的心肌组织在RIPA裂解液中充分匀浆,提取上清液,用二喹啉甲酸(BCA)法测定并调整各组蛋白浓度一致,取35 μg蛋白进行聚丙烯酰胺凝胶电泳,聚偏氟乙烯(PVDF)湿法转膜,5%脱脂牛奶封闭后加入一抗(1∶1 000)4℃孵育过夜,经磷酸盐吐温缓冲液(TBST)洗涤后加入二抗,室温孵育1 h,再次TBST洗涤后加入ECL发光液孵育显影,并用Image-J软件分析灰度值。
1.3 统计学分析所有数据均采用SPSS 22.0统计软件处理,以均数±标准差(x±s)表示。多组间比较采用单因素方差分析法,方差齐时组间两两比较采用最小显著性差异(LSD)法;方差不齐时则采用Welch检验,若差异存在统计学意义,则组间两两比较采用Tambane′s T2法。以P < 0.05表示差异有统计学意义。
2 结果与分析 2.1 BMP7对心梗后心衰大鼠左心室功能的影响心肌梗死4周后,大鼠心脏的收缩功能显著降低(图 1)。由表 1可知,药物干预4周后,与Sham组相比,MI组和MI+BMP7组的LVEDD值和LVESD值显著增加,而LVEF值和LVFS值显著降低(P < 0.05),表明左心室扩张及收缩功能障碍。与MI组相比,MI+BMP7组LVEF值和LVFS值均显著增加(P < 0.05)。

|
| 图 1 大鼠超声心动图 Fig. 1 Echocardiogram of rats |
| 组别 Group |
例数(只) Cases (number) |
LVEDD (mm) | LVESD (mm) | LVEF (%) | LVFS (%) |
| Sham group | 6 | 6.08±0.13 | 3.29±0.23 | 82.61±2.46 | 46.22±2.74 |
| MI group | 6 | 7.92±0.69# | 6.47±0.59# | 43.17±1.67# | 18.39±0.93# |
| MI+BMP7 group | 7 | 7.18±0.41# | 5.18±0.39#* | 59.43±3.50#* | 27.67±2.18#* |
| Note: Compared with Sham group, #P < 0.05;compared with MI group, *P < 0.05 | |||||
2.2 BMP7对心梗后心衰大鼠血浆NT-proBNP表达的影响
NT-proBNP作为心衰诊断及预后的独立预测因子,其表达变化与左心室重构密切相关,NT-proBNP的低表达可能是心脏反向重塑的重要指标[9, 10]。由图 2可知,与Sham组相比,MI组大鼠血浆NT-proBNP含量显著增加(P < 0.05);与MI组相比,MI+BMP7组大鼠血浆NT-proBNP含量显著降低(P < 0.05)。该结果表明BMP7可显著抑制心肌重构,改善心脏功能和心肌梗死大鼠的预后情况。
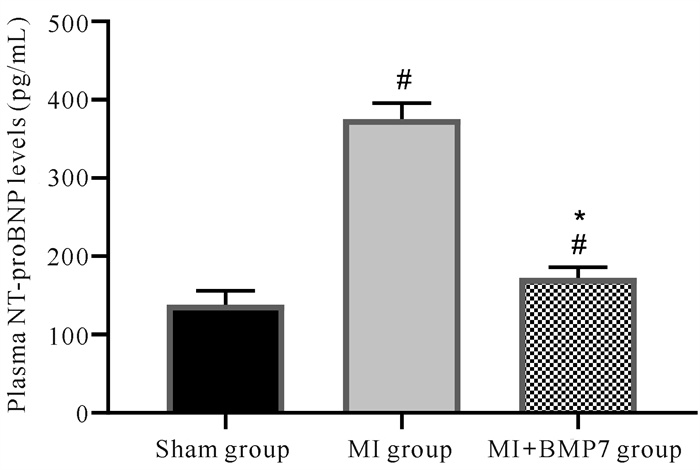
|
| Compared with Sham group, #P < 0.05;Compared with MI group, *P < 0.05 图 2 大鼠血浆NT-proBNP的表达水平 Fig. 2 Expression level of plasma NT-proBNP in rats |
2.3 BMP7对心梗后心衰大鼠心肌纤维及炎症反应的影响
Sham组心肌纤维排列均匀有序且分界清晰,未见明显炎症及出血。MI组心肌组织出现大面积梗死,组织内出现大量心肌细胞坏死和心肌纤维化,纤维化程度与本课题组此前的研究结果(Masson染色)一致[11],伴有淋巴细胞和肥大细胞等炎性细胞浸润。与MI组相比,MI+BMP7组心肌纤维断裂坏死减少,纤维化程度及炎性细胞浸润明显减轻。结果如图 3所示。
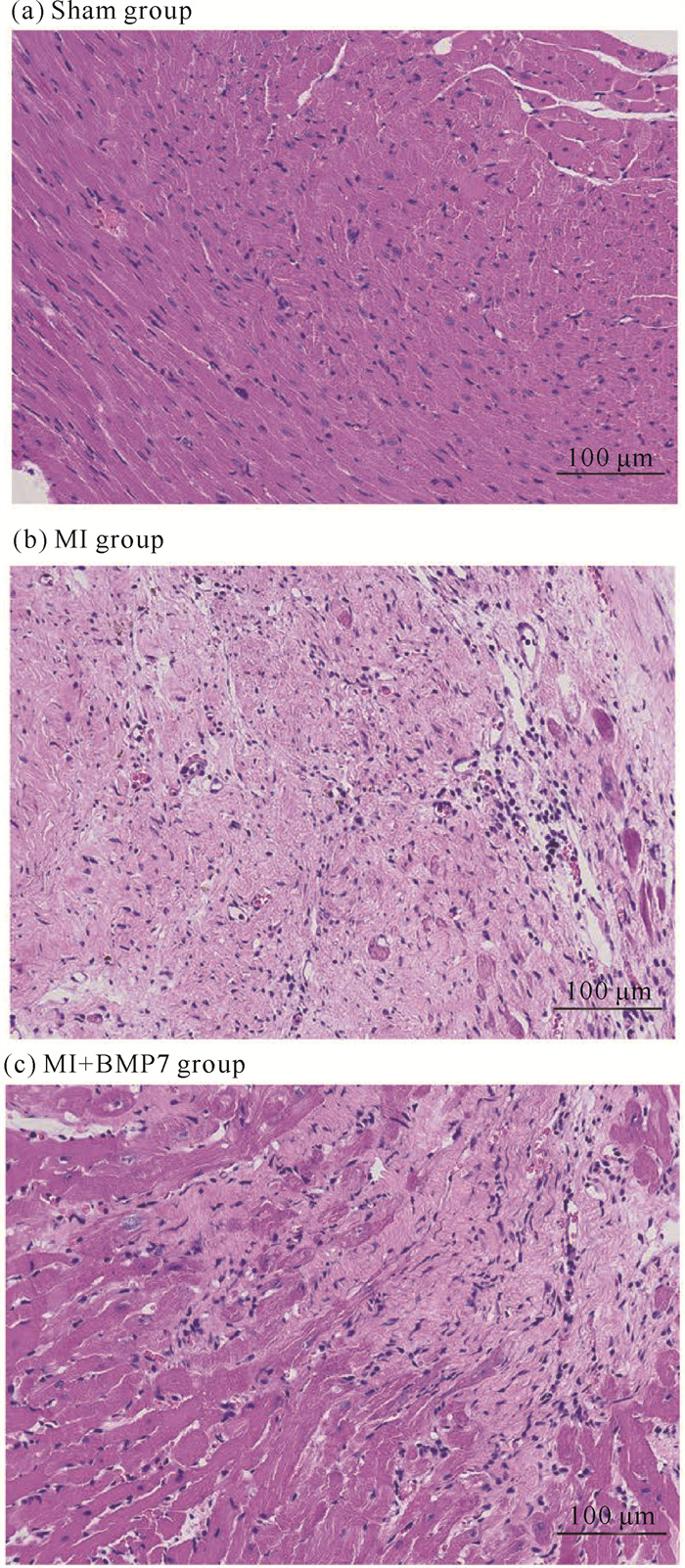
|
| 图 3 大鼠心肌组织HE染色结果 Fig. 3 HE staining results of myocardial tissue of rats |
2.4 BMP7对心梗后心衰大鼠心肌细胞凋亡的影响
由图 4可知,与Sham组相比,MI组凋亡阳性细胞明显增多,细胞凋亡率增加;与MI组相比,MI+BMP7组凋亡阳性细胞显著减少,细胞凋亡率降低(P < 0.05)。
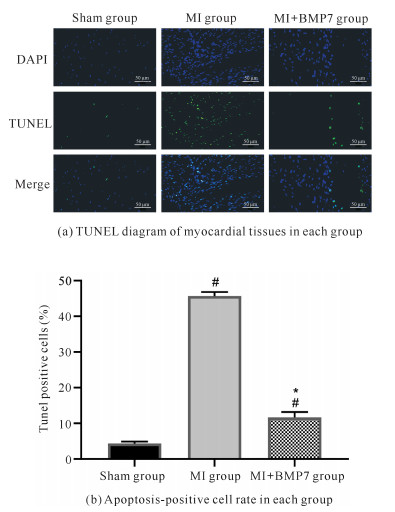
|
| #P < 0.05 compared with Sham group; *P < 0.05 compared with MI group 图 4 TUNEL染色检测心肌细胞凋亡 Fig. 4 Detection of cardiomyocyte apoptosis by TUNEL staining |
2.5 BMP7对心梗后心衰大鼠心肌细胞凋亡相关蛋白表达的影响
由图 5可知,与Sham组相比,MI组心肌组织中Bcl-2蛋白表达水平显著降低(P < 0.05);与MI组相比,MI+BMP7组可显著上调Bcl-2蛋白表达水平(P < 0.05)。MI组心肌组织中Bax、Cleaved caspase-3和p-NF-κB p65蛋白水平显著高于Sham组(P < 0.05),MI+BMP7组显著低于MI组(P < 0.05)。
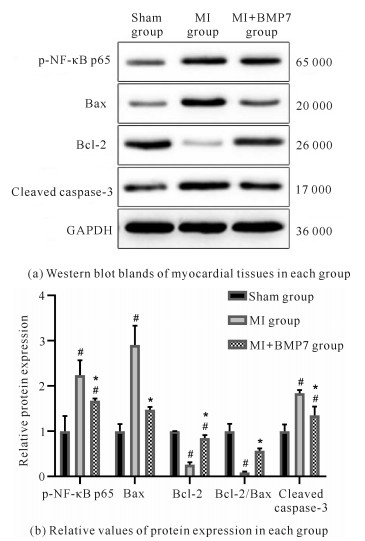
|
| #P < 0.05 compared with Sham group; *P < 0.05 compared with MI group 图 5 大鼠心肌组织凋亡相关蛋白的表达水平 Fig. 5 Expression level of apoptosis-associated proteins in myocardial tissue of rats |
3 讨论
心肌重构既是心衰发生发展的重要病理基础,又是心功能障碍的独立危险因素[12]。虽然已有多种药物能逆转心肌重构,但是心衰患者在5年内的死亡率仍高达50%[13, 14]。因此,寻找更有效的药物或治疗靶点以减缓心力衰竭的发展并改善患者预后具有重要的意义。近年来的研究表明,BMP7具有显著的抗缺血效应[4, 5],还可以减轻心肌纤维化,对心肌有保护作用,但其对心梗后心衰大鼠心功能的影响及具体作用机制尚未明确。本研究发现,心肌梗死4周后大鼠心脏的收缩功能显著降低,外源性给予BMP7可改善左心室收缩功能,因此减轻心脏扩张、抑制心肌细胞凋亡可能是实现上述作用的机制之一。
超声心动图作为临床上评价心力衰竭最常用的检测手段,其中LVEF和LVFS是反映左心室收缩功能最有价值的指标[15]。研究结果显示,模型组在未经BMP7治疗的情况下,LVEF值和LVFS值均明显降低,且LVEF值< 45%,提示左前降支结扎4周后大鼠出现明显的心力衰竭[8]。与MI组相比,MI+BMP7组的LVEF值和LVFS值均显著增加,提示早期BMP7治疗可减轻心衰程度,改善心梗后的心脏功能。HE染色结果显示,BMP7的干预使大鼠心肌纤维断裂坏死减少,纤维化程度及炎性细胞浸润明显减轻,从病理学角度印证了上述结论。
心肌细胞属于不可再生的永久性细胞,凋亡作为心肌细胞进行性丢失的主要原因,能促进心肌梗死后心脏发展成心力衰竭[16]。细胞凋亡过程涉及多种蛋白,其中Bcl-2家族中的Bcl-2和Bax与细胞凋亡的发生密切相关,两者分别发挥抑制凋亡和促进凋亡的作用。此外,Caspase-3的激活也是细胞凋亡发生的重要标志。大量研究表明,Bcl-2/Bax比值的上调和Caspase-3活性的下调可降低心力衰竭大鼠心肌细胞的凋亡[17, 18]。近年来,先天性免疫在心血管病理学的发展以及心肌保护中发挥着极其重要的作用,而NF-κB p65活化又是该过程的关键环节[19]。NF-κB p65的激活在心血管疾病中的作用取决于激活时间和细胞环境[20]。临床研究表明,NF-κB p65的激活与心力衰竭密切相关,心力衰竭患者的心肌组织均表现出NF-κB p65的高活化状态[20, 21]。此外,动物实验研究表明,心肌梗死后NF-κB p65慢性或持续性的激活将导致心肌组织炎症的持续存在,细胞凋亡水平增加,进而发展成心力衰竭;而抑制NF-κB p65的激活可降低细胞凋亡水平,改善心脏功能[22]。
本研究中TUNEL染色和蛋白免疫印迹结果显示,与Sham组相比,MI组大鼠心肌细胞凋亡率和活化的Caspase-3的表达显著增高,且Bcl-2/Bax比值显著降低,这进一步证实了心肌细胞凋亡是心衰发生、发展的重要病理生理基础。早期给予BMP7治疗,心梗大鼠的心肌细胞凋亡率明显降低,促凋亡相关蛋白表达减少,同时心梗引起的p-NF-κB p65高表达也明显降低,提示BMP7干预对心梗后心脏有保护作用,其机制可能是通过抑制NF-κB p65激活和Caspase-3信号通路从而减少心梗后心肌细胞凋亡。Urbina等[23]研究发现,在小鼠糖尿病心肌模型中,BMP7可通过磷酸酯酶与张力蛋白同源物(PTEN)和丝氨酸/苏氨酸蛋白激酶(Akt)途径来抑制心肌细胞凋亡。Xu等[5]研究表明,外源性过表达BMP7可减轻缺氧/复氧心肌细胞的凋亡,其机制可能与NF-κB的核易位有关。以上研究结果均与本研究的结果相符。
4 结论早期使用外源性BMP7对心肌梗死具有保护作用,可在一定程度上抑制心衰进展,其机制涉及抑制NF-κB p65活化和Caspase-3信号通路,通过减少心肌细胞凋亡来发挥改善心脏功能的作用,这也为心梗后心衰的防治提供了一个新的治疗方向。
| [1] |
WENCKER D, CHANDRA M, NGUYEN K, et al. A mechanistic role for cardiac myocyte apoptosis in heart failure[J]. The Journal of Clinical Investigation, 2003, 111(10): 1497-1504. DOI:10.1172/JCI17664 |
| [2] |
KOSTIN S, POOL L, ELSÄSSER A, et al. Myocytes die by multiple mechanisms in failing human hearts[J]. Circulation Research, 2003, 92(7): 715-724. DOI:10.1161/01.RES.0000067471.95890.5C |
| [3] |
谢赛阳, 邓伟, 唐其柱. 骨形态发生蛋白在心肌重构中的作用[J]. 中华心血管病杂志, 2019, 47(6): 504-507. DOI:10.3760/cma.j.issn.0253-3758.2019.06.017 |
| [4] |
LEFER A M, TSAO P S, MA X L, et al. Anti-ischaemic and endothelial protective actions of recombinant human osteogenic protein (hOP-1)[J]. Journal of Molecular and Cellular Cardiology, 1992, 24(6): 585-593. DOI:10.1016/0022-2828(92)91043-5 |
| [5] |
XU J H, ZHAO Y Y, WANG J K, et al. Effects of mouse recombinant bone morphogenetic protein-7 transfection on cell apoptosis, NF-kappaB, and downstream genes in cultured primary cardiomyocytes after simulated ischemia and reperfusion injury[J]. Journal of Cardiovascular Pharmacology, 2010, 56(1): 69-77. DOI:10.1097/FJC.0b013e3181e0badc |
| [6] |
JIN Y, CHENG X, LU J, et al. Exogenous BMP-7 facilitates the recovery of cardiac function after acute myocardial infarction through counteracting TGF-β1 signaling pathway[J]. The Tohoku Journal of Experimental Medicine, 2018, 244(1): 1-6. DOI:10.1620/tjem.244.1 |
| [7] |
ERA T, UFNAL M, SZCZEPASKA-SADOWSKA E. TNF and angiotensin type 1 receptors interact in the brain control of blood pressure in heart failure[J]. Cytokine, 2015, 71(2): 272-277. DOI:10.1016/j.cyto.2014.10.019 |
| [8] |
ZHANG L, GAN Z K, HAN L N, et al. Protective effect of heme oxygenase-1 on Wistar rats with heart failure through the inhibition of inflammation and amelioration of intestinal microcirculation[J]. Journal of Geriatric Cardiology, 2015, 12(4): 353-365. |
| [9] |
BOSTAN M M, STǍTESCU C, ANGHEL L, et al. Post-myocardial infarction ventricular remodeling biomarkers-The key link between pathophysiology and clinic[J]. Biomolecules, 2020, 10(11): 1587. DOI:10.3390/biom10111587 |
| [10] |
MURPHY S P, PRESCOTT M F, MAISEL A S, et al. Association between angiotensin receptor-neprilysin inhibition, cardiovascular biomarkers, and cardiac remodeling in heart failure with reduced ejection fraction[J]. Circulation Heart Failure, 2021, 14(6): e008410. DOI:10.1161/CIRCHEARTFAILURE.120.008410 |
| [11] |
余平, 梁鹏, 庞诗锋, 等. 骨形态发生蛋白7通过调节GSK-3β活性对心肌梗死后大鼠心肌纤维化的影响[J]. 岭南急诊医学杂志, 2021, 26(1): 8-10, 51. DOI:10.3969/j.issn.1671-301X.2021.01.003 |
| [12] |
魏玲, 李慧萍, 魏伟, 等. 慢性心衰大鼠心肌细胞凋亡、心肌纤维化及其相关性研究[J]. 西南国防医药, 2018, 28(1): 35-38. DOI:10.3969/j.issn.1004-0188.2018.01.012 |
| [13] |
WANG X F, QU X Q, ZHANG T T, et al. Testosterone suppresses ventricular remodeling and improves left ventricular function in rats following myocardial infarction[J]. Experimental and Therapeutic Medicine, 2015, 9(4): 1283-1291. DOI:10.3892/etm.2015.2269 |
| [14] |
OKONKO D O, SHAH A M. Heart failure: Mitochondrial dysfunction and oxidative stress in CHF[J]. Nature Reviews Cardiology, 2015, 12(1): 6-8. DOI:10.1038/nrcardio.2014.189 |
| [15] |
RODRIGUES J C, ROHAN S, DASTIDAR A G, et al. The relationship between left ventricular wall thickness, myocardial shortening, and ejection fraction in hypertensive heart disease: Insights from cardiac magnetic resonance imaging[J]. Journal of Clinical Hypertension, 2016, 18(11): 1119-1127. DOI:10.1111/jch.12849 |
| [16] |
赵英利, 邓兵. 心肌梗死后心室重构的机制及中医药防治进展[J]. 中西医结合心脑血管病杂志, 2019, 17(2): 211-215. |
| [17] |
HUANG P, FU J, CHEN L, et al. Redd1 protects against post-infarction cardiac dysfunction by targeting apoptosis and autophagy[J]. International Journal of Molecular Medicine, 2019, 44(6): 2065-2076. |
| [18] |
WANG L, HE Y, ZHANG Y, et al. Effects of active components of Fuzi and Gancao compatibility on Bax, Bcl-2, and Caspase-3 in chronic heart failure rats[J]. Evidence-based Complementary and Alternative Medicine, 2016, 2016: 7686045. |
| [19] |
VALEN G. Signal transduction through nuclear factor kappa B in ischemia-reperfusion and heart failure[J]. Basic Research in Cardiology, 2004, 99(1): 1-7. DOI:10.1007/s00395-003-0442-7 |
| [20] |
LORENZO O, PICATOSTE B, ARES-CARRASCO S, et al. Potential role of nuclear factor κB in diabetic cardiomyopathy[J]. Mediators of Inflammation, 2011, 2011: 652097. |
| [21] |
HEIDEN K V D, CUHLMANN S, LUONG L A, et al. Role of nuclear factor κB in cardiovascular health and disease[J]. Clinical Science, 2010, 118(10): 593-605. DOI:10.1042/CS20090557 |
| [22] |
HAMID T, GUO S Z, KINGERY J R, et al. Cardiomyocyte NF-κB p65 promotes adverse remodelling, apoptosis, and endoplasmic reticulum stress in heart failure[J]. Cardiovascular Research, 2011, 89(1): 129-138. DOI:10.1093/cvr/cvq274 |
| [23] |
URBINA P, SINGLA D K. BMP-7 attenuates adverse cardiac remodeling mediated through M2 macrophages in prediabetic cardiomyopathy[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2014, 307(5): 762-772. DOI:10.1152/ajpheart.00367.2014 |



