2. 亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530005
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning, Guangxi, 530005, China
糖苷类化合物通常是指由单糖或多糖的半缩醛羟基与配体两部分缩合而成的含糖衍生物,配体可以是糖类,也可以是非糖类物质——蛋白质、脂肪醇等[1]。糖苷类化合物不仅可为生物体提供能量、调节植物的生长,而且在生产和生活中使用也非常广泛[2]。如在医药行业当中,环烯醚萜苷类化合物、芳香碳糖苷化合物、三萜苷类化合物等糖苷类化合物因具有极大的药理性价值,被用于治疗营养不良、中风等多种症状[3, 4]。在化妆品行业,α-熊果苷是一种十分有效的美白成分,而甘油糖基化后生成的2-O-(α-D-glucopyranosyl) -sn-glycero是一种很好的保湿剂(Glycoin®)[5, 6]。此外,烷基糖苷作为一类可降解、毒性低的优质非离子型表面活性剂被大家所熟知[7]。因此,具有极大应用价值的糖苷类化合物引起了人们的研究热潮。除了直接从自然界获取外,人们还可以使用多种方法来合成糖苷类化合物,如化学法、生物催化法等,通过对糖类或非糖类化合物糖基化修饰来形成新的糖苷键,从而合成糖苷类化合物。
蔗糖磷酸化酶主要存在于微生物体内,属于糖基水解酶GH13家族。除了能够水解蔗糖外,蔗糖磷酸化酶还具有催化糖苷键转移的作用[8, 9],因此它可以作为一种生物催化剂,将底物合成糖苷类化合物[10]。Wang等[11]利用蔗糖磷酸化酶合成曲二糖,使得益生元曲二糖得到了大规模的生产;对减轻过敏性皮炎症状有益的低聚糖——蜜二糖也可以通过蔗糖磷酸化酶来催化合成[5];经过蔗糖磷酸化酶的作用,可以将苯二酚分子催化加上葡萄糖基,形成具有美白作用的熊果苷[12]。Gudiminchi等[13]利用蔗糖磷酸化酶对维生素C进行葡萄糖糖基化,使其不稳定性得到很大程度的改善。此外,蔗糖磷酸化酶还可对儿茶素[14]、白藜芦醇[15]、甜菊醇[16]、槲皮素[17]等进行转糖苷催化。因此,蔗糖磷酸化酶在转糖苷催化方面有较大的应用价值。目前,未有关于丁酸梭菌Clostridium butyricum中蔗糖磷酸化酶的相关报道,本研究对其酶学性质和转糖苷功能进行探讨,并进一步讨论不同来源的蔗糖磷酸化酶的差异性,以挖掘出具有利用价值的蔗糖磷酸化酶,提高其在工业应用中的潜力。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒丁酸梭菌C.butyricum DSM10702、表达载体pQE30、感受态细胞Escherichia.coli XL1-blue等均由本实验室保存。
1.1.2 主要试剂和仪器试剂:PrimerSTARTM HS DNA聚合酶、T4 DNA连接酶、dNTP、λ/Hind Ⅲ DNA marker、限制性内切酶BamH Ⅰ、Pst Ⅰ等均购买自Takara(宝)生物股份有限公司;胶回收/PCR纯化试剂盒、质粒DNA提取试剂盒以及纯化试剂盒均购自Fluxion Biosciences公司;蔗糖购自生工生物工程(上海)股份有限公司;葡萄糖-1-磷酸(G-1-P)、儿茶素等购买自上海源叶生物科技有限公司。
仪器:PCR仪(T-Gradient Thermoblock、MJ Reserch PTC-2000,苏州亚凡生物技术有限公司),离心机(Eppendorf Centrifuge 5415D,上海智岩科学仪器有限公司),高效液相色谱仪(Agilent G1314F,杭州瑞析科技有限公司),隔水式恒温培养箱(Binder,上海齐欣科学仪器有限公司),恒温振荡摇床(ZHWY-211B,上海知楚仪器有限公司)。
1.2 方法 1.2.1 蔗糖磷酸化酶基因的克隆通过对高通量全基因组从头测序丁酸梭菌的结果分析,查找糖基水解酶13家族中被注释为蔗糖磷酸化酶的核苷酸序列,并对丁酸梭菌的蔗糖磷酸化酶基因所编码的蛋白质进行结构组件分析,充分了解其结构,然后利用软件Vector NTI Advance 11.5进行引物设计,所设计的引物序列如下(其中下划线表示酶切位点):
cbsp-F:5′-CTCGGATCCGATAAGATAAAAAATGAAATAATG-3′;
cbsp-R:5′-CTACTGCAGCTCAATAGTAAAATCATAACTCTT-3′。
PCR程序:98℃ 3 min;98℃ 15 s,56.5℃ 10 s,72℃ 110 s,30个循环;72℃ 10 min。将PCR扩增所得的DNA片段及提取的质粒pQE30分别经BamH Ⅰ和Hind Ⅲ双酶切处理后,在T4 DNA连接酶下进行连接,然后转化到E.coli XL1-blue中。转化子送生工生物工程(上海)股份有限公司进行测序,将构建成功的重组质粒命名为pQE30-cbsp。
1.2.2 重组酶Cbsp的生物信息学分析在http://smart.embl-heidelberg.de/网站对蔗糖磷酸化酶基因cbsp编码的氨基酸序列进行SMART Main page分析,在http://www.cbs.dtu.dk/services/SignalP/网站对重组酶Cbsp进行SignalP 4.1信号肽分析。
1.2.3 重组酶Cbsp的诱导表达及纯化将测序正确的重组质粒转入E.coli XL1-blue感受态细胞中,于37℃、220 r·min-1培养至OD600为0.4-0.6时,加入终浓度为0.5 mmol·L-1的IPTG,在20℃、180 r·min-1条件下诱导22 h,离心收集菌体。超声仪破胞后经镍亲和层析(Ni-NTA)纯化重组酶Cbsp,并进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.4 重组酶Cbsp的酶学性质分析酶活力测定方法[18]:取170 μL的磷酸-柠檬酸缓冲液、20 μL 10%的蔗糖溶液,放置在最适温度水浴锅中水浴2-3 min后, 加入10 μL适当稀释的酶液,精确反应20 min, 然后加入400 μL DNS终止反应,沸水浴5 min显色。冷却至室温后,取200 μL混合液置于96孔酶标板中,在540 nm波长处读取样品的吸光值。对照为用10 μL灭活后的酶液替代原反应体系的酶液。酶活单位(U/mL)=(葡萄糖含量×103×稀释倍数)/(198.17×20×0.01),其中:198.17为葡萄糖分子量,20为反应时间(min),0.01为粗酶液体积(mL)。
(1) pH值对重组酶的影响。
在常温条件下,测定不同pH值(3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0)的磷酸氢二钠-柠檬酸缓冲液对重组酶酶活力的影响,得到重组酶的最适pH值。将重组酶保存在不同pH值(3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0的磷酸氢二钠-柠檬酸;8.0,8.5,9.0的硼酸-硼砂;9.0,9.5,10.0,10.5的甘氨酸-氢氧化钠)的缓冲液中,于4℃冰箱放置12 h;然后,根据酶活力测定方法,将经不同pH值缓冲液处理过的酶液加入反应体系中,测定重组酶的pH稳定性。每组3个平行,计算不同pH值下重组酶的酶活力。相对酶活力是指以最高酶活力为100%,计算出其他条件下酶活力的相对比例。
(2) 温度对重组酶的影响。
在最适pH值条件下,测定不同反应温度(25-65℃,间隔5℃)对重组酶酶活力的影响,得到重组酶的最适温度。将重组酶放置在不同温度(4℃、35℃、40℃、45℃和50℃)下,测定随时间变化重组酶的酶活力,即重组酶的热稳定性。每组3个平行,计算不同温度条件下重组酶的酶活力。
(3) Km和Vmax的测定。
在最适pH值和最适温度条件下,测定以不同浓度(1.5-234.0 mmol·L-1)蔗糖为底物时重组酶的酶活力,使用软件GraphPad Prism 5通过非线性回归分析拟合出重组酶的Km、Vmax。
(4) 化学试剂对重组酶的影响。
在最适反应条件下,分别测定N, N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、乙腈、甲醇、乙醇、异丙醇、正丁醇、乙二醇、1, 2-丙二醇、1, 3-丙二醇、2, 3-丁二醇等醇类(各试剂浓度设为5%、10%、15%、20%、25%、30%,V∶V)对重组酶酶活力的影响,同时还测定0.05%(W∶V, 下同)SDS、1%(V∶V,下同)Triton X-100、5%(V∶V,下同)Tween-80、0.01 mol·L-1咪唑、4 mol·L-1脲、1%(V∶V,下同)巯基乙醇等蛋白质还原剂和变性剂对重组酶酶活力的影响。以不添加化学试剂的反应作为对照,每组3个平行,计算不同浓度化学试剂存在时重组酶的酶活力。
1.2.5 转糖苷功能的测定(1) 以糖类和糖醇类为受体。
在最适反应条件下,分别以终浓度15% (V∶V, 下同)的G-1-P和8% (W∶W, 下同)的蔗糖为糖基供体,以终浓度10% (V∶V)的D-/L-阿拉伯糖、L-山梨糖、D-半乳糖、L-鼠李糖、D-甘露糖、D-果糖、D-木糖、D-甘露糖、纤维二糖、海藻糖、麦芽糖、甘露醇和木糖醇为糖基受体,加入适量的纯酶反应12 h后煮沸10 min终止反应,通过HPLC检测产物。
检测条件:仪器设备为Agilent 1260系列液相色谱仪、示差折光检测器,色谱柱为Alltima Aminoz氨基柱(4.6 μm×250 mm,5 μm),流动相为70% (V∶V)乙腈,等度洗脱,进样量10 μL,柱温25℃,流速1 mL·min-1。
(2) 以醇类为受体。
① 在最适反应条件下,分别以终浓度15%的G-1-P和8%的蔗糖为糖基供体,以终浓度5%(V∶V)的甲醇、乙醇、异丙醇、正丙醇、1, 2-丙二醇、1, 3-丙二醇、2, 3-丁二醇、乙二醇和丙三醇为糖基受体,加入适量的纯酶反应12 h后煮沸10 min终止反应,通过HPLC检测产物。
检测条件:仪器设备为Agilent 1260系列液相色谱仪、示差折光检测器,色谱柱为Alltima Aminoz氨基柱(4.6 μm×250 mm,5 μm),流动相为83% (V∶V)乙腈,等度洗脱,进样量10 μL,柱温25℃,流速1 mL·min-1。
② 在最适反应条件下,分别以终浓度15% 的G-1-P和8%的蔗糖为糖基供体,以200 μL正己醇、正辛醇、正壬醇和正癸醇为糖基受体,加入适量的纯酶反应12 h后煮沸10 min终止反应,通过HPLC检测产物。
检测条件:仪器设备为蒸发光散射检测器,色谱柱为C18柱,流动相为75% (V∶V)甲醇,等度洗脱,进样量10 μL,流速0.8 mL·min-1。
(3) 以烷基糖苷类物质为受体。
在最适反应条件下,分别以终浓度15%的G-1-P和8%的蔗糖为糖基供体,以终浓度1%的己基-β-D-葡萄糖苷、庚基-β-D-葡萄糖苷、N-辛基-β-D-葡萄糖苷、壬基-β-D-葡萄糖苷和0.5%的癸基-β-D-葡萄糖苷为糖基受体,加入适量的纯酶反应12 h后煮沸10 min终止反应,通过HPLC检测产物。
检测条件:仪器设备为蒸发光散射检测器,色谱柱为C18柱,流动相为75% (V∶V)甲醇,等度洗脱,进样量10 μL,流速1 mL·min-1。
(4) 以L-抗坏血酸和儿茶素类物质为受体。
在最适反应条件下,分别以终浓度15%的G-1-P和8%的蔗糖为糖基供体,以终浓度120 mmol·L-1 L-抗坏血酸和终浓度35 mmol·L-1儿茶素为糖基受体,加入适量的纯酶反应12 h后煮沸10 min终止反应,通过HPLC检测产物。
L-抗坏血酸检测条件:仪器设备为Agilent 1260系列液相色谱仪、紫外检测器,色谱柱为C18柱,流动相为98% (V∶V)甲醇,等度洗脱,进样量10 μL,柱温30℃,流速1 mL/min,检测波长250 nm。
儿茶素检测条件:仪器设备为Agilent 1260系列液相色谱仪、紫外检测器,色谱柱为C18柱,流动相为95% (V∶V)的甲醇,等度洗脱,进样量10 μL,柱温35℃,流速1 mL/min,检测波长254 nm。
蔗糖磷酸化酶的糖苷转化率=(实验组底物减少量/对照组底物的量)×100%。
2 结果与分析 2.1 生物信息学分析及基因的克隆经SMART Main page分析发现,其N端23-382位氨基酸为α-淀粉酶结构域[图 1(a)]。结合SignalP 4.1分析,结果显示重组酶Cbsp不含信号肽[图 1(b)]。以丁酸梭菌的基因组DNA为模板,利用引物cbsp-F、cbsp-R进行PCR扩增目的基因,得到一条大小约为1.5 kb的特异性条带,测序正确后将其命名为cbsp [图 1(c)]。
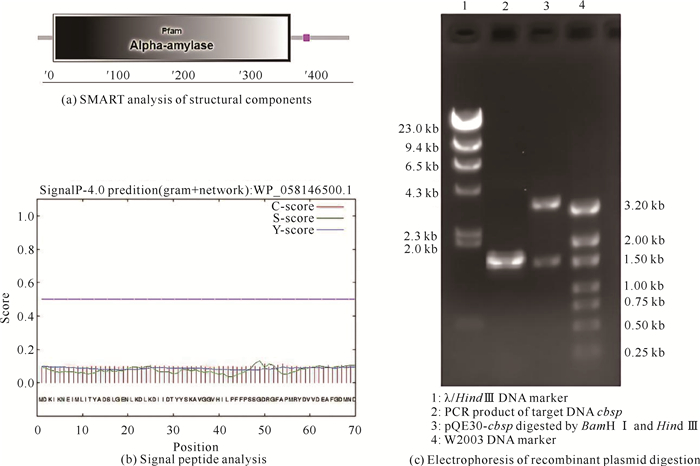
|
| 图 1 蔗糖磷酸化酶生物信息学分析及重组质粒酶切电泳图 Fig. 1 Bioinformatics analysis of sucrose phosphorylase and electrophoresis map of recombinant plasmid digestion |
2.2 重组菌株的诱导表达与纯化
如图 2所示,含有重组质粒的菌株和重组酶Cbsp纯化物在约55 kDa大小处均有明显的蛋白质特征条带,与理论分子质量一致,可进行下一步测定。
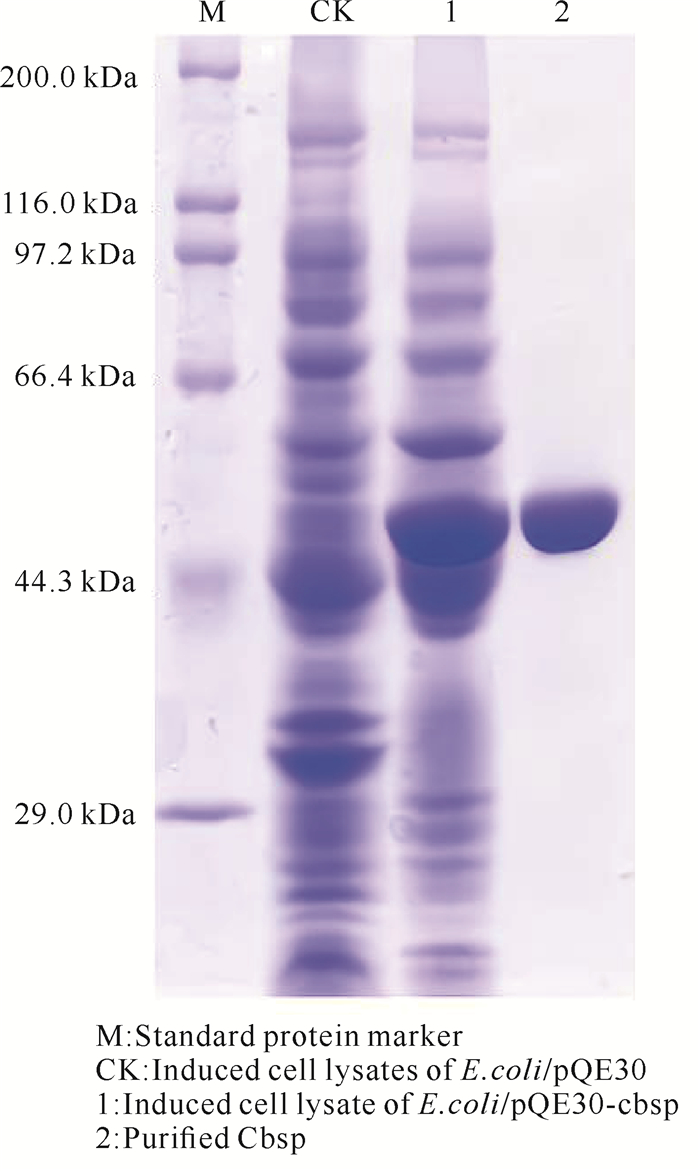
|
| 图 2 Cbsp的SDS-PAGE分析 Fig. 2 SDS-PAGE analysis of Cbsp |
2.3 重组酶Cbsp的酶学性质分析 2.3.1 温度和pH值对酶活力的影响
如图 3(a)所示,Cbsp的最适pH值为7.0,在pH值为6.0-7.5时可以保持60%以上的相对酶活力,当pH值大于7.5时,Cbsp酶活力急剧下降;当pH值达到8.0时,Cbsp仅剩20%左右的相对酶活力。如图 3(b)所示,Cbsp的最适温度为45℃,在35-50℃时能保持40%以上的相对酶活力,当温度大于55℃时则完全失活,说明Cbsp热稳定性不佳,会对后续相关功能的研究造成一定的影响。如图 3(c)(d)所示,在35℃、40℃和4℃条件下保存36 h,Cbsp的相对酶活力仍然可以保持在80%以上,在45℃条件下保存42 h后,酶活力完全丧失,半衰期为210.4 min;在50℃保存0.5 h相对酶活力仅残余20%,1 h后酶活力完全失去,半衰期为9.57 min。如图 3(d)所示,Cbsp在pH值为6.5-9.0时酶活力较为稳定,能够保持80%以上的相对酶活力,表现出较好的碱耐受性。
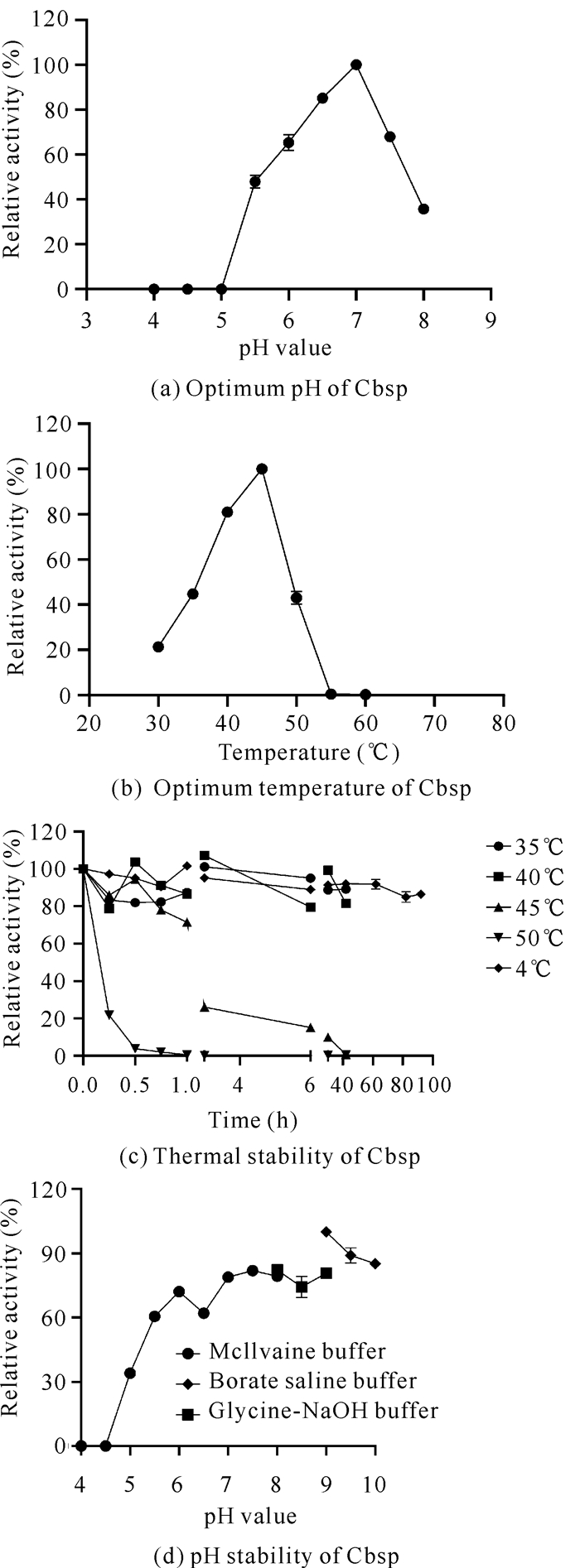
|
| 图 3 pH值和温度对Cbsp的影响 Fig. 3 Effect of pH value and temperature on Cbsp |
2.3.2 重组酶Cbsp的Km和Vmax
利用软件GraphPad Prism 5,通过双倒数作图法拟合出Cbsp的Km为(62.4±4.749) mmol·L-1,Vmax为(957±23.29) μmol·mg-1·min-1,如图 4所示。
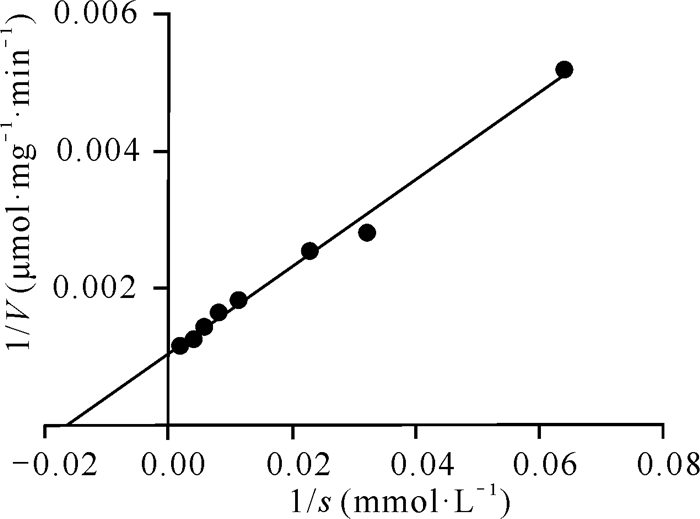
|
| 图 4 Cbsp的Km和Vmax Fig. 4 Km and Vmax of Cbsp |
2.3.3 化学试剂对酶活力的影响
如图 5: (a)-(c)所示,除了低浓度的DMSO和甲醇对酶活力有轻微的促进作用外,其他一元醇、二元醇和有机试剂都不同程度地抑制酶活力,并且抑制强度随有机试剂浓度的增大而增强。如图 5(d)所示,1% Triton X-100、5% Tween-80和20 mmol·L-1 DTT对于酶活力具有促进作用,其中20 mmol·L-1 DTT可明显提高酶活力;0.05% SDS和4 mol·L-1脲则使酶完全失去活力。由此可知,后续研究可以通过试剂来增强重组酶的酶活力,促进底物的溶解,进而提高其转化效率。
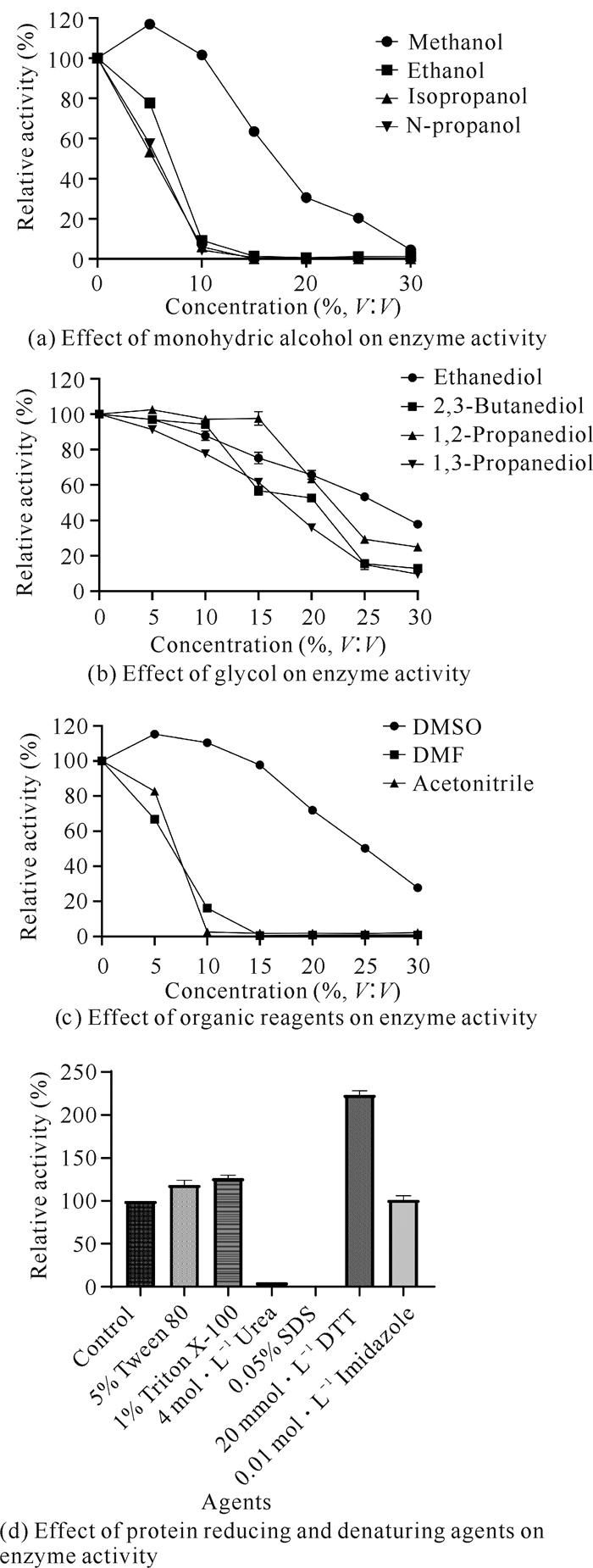
|
| 图 5 化学试剂对于Cbsp的影响 Fig. 5 Effect of chemical reagents on Cbsp |
2.4 转糖苷功能的测定
以终浓度15%的G-1-P为糖基供体时,Cbsp对D-阿拉伯糖、L-阿拉伯糖、D-果糖、D-半乳糖、D-甘露糖、L-山梨糖、木糖醇、1, 2-丙二醇、1, 3-丙二醇、2, 3-丁二醇、乙二醇、丙三醇、L-抗坏血酸、(-)-儿茶素和己基-β-D-吡喃葡萄糖苷都具有转糖苷活性;以终浓度8%的蔗糖为供体时,Cbsp仅对己基-β-D-吡喃葡萄糖苷和(-)-儿茶素有转糖苷活性。其中以终浓度8%的蔗糖为糖基供体时,Cbsp对终浓度1%的己基-β-D-吡喃葡萄糖苷具有较高的转糖苷能力,转糖苷产物检测结果如图 6所示。从图 6可知,以终浓度8%的蔗糖为糖基供体时,Cbsp对己基-β-D-吡喃葡萄糖苷的转糖苷效率为42.0%[图 6(a)箭头所指为转糖苷产物]。而当以终浓度15%的G-1-P为糖基供体时,己基-β-D-吡喃葡萄糖苷的转化率为5.5%[图 6(b)箭头所指为转糖苷产物],远远低于以蔗糖为糖基供体时的转化效率。另外,Cbsp只有在以蔗糖为糖基供体时才对(-)-儿茶素具有转糖苷活性,其结果如图 7所示。从图 7可以看出Cbsp催化(-)-儿茶素转糖苷生成了儿茶素葡萄糖苷[图 7(a)箭头所指],经计算其转化率约为6.8%。
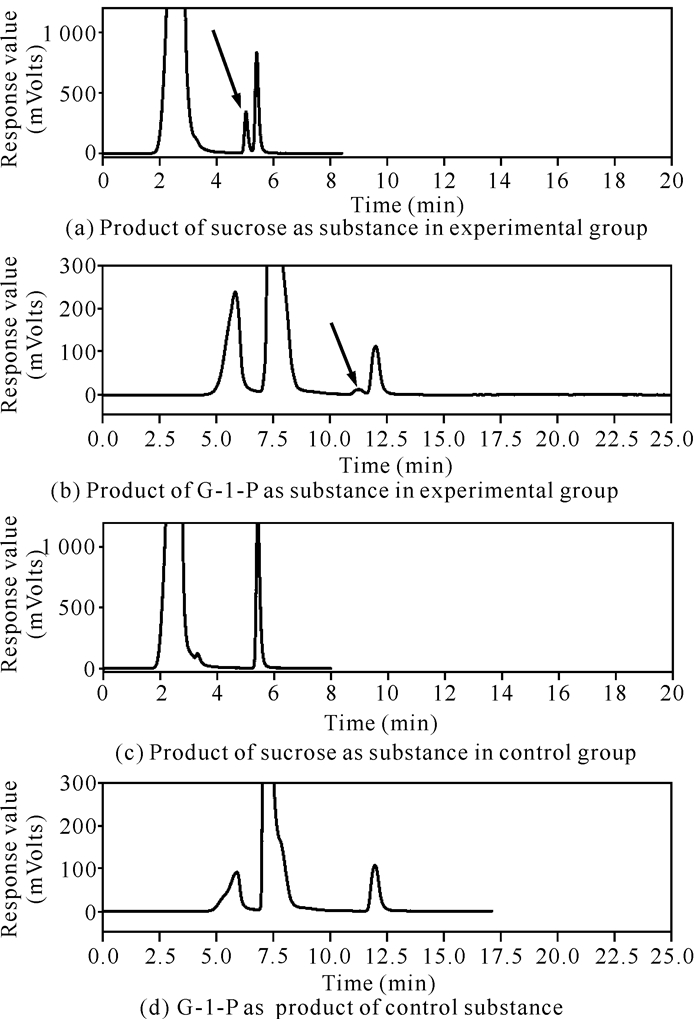
|
| 图 6 以己基-β-D-吡喃葡萄糖苷为受体时Cbsp的转糖苷产物分析 Fig. 6 Transglycosylation product analysis of Hexyl β-D-glucopyranoside as receptor by Cbsp |
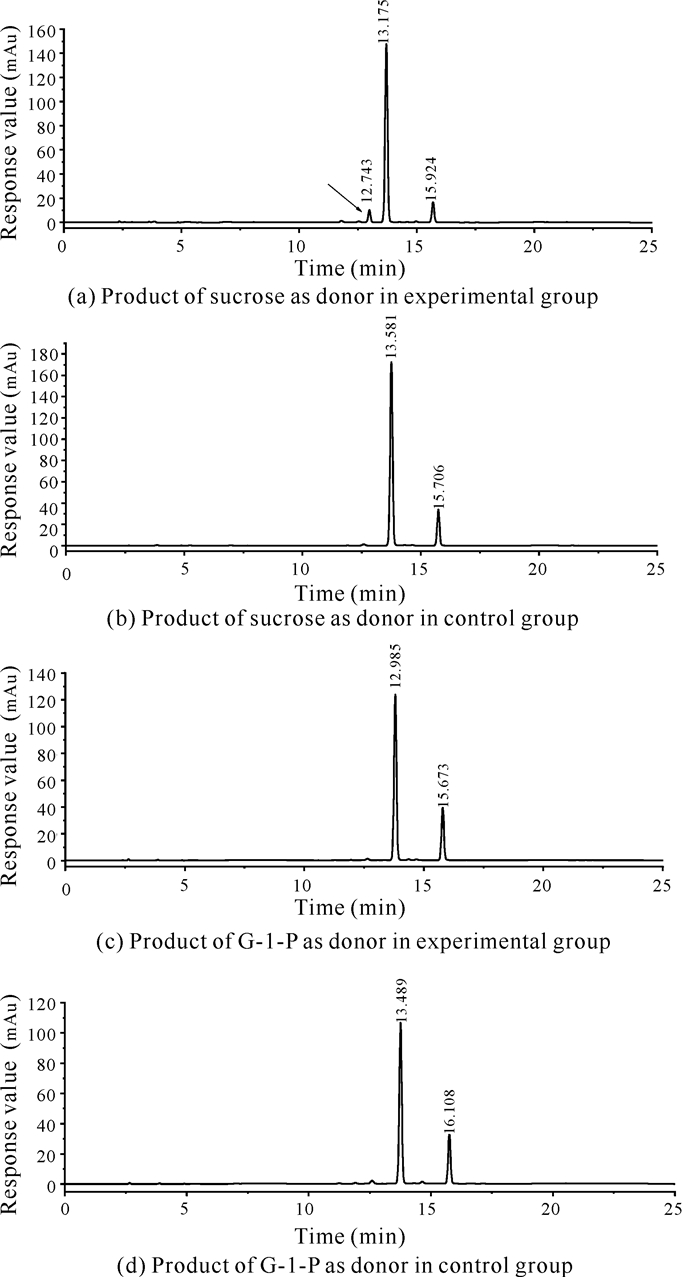
|
| 图 7 以-(-)儿茶素为受体时Cbsp的转糖苷产物分析 Fig. 7 Transglycosylation product analysis of (-)-catechin as receptor by Cbsp |
3 讨论
如今,随着蔗糖磷酸化酶的应用愈加广泛,对于其性能的研究需求也越来越大。何贺贺等[19]研究发现来自肠膜明串珠菌Leuconostoc mesenteroides的蔗糖磷酸化酶的最适反应温度为37℃,来源于Bacillus megaterium NCIB 8508的蔗糖磷酸化酶最适反应温度为50℃。来自Bifidobacterium longum的蔗糖磷酸化酶在20-50℃时,相对酶活性为98%以上;在60-90℃时,相对酶活性为70%以上[18]。本研究中的重组酶Cbsp最适反应温度是45℃,在40℃以下保存36 h时酶只有80%的相对活性,一旦温度上升到50℃且只保存1 h酶便会完全失活。这些研究不仅表明了不同的来源会造成酶活力的差异,而且还说明了大多数的蔗糖磷酸化酶都不是嗜热型酶。
本研究中的Cbsp与Kitao等[20]报道的来自肠膜明串珠菌的蔗糖磷酸化酶相比,都对部分单糖及糖醇类具有受体特异性,有利于对人体健康十分有帮助的益生元低聚糖如曲二糖等的合成,这些益生元通过蔗糖磷酸化酶转糖苷功能来催化合成,极大地降低了工业成本,带来非常大的经济效益。另外,本研究中的重组酶Cbsp还对烷基糖苷类物质己基-β-D-吡喃葡萄糖苷具有42.0%的转糖苷效率,能够有效地发生转糖苷反应,得到的产物可以作为一类具有低刺激度、可生物降解、毒性低、无污染等优良性状的新型的非离子表面活性剂,在食品、洗涤剂、农药和医疗等领域展现出广阔的应用前景[21]。
本研究的重组酶Cbsp虽对(-)-儿茶素具有转糖苷活性,但转化率仅有6.8%,而且部分受体底物无法发生转糖苷反应,可能是由于受体亲和力太低,无法与反应系统中的水分子等其他物质竞争结合位点。De Winter等[22]利用液态双相体系进行糖基化转换,大大提高了转糖苷效率,证明了亲和力低会影响糖基化反应。因此,水相系统、非水相系统和微水相系统等不同的反应系统对转糖苷反应有明显的影响。下一步可改善反应体系,以提高转糖苷活性。
4 结论本研究克隆了来源于丁酸梭菌DSM10702中的蔗糖磷酸化酶基因cbsp,并在感受态细胞E.coli XL1-blue中成功实现了异源表达。重组酶蛋白分子质量大小约为55 kDa。以蔗糖为底物时,蔗糖磷酸化酶最适反应温度为45℃,最适pH值为7.0,在35-45℃、pH值6.0-9.0条件下能保持酶活力稳定;Km为(62.4±4.749) mmol·L-1,Vmax为(957±23.29) μmol·mg-1·min-1。当G-1-P为糖基供体时,Cbsp对于大部分单糖及糖醇类受体表现出转糖苷活性,对(-)-儿茶素、己基-β-D-吡喃葡萄糖苷和L-抗坏血酸表现出一定程度的转糖苷活性。对来自丁酸梭菌的蔗糖磷酸化酶的酶学性质的研究,为蔗糖磷酸化酶相关数据库增添了新的内容,但相比之下,重组酶Cbsp相对较弱的热稳定性十分不利于工业应用,未来可加强这方面的研究改造。
| [1] |
杨荣玲, 吴婷婷, 赵祥杰, 等. 糖苷类化合物非水相生物催化结构修饰的研究进展[J]. 生物质化学工程, 2020, 54(3): 54-60. |
| [2] |
LALITHA K, MUTHUSAMY K, PRASADY S, et al. Recent developments in β-C-glycosides: synthesis and applications[J]. Carbohydrate Research, 2015, 402: 158-171. DOI:10.1016/j.carres.2014.10.008 |
| [3] |
GUO N, JIN C, SHEN L, et al. Chemical components, pharmacological actions, and clinical applications of Rhizoma Picrorhizae[J]. Phytotherapy Research, 2020, 34(5): 1071-1082. DOI:10.1002/ptr.6591 |
| [4] |
雷田, 康小东, 李鸿鹏, 等. 路易斯酸催化的芳基C-糖苷化研究进展[J]. 有机化学研究, 2019, 7(3): 95-102. |
| [5] |
林俊芳, 谢露, 郭丽琼, 等. 重组蔗糖磷酸化酶在制备功能性低聚糖中的应用: 106367458[P]. 2017-02-01.
|
| [6] |
ZHU X T, TIAN Y Q, ZHANG W, et al. Recent progress on biological production of α-arbutin[J]. Applied Microbiology and Biotechnology, 2018, 102(19): 8145-8152. DOI:10.1007/s00253-018-9241-9 |
| [7] |
OJHA S, MISHRAS, KAPOOR S, et al. Synthesis of hexyl α-glucoside and α-polyglucosides by a novel Microbacterium isolate[J]. Applied Microbiology and Biotechnology, 2013, 97(12): 5293-5301. DOI:10.1007/s00253-013-4855-4 |
| [8] |
LEE J H, MOON Y H, KIM N, et al. Cloning and expression of the sucrose phosphorylase gene from Leuconostoc mesenteroides in Escherichia coli[J]. Biotechnology Letters, 2008, 30(4): 749-754. DOI:10.1007/s10529-007-9608-y |
| [9] |
CERDOBBEL A, DE WINTER K, DESMET T, et al. Sucrose phosphorylase as cross-linked enzyme aggregate: Improved thermal stability for industrial applications[J]. Biotechnology Journal, 2010, 5(11): 1192-1197. DOI:10.1002/biot.201000202 |
| [10] |
CERDOBBEL A, DE WINTER K, AERTS D, et al. Increasing the thermostability of sucrose phosphorylase by a combination of sequence- and structure-based mutagenesis[J]. Protein Engineering Design and Selection Peds, 2011, 24(11): 829-834. DOI:10.1093/protein/gzr042 |
| [11] |
WANG M, WU J, WU D. Cloning and expression of the sucrose phosphorylase gene in Bacillus subtilis and synthesis of kojibiose using the recombinant enzyme[J]. Microbial Cell Factories, 2018, 17: 23. DOI:10.1186/s12934-017-0842-2 |
| [12] |
江瑞妮, 叶康, 甘恬, 等. 蔗糖磷酸化酶及其在糖基化反应中的应用[J]. 生物工程学报, 2021, 37(1): 112-129. |
| [13] |
GUDIMINCHI R K, NIDETZKY B. Walking a fine line with sucrose phosphorylase: efficient single-step biocatalytic production of l-ascorbic acid 2-glucoside from sucrose[J]. ChemBioChem, 2017, 18(14): 1387-1390. DOI:10.1002/cbic.201700215 |
| [14] |
KITAO S, ARIGA T, MATSUDO T, et al. The syntheses of catechin-glucosides by transglycosylation with Leuconostoc mesenteroides sucrose phosphorylase[J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(12): 2010-2015. DOI:10.1271/bbb.57.2010 |
| [15] |
DE WINTER K, DEWITTE G, DIRKS-HOFMEISTER M E, et al. Enzymatic glycosylation of phenolic antioxidants: Phosphorylase-mediated synthesis and characterization[J]. Journal of Agricultural and Food Chemistry, 2015, 63(46): 10131-10139. DOI:10.1021/acs.jafc.5b04380 |
| [16] |
GUO Q, ZHANG T, WANG N, et al. RQ3, a natural rebaudioside D isomer, was obtained from Glucosylation of rebaudioside a catalyzed by the CGTase Toruzyme 3.0 L[J]. Journal of Agricultural and Food Chemistry, 2019, 67(28): 8020-8028. DOI:10.1021/acs.jafc.9b02545 |
| [17] |
封悦洋, 王颖, 姚明东, 等. 生物合成槲皮素糖苷类衍生物的研究进展[J]. 化工学报, 2020, 71(7): 2945-2955. |
| [18] |
CHOI H C, SEO D H, JUNG J H, et al. Development of new assay for sucrose phosphorylase and its application to the characterization of Bifidobacterium longum SJ32 sucrose phosphorylase[J]. Food Science and Biotechnology, 2011, 20(2): 513-518. DOI:10.1007/s10068-011-0071-0 |
| [19] |
何贺贺, 林厚民, 寇力丹, 等. 肠膜明串珠菌ATCC 12291蔗糖磷酸化酶的酶学性质及转糖苷分子改造[J]. 食品科学, 2019, 40(20): 122-129. |
| [20] |
KITAO S, SEKINE H. Transglucosylation catalyzed by sucrose phosphorylase from Leuconostoc mesenteroides and production of glucosyl-xylitol[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(12): 2011-2014. DOI:10.1271/bbb.56.2011 |
| [21] |
刘灯峰, 陈朗秋, 李宏伟, 等. 烷基-β-D-吡喃葡萄糖苷的合成与性能[J]. 应用化学, 2013, 30(10): 1120-1126. |
| [22] |
DE WINTER K, DESMET T, DEVLAMYNCK T, et al. Biphasic catalysis with disaccharide phosphorylases: chemoenzymatic synthesis of α-D-glucosides using sucrose phosphorylase[J]. Organic Process Research and Development, 2014, 18(6): 781-787. |



