2. 江苏省海洋水产研究所,江苏南通 226007;
3. 江苏农垦金鲤渔业有限公司,江苏盐城 224500
2. Jiangsu Marine Fisheries Research Institute, Nantong, Jiangsu, 226007, China;
3. Jiangsu Agricultural Reclamation Golden Carp Fishery Company Limited, Yancheng, Jiangsu, 224500, China
急性肝胰腺坏死病(Acute Hepatopancreatic Necrosis Disease,AHPND)是一种新出现的对虾病害,可感染凡纳滨对虾(Penaeus vannamei)、斑节对虾(Penaeus monodon)和中国对虾(Fenneropenaeus chinensis),死亡率为70%-100%[1]。据相关研究表明,AHPND病原为携带一个69 kD的pVA1质粒,可编码pirA、pirB毒力基因的一类弧菌(VPAHPND),通过基因重组和敲除技术,发现pirA和pirB的突变导致菌株致病力消失,证明PirA和PirB毒力蛋白是引起AHPND的主要致病因子[2]。Victorio-De Los Santos等[3]通过克隆重组PirA和PirB毒力蛋白,发现PirB亚基是一种特异性氨基糖凝集素,可与虾肝胰腺上皮细胞膜上受体分子结合,从而触发细胞大量脱落,这进一步证实了PirA、PirB毒力蛋白是AHPND的关键致病因子。
研究发现pirA和pirB毒力基因共同位于1 665 bp的基因片段上,pirA(336 bp)与pirB(1 317 bp)基因之间相隔12 bp基因序列,该序列分析结果与荧光发光杆菌(Photorhabdus)的pirA2B2[4]和致病杆菌属(Xenorhabdus)的pirAB[5]基因相似,二者都利用自身的启动子进行表达,重组表达产生的PirAB毒素对四龄棉铃虫(Helicoverpa armigera)具有较强的杀虫毒性[6]。Sirikharin等[7]将pirA和pirB基因片段分别克隆并连接到pET-17b载体和pGEX-4T-1载体,并在大肠杆菌(Escherichia coli) BL-21(DE3)中表达,结果发现单独表达pirA或pirB基因所得到的蛋白没有毒性或毒性较低,猜测PirA和PirB重组蛋白需要结合才能诱发AHPND的典型症状。然而,诱导死亡所需的重组PirA和重组PirB组合的数量相对较高,其次表达载体、重组蛋白的构建方法和表达细胞系的选择不同,可能导致重组蛋白的构象和活性发生变化,影响毒力大小[7-10],最后PirA和PirB在致病机制中的作用尚未完全确定。本研究通过PCR扩增获得VPAHPND的毒力基因,克隆并连接到pET 21b(+)原核表达载体上,并进行原核表达和纯化,以获取大量PirA、PirB及PirAB蛋白,为下一步的PirA/PirB毒力和抗体的研究积累技术基础。
1 材料与方法 1.1 菌株和质粒VPAHPND菌株(编号1669)和表达质粒pET 21b(+)由江苏省海洋水产研究所生物技术室保存并提供,克隆菌株E.coli Top10、表达菌株E.coli BL-21(DE3)购自南京诺唯赞生物科技股份有限公司。
1.2 试剂及仪器高分子量蛋白marker、2×Taq PCR MasterMix、DNA分子量marker、Nhel和Scal限制性内切酶、异丙基硫代半乳糖苷(Isopropyl β-D-thiogalactoside, IPTG)、辣根过氧化氢酶DAB显色试剂盒、Mag-Beads His-Tag蛋白纯化磁珠、硝酸纤维素印迹膜(NC印迹膜)、10×TBST WB漂洗液购自生工生物工程(上海)股份有限公司;细菌基因组DNA提取试剂盒、DNA纯化回收试剂盒购自天根生化(北京)科技有限公司;兔抗(PirA和PirB)一抗、山羊抗兔IgG二抗(辣根过氧化物酶HRP标记)购自康为世纪生物科技有限公司,ClonExpressⅡ重组克隆试剂盒购自南京诺唯赞生物科技股份有限公司;SDS-PAGE凝胶制备试剂盒购自北京索莱宝科技有限公司。蛋白电泳槽(DYCZ-24DN)、湿转仪(DYCZ-4OD)购自北京六一生物科技有限公司;冷冻离心机、PCR仪、移液枪均购自德国艾本德公司(Eppendorf);超微量分光光度计(DeNovix DS-11)购自广州市深华生物技术有限公司。
1.3 方法 1.3.1 目的片段的扩增将经平板纯化的VPAHPND 1669菌种转接到LB液体培养基,28℃、200 r/min培养16 h,6 000 g离心收集菌体,采用细菌基因组DNA提取试剂盒提取DNA。根据GenBank登录的pirAB基因(NC_025152.1)序列设计3对引物,分别用于扩增pirA、pirB、pirAB (表 1)。下划线分别为Nhel、Scal两个酶切位点。pirA引物:pirA-F-Nhel/pirA-R-Scal,pirB引物:pirB-F-Nhel/pirB-R-Scal,pirAB引物:pirAB-F-Nhel/pirAB-R-Scal。反应体系:2×Taq PCR MasterMix 12.5 μL,DNA模板1 μL,上下游引物各1 μL (10 μmol/L),ddH2O 9.5 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸60 s,共30个循环;最后72℃终延伸10 min。扩增产物经1%琼脂糖凝胶电泳鉴定后,用DNA纯化回收试剂盒纯化并回收目的片段。
| 引物名称 Primer name |
引物序列(5′→3′) Primer sequence (5′→3′) |
| pirA-F-Nhel | GGAGATATACATATGGCTAGCATGAGTAACAATATAAAACATGAAACTGACT |
| pirA-R-Scal | GCAAGCTTGTCGACGGAGCTCTTAGTGGTAATAGATTGTACAGAAACCACG |
| pirB-F-Nhel | GGAGATATACATATGGCTAGCATGACTAACGAATACGTTGTAACAATGT |
| pirB-R-Scal | GCAAGCTTGTCGACGGAGCTCCTACTTTTCTGTACCAAATTCATCGG |
| pirAB-F-Nhel | GGAGATATACATATGGCTAGCATGAGTAACAATATAAAACATGAAACTGACT |
| pirAB-R-Scal | GCAAGCTTGTCGACGGAGCTCCTACTTTTCTGTACCAAATTCATCGG |
1.3.2 重组表达质粒的构建
使用Nhel和Scal限制性内切酶酶切载体pET 21b(+),酶切体系:ddH2O 11 μL,载体30 μL,10×QuickCut Buffer 5 μL,Nhel和Scal各2 μL;酶切反应条件:37℃水浴2 h。酶切产物经1%琼脂糖凝胶电泳鉴定,用DNA回收试剂盒纯化并回收目的片段。利用ClonExpressⅡ重组克隆试剂盒将pirA、pirB和pirAB的PCR扩增DNA片段连接到质粒载体pET 21b(+),将连接产物转化到感受态细胞Top10中,涂布于含有100 μg/mL氨苄青霉素(Amp)的LB平板上,37℃过夜培养后,挑取单克隆进行Nhel和Scal双酶切验证,验证正确的质粒送南京擎科生物科技有限公司测序。将鉴定正确的重组表达质粒转入E.coli BL21 (DE3)中,涂布于LB平板(添加100 μg/mL Amp),37℃过夜培养,挑取单克隆菌落送南京擎科生物科技有限公司测序,进一步验证连接的正确性及所克隆基因的完整性。
1.3.3 重组蛋白表达条件的优化将鉴定正确的重组菌接种至含100 μg/mL Amp的LB液体培养基,37℃、200 r/min摇床培养过夜。为得到高浓度的重组蛋白,对诱导表达过程中的IPTG浓度、诱导温度和诱导时间进行优化。时间和温度优化:在1.0 mmol/L IPTG浓度下,分别于20℃、25℃和30℃条件下,以150 r/min摇床培养4 h、8 h、12 h、16 h、20 h和24 h,各取2 mL菌液进行检测。IPTG浓度优化:分别以0.01 mmol/L、0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L和2.0 mmol/L IPTG于20℃、150 r/min诱导16 h,各取2 mL菌液,离心弃上清。将菌体用0.01 mol/L PBS缓冲液重悬,冰浴超声波破碎菌体,超声条件:45 W、超声5 s停5 s, 总时间5 min,超声后4℃、10 000 r/min离心10 min,分别取其上清液和沉淀进行SDS-PAGE电泳分析,确定最佳诱导条件。
1.3.4 重组蛋白的纯化与分析按1∶100体积比接种过夜培养的重组菌液于500 mL含100 μg/mL Amp的LB液体培养基中,160 r/min、37℃培养菌液至OD600为0.6-0.8;以实验确定的诱导时间、温度、IPTG浓度诱导表达重组蛋白。诱导表达结束后,10 000 g离心10 min收取菌体,并用0.01 mol/L PBS重悬菌体进行超声波破碎,10 000 g离心10 min收取上清液。按照Mag-Beads His-Tag蛋白纯化磁珠说明书进行操作,使用含有不同浓度咪唑(5 mmol/L、10 mmol/L、20 mmol/L、50 mmol/L、500 mmol/L)的洗脱缓冲液进行目标蛋白纯化,并收集洗脱液。纯化的蛋白进行SDS-PAGE电泳分析,并采用超微量分光光度计测定其蛋白质含量。
1.3.5 Western blot检测重组蛋白表达纯化蛋白经12% SDS-PAGE分离,转移至硝酸纤维素膜,用5%脱脂牛奶于室温封闭过夜;用1×TBST WB漂洗液洗涤3次,每次5 min;加入兔抗(PirA和PirB)一抗(1∶1 000稀释),室温孵育2-3 h;1×TBST WB漂洗液洗涤3次,每次5 min,加入辣根过氧化物酶HRP标记的山羊抗兔IgG二抗(1∶4 000稀释),于室温孵育1 h;1×TBST漂洗液洗涤3次,每次10 min。最后用辣根过氧化氢酶DAB显色试剂盒底物显色液显色,观察结果。
2 结果与分析 2.1 表达菌株的构建pirA、pirB及pirAB扩增片段分别为336 bp、1 317 bp、1 665 bp,与预测目的条带大小一致[图 1(a)];空载质粒pET 21b(+)双酶切后全长为5 442 bp [图 1(b)];将目的片段和双酶切后的pET 21b(+)质粒载体连接后,获取重组质粒pET21b-pirA、pET 21b-pirB、pET21b-pirAB,经双酶切验证,条带大小与预测一致[图 1(c)]。经测序结果分析,pirA、pirB和pirAB序列成功克隆至载体质粒中。

|
| M: DNA marker, (a) Electrophoresis of PCR amplified fragments, (b) Double enzyme digestion of pET 21b(+) vector fragments, (c) Double enzyme digestion of recombinant plasmi 图 1 重组表达质粒pET 21b-pirA、pET 21b-pirB、和pET 21b-pirAB的构建 Fig. 1 Construction of recombinant expression plasmids pET 21b-pirA, pET 21b-pirB, and pET 21b-pirAB |
2.2 重组蛋白表达分析 2.2.1 IPTG浓度对诱导表达的影响
PirA (17 kDa)、PirB (50 kDa)及PirAB (50+17) kDa在8个浓度梯度组中均呈现清晰的目的条带,表明8个浓度的IPTG都能诱导重组PirA、PirB和PirAB蛋白的表达,PirB和PirAB在不添加IPTG的情况下也能成功表达(图 2)。重组蛋白PirB和PirAB在IPTG浓度为0时的表达量显著低于IPTG浓度为0.01 mmol/L的表达量(图 3),其他浓度的IPTG对重组蛋白表达量影响较小。因此,确定诱导重组蛋白PirA、PirB和PirAB表达的IPTG最适浓度为0.01 mmol/L。

|
| M: Protein molecular weight standard; 1-9:Supernatant of induced bacterial crushing solution (IPTG concentrations were 0 mmol/L, 0.01 mmol/L, 0.1 mmol/L, 0.2 mmol/L, 0.4 mmol/L, 0.6 mmol/L, 0.8 mmol/L, 1.0 mmol/L, 2.0 mmol/L, respectively); The target protein is shown in the frame 图 2 IPTG浓度对重组蛋白表达的影响 Fig. 2 Effect of IPTG concentration on the expression of recombinant protein |

|
| M: Protein molecular weight standard; 1:IPTG concentration of 0.01 mmol/L; 2:IPTG concentration of 0 mmol/L 图 3 PirB和PirAB蛋白的Western blot鉴定结果 Fig. 3 Western blot identification results of PirB and PirAB protein |
2.2.2 诱导温度和时间对诱导表达的影响
重组表达的温度和诱导时间结果表明,随着诱导时间的延长,重组蛋白PirA和PirAB表达量显著上升,并于24 h达到峰值;重组蛋白PirB的表达量在诱导4 h后没有显著变化(图 4)。重组蛋白在20℃、25℃和30℃条件下均能较好地表达,细菌裂解液的上清液和沉淀中都能观察到目的条带,根据目的条带的粗细可知,80%左右的重组蛋白为可溶性表达(图 4)。如图 4:(j)-(l)所示,在20℃、25℃、30℃条件下,PirA和PirAB诱导24 h,PirB诱导4 h时,上清液样品SDS-PAGE结果中30℃诱导培养时重组蛋白PirA、PirB和PirAB表达量最大。以上结果表明,30℃为PirA、PirB和PirAB重组蛋白的最适诱导温度,重组蛋白PirA和PirAB的最适诱导时间为24 h,重组蛋白PirB的最适诱导时间为4 h。
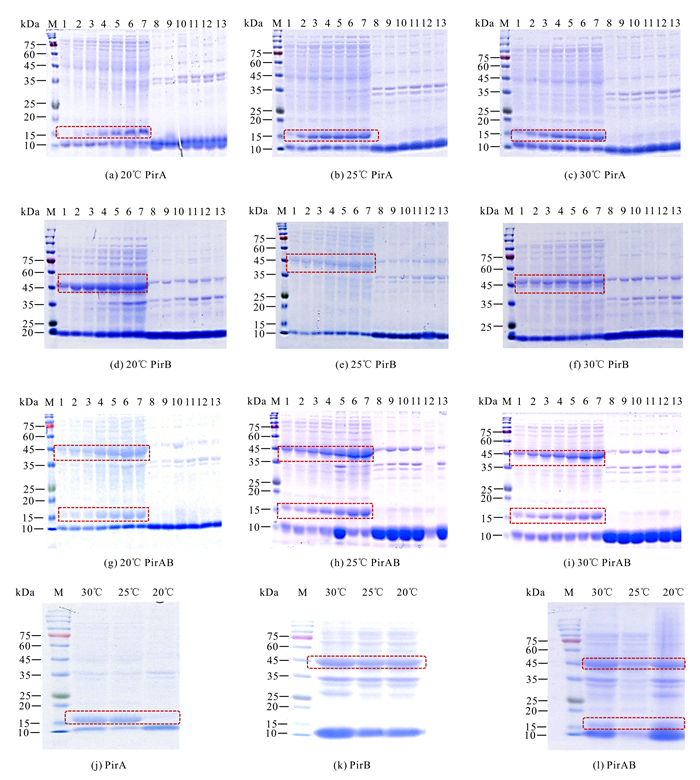
|
| M: Protein molecular weight standard; 1:Broken liquid of uninduced bacteria; 2-7:Supernatant of the disrupted liquid of induced bacteria (times are 4 h, 8 h, 12 h, 16 h, 18 h, 24 h, respectively); 8-13:Broken induced bacteria liquid precipitation (times are 4 h, 8 h, 12 h, 16 h, 18 h, 24 h, respectively); The target protein is shown in the frame 图 4 诱导时间和温度对重组蛋白PirA、PirB和PirAB表达的影响 Fig. 4 Effect of induction time and temperature on the expression of recombinant proteins PirA, PirB and PirAB |
2.3 重组蛋白纯化及浓度测定
重组蛋白经纯化后浓度为1.2-2.0 mg/mL,PirA、PirB重组蛋白经10 mmol/L咪唑洗脱后能得到高纯度蛋白,PirAB经20 mmol/L、50 mmol/L、500 mmol/L咪唑洗脱液后均能得到高纯度蛋白,获得的3种高纯度重组蛋白均可满足多克隆抗体制备的要求(图 5)。
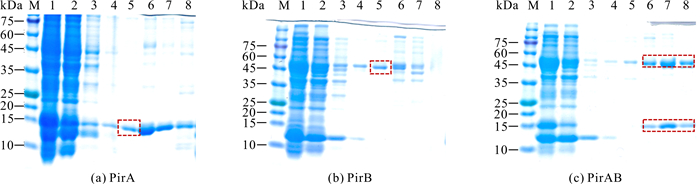
|
| M: protein molecular weight standard; 1:Unpurified crude protein; 2, 3:Wash miscellaneous liquid; 4-8:Eluent (imidazole concentration is 5 mmol/L, 10 mmol/L, 20 mmol/L, 50 mmol/L, 500 mmol/L); The target protein is shown in the frame 图 5 PirA、PirB和PirAB蛋白纯化产物的SDS-PAGE电泳分析 Fig. 5 SDS-PAGE electrophoresis analysis of purification products of proteins PirA, PirB and PirAB |
2.4 Western blot检测重组蛋白表达
Western blot检测结果显示,PirA、PirB及PirAB分别在17 kDa、50 kDa及(50+17) kDa附近显色(图 6),与预测蛋白大小一致,表明所获得的纯化重组蛋白均具有较好的免疫原性。

|
| M: protein molecular weight standard; 1:PirAB; 2:PirA; 3:PirB 图 6 PirA、PirB和PirAB蛋白纯化产物Western blot分析 Fig. 6 Western blot analysis of purified products of proteins PirA, PirB and PirAB |
3 讨论
AHPND主要致病因子为毒力蛋白PirAB,大量获取该蛋白的方式主要为硫酸铵沉淀法和异源表达。致病菌菌体中毒力蛋白PirAB表达量少,硫酸铵沉淀法获得的毒力蛋白杂蛋白多,后期纯化复杂,不利于后期的攻毒实验。原核表达系统可以目标明确地获得大量融合蛋白,通过亲和层析纯化,可有效降低杂蛋白含量,获得高纯度重组目的蛋白[11]。本研究直接将pirAB的全序列插入含有6个His标签的pET 21b(+)载体中,然后将重组质粒转入E.coli BL21(DE3),并对重组菌种的表达条件进行优化,最后成功表达了PirA、PirB和PirAB重组蛋白。
诱导剂IPTG为乳糖类似物,不受细胞代谢的影响,但IPTG对E.coli生长亦存在抑制作用,因此,在不影响融合蛋白表达的基础上应选用最小的剂量[12]。柴政斌等[13]发现,IPTG浓度对融合蛋白GST-PADI4的表达量无明显影响,但可溶性目的蛋白的比例会随着浓度的升高而增加。在本研究中,IPTG浓度为0时的PirB及PirAB表达量显著低于浓度为0.01 mmol/L的表达量,其他浓度的IPTG对重组蛋白表达量影响较小。另外,相关研究表明,低温诱导蛋白能促进蛋白的正确折叠,从而得到较好的可溶性蛋白,但合成的速率较慢[14]。本研究发现,PirA、PirB和PirAB重组蛋白主要以可溶性蛋白形式存在,不易形成包涵体,尽管不同诱导温度对各重组蛋白的表达影响较小,但在30℃条件下,重组蛋白的表达比例最高。这一结果与叶彩燕[15]诱导表达VPAHPND PirB蛋白的诱导温度一致。
PirAB与苏云金芽孢杆菌(Bacillus thuringiensis,Bt)杀虫蛋白Cry具有较高的同源性,推测PirAB破坏宿主细胞的作用机制与Cry毒素较相似[16]。Lin等[17]的研究表明,在纯化PirA和PirB单体的情况下,两者相互结合的亲合力较低,并提出了这两种二元毒力复合物的异四聚体相互作用模型,认为PirA和PirB蛋白在重组的情况下形成的PirA/PirB复合体才会具有较强的细胞毒性,且PirA/PirB的结构也不稳定。pirA和pirB基因位于毒力质粒(pVA1)的同一个操纵子上[18],理论上认为,这两个基因在共表达情况下才产生PirA和PirB毒素,此时这两者的相互作用才具有较高的细胞毒力[19]。Yang等[5]将嗜线虫致病杆菌(Xenorhabdus nematophila) HB310的pirA基因去除终止密码子后,通过柔性连接子linker与pirB基因连接重组并融合表达了PirAB-fusion蛋白,同时共表达了PirAB蛋白;经针对大蜡螟(Galleria mellonella)的半数致死量(LD50)验证,共表达的PirAB蛋白生物活性比PirA/PirB重组蛋白混合物强,PirAB-fusion蛋白丧失了生物活性。在本研究中,在不去除PirA的终止密码子的前提下,联合表达pirA和pirB基因,得到的重组蛋白PirAB具有17 kDa的PirA蛋白和50 kDa的PirB蛋白,该联合表达蛋白理论上具有较高的细胞毒性,可为后期抗体的研发提供技术资料。
综上所述,本实验在最适诱导条件和高效纯化条件下获得了小批量高纯度的PirA、PirB重组蛋白,并首次共表达了VPAHPND的PirAB蛋白,SDS-PAGE电泳分析表明,表达的3种重组蛋白主要以可溶性形式存在,Western blot分析证实该重组蛋白质具有良好的反应原性。此实验结果为下一步的抗体制备和致病机理研究提供了充足的实验材料,为AHPND的防控研究提供了实践基础。
| [1] |
LIU F, LI S, YU Y, et al. Pathogenicity of a Vibrio owensii strain isolated from Fenneropenaeus chinensis carrying pirAB genes and causing AHPND[J]. Aquaculture, 2021, 530: 735747. DOI:10.1016/j.aquaculture.2020.735747 |
| [2] |
LEE C T, CHEN I T, YANG Y T, et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin[J]. Proceedings of the National Academy of Sciences, 2015, 112(34): 10798-10803. DOI:10.1073/pnas.1503129112 |
| [3] |
VICTORIO-DE LOS SANTOS M, VIBANCO-PÉREZ N, SOTO-RODRIGUEZ S, et al. The B subunit of pirABvp toxin secreted from Vibrio parahaemolyticus causing AHPND is an amino sugar specific lectin[J]. Pathogens, 2020, 9(3): 182. DOI:10.3390/pathogens9030182 |
| [4] |
孙建宇. 荧光发光杆菌TT01菌株pirAB基因的克隆表达及杀虫谱研究[D]. 广州: 中山大学, 2012.
|
| [5] |
YANG Q, ZHANG J, LI T, et al. PirAB protein from Xenorhabdus nematophila HB310 exhibits a binary toxin with insecticidal activity and cytotoxicity in Galleria mellonella[J]. Journal of Invertebrate Pathology, 2017, 148: 43-50. DOI:10.1016/j.jip.2017.04.007 |
| [6] |
郭笑笑, 杨晴, 刘淑琴, 等. 嗜线虫致病杆菌PirAB毒素对棉铃虫相关酶活性的影响[J]. 农业生物技术学报, 2019, 27(7): 1266-1274. |
| [7] |
SIRIKHARIN R, TAENGCHAIYAPHUM S, SANGUANRUT P, et al. Characterization and PCR detection of binary, Pir-like toxins from Vibrio parahaemolyticus isolates that cause acute hepatopancreatic necrosis disease (AHPND) in shrimp[J]. PloS One, 2015, 10(5): e0126987. DOI:10.1371/journal.pone.0126987 |
| [8] |
JOSHI J, SRISALA J, TRUONG V H, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND)[J]. Aquaculture, 2014, 428/429: 297-302. DOI:10.1016/j.aquaculture.2014.03.030 |
| [9] |
FENG B, LIU H, WANG M, et al. Diversity analysis of acute hepatopancreatic necrosis disease-positive Vibrio parahaemolyticus strains[J]. Aquaculture and Fisheries, 2017, 2(6): 278-285. DOI:10.1016/j.aaf.2017.10.001 |
| [10] |
ZHANG D, BADER T J, LANGE M D, et al. Toxicity of recombinant PirA and PirB derived from Vibrio parahaemolyticus in shrimp[J]. Microbial Pathogenesis, 2021, 155: 104886. DOI:10.1016/j.micpath.2021.104886 |
| [11] |
张萌萌, 潘迎捷, 王永杰. 欧文氏弧菌毒力蛋白PirAB的原核表达与纯化[J]. 微生物学杂志, 2019, 39(1): 65-68. |
| [12] |
肖玲玲, 杨洁, 张瑞, 等. IPTG浓度对大肠杆菌中重组GroEL表达的影响[J]. 口腔医学研究, 2017, 33(2): 140-144. |
| [13] |
柴政斌, 张更林, 王学政, 等. 融合蛋白GST-PADI4可溶性表达条件的优化及纯化[J]. 中国生物制品学杂志, 2014, 27(3): 404-408. |
| [14] |
杨晰朦, 陈香梅. 结核分枝杆菌ESAT6-CFP10融合蛋白的原核表达及其表达条件的优化[J]. 中国生物制品学杂志, 2020, 33(3): 286-292. |
| [15] |
叶彩燕. 一例对虾急性肝胰腺坏死症病原分离鉴定及PirB蛋白的功能分析[D]. 成都: 四川农业大学, 2019.
|
| [16] |
LIN S J, HSU K C H, WANG H C. Structural insights into the cytotoxic mechanism of Vibrio parahaemolyticus PirA(vp) and PirB(vp) toxins[J]. Marine Drugs, 2017, 15(12): 373. |
| [17] |
LIN S J, CHEN Y F, HSU K C, et al. Structural insights to the heterotetrameric interaction between the Vibrio parahaemolyticus pirAvp and pirBvp toxins and activation of the cry-like pore-forming domain[J]. Toxins, 2019, 11(4): 233. |
| [18] |
HAN J E, TANG K F, TRAN L H, et al. Photorhabdus insect-related (Pir) toxin-like genes in a plasmid of Vibrio parahaemolyticus, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp[J]. Diseases of Aquatic Organisms, 2015, 113: 33-40. |
| [19] |
SOTO-RODRIGUEZ S A, LOZANO-OLVERA R, MONTFORT G R C, et al. PirAB from Vibrio parahaemolyticus exhibits a binary toxin action with bactericidal activity and cytotoxicity in Penaeus vannamei[J]. Preprints, 2022, 2022010200. DOI:10.20944/preprints202201.0200.v1 |



