面包树(Artocarpus altilis)是桑科(Moraceae)波罗蜜属(Artocarpus)的常绿乔木,因其可食用的果实富含淀粉且具有面包状质地而得名[1-3]。面包树在中国主要分布在海南和台湾等地[3, 4]。面包树的叶、根、茎和皮常被用作热带地区的传统药物,能够缓解哮喘、高血压、腹泻等疾病[5, 6],同时也可用作衣服材料、建筑材料和动物饲料[7, 8]。面包树树叶富含类黄酮、三萜类等二次代谢产物,其中以异戊二烯类黄酮含量最为丰富[9, 10]。许多异戊二烯类黄酮化合物对多种细胞系(如小鼠白血病P388、人体鼻咽癌KB、小鼠L-1210和结肠38等细胞)有较强的细胞毒活性,对花生四烯酸5-脂氧合酶具有抑制作用以及对致龋细菌具有抗菌活性[11]。活性研究结果表明,面包树中的类黄酮单体具有抗氧化、抗炎、抗血小板凝集和抑制组织蛋白酶K等生物活性[12-14]。
类黄酮的提取方法主要包括热水提取法、碱性水溶液提取法、醇提法、超声波辅助提取法、微波提取法、酶解法、回流提取法和大孔树脂吸附法等[15-17]。其中热水提取法仅限于提取黄酮苷类物质,但提取杂质较多,回收率较低。碱性水溶液提取法提取出的类黄酮大多具有酚羟基,呈酸性,易在碱性水溶液或醇溶液浸出,同样存在杂质浸出的问题。醇提法是目前主要的提取方法,一般认为醇浓度增高有利于总类黄酮提取,常见的有冷浸法、渗漉法和回流法。超声波辅助提取法也是目前主流的提取方法,利用超声波的空化作用破坏细胞膜,促进类黄酮释放。此外,根据不同原理,常用的提取手段还包括微波提取法、酶解法和大孔树脂吸附法等。由于各种方法都有各自的优缺点,考虑到提取物的性质、提取成本、工艺设备及类黄酮的提取率等因素,本试验拟采用常温提取法、回流提取法、超声波辅助提取法提取面包树树叶中的总黄酮,通过比较3种不同的提取方法,以类黄酮得率和含量为考察结果,得到最佳的类黄酮提取工艺,同时对提取后的类黄酮成分进行抗氧化活性评价,以期为面包树树叶类黄酮化合物的分离纯化和生物活性评价奠定理论基础。
1 材料与方法 1.1 材料与试剂面包树树叶在2019年采集于海南省保亭黎族苗族自治县保城镇,将采集到的树叶在阴暗条件下自然风干,粉碎机粉碎,晾干贮藏。无水乙醇、冰醋酸、浓盐酸、氢氧化钠、磷酸二氢钾和磷酸氢二钠均购于天津市凯通化学试剂有限公司,2, 2-二苯基-1-间三硝苯基联肼(DPPH)、2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)均购于上海麦克林生化科技有限公司,其余试剂均购于天津市凯通化学试剂有限公司且均为分析纯。
1.2 仪器设备DL-360E型超声波清洗器(上海之信仪器有限公司),BSA124S型电子分析天平[赛多利斯科学仪器(北京)有限公司],752型紫外可见光分光光度仪(上海光谱仪器有限公司)。
1.3 方法 1.3.1 标准曲线制定及类黄酮含量和得率的测定参照Meda等[18]的方法绘制芦丁标准曲线。称取配置的0.2 mg/mL芦丁标准溶液,分别取1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL于10 mL离心管中,加入0.3 mL 5% NaNO2摇匀,静置6 min,再加入0.3 mL 10% AlCl3,静置6 min。然后加入4.0 mL 10% NaOH,用蒸馏水定容至10 mL,静置15 min,于510 nm处测定反应液的吸光度,以吸光值为纵坐标,标准溶液中芦丁的质量浓度为横坐标作标准曲线,根据曲线方程y=1.2457x+0.0171, R2=0.999 8,计算样品中的类黄酮含量。取3组平行实验结果计算类黄酮得率,类黄酮得率的计算公式如下:类黄酮得率(%)=类黄酮浓度C(mg/mL)×提取液总体积V (mL)/样品质量M (g)×103×100%。
1.3.2 不同提取方式对类黄酮得率和含量的影响准确称取面包树树叶粉末10 g,放入500 mL烧杯中,在固液比1∶8 (g/mL)、乙醇溶液体积分数80%、提取时间2 h的条件下进行提取,分别采用以下3种方式:常温提取法、回流提取法(70℃)、超声波辅助提取法(70℃)。将3种提取方式所得的溶液分别在4 000 r/min的转速下离心30 min,旋转蒸发,倒出上清液,水浴加热蒸干后,放入恒温干燥箱得到干燥物,每个处理方式重复3次。按照1.3.1节的方法计算出类黄酮的得率和含量。
1.3.3 单因素试验准确称取干燥的面包树树叶粉末5 g,放入100 mL烧杯中,选取提取时间(20 min、40 min、60 min、80 min、100 min)、固液比[1∶4 (g/mL)、1∶6 (g/mL)、1∶8 (g/mL)、1∶10 (g/mL)、1∶12 (g/mL)]、乙醇体积分数(60%、70%、80%、90%、100%)、提取温度(40℃、50℃、60℃、70℃、80℃、90℃)、提取次数(1次、2次、3次、4次、5次) 5个因素进行单因素试验,按照1.3.2节得到的最佳提取方式进行提取,将所得溶液在4 000 r/min的转速下离心30 min,旋转蒸发,倒出上清液,水浴加热蒸干后放入恒温干燥箱中得到干燥物,平行3次试验。按照1.3.1节的方法计算出类黄酮的得率和含量。
1.3.4 响应面优化按照Box-Benhnken中心组合试验设计原理,采用Design-Expert 8.0.6软件设计响应面试验,在单因素试验的基础上,以提取时间(X1)、乙醇体积分数(X2)、固液比(X3)、提取温度(X4)为自变量。根据前期试验,确定提取时间40-100 min、乙醇体积分数70%-100%、固液比1∶6-1∶12 (g/mL)、提取温度60-90℃为取值区间,并以编码值+1、0、-1分别代表自变量的高、中、低水平。面包树树叶类黄酮得率为YA,试验自变量因素编码及水平见表 1。
| 编码及水平 Coding and level |
X1: 提取时间(min) X1: Extraction time (min) |
X2: 乙醇体积分数(%) X2: Ethanol volume fraction(%) |
X3: 固液比(g/mL) X3: Solid-liquid ratio(g/mL) |
X4: 提取温度(℃) X4: Extraction temperature(℃) |
| -1 | 40 | 70 | 6 | 60 |
| 0 | 70 | 85 | 8 | 75 |
| +1 | 100 | 100 | 12 | 90 |
1.3.5 DPPH自由基清除率测定
参照Thaipong等[19]的测定方法,首先取2 mL不同浓度的样品溶液与2 mL 0.1 mmol/L的DPPH溶液混匀,在黑暗条件下反应30 min,于517 nm测量吸光度(Ai);其次将2 mL不同浓度的样品溶液与2 mL无水乙醇混匀,在黑暗条件下反应30 min,于517 nm测量吸光度(Aj);最后将2 mL 0.1 mmol/L的DPPH无水乙醇溶液与2 mL无水乙醇做对照,在黑暗条件下反应30 min,于517 nm测量吸光度(A0)。DPPH自由基清除率(K)的计算公式如下:K=[1-(Ai-Aj)/A0]×100%。
1.3.6 ABTS+自由基清除率测定参照Re等[20]的测定方法,首先将7 mmol/L ABTS溶液与13.24 mg过硫酸钾混合16 h,生成ABTS+自由基溶液;其次将所得溶液冷藏后稀释,在734 nm处测量吸光度(Xi);然后将1.0 mL不同浓度的样品溶液与1.9 mL ABTS+自由基溶液混合,放置7 min后,于734 nm处测量吸光度(Xj);最后将1.0 mL不同浓度的样品溶液与1.9 mL无水乙醇溶液混合,放置7 min后于734 nm处测量吸光度(X0)。ABTS+自由基清除率(R)的计算公式如下:R=[1-(Xi-Xj)/X0]×100%。
1.4 数据处理采用Design-Exper 8.0.6、Statistix 8软件分析试验数据,采用Graphpad Prism 7软件绘图。
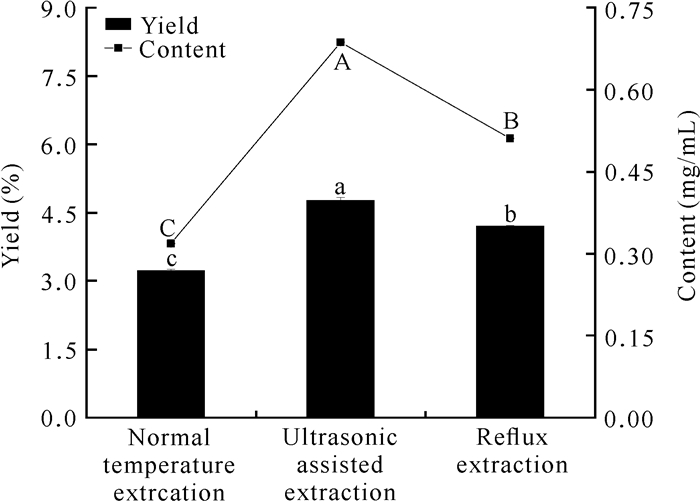
2 结果与分析 2.1 提取方式对面包树树叶类黄酮得率和含量的影响使用不同的提取方式测定面包树树叶中的类黄酮得率和含量的结果如图 1所示。常温提取下的类黄酮得率为3.23%,类黄酮含量为0.318 5 mg/mL。超声波辅助提取下的类黄酮得率为4.77%,含量为0.686 8 mg/mL,回流提取方式下的类黄酮得率为4.21%,含量为0.510 8 mg/mL。通过比较可以看出,超声波辅助提取法在类黄酮得率及含量两个指标上均高于其他两种方式,因此采用超声波辅助提取法进行下一步试验。
|
| Different letters indicate significant differences (P < 0.05) 图 1 提取方式对面包树树叶类黄酮得率及含量的影响 Fig. 1 Effect of extraction methods on the yield and content of flavonoids from A.altilis leaves |
2.2 提取时间对面包树树叶类黄酮得率和含量的影响
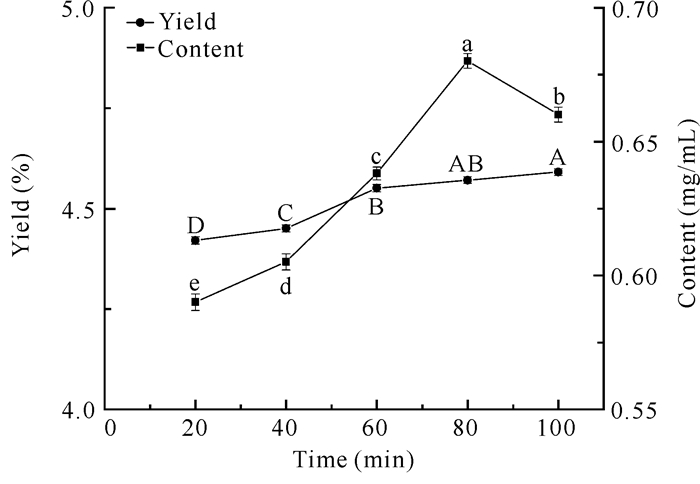
随着提取时间的增加,类黄酮得率逐步上升,60 min后处于缓慢的上升趋势(图 2)。当提取时间为100 min时,类黄酮的得率达到最大值。随着时间的增加,类黄酮含量呈先上升后下降的趋势,80 min时类黄酮含量最高,而后下降可能是由于随着提取时间的增加,类黄酮含量已趋于饱和状态,类黄酮结构改变使其含量下降。
|
| Different letters indicate significant differences (P < 0.05) 图 2 提取时间对面包树树叶类黄酮得率及含量的影响 Fig. 2 Effect of extraction time on the yield and content of flavonoids from A.altilis leaves |
2.3 固液比对面包树树叶类黄酮得率和含量的影响
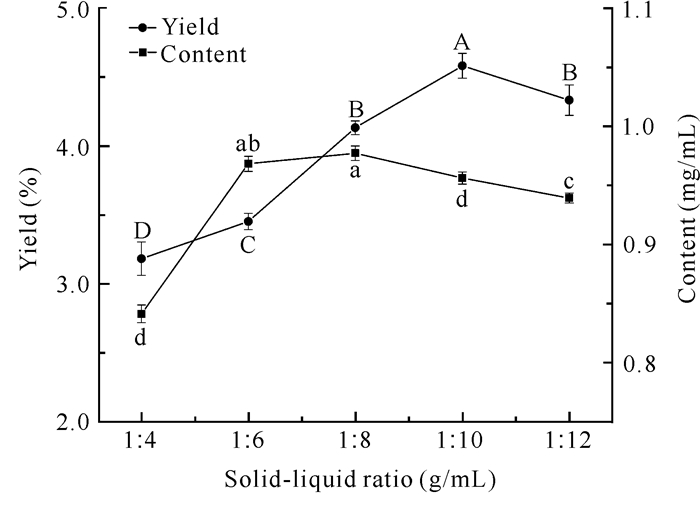
由图 3可知,在固液比为1∶4 (g/mL)时类黄酮得率较低,因为此时溶剂过少,已达到饱和状态,还有大量溶质未溶解。随着固液比增加,得率呈先上升后逐渐下降的趋势,当固液比达到1∶10 (g/mL)时类黄酮得率最高。在固液比为1∶4-1∶6 (g/mL)时,随着溶剂增加,类黄酮含量明显增多;在固液比为1∶6-1∶8 (g/mL)时类黄酮含量趋于稳定;在固液比为1∶8-1∶12 (g/mL)时,类黄酮含量呈明显下降趋势,固液比为1∶8 (g/mL)时类黄酮含量最高。
|
| Different letters indicate significant differences (P < 0.05) 图 3 固液比对面包树树叶类黄酮得率及含量的影响 Fig. 3 Effect of solid-liquid ratio on the yield and content of flavonoids from A.altilis leaves |
2.4 乙醇体积分数对面包树树叶类黄酮得率和含量的影响
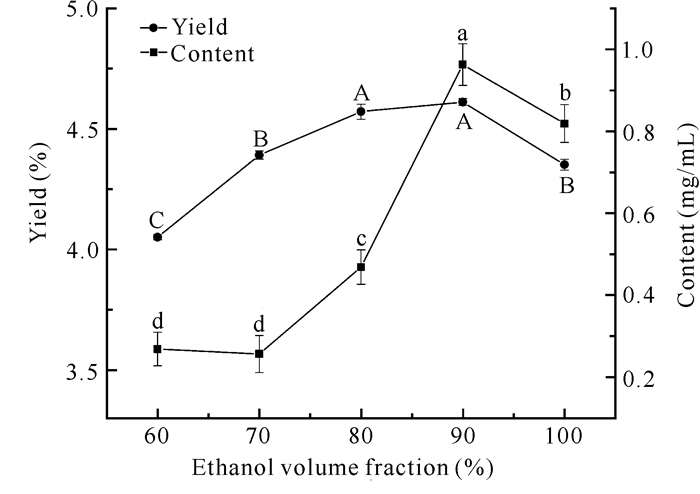
随着乙醇体积分数的增大,类黄酮得率和含量均呈先上升后下降的趋势,在乙醇体积分数为90%时,类黄酮得率和含量最高(图 4)。分析原因可能是由于乙醇体积分数越大,与溶质碰撞的概率就越大,使类黄酮得率和含量达到最高,而后乙醇体积分数超过了类黄酮的最佳提取条件,导致提取效果下降。
|
| Different letters indicate significant differences (P < 0.05) 图 4 乙醇体积分数对面包树树叶类黄酮得率及含量的影响 Fig. 4 Effect of ethanol volume fraction on the yield and content of flavonoids from A.altilis leaves |
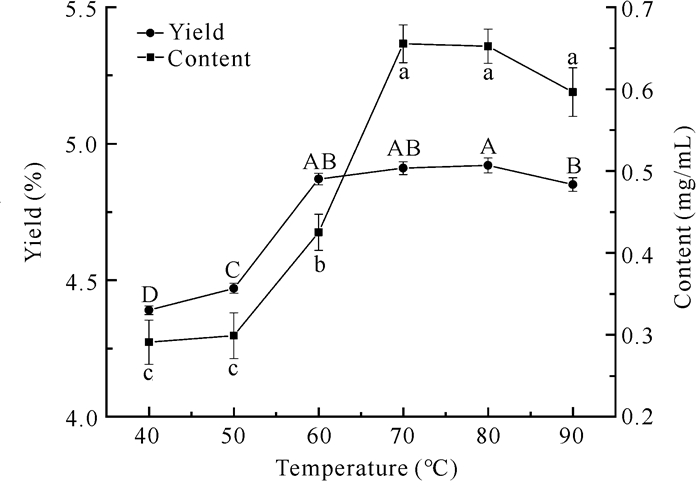
2.5 提取温度对面包树树叶类黄酮得率和含量的影响
随着提取温度的升高,类黄酮得率呈先上升后下降的趋势(图 5)。提取温度在60-80℃时处于稳定状态,在80℃时类黄酮得率最大,而超过80℃时明显下降,可能是因为温度超过了乙醇的沸点,提取剂容易挥发,导致提取能力降低,从而影响类黄酮得率。随着提取温度的升高,类黄酮含量显著上升,当温度为70℃时,类黄酮含量最高,而高于80℃类黄酮含量明显下降。
|
| Different letters indicate significant differences (P < 0.05) 图 5 提取温度对面包树树叶类黄酮得率及含量的影响 Fig. 5 Effect of extraction temperature on the yield and content of flavonoids from A.altilis leaves |
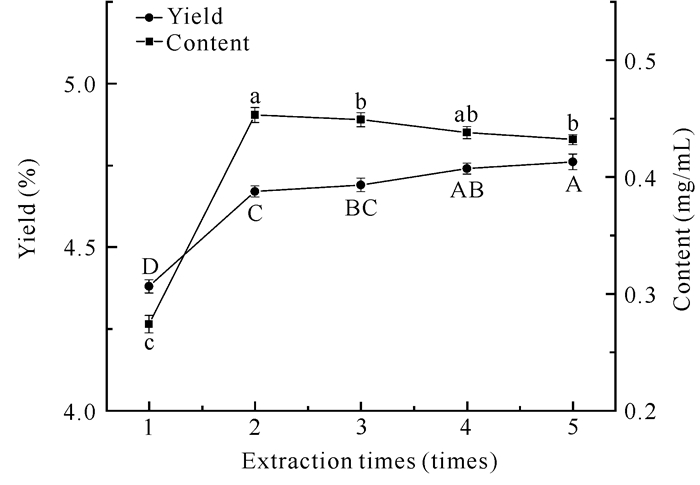
2.6 提取次数对面包树树叶类黄酮得率和含量的影响
随着提取次数的增加,类黄酮得率逐渐增大,但是在第2次提取后,类黄酮得率虽然上升,但是增速明显变缓,直到第5次提取时类黄酮得率达到最高(图 6)。类黄酮含量随着提取次数的增加呈先上升后缓慢下降的趋势,分析原因可能是由于第2次提取时部分类黄酮没有从溶剂中完全提取出来,使之后的类黄酮含量缓慢上升。
|
| Different letters indicate significant differences (P < 0.05) 图 6 提取次数对面包树树叶类黄酮得率及含量的影响 Fig. 6 Effect of extraction times on the yield and content of flavonoids from A.altilis leaves |
2.7 响应面分析法优化
从单因素试验结果可以得出,在面包树树叶类黄酮提取过程中,类黄酮得率与含量呈相同的变化趋势,因此单因素试验以得率(YA)为指标对整个工艺进行优化,Box-Benhnken试验设计结果如表 2所示。
| 试验号 Test number |
X1: 提取时间(min) X1: Extraction time (min) |
X2: 乙醇体积分数(%) X2: Ethanol volume fraction (%) |
X3: 固液比(g/mL) X3: Solid-liquid ratio (g/mL) |
X4: 提取温度(℃) X4: Extraction temperature (℃) |
得率(%) YA (%) |
| 1 | 0 | -1 | 1 | 0 | 4.48 |
| 2 | 0 | 1 | 0 | 1 | 3.68 |
| 3 | 1 | 0 | 1 | 0 | 3.87 |
| 4 | 0 | 0 | 0 | 0 | 8.49 |
| 5 | 1 | 1 | 0 | 0 | 3.34 |
| 6 | 0 | 0 | 1 | 1 | 3.12 |
| 7 | 1 | -1 | 0 | 0 | 6.05 |
| 8 | 0 | 1 | -1 | 0 | 3.34 |
| 9 | 0 | -1 | 0 | -1 | 6.48 |
| 10 | -1 | -1 | 0 | 0 | 3.52 |
| 11 | 1 | 0 | 0 | -1 | 7.21 |
| 12 | -1 | 0 | 0 | 1 | 3.2 |
| 13 | -1 | 1 | 0 | 0 | 4.35 |
| 14 | 0 | -1 | 0 | 1 | 4.43 |
| 15 | 0 | 0 | 0 | 0 | 7.89 |
| 16 | 0 | 0 | 1 | -1 | 5.35 |
| 17 | 0 | 1 | 0 | -1 | 5.89 |
| 18 | -1 | 0 | 0 | -1 | 5.26 |
| 19 | 0 | 0 | 0 | 0 | 8.51 |
| 20 | 0 | 0 | -1 | -1 | 3.79 |
| 21 | -1 | 0 | 1 | 0 | 4.71 |
| 22 | 0 | -1 | -1 | 0 | 5.29 |
| 23 | 0 | 0 | -1 | 1 | 3.94 |
| 24 | 0 | 0 | 0 | 0 | 8.47 |
| 25 | -1 | 0 | -1 | 0 | 3.78 |
| 26 | 1 | 0 | -1 | 0 | 5.82 |
| 27 | 1 | 0 | 0 | 1 | 3.81 |
| 28 | 0 | 1 | 1 | 0 | 4.48 |
| 29 | 0 | 0 | 0 | 0 | 8.46 |
回归模型显著性检验见表 3。对表 2中的试验数据进行回归分析,得到类黄酮得率的二次多元回归方程(模型)YA=0.084+3.260X1-3.191X2+2.527X3-7.284X4-6.556X1X3-2.482X1X4+3.611X2X3-2.681X2X4-4.408X3X4 -0.019X12-0.018X22-0.022X32-0.017X42。对方程进行F检验可得出,失拟检验F失拟=5.63<F0.05(14,10)=6.4,检验不显著,其他因素对实验结果影响不显著;F回归=20.11>F0.01(14,4)=2.39,检验极显著,能够较好地反映面包树树叶类黄酮得率与4个影响因素之间的关系,同时复相关系数R2=0.952 6,说明采用此模型分析面包树树叶类黄酮的得率是可行的。
| 方差来源 Sources of variance |
平方和 Sum of squares |
自由度 Degrees of freedom |
均方 Mean square |
F比值 F ratio |
P值(显著水平) P value (significant level) |
| Model | 85.64 | 14 | 6.12 | 20.11 | <0.000 1** |
| Residual | 4.26 | 14 | 0.30 | ||
| Loss of quasi | 3.98 | 10 | 0.40 | 5.63 | 0.055 1 |
| Error | 0.28 | 4 | 0.071 | ||
| Sum | 28 | ||||
| Note: ** indicates extremely significant difference (P<0.01) | |||||
回归方程系数显著性检验如表 4所示,X4、X12、X22、X32、X42项对面包树树叶类黄酮得率的影响极显著(P<0.01),X1、X2、X1X2、X1X3、X3X4项对面包树树叶中类黄酮得率的影响显著(P<0.05),其他因素对实验结果影响不显著。根据回归方程系数显著性检验可以得出影响类黄酮提取程度的因素大小为提取温度(X4)>提取时间(X1)>乙醇体积分数(X2)>固液比(X3)。
| 模型中的系数项 Coefficient term in the model |
系数估计值 Coefficient estimate |
自由度 Degrees of freedom |
标准误差 Standard error |
95%置信度的置信区间 95% confidence interval |
P值 P value |
|
| 下限 Lower limit |
上限 Upper limit |
|||||
| Intercept | 0.084 | 1 | 1.827 | 0.078 | 0.089 | <0.000 1** |
| X1 | 23.260 | 1 | 1.179 | 6.606 | 5.991 | 0.015 2* |
| X2 | -3.186 | 1 | 1.179 | -5.721 | -5.789 | 0.017 0* |
| X3 | 2.527 | 1 | 1.179 | -2.499 | 2.560 | 0.979 5 |
| X4 | -3.087 | 1 | 1.179 | -0.013 | -4.755 | <0.000 1** |
| X1X2 | -6.556 | 1 | 2.042 | -0.015 | -2.175 | 0.006 3* |
| X1X3 | -5.333 | 1 | 2.042 | -0.013 | -0.955 | 0.020 5* |
| X1X4 | -2.482 | 1 | 2.042 | -6.863 | 1.899 | 0.244 5 |
| X2X3 | 3.611 | 1 | 2.042 | -0.770 | 0.011 | 0.098 8 |
| X2X4 | -2.681 | 1 | 2.042 | -4.678 | 4.085 | 0.886 7 |
| X3X4 | -4.408 | 1 | 2.042 | -0.012 | -2.341 | 0.048 8* |
| X12 | -0.019 | 1 | 1.604 | -0.023 | -0.014 | <0.000 1** |
| X22 | -0.018 | 1 | 1.604 | -0.023 | -0.014 | <0.000 1** |
| X32 | -0.022 | 1 | 1.604 | -0.027 | -0.018 | <0.000 1** |
| X42 | -0.017 | 1 | 1.604 | -0.022 | -0.012 | <0.000 1** |
| Note: * indicates significant difference (P<0.05);** indicates extremely significant difference (P<0.01) | ||||||
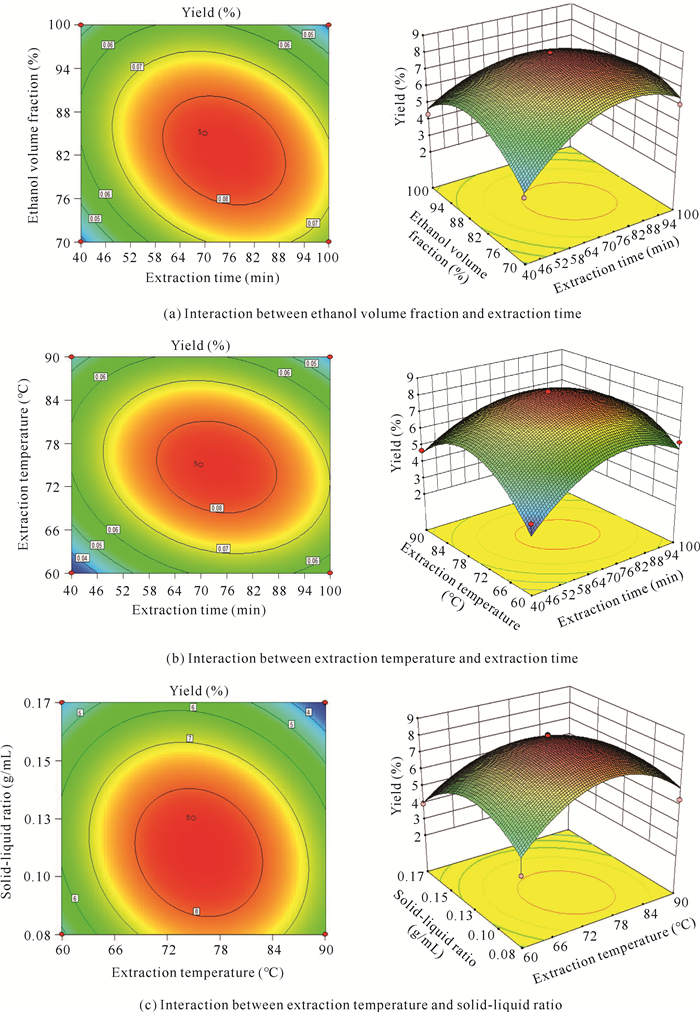
2.8 交互作用因素分析
响应曲面分析与优化模型中各因素交互作用对响应值YA的影响如图 7所示。曲面越弯曲说明该因素对类黄酮得率的影响越显著。从图 7(a)可以看出,提取时间对类黄酮得率的影响最大,而乙醇体积分数影响最小。当乙醇体积分数不变时,随着时间的增加,类黄酮得率亦增加,说明面包树树叶中的类黄酮逐渐溶解在乙醇中,当溶剂达到饱和状态时,提取得率逐渐下降。从图 7(b)可以看出,当温度不变时,随着提取时间的增大,面包树树叶中的类黄酮得率亦增加;当提取时间到达一定值时,类黄酮得率反而呈下降趋势。当提取时间一定时,温度越高,得率越大。从图 7(c)可以看出,曲面弯曲程度最小,说明固液比和提取温度的交互作用对类黄酮得率影响最小。
|
| 图 7 乙醇体积分数、提取时间、提取温度和固液比对类黄酮得率影响的等高面和响应曲面分析 Fig. 7 Contour surface and response surface analysis of the effects of ethanol volume fraction, extraction time, extraction temperature and solid-liquid ratio on flavonoids yield |
2.9 响应面方程验证
响应面软件得出的最佳提取工艺为乙醇体积分数86.15%、固液比1∶8.3 (g/mL)、提取温度74.03℃、提取时间71.33 min,类黄酮得率为8.56%。以此条件进行验证试验,类黄酮得率为8.87%,理论与实际得率误差为0.31%,此时类黄酮含量为0.93 mg/mL。
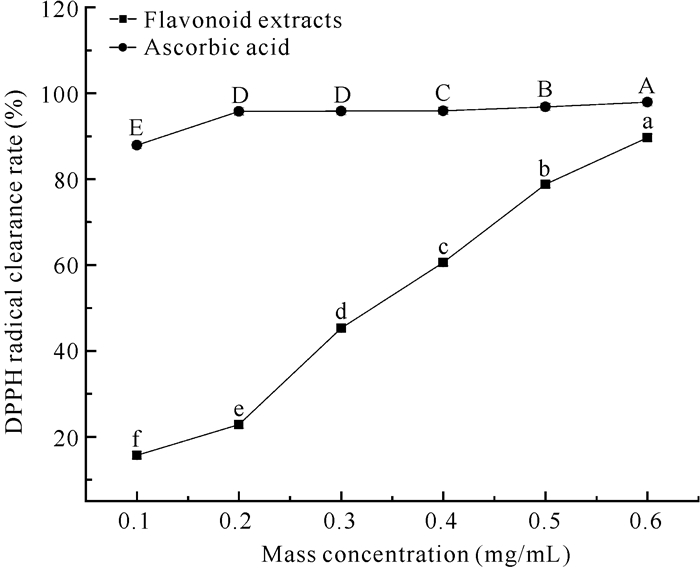
2.10 DPPH自由基清除能力随着质量浓度的增大,类黄酮提取物和抗坏血酸对DPPH自由基的清除能力逐渐增强(图 8)。当质量浓度达到0.6 mg/mL时,类黄酮提取物和抗坏血酸对DPPH自由基的清除能力最大,分别为89.62%和97.89%。类黄酮提取物对DPPH自由基的IC50值为0.23 mg/mL。
|
| Different letters indicate significant differences (P < 0.05) 图 8 面包树树叶类黄酮提取物及抗坏血酸对DPPH自由基清除作用 Fig. 8 Scavenging effect of flavonoids extract from A.altilis leaves and ascorbic acid on DPPH free radicals |
2.11 ABTS+自由基清除能力
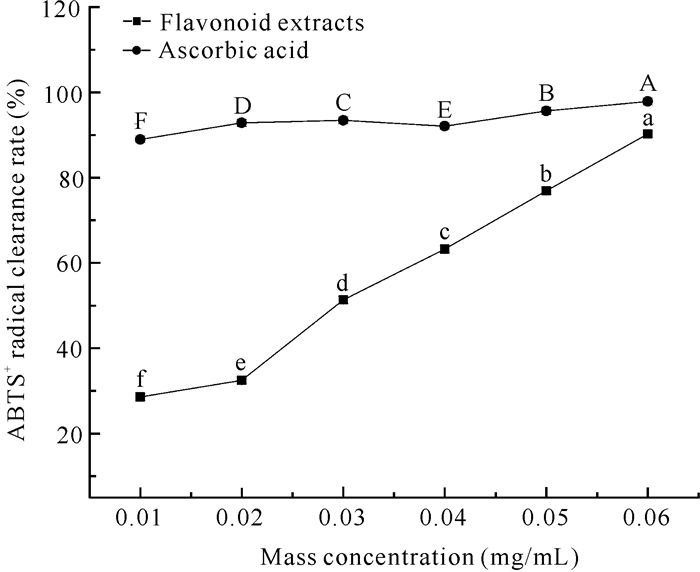
随着质量浓度的升高,面包树树叶类黄酮提取物和抗坏血酸对ABTS+自由基表现出强烈的清除作用(图 9)。且当质量浓度为0.06 mg/mL时,清除率均达到最大,类黄酮提取物和抗坏血酸对ABTS+自由基的清除率分别为90.26%和97.87%。类黄酮提取物对ABTS+自由基的IC50值为0.024 mg/mL。
|
| Different letters indicate significant differences (P < 0.05) 图 9 面包树树叶类黄酮提取物及抗坏血酸对ABTS+自由基的清除作用 Fig. 9 Scavenging effect of flavonoids extract from A.altilis leaves and ascorbic acid on ABTS+ free radicals |
3 讨论
采用传统工艺提取面包树树叶中的类黄酮成本较高,类黄酮得率和纯度也较低,而采用超声波辅助提取法不仅可以缩短提取时间,还能提高提取效率,且有效成分也易于分离纯化。孔方等[21]采用绿色新型低共熔溶剂结合超声波辅助提取法提取废弃苹果叶中总黄酮的效果最好,得率为7.06%。刘小娟等[22]采用超声波辅助提取衢枳壳总黄酮,得率为6.21%。本研究以常温提取法、回流提取法和超声波辅助提取法3种方法提取面包树树叶类黄酮化合物,发现超声波辅助提取法在类黄酮得率及含量两个指标上均高于其他两种方式,分析其原因可能是超声波提高了分子的热运动频率,使分子间的碰撞次数增多,进而使溶质更易溶于溶剂中。本研究使用超声波辅助提取法和响应面分析法优化得到面包树树叶类黄酮的最佳提取工艺,类黄酮得率为8.87%,表明超声波辅助提取法能显著提高面包树树叶类黄酮的提取量,试验优化得到的技术参数稳定可靠。
提取条件对提取工艺效果有较大的影响,各提取方法原理不尽相同。根据本试验得出的最佳提取工艺条件进行以下分析:随着提取时间的延长,类黄酮物质与溶剂的接触越充分,得率逐渐升高,但到达一定时间后,由于细胞内外类黄酮溶质的浓度差达到平衡,得率逐渐趋于稳定;随着固液比的增大,溶质更易于扩散至胶束溶液中,胶束溶液用量越大,类黄酮得率越高;提取温度的升高有利于分子热运动速率的提升,有利于类黄酮分子在乙醇中溶解,但温度过高,会加剧乙醇的挥发,同时易破坏类黄酮的部分结构;乙醇是公认的提取类黄酮的绿色溶剂,根据“相似相溶”的原理,乙醇浓度在80%左右时与类黄酮苷元的极性相似[23, 24]。
类黄酮化合物广泛存在于各种植物中,是一类具有发展前景的天然植物抗氧化剂。唐静月等[25]研究铁皮石斛花总黄酮对DPPH自由基、ABTS+自由基的清除能力发现,总黄酮含量与抗氧化活性具有相关性。赵旭萍等[26]研究发现,多羽凤尾蕨中总黄酮提取物具有较强的DPPH自由基清除能力。本研究结果表明,当提取物质量浓度为0.6 mg/mL时,面包树树叶类黄酮对DPPH自由基、ABTS+自由基的清除率分别为89.62%、90.26%,表明面包树树叶类黄酮具有良好的抗氧化性,可为后续相关抗氧化剂的研究提供参考依据。但是面包树树叶类黄酮的具体化学成分种类及含量仍需进一步研究,以期为抗氧化剂的研究奠定理论基础。
4 结论本研究通过比较3种提取方式得出超声波辅助提取法为面包树树叶类黄酮的最佳提取方法,在单因素试验的基础上,采用响应面分析法对提取工艺进行优化,得出最佳提取工艺条件为乙醇体积分数86.15%、固液比1∶8.3 (g/mL)、提取温度74.03℃、超声时间71.33 min,各个因素对面包树树叶类黄酮提取的影响顺序为提取温度>提取时间>乙醇体积分数>固液比。抗氧化试验结果显示,面包树树叶类黄酮对DPPH和ABTS+自由基具有较高的清除性能,且当质量浓度达到最大时,可得到与抗坏血酸相当的抗氧化效果。综上可知,面包树树叶类黄酮含量与其抗氧化性存在极大的相关性,具有广阔的发展利用空间。
| [1] |
HOUNG T T, CUONG N X, TRAM L H, et al. A new prenylated aurone from Artocarpus altilis[J]. Journal of Asian Natural Products Research, 2012, 14(9): 923-928. DOI:10.1080/10286020.2012.702758 |
| [2] |
MAI N T T, HAI N X, PHU D H, et al. Three new geranyl aurones from the leaves of Artocarpus altilis[J]. Phytochemistry Letters, 2012, 5: 647-650. DOI:10.1016/j.phytol.2012.06.014 |
| [3] |
钟雪瑶, 王少曼, 张彦军, 等. 响应面法优化面包果淀粉的酶法提取工艺[J]. 食品工业科技, 2020, 41(21): 139-144. DOI:10.13386/j.issn1002-0306.2020010004 |
| [4] |
吴刚, 白亭玉, 苏兰茜, 等. 面包果芽接繁殖技术[J]. 林业科技通讯, 2020(11): 74-76. DOI:10.13456/j.cnki.lykt.2019.11.22.0002 |
| [5] |
FAKHRUDIN N, PERTIWI K K, TAKUBESSI M I, et al. A geranylated chalcone with antiplatelet activity from the leaves of breadfruit (Artocarpus altilis)[J]. Pharmacia, 2020, 67(4): 173-180. DOI:10.3897/pharmacia.67.e56788 |
| [6] |
WANG Y, DENG T, LIN L, et al. Bioassay-guided isolation of antiatherosclerotic phytochemicals from Artocarpus altilis[J]. Phytother Research, 2006, 20(12): 1052-1055. DOI:10.1002/ptr.1990 |
| [7] |
PRADHAN C, MOHANTY M, ROUT A. Phytochemical screening and comparative bioefficacy assessment of Artocarpus altilis leaf extracts for antimicrobial activity[J]. Frontiers in Life Science, 2012, 6(3/4): 71-76. |
| [8] |
吴刚, 朱科学, 王颖倩, 等. 面包果主要营养组分研究初报[J]. 中国热带农业, 2018(2): 39-44. DOI:10.3969/j.issn.1673-0658.2018.02.011 |
| [9] |
LAN W C, TZENG C W, LIN C C, et al. Prenylated flavonoids from Artocarpus altilis: antioxidant activities and inhibitory effects on melanin production[J]. Phytochemistry, 2013, 89: 78-88. DOI:10.1016/j.phytochem.2013.01.011 |
| [10] |
WANG Y, XU K, LIN L, et al. Geranyl flavonoids from the leaves of Artocarpus altilis[J]. Phytochemistry, 2007, 68(9): 1300-1306. DOI:10.1016/j.phytochem.2007.01.009 |
| [11] |
NOMURA T, HANO Y, AIDA M. Isoprenoid-substituted flavonoids from Artocarpus plants (Moraceae)[J]. Heterocycles, 1998, 47(2): 1179-1205. DOI:10.3987/REV-97-SR(N)9 |
| [12] |
JALAL T K, KHAN A A Y F, NATTO H A, et al. Identification and quantification of Quercetin, a major constituent of Artocarpus altilis by targeting related genes of apoptosis and cell cycle: in vitro cytotoxic activity against human lung carcinoma cell lines[J]. Nutrition and Cancer, 2019, 71(5/8): 792-805. |
| [13] |
符红梅, 谭乐和. 面包果的应用价值及开发利用前景[J]. 中国南方果树, 2008, 37(4): 43-44. |
| [14] |
王宇. Artocarpus altilis的化学成分分离、衍生以及生物活性评价[D]. 杭州: 浙江大学, 2007.
|
| [15] |
金春雪, 上官进, 刘政, 等. 银杏叶中黄酮甙类化合物的提取与初步分离[J]. 信阳师范学院学报, 1998, 11(2): 186-187, 206. DOI:10.3969/j.issn.1003-0972.1998.02.023 |
| [16] |
邸娜, 郑喜清, 韩海军, 等. 植物天然成分黄酮类化合物的提取方法[J]. 安徽农业科学, 2014, 42(33): 11888-11889, 11907. DOI:10.3969/j.issn.0517-6611.2014.33.096 |
| [17] |
米文珍. 紫花苜蓿质量控制及总黄酮提取工艺研究[D]. 沈阳: 沈阳药科大学, 2009.
|
| [18] |
MEDA A, LAMIEN C E, ROMITO M, et al. Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J]. Food Chemistry, 2005, 91: 571-577. DOI:10.1016/j.foodchem.2004.10.006 |
| [19] |
THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19: 669-675. DOI:10.1016/j.jfca.2006.01.003 |
| [20] |
RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. |
| [21] |
孔方, 李莉, 刘言娟. 超声辅助低共熔溶剂提取苹果叶中的总黄酮[J]. 食品工业科技, 2020, 41(14): 134-139, 147. |
| [22] |
刘小娟, 方月娟, 夏道宗, 等. 衢枳壳总黄酮提取工艺的优化及其抗氧化活性[J]. 中成药, 2020, 42(7): 1687-1691. |
| [23] |
薛鹤, 曾阳, 李锦萍, 等. 金露梅黄酮提取工艺的响应面优化及其抗氧化和降血糖活性分析[J]. 南方农业学报, 2022, 53(2): 505-515. |
| [24] |
薛宏坤, 谭佳琪, 刘成海, 等. 超声-闪式联合法制备蓝莓花色苷提取物及其体内外抗肿瘤活性评价[J]. 食品科学, 2020, 41(6): 259-269. |
| [25] |
唐静月, 颜美秋, 齐芳芳, 等. 铁皮石斛花总黄酮提取工艺优化及体外抗氧化活性研究[J]. 浙江中医药大学学报, 2017, 41(3): 235-242. |
| [26] |
赵旭萍, 杨柳, 刘亚华, 等. 多羽凤尾蕨总黄酮提取工艺优化及抗氧化性研究[J]. 粮食与油脂, 2022, 35(1): 129-132, 138. |



