2. 贵州工业职业技术学院, 贵州贵阳 550008;
3. 贵州省中国科学院天然产物化学重点实验室, 贵州贵阳 550014
2. Guizhou Industry Polytechnic College, Guiyang, Guizhou, 550008, China;
3. Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang, Guizhou, 550014, China
黑老虎(Kadsura coccinea)又名冷饭团、布福娜、大叶五味子等,为木兰科(Magnoliaceae)南五味子属(Kadsura longipedunculata)植物,分布于贵州、广西、云南等地。黑老虎是一种重要的中药材,主要以根入药,用于治疗胃溃疡、十二指肠溃疡、急性肠胃炎、风湿性关节炎、跌打肿痛等疾病[1-3]。现代生物和医学研究表明,黑老虎还具有抗肿瘤、抗人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)、抗炎、保肝、抗氧化等作用[4-7],从而受到人们广泛关注。木脂素类化合物是黑老虎的主要化学成分之一,被认为是主要药效成分和重要化学标志物。三萜类化合物是从黑老虎分离得到的另一类主要成分,因其结构多样和新颖逐渐成为研究热点[8-12]。然而,这两类主要成分在植株不同部位的分布和积累差异还鲜有报道。广泛靶向代谢组学技术通过高通量化学对生物样品中代谢产物进行定性和定量分析,已得到广泛认可[13-15]。基于此,本研究对黑老虎叶、茎、根中代谢物进行鉴定,并根据其结构配置进行归类,解析其中的木脂素和萜类化合物在植株不同部位的分布与积累差异,阐明其高度积累和特有成分,为进一步研究与挖掘黑老虎的利用价值提供支持。
1 材料与方法 1.1 样品采集与预处理黑老虎植株为人工栽培,生长在覆盖80%遮阳网的塑料大棚,位于贵州省贵阳市乌当区下坝镇普渡村。植株定期修剪管理、长势良好,栽培6 a,藤蔓已木质化。于2020年7月29日,选3株长势较为接近的植株取样,用小铲子辅助刨开土壤,每株剪下2-3条主根及细根作为根部样品,2-3条地上约10 cm的主蔓之一为茎,5-6片中下部长势较好的成熟叶片为叶。分别用10 mL冻存管取3个重复,分别标记为根(KR)、茎(KS)和叶(KL),迅速置于液氮中,随后用干冰保存转运至实验室-80℃超低温冰箱中保存备用。
样品放置于冻干机(Scientz-100F,宁波新芝冻干设备有限公司)中真空冷冻干燥,用研磨仪(MM 400,德国Retsch公司)研磨(30 Hz,1.5 min)至粉末状。准确称取100 mg粉末,溶解于1.2 mL 70%甲醇提取液中,每30 min涡旋1次,每次持续30 s,共涡旋6次,样本置于4℃冰箱过夜。在12 000 r/min离心10 min后,吸取上清液,用微孔滤膜(0.22 μm)过滤样品,并保存于进样瓶中,用于高效液相-串联质谱(UPLC-MS/MS)分析。
1.2 色谱质谱采集条件采用UPLC-MS/MS联用技术对样本进行物质鉴定,液相条件设置如下。①色谱柱:Agilent SB-C18 (2.1 mm×100 mm,1.8 μm)。②流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸)。③洗脱梯度:0.00 min B相比例为5%;9.00 min内B相比例线性增加到95%,并在95%维持1 min;10.00-11.10 min,B相比例降至5%,并以5%平衡至14 min。④流速为0.35 mL/min,柱温为40℃,进样量为4 μL。
利用AB4500 Q TRAP UPLC/MS/MS系统(配备ESI Turbo离子喷雾接口)检测电喷雾离子源(ESI),由Analyst 1.6.3软件(AB Sciex)控制运行。ESI操作参数如下:离子源,涡轮喷雾;源温度550℃;离子喷雾电压(IS)分为正离子模式和负离子模式,分别为5 500 V和-4 500 V;离子源气体Ⅰ(GSⅠ)、气体Ⅱ(GSⅡ)和帘气(CUR)分别设置为50 psi、60 psi和25.0 psi,参数设置为高。
1.3 质控样本质控样本(Quality Control Samples,QC)由样本提取物混合制备而成,用于分析样本在相同处理方法下的重复性。在仪器分析过程中,每3个检测分析样本中插入1个质控样,以监测分析过程的稳定性。
1.4 数据分析基于武汉迈特维尔生物科技有限公司的MVDB V2.0数据库和代谢物信息公共数据库,根据二级谱信息进行物质定性,采用三重四极质谱多反应监测模式(Multi Reaction Monitor,MRM)对代谢物进行定量。获得不同样本的代谢物质谱分析数据后,利用软件Analyst 1.6.3对物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正[16]。
通过对样本进行主成分分析(Principal Component Analysis,PCA),判别黑老虎根、茎、叶各样本组之间及组内木脂素和萜类成分变异度大小。根据正交偏最小二乘法判别分析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA)代谢组数据,进一步展示各部位间的差异。模型的预测参数及解读参照方贤胜等[15]和Thévenot等[17]所述。基于OPLS-DA结果,从获得的多变量分析OPLS-DA模型的变量重要性投影(Variable Importance in Projection,VIP),选取VIP≥1,fold change≥2和fold change≤0.5的差异代谢物(Differentially Accumulating Metabolites,DAMs)。
2 结果与分析 2.1 木脂素类成分黑老虎植株中共鉴定出木脂素类化合物39个,其中叶和茎中各含24个,根中最多,有32个,3个部位含17个相同的木脂素类化合物(表 1)。叶中特有2个,分别为7S, 8R-苏式-3′, 4, 9′-三羟基-3-甲氧基-7, 8-二氢苯并呋喃-1′-丙醇基新木脂素-9-O-鼠李糖苷和7R, 8S-赤式-3′, 4, 9, 9′-四羟基-3-甲氧基-8-O-4′-新木脂素-7-O-葡萄糖苷。根中特有13个,如日本南五味子木脂素H、五味子木脂素J、五味子木脂素N等,木脂素类化合物种类较丰富。
| 序号 No. |
质荷比 m/z |
离子模式 Ion model |
鉴定成分 Identified component |
峰面积(×106) Peak areas (×106) |
||
| KL | KS | KR | ||||
| 1 | 357.1 | [M-H]- | Pinoresinol | 0.052 | 0.454 | 0.131 |
| 2 | 357.1 | [M-H]- | Epipinoresinol | 0.046 | 0.459 | 0.129 |
| 3 | 359.2 | [M+H]+ | Matairesinol | 0.009 | 0.238 | 0.094 |
| 4 | 357.2 | [M-H]- | Kadsuralignan C | 0.005 | 0.013 | 1.208 |
| 5 | 385.2 | [M-H]- | Kadsuralignan H | - | - | 0.148 |
| 6 | 389.2 | [M+H]+ | Gomisin J | - | - | 0.088 |
| 7 | 391.2 | [M+H]+ | Pregomisin | - | 0.004 | 3.452 |
| 8 | 389.2 | [M-H]- | Kadangustin H | 0.001 | 0.001 | 0.135 |
| 9 | 401.2 | [M+H]+ | Gomisin N | - | - | 2.506 |
| 10 | 401.2 | [M-H]- | Kadsuralignan A | - | - | 0.051 |
| 11 | 403.2 | [M-H]- | Kadangustin I | - | - | 4.940 |
| 12 | 417.2 | [M+H]+ | Iso-schisandrin ethyl alcohol | - | - | 11.167 |
| 13 | 417.2 | [M+H]+ | Schisandrol B | 0.008 | 0.056 | 11.359 |
| 14 | 417.2 | [M-H]- | Syringaresinol | 0.008 | 0.091 | 0.004 |
| 15 | 419.2 | [M-H]- | Lyoniresinol | 0.072 | 0.132 | - |
| 16 | 413.2 | [M-H2O+H]+ | Schinsanlignone A | - | - | 0.597 |
| 17 | 443.2 | [M+H]+ | Acetylepigomisin R | - | - | 15.692 |
| 18 | 483.2 | [M+H]+ | Kadusurain C | 0.007 | 0.005 | 13.627 |
| 19 | 491.2 | [M-H]- | 7S, 8R-threo-3′, 9, 9′-trihydroxy-3-methoxy-4′, 7-epoxy-neolignan-4-O-rhamnoside | 0.320 | 0.016 | - |
| 20 | 493.2 | [M+H]+ | 7S, 8R-threo-3′, 4, 9′-trihydroxy-3-methoxy-4′, 7-epoxy-neolignan-9-O-rhamnoside | 0.140 | - | - |
| 21 | 509.2 | [M-H]- | 7S, 8S-threo-3′, 4, 7, 9-tetrahydroxy-3-methoxy-8-O-4′-neolignan-9′-O-rhamnoside | 2.629 | 0.292 | - |
| 22 | 537.2 | [M+Na]+ | Gomisin G | - | - | 0.116 |
| 23 | 543.2 | [M+Na]+ | Schisantherin D | - | - | 0.079 |
| 24 | 538.2 | [M+NH4]+ | Matairesinoside | 0.307 | 4.251 | 0.222 |
| 25 | 519.2 | [M-H]- | Pinoresinol-4-O-glucoside | 0.454 | 0.129 | 0.022 |
| 26 | 521.2 | [M+H]+ | Benzoylisogomisin O | - | - | 1.200 |
| 27 | 523.2 | [M+H]+ | Isolariciresinol-9-O-glucoside | 0.168 | 0.315 | 0.121 |
| 28 | 521.2 | [M-H]- | Isolariciresinol-9′-O-glucoside | 6.265 | 7.410 | 0.065 |
| 29 | 521.2 | [M-H]- | Lariciresinol-4′-O-glucoside | 1.828 | 0.560 | - |
| 30 | 523.2 | [M-H]- | Secoisolariciresinol-4-O-glucoside | 0.572 | 1.955 | 0.163 |
| 31 | 523.2 | [M-H]- | Secoisolariciresinol-9′-O-glucoside | 7.244 | 4.228 | 0.571 |
| 32 | 525.2 | [M-H]- | 7R, 8S-erythro-3′, 4, 9, 9′-tetrahydroxy-3-methoxy-8-O-4′-neolignan-7-O-glucopyr-anoside | 2.254 | - | - |
| 33 | 535.2 | [M-H]- | 1-hydroxypinoresinol-1-O-glucoside | 0.105 | 0.199 | - |
| 34 | 537.2 | [M+H]+ | Schisantherin A | - | - | 0.037 |
| 35 | 537.2 | [M-H]- | Olivil-4′-O-glucoside | 0.834 | 4.991 | 0.162 |
| 36 | 543.2 | [M-H]- | Kadsuralignan G | 0.012 | 0.064 | 32.978 |
| 37 | 549.2 | [M-H]- | 5′-methoxymatairesinoside | - | 0.055 | 0.223 |
| 38 | 557.2 | [M-H]- | Kadangustin F | - | - | 0.330 |
| 39 | 581.2 | [M+H]+ | Kadangustin E | 0.028 | 0.039 | 13.004 |
| Note:"-" indicates not detected | ||||||
以代谢物质谱峰面积或累计值表示该成分或该类成分的丰度。黑老虎根中木脂素类化合物丰度(114.62×106)远高于叶(23.37×106)和茎(25.96×106),17个相同的木脂素类化合物在叶、茎和根中丰度分别为16.02×106、24.70×106和74.00×106,说明不同部位差异较大。茎中特有成分丰度为1.20×106,根部为36.95×106。由此可见,根部与叶、茎所含的相同成分及特有成分丰度都较高。进一步分析发现,根部日本南五味子木脂素G、乙酰表戈米辛R、Kadusurain C、狭叶南五味子素E、异五味子醇乙和五味子醇乙丰度排名靠前,这6个化合物的丰度累计值(97.83×106)占根中木脂素类化合物总量的85.3%;其中日本南五味子木脂素G丰度高达32.98×106,占总量的28.8%,单个物质已超过了叶和茎中木脂素类化合物总丰度。
2.2 萜类成分在黑老虎植株中共鉴定出萜类化合物41个,数量上以三萜类化合物占主导(表 2)。叶和茎中都含36个,根中39个,3个部位含有34个相同的萜类化合物。叶中特有1个萜类成分,为蒲公英萜醇;根中特有4个,分别为马达积雪草酸、2α, 3β, 19α, 23-四羟基熊果-12-烯-28-酸、Kadcoccilactone M和Kadcoccilactone A。
| 序号 No. |
质荷比 m/z |
离子模式 Ion model |
鉴定成分 Identified component |
峰面积(×106) Peak areas (×106) |
归类 Classification |
||
| KL | KS | KR | |||||
| 1 | 223.1 | [M+H]+ | Dehydrovomifoliol | 0.136 | 0.147 | 0.089 | Sesterpene |
| 2 | 373.1 | [M-H]- | Geniposidic acid | 0.049 | 0.231 | 0.053 | Sesterpene |
| 3 | 321.2 | [M+H]+ | Ent-16α, 17-dihydroxykauran-2-one | 0.131 | 0.053 | 0.004 | Diterpene |
| 4 | 425.4 | [M+H]+ | Lupenone | 0.035 | 0.031 | 0.036 | Triterpene |
| 5 | 427.4 | [M+H]+ | Taraxerol | 0.083 | - | - | Triterpene |
| 6 | 453.3 | [M+H]+ | Kadcoccinic acid D | 11.232 | 6.650 | 8.835 | Triterpene |
| 7 | 455.4 | [M+H]+ | Coccinic acid | 1.380 | 1.016 | 2.076 | Triterpene |
| 8 | 453.3 | [M-H]- | 3-ketoursolic acid | 0.009 | 0.006 | 0.012 | Triterpene |
| 9 | 453.3 | [M-H]- | Ursonic acid | 0.010 | 0.006 | 0.014 | Triterpene |
| 10 | 453.3 | [M-H]- | Oleanonic acid | 0.008 | 0.007 | 0.013 | Triterpene |
| 11 | 455.4 | [M+H]+ | 3β-hydroxytaraxastan-28, 20β-olide | 0.102 | 0.077 | 0.114 | Triterpene |
| 12 | 455.4 | [M+H]+ | 3β-hydroxy-urs-11-en-28, 13β-lactone | 0.173 | 0.091 | 0.138 | Triterpene |
| 13 | 465.3 | [M-H]- | Kadcoccilactone U | 0.311 | 0.417 | 0.638 | Triterpene |
| 14 | 467.3 | [M-H]- | Kadcoccinic acid C | 0.116 | 0.066 | 0.121 | Triterpene |
| 15 | 467.3 | [M-H]- | Kadsuracoccinic acid A | 0.033 | 0.032 | 0.073 | Triterpene |
| 16 | 471.4 | [M-H]- | Maslinic acid | 0.095 | 0.049 | 0.081 | Triterpene |
| 17 | 471.4 | [M-H]- | 2α-hydroxyursolic acid | 0.073 | 0.055 | 0.109 | Triterpene |
| 18 | 471.4 | [M-H]- | 2-hydroxyoleanolic acid | 0.091 | 0.058 | 0.097 | Triterpene |
| 19 | 481.3 | [M-H]- | Kadcoccilactone Q | 0.005 | 0.004 | 0.005 | Triterpene |
| 20 | 483.3 | [M-H]- | Kadcotrione A | 1.529 | 0.635 | 1.698 | Triterpene |
| 21 | 485.3 | [M+H]+ | Kadcoccitone C | 5.219 | 2.095 | 2.296 | Triterpene |
| 22 | 483.3 | [M-H]- | Kadcotrione C | 0.110 | 0.072 | 0.601 | Triterpene |
| 23 | 485.3 | [M-H]- | Kadcoccilactone R | 0.712 | 0.441 | 0.748 | Triterpene |
| 24 | 485.3 | [M-H]- | Kadcoccinic acid G | 0.748 | 0.439 | 0.833 | Triterpene |
| 25 | 487.4 | [M-H]- | Madasiatic acid | - | - | 0.027 | Triterpene |
| 26 | 499.3 | [M-H]- | Kadcoccilactone E | - | 0.003 | 3.092 | Triterpene |
| 27 | 499.3 | [M-H]- | Kadcoccinic acid B | 0.350 | 0.303 | 0.349 | Triterpene |
| 28 | 499.3 | [M-H]- | Kadcoccinic acid A | 0.005 | 0.010 | 0.004 | Triterpene |
| 29 | 499.3 | [M-H]- | Kadcoccitone A | 0.060 | 0.103 | 0.100 | Triterpene |
| 30 | 499.3 | [M-H]- | Kadcoccitone B | 0.147 | 0.229 | 0.247 | Triterpene |
| 31 | 503.3 | [M-H]- | 2α, 3β, 19α, 23-tetrahydroxyurs-12-en-28-oic acid | 0.000 | 0.000 | 0.049 | Triterpene |
| 32 | 505.3 | [M-H]- | Kadcoccilactone M | 0.000 | 0.000 | 1.223 | Triterpene |
| 33 | 509.3 | [M-H]- | Kadcoccilactone N | 1.994 | 1.334 | 3.711 | Triterpene |
| 34 | 511.3 | [M-H]- | Kadcoccinone A | 0.002 | 0.001 | 0.003 | Triterpene |
| 35 | 515.3 | [M-H]- | Kadcoccilactone A | - | - | 12.903 | Triterpene |
| 36 | 527.3 | [M-H]- | Kadcoccinone C | 0.005 | 0.002 | 0.008 | Triterpene |
| 37 | 543.2 | [M-H]- | Kadcoccilactone F | 0.013 | 0.063 | 31.932 | Triterpene |
| 38 | 575.3 | [M-H]- | Kadcoccilactone H | 9.882 | 2.217 | 1.715 | Triterpene |
| 39 | 345.1 | [M-H]- | 6-deoxycatalpol | 0.024 | 0.029 | - | Terpenes |
| 40 | 493.2 | [M-H]- | 6-O-p-coumaroylajugol | 0.053 | 0.106 | 0.100 | Terpenes |
| 41 | 509.2 | [M-H]- | 6-O-trans-caffeoyl ajugol | 2.138 | 0.284 | 0.014 | Terpenes |
| Note:"-" indicates not detected | |||||||
黑老虎根部萜类化合物丰度(74.16×106)远高于叶(37.06×106)和茎(17.36×106),不同部位成分差异也较大,但占比最高的均为三萜类化合物。34个相同萜类成分在叶、茎、根中丰度分别为3.696×106、17.33×106和56.87×106,根中特有萜类成分丰度为14.20×106,可见,根与叶、茎相同成分丰度较高,加之特有部分使萜类丰度远高于叶和茎。根部丰度最高的为Kadcoccilactone F,其次为Kadcoccilactone A,二者丰度累计值(44.83×106)占根中萜类总量的60.5%,已超过叶和茎中萜类成分总量。此外,南五味子酸D、Kadcoccitone C、Kadcoccilactone N和Kadcoccilactone H在3个部位中丰度都较高。
2.3 差异成分分析 2.3.1 PCA结果分析PCA得分图显示,LC-MS分析所得原始数据在PC1、PC2两种主成分中呈现良好(图 1)。由图 1可知,第1主成分的贡献率为59.2%,第2主成分的贡献率为29.0%,2个主成分的贡献率之和为88.2%,代表这两个主成分能够基本反映检测样的主要特征信息,各样本表现出明显的分离趋势,表明数据处理结果可信,各样本组间存在明显差异。
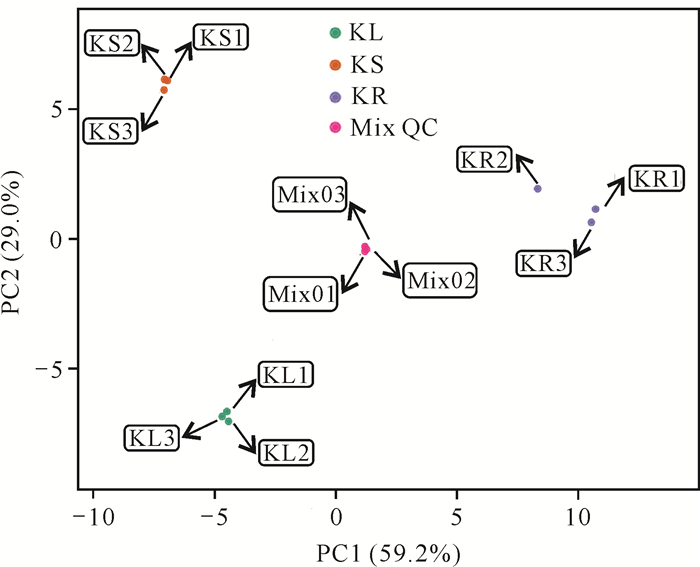
|
| 图 1 样本PCA得分图 Fig. 1 PCA score chart of samples |
2.3.2 OPLS-DA结果分析
OPLS-DA得分结果显示,模型具有很好的预测能力和可靠性,能够很好地表现各组间木脂素和萜类化合物的变化趋势。对OPLS-DA模型进行200次排列验证,P<0.005表示模型有意义,可根据VIP值分析筛选DAMs (表 3)。
| 对比组 Pairwise groups |
R2X | R2Y | Q2 | 0/200 |
| KL vs KR | 0.893 | 1 | 0.995 | P<0.005 |
| KS vs KR | 0.936 | 1 | 0.997 | P<0.005 |
2.3.3 差异代谢物筛选
基于OPLS-DA结果,根据DAMs筛选标准,KL与KR之间共筛选出51个DAMs (木脂素36个、萜类15个),24个木脂素类化合物和9个萜类化合物在根中丰度显著高于叶,以上调模式为主导。KS与KR之间有54个DAMs,21个木脂素类化合物和12个萜类化合物在根中丰度显著高于茎,亦是上调模式占主导(表 4)。
| 类别 Class |
KL vs KR | KS vs KR | |||||
| 总数 Total |
上调 Increased |
下调 Decreased |
总数 Total |
上调 Increased |
下调 Decreased |
||
| Lignans | 36 | 24 | 12 | 37 | 21 | 16 | |
| Terpenoids | 15 | 9 | 6 | 17 | 12 | 5 | |
两个对比组中差异倍数排在前12的主要为木脂素类化合物(图 2)。其中,乙酰表戈米辛R、Kadcoccilactone A、异五味子醇乙、狭叶南五味子素Ⅰ在根部丰度显著上升,而1-羟基松脂醇-1-O-葡萄糖苷、7S, 8S-苏式-3′, 4, 7, 9-四羟基-3-甲氧基-8-O-4′-新木脂素-9′-O-鼠李糖苷、落叶松脂素-4′-O-葡萄糖苷丰度显著下降。
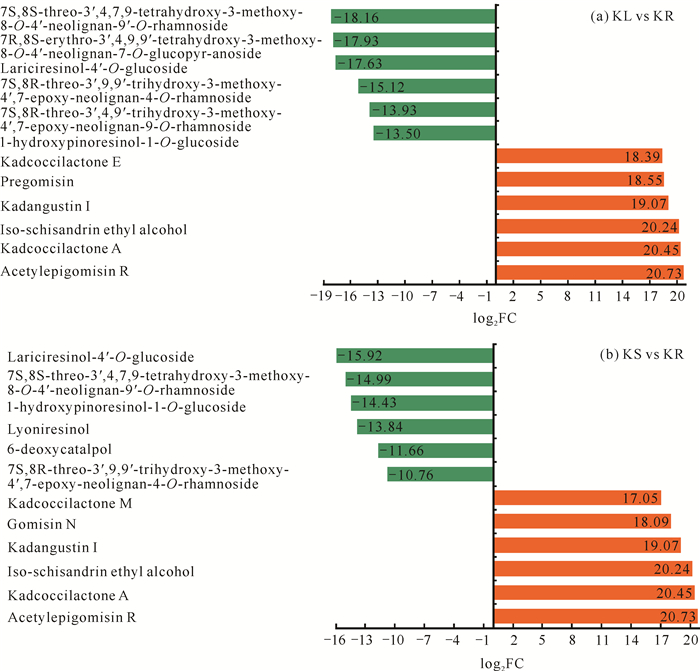
|
| 图 2 差异倍数最大的12个成分 Fig. 2 Top 12 components with the largest difference multiple |
3 讨论
木脂素类化合物被认为是黑老虎药用部位的主要化学成分、主要药效成分和重要化学标志物,目前主要从根部(少量于茎中)分离得到[11, 12]。代谢组检测显示,黑老虎根中含有32个木脂素类化合物,其数量约是叶和茎的1.3倍,丰度分别约是叶、茎的4.9倍和4.4倍;根部特有木脂素类化合物数量达13个,根部与叶、茎所含的相同成分及特有成分丰度均较高。丰度排名前6的木脂素类化合物(4个为根部特有)是根部木脂素丰度最主要的贡献者,这些化合物及其他丰度较高的木脂素类化合物有多个被证实具有活性作用。例如,日本南五味子木脂素G(丰度最高)具有抗一氧化氮(NO)生成活性[18];Kadusurain C对4种人肿瘤细胞(A549、HCT116、HL-60、HepG2)具有抗增殖作用[19];狭叶南五味子素E对HIV-1有抑制活性[20]。
黑老虎根部萜类化合物数量略多于茎和叶,其中叶中丰度约为茎的2.1倍,根部丰度约为叶的2.0倍,在数量和丰度上均以三萜类化合物为主导。三萜类化合物被认为是黑老虎的另一类主要成分,近十年已分离得到40余种,成为天然产物的研究热点之一[11]。本研究鉴定出的丰度较高的三萜类化合物有多个被证实具有生物活性。如Kadcoccinone A-F对6种人类癌症细胞系(HL-60、SMMC7721、A-549、MCF-7、SW-480、Hela)具有细胞毒活性[21],Kadcotrione A具有抗HIV-1活性,半最大效应浓度(EC50)值为47.91 μg/mL[22],Kadcoccitone B抗HIV活性的EC50值为30.29 μg/mL[23]。
现代研究表明,五味子木脂素类成分是五味子传统功效的主要物质基础,与五味子具有的功能活性一致[12]。黑老虎主要以根入药,根部木脂素丰度远高于茎和叶,其传统药用功效可能与上述研究有关。此外,三萜类化合物作为黑老虎的另一类主要成分,其在根部的丰度也远高于茎和叶,是否也是传统功效的主要物质有待进一步研究。本研究检测到的木脂素和萜类化合物只有少数被报道过,而前期鉴定得到的化合物也只有部分被广泛靶向代谢组学技术鉴定出来,可能由于次生代谢物受植物生长微环境及外界复杂环境等综合影响,今后还需扩大测试样本进行比较分析,探究黑老虎化学成分,为进一步明确药效物质、质量控制体系建立提供支持。
4 结论本研究结果显示,黑老虎根部特有木脂素类化合物较多,根部木脂素类化合物数量远多于茎和叶;以三萜类化合物为主导的萜类化合物,在数量上根部略多于茎和叶;根部与叶、茎相同及特有的木脂素和萜类化合物丰度均较高,使两类物质丰度远高于茎和叶。以上研究结果为黑老虎的综合利用和开发提供了参考。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志: 第30卷 第1册[M]. 北京: 科学出版社, 1999.
|
| [2] |
国家中医药管理局《中华本草》编委会. 中华本草: 第2册[M]. 上海: 上海科学技术出版社, 1999.
|
| [3] |
舒永志, 成亮, 杨培明. 黑老虎的化学成分及药理作用研究进展[J]. 中草药, 2011, 42(4): 805-813. |
| [4] |
SUN J, YAO J Y, HUANG S X, et al. Antioxidant activity of polyphenol and anthocyanin extracts from fruits of Kadsura coccinea (Lem.) A.C.Smith[J]. Food Chemistry, 2009, 117(2): 276-281. DOI:10.1016/j.foodchem.2009.04.001 |
| [5] |
BAN N K, THANH B V, KIEM P V, et al. Dibenzocyclooctadiene lignans and lanostane derivatives from the roots of Kadsura coccinea and their protective effects on primary rat hepatocyte injury induced by t-butyl hydroperoxide[J]. Planta Medica, 2009, 75(11): 1253-1257. DOI:10.1055/s-0029-1185537 |
| [6] |
延在昊, 成亮, 孔令义, 等. 黑老虎化学成分及其抗氧化活性研究[J]. 中草药, 2013, 44(21): 2969-2973. |
| [7] |
杨艳, 高渐飞. 冷饭团不同部位挥发性成分及抗氧化活性分析[J]. 广西植物, 2018, 38(7): 943-952. |
| [8] |
舒永志, 成亮, 曺濬喆, 等. 黑老虎的化学成分研究[J]. 中草药, 2012, 43(3): 428-431. |
| [9] |
段林坪. 黑老虎化学成分及生物活性研究[D]. 南京: 南京农业大学, 2018.
|
| [10] |
李力, 汤立洁, 徐永莉, 等. 近十年黑老虎的化学成分及功能作用研究进展[J]. 中药材, 2020, 43(1): 236-242. |
| [11] |
YANG Y P, HUSSAIN N, ZHANG L, et al. Kadsura coccinea: a rich source of structurally diverse and biologically important compounds[J]. Chinese Herbal Medicines, 2020, 12(3): 214-223. |
| [12] |
任伟光, 张翠英. 五味子的研究进展及质量标志物(Q-marker)的预测分析[J]. 中草药, 2020, 51(11): 3110-3116. |
| [13] |
LAU W, SATTELY E S. Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone[J]. Plant Science, 2015, 349(6253): 1224-1228. |
| [14] |
XU L, XU Z Z, WANG X, et al. The application of pseudotargeted metabolomics method for fruit juices discrimination[J]. Food Chemistry, 2020, 316: 126278. |
| [15] |
方贤胜, 吴涛, 肖良俊. 基于广泛靶向代谢组学的浅黄色和紫色核桃内种皮成分差异分析[J/OL]. 食品科学, 2020: 1-11(2020-03-03)[2021-12-05]. http://kns.cnki.net/kcms/detail/11.2206.ts.20200302.1522.016.html.
|
| [16] |
FRAGA C G, CLOWERS B H, MOORE R J, et al. Signature-discovery approach for sample matching of a nerve-agent precursor using liquid chromatography-Mass spectrometry, XCMS, and chemometrics[J]. Analytical Chemistry, 2010, 82: 4165-4173. |
| [17] |
THÉVENOT E A, ROUX A, XU Y, et al. Analysis of the human adult urinary metabolome variations with age, body mass index, and gender by implementing a comprehensive workflow for univariate and OPLS statistical analyses[J]. Journal of Proteome Research, 2015, 14: 3322-3335. |
| [18] |
MURAKAMI A, NAKAMURA Y, TORIKAI K, et al. Inhibitory effect of citrus nobiletin on phorbol ester-induced skin inflammation, oxidative stress, and tumor promotion in mice[J]. Cancer Research, 2000, 60: 5059-5066. |
| [19] |
LIN N, SATO T, TAKAYAMA Y, et al. Novel anti-inflammatory actions of nobiletin, a citrus polymethoxy flavonoid, on human synovial fibroblasts and mouse macrophages[J]. Biochemical Pharmacology, 2003, 65(12): 2065-2071. |
| [20] |
MA D F, ZHANG Y M, YANG T T, et al. Isoflavone intake inhibits the development of 7, 12-dimethylbenz(a)anthracene(DMBA)-induced mammary tumors in normal and ovariectomized rats[J]. Journal of Clinical Biochemistry & Nutrition, 2014, 54(1): 31-38. |
| [21] |
HU Z X, SHI Y M, WANG W G, et al. Kadcoccinones A-F, new biogenetically related lanostane-type triterpenoids with diverse skeletons from Kadsura coccinea[J]. Organic Letters, 2015, 17: 4616-4619. |
| [22] |
LIANG C Q, SHI Y M, LI X Y, et al. Kadcotriones A-C: tricyclic triterpenoids from Kadsura coccinea[J]. Journal of Natural Products, 2013, 76: 2350-2354. |
| [23] |
LIANG C Q, SHI Y M, LUO R H, et al. Kadcoccitones A and B, two new 6/6/5/5-fused tetracyclic triterpenoids from Kadsura coccinea[J]. Organic Letters, 2012, 14(24): 6362-6365. |


