2. 南方医科大学中医药学院,广东广州 510515;
3. 广东省中药制剂重点实验室,广东广州 510515
2. School of Traditional Chinese Medicine, Southern Medical University, Guangzhou, Guangdong, 510515, China;
3. Guangdong Provincial Key Laboratory of Chinese Medicine Pharmaceutics, Guangzhou, Guangdong, 510515, China
海洋放线菌因其特殊的生存环境,蕴藏着丰富、结构新颖、活性独特的次生代谢产物资源,开发潜力巨大,其中超过50%的抗生素来自海洋放线菌[1]。在过去的几十年里,海洋放线菌产生的次级代谢产物是抗生素、抗肿瘤剂、驱虫药和抗真菌剂的丰富来源[2]。然而,由于取样难和培养技术的限制,对深海放线菌及其代谢物的研究非常有限,远远低于浅水和陆地来源放线菌的研究[3]。目前研究中可利用的海洋放线菌活性菌株资源依然有限,且利用率较低,如何深入、有效地挖掘现有深海放线菌化学多样性是其可持续利用的关键。
最近的研究发现,在放线菌基因组中有大量生物合成基因簇,这些基因簇在标准的实验室培养条件下似乎没有表达[4]。激活这些神秘的基因簇有望增加发现新型天然产物的机会。因此,需要新手段、新方法去激活基因簇的表达,以发现更多结构新颖的次级代谢产物。
放线菌具有复杂的形态划分机制和代谢调控网络,能产生较多次级代谢产物,而大部分生物合成基因簇在标准的培养条件下处于休眠状态[5]。单菌多次级代谢产物(OSMAC)策略[6]已被证明是一种简单而强大的工具,其通过改变培养条件、培养方法等手段,可以激活微生物中的许多沉默生物遗传基因簇,从而获得大量具有活性的代谢产物和天然产物。例如,Abdelmohsen等[7]分别使用4种不同培养基培养红海海绵放线菌Actinokineosopora sp.EG49,并从肉汤培养基的发酵液中分离出两种新化合物Actinosporins A和Actinosporins B,其中Actinosporins A对布氏锥虫(Trypanosoma brucei)的半抑制浓度(IC50)为15 μmol/L。Sproule等[8]分别采用14种液体培养基培养从爱德华岛沉积物中分离得到的放线菌Streptomyces sp.RKND004,在细菌种子培养基(BSM)的发酵液中分离得到两种多环聚醚离子载体Terrosamycins A和Terrosamycins B,这两种载体对革兰氏阳性菌均有较好的抗生素活性,对两种乳腺癌细胞均有抑制活性。Wu等[9]分别用7种液体培养基培养深海放线菌Streptomyces sp.YB104,并从ACM液体培养基的发酵液中得到浓度为25 mg/L的新天然产物Thinomycin B。此外,据文献报道,海洋细菌TM104在摇床发酵和静态发酵两种条件下产生不同的含硫抗生素(Tropodithietic acid TDA),表明TDA表达受环境和培养条件的影响[10]。
Streptomyces sp.SCSIO 15079是一株分离自印度洋深海-3 386 m沉积物的放线菌,前期通过小规模发酵罐发酵研究,从该菌株代谢产物浸膏中分离得到6个新的芳香酸类化合物和3个新的亮氨酸衍生物,这些化合物均有较好的降血脂活性[11]。为了深入研究Streptomyces sp. SCSIO 15079的化学和生物多样性,本研究运用OSMCA策略,考察海盐浓度、pH值及发酵方式对其次级代谢产物多样性的影响,并对发酵产物的差异部分进行分离和化学结构鉴定,以期进一步丰富放线菌的次级代谢产物研究。
1 材料与方法 1.1 材料放线菌Streptomyces sp.SCSIO 15079于2013年分离自印度洋深海沉积物样品(10.00371667°N, 88.72803333°E,-3 386 m),经16S rRNA基因测序及形态学分析,鉴定为链霉菌属(Streptomyces sp.),编号为SCSIO 15079,该菌株保存在南方医科大学中医药学院中药化学实验室。
A液体培养基:酵母提取粉1 g/L,甘油20 g/L,葡萄糖10 g/L,玉米粉5 g/L,大豆粉10 g/L,牛肉膏20 g/L,MgSO4 0.1 g/L,CaCO3 1 g/L,蒸馏水1 L,pH值为7.2。
仪器和试剂: AVANCEⅢTMHD-600 MHz核磁共振仪(德国Bruker公司),中压色谱仪(瑞士Buchi公司),Agilent1200/1260高效液相色谱仪(美国Agilent公司),半制备色谱柱(YMC-packODS-A, 10 mm×250 mm, 5 μm,日本YMC公司),硅胶柱色谱和薄层硅胶板(烟台江友硅胶开发有限公司),葡聚糖凝胶Sephadex LH-20 (美国Amersham公司),EYELAN-1001型旋转蒸发仪(上海爱朗仪器有限公司),CDCl3、CD3OD、DMSO-d6等氘代溶剂(美国CIL公司),提取分离所用试剂石油醚、乙酸乙酯、二氯甲烷、甲醇等均为分析纯(天津市津东天正精细化工试剂厂),液相乙腈、甲醇等均为色谱纯(上海星可高纯溶剂有限公司)。
1.2 方法 1.2.1 菌株发酵条件优化菌株Streptomyces sp.SCSIO 15079经过活化后,接种到装有100 mL A液体培养基的1 L三角瓶中,在28℃、180 r/min的摇床中培养3 d即获得种子培养液。
将种子培养液以3%的接种量转移至装有300 mL A液体培养基的1 L三角瓶中,以A液体培养基作为初始培养基,控制pH值在7.2左右,于28℃的摇床中180 r/min振荡培养5 d后对海盐的浓度(0%、3%、5%)进行考察;取确定的海盐浓度并按原来的培养条件对pH值(4.0,5.0,7.2,8.0,10.0)进行考察;取确定的海盐浓度和pH值并按原来的培养条件考察发酵时长(5 d、6 d、7 d)。每个条件设3个平行样,观察并记录菌株的生长状况。采用高速离心的方法将菌丝体和菌液分开,分别用500 mL乙酸乙酯萃取3次,再分别合并菌体和发酵液的萃取液,浓缩,得到发酵液乙酸乙酯相浸膏。通过建立指纹图谱分析比对紫外吸收,找出产物最丰富的发酵条件。
1.2.2 发酵方式对菌株次级代谢产物多样性的影响在1.2.1节确定的发酵条件下,将种子液以3%的比例接种到装有300 mL A液体培养基的1 L三角瓶中,发酵体积28 L,28℃、180 r/min摇床培养7 d得到摇床发酵液。发酵罐发酵则是将3%的种子液接入到装有40 L发酵液的发酵罐中,通过发酵罐里面溶解氧(DO)水平来确定发酵终止时间,最终发酵时间为80 h。通过指纹图谱对比紫外吸收分析不同发酵方式对Streptomyces sp.SCSIO 15079次级代谢产物多样性的影响。
1.2.3 化合物提取分离与纯化摇床发酵结束后,得到的发酵液通过超速离心机将菌丝体和菌液分离,分别向菌丝体和菌液中加入双倍乙酸乙酯,37℃超声30 min,浸泡过夜,抽滤后收集上清液。在38℃下进行减压蒸馏除去上清液中的乙酸乙酯,剩下菌丝体及菌液中再加入回收的乙酸乙酯,重复浸泡提取3次,最终合并菌液和菌丝体的乙酸乙酯萃取物,得粗浸膏为50.0 g。
浸膏采用正相硅胶柱色谱、十八烷基硅烷(Octadecyl Silane, ODS)反相柱色谱、葡聚糖凝胶柱色谱、半制备高效液相色谱等方法对摇床发酵产物中与发酵罐发酵具有差异的化学成分进行导向分离和纯化,并根据核磁共振方法和文献对比鉴定化合物结构。
2 结果与分析 2.1 发酵条件优化结果所得浸膏经HPLC分析发现,随着海盐浓度的增加,菌株次级代谢产物减少;在pH值为7时,菌株的代谢产物比偏酸性和偏碱性条件的代谢产物更丰富;发酵时间为7 d时,指纹图谱中小极性吸收峰有所增加。因此,最后确定的最佳发酵条件:不添加海盐、pH值为7.2的A液体培养基,摇床发酵时长为7 d。
2.2 化合物的提取与分离结果浸膏用硅胶拌样,用正相硅胶色谱柱进行梯度洗脱(石油醚-乙酸乙酯0-100%、乙酸乙酯-甲醇0-100%,流速50 mL/min),经薄层色谱法合并为10个馏分Fr.1-10。Fr.10经ODS反相中压梯度洗脱、半制备高效液相色谱(MeOH∶H2O=75∶25)纯化得到化合物 6 (3.2 mg)。Fr.4经ODS反相中压梯度分离成3小段,Fr.4-3经葡聚糖凝胶柱色谱分离合并后,采用半制备高效液相色谱(MeOH∶H2O=80∶20)纯化得到化合物 1 (5.5 mg),采用半制备高效液相色谱(MeOH∶H2O=55∶45)纯化得到化合物 2 (3.3 mg)。Fr.6经ODS反相中压柱色谱、葡聚糖凝胶柱色谱分析合并得到10个组分,Fr.6-10采用半制备高效液相色谱(MeOH∶H2O=35∶65)纯化得到化合物 4 (4.2 mg)和化合物 3 (6.1 mg),Fr.6-5再次经葡聚糖凝胶柱色谱、半制备高效液相色谱(MeOH∶H2O=60∶40)纯化分别得到化合物 5、化合物 7、化合物 8和化合物 9 (2-5 mg)。
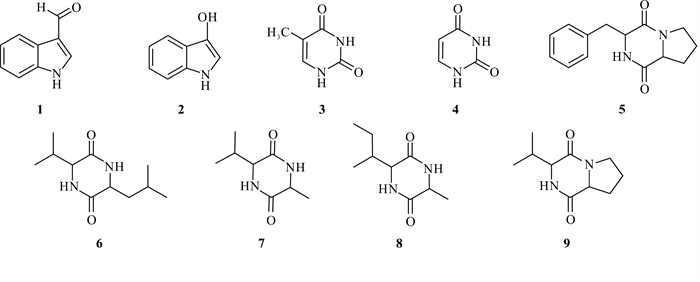
2.3 化合物的结构鉴定结果化合物 1:白色片状晶体。1H-NMR(600 MHz,CD3OD)δ:9.90(1H,s,H-10),8.11(1H,s,H-2),8.17(1H,d,J=7.7 Hz,H-5),7.49(1H,d,J=8.0 Hz,H-6),7.23-7.30(2H,m,H-7,H-8);13C-NMR(151 MHz,CD3OD)δ:187.1(C-10)139.4(C-2),125.4(C-3)为138.6(C-9),124.7(C-6),123.3(C-7),122.1(C-5),119.8(C-4),112.8(C-8)。以上数据与文献[12]报道的吲哚甲醛一致,确认化合物 1为吲哚甲醛。
化合物 2:白色晶体。1H-NMR(600 MHz,CD3OD)δ:7.16(1H,s,H-2),7.54(1H,d,J=7.9 Hz,H-5),7.34(1H,d,J=8.1 Hz,H-6),7.09(1H,m,H-7),7.01(1H,m,H-8);13C-NMR(151 MHz,CD3OD)δ:138.0(C-3),124.5(C-2),128.7(C-9),124.6(C-6),122.4(C-7),119.8(C-5),109.1(C-4),112.2(C-8)。通过对比文献[12],确认化合物 2为3-羟基吲哚。
化合物 3:白色粉末。1H-NMR(600 MHz,DMSO-d6)δ:0.95(1H,brs,NH),10.61(H,brs,NH),7.32(1H,s,H-6),1.70(3H,s,H-7);13C-NMR(151 MHz,DMSO-d6)δ:165.0(C-4),151.5(C-2),137.8(C-6),107.7(C-5),11.8(C-7)。通过对比文献[13],确定化合物 3为胸腺嘧啶。
化合物 4:白色粉末。1H-NMR(600 MHz,DMSO-d6)δ:10.93(2H,brs,2NH),7.37(1H,d,J=7.5 Hz,H-5),5.42(1H,d,J=7.5 Hz,H-6);13C-NMR(151 MHz,DMSO-d6)δ:164.4(C-2),151.6(C-4),142.3(C-6),100.2(C-5)。通过对比文献[13],确定化合物 4为尿嘧啶。
化合物 5:黄色固体。1H-NMR(600 MHz,CDCl3)δ:7.22-7.37(5H,m,H2′-6′),4.27(1H,dd,J=3.0,10.7 Hz,H-9),4.08(1H,t,J=7.6 Hz,H-6),3.67(1H,m,Ha-10),3.60(2H,m,H-3),2.78(1H,m,Hb-10),2.33(1H,m,Ha-5),2.02(2H,m,H-4),1.91(1H,m,Hb-5);13C-NMR(151 MHz,CDCl3)169.5(C-1),165.2(C-7),136.0(C-1′),129.5(C-2′),129.2(C-3′),129.5(C-6′),129.2(C-5′),127.7(C-4′),59.3(C-6),56.3(C-9),45.6(C-3),36.9(C-10),28.5(C-5),22.7(C-4)。以上数据与文献[14]报道一致,故鉴定化合物 5为环-(苯丙氨酸-脯氨酸)二肽。
化合物 6:白色无定型结晶,易溶于氯仿。1H-NMR(600 MHz,CDCl3)δ:4.01(1H,d,J=10.0 Hz,H-3),3.90(1H,m,H-6),2.41(1H,m,H-11),1.89(1H,m,H-8),1.79(1H,m,Ha-7),1.67(1H,m,Hb-7),1.05(3H,d,J=7.14 Hz,H-12),0.99(3H,d,J=6.54 Hz,H-12),0.95(6H,d,J=6.42 Hz,H-9,10);13C-NMR(151 MHz,CDCl3)δ:169.1(C-2),167.5(C-5),60.3(C-3),53.2(C-6),31.6(C-11),24.3(C-8),43.8(C-7),23.4(C-9),21.1(C-10),28.9(C-12),16.5(C-13)。以上数据与文献[15]报道一致,故鉴定化合物 6为环-(亮氨酸-缬氨酸)二肽。
化合物 7:黄棕色固体。1H-NMR(600 MHz,CDCl3)δ:4.12(1H,m,H-6),3.86(1H,m,H-3),2.11(1H,m,H-7),1.50(3H,d,J=7.0 Hz,H-10),1.05(3H,d,J=7.1 Hz,H-8),0.97(3H,d,J=6.84 Hz,H-9);13C-NMR(151 MHz,CDCl3)δ:169.4(C-5),168.0(C-2),61.2(C-3),50.3(C-6),32.7(C-7),19.8(C-10),18.8(C-8),16.5(C-9)。以上数据与文献[16]报道一致,故鉴定化合物 7为环-(丙氨酸-缬氨酸)二肽。
化合物 8:白色固体。1H-NMR(600 MHz,CD3OD)δ:4.03(1H,m,H-3),3.90(1H,s,H-6),1.87-2.00(1H,m,H-8),1.51(1H,m,H-9a),1.43(3H,d,J=7.1 Hz,H-7),1.20-1.29(1H,m,H-9b),1.01(3H,d,J=7.1 Hz,H-11),0.94(3H,t,J=7.4 Hz,H-10);13C-NMR(151 MHz,CD3OD)δ:171.3(C-2),169.2(C-5),60.9(C-6),51.6(C-3),40.3(C-8),25.6(C-9),20.9(C-7),15.5(C-11),12.2(C-10)。以上数据与文献[17]报道一致,故鉴定化合物 8为环-(丙氨酸-异亮氨酸)。
化合物 9:白色固体。1H-NMR(600 MHz,DMSO-d6)δ:6.86(1H,brs,H-8),4.08(1H,dd,J=10.0,6.4 Hz,H-6),3.83-3.61(2H,m,H-5),3.51(1H,m,H-9),2.50-2.14(2H,m,H-3),2.12-1.69(2H,m,H-4),1.03(3H,d,J=6.9 Hz,H-11),0.98(3H,d,J=6.8 Hz,H-12);13C-NMR(151 MHz,DMSO-d6)δ:168.7(C-1),165.0(C-7),62.6(C-9),57.6(C-6),45.1(C-3),32.4(C-10),29.0(C-5),21.5(C-4),19.0(C-11),18.3(C-12)。以上数据与文献[18]报道一致,故鉴定化合物 9为环-(缬氨酸-脯氨酸)。
化合物 1 - 9结构式如图 1所示。
|
| 图 1 化合物 1 - 9结构式 Fig. 1 Structure formula of compounds 1 - 9 |
3 讨论
为了激活菌种中不同的合成基因簇,获得更多结构新颖的化合物,前人采用OSMAC策略开展菌种次级代谢产物多样性研究,目前该类研究大多数采用改变培养基成分而发酵方式不变的方式,改变发酵方式而培养基成分不变的方式研究较少,因此相关实验机制尚不确定。本研究基于OSMAC策略,在相同培养基条件下,采用单因素实验研究发酵条件和发酵方式对深海来源放线菌Streptomyces sp.SCSIO 15079次级代谢产物多样性的影响。研究结果表明,Streptomyces sp.SCSIO 15079在不添加海盐、pH值为7.2的A液体培养基中摇床发酵7 d,可产生更多具有活性的次级代谢产物。经指纹图谱比对发现,使用摇床和发酵罐两种不同发酵方式获得的发酵产物,其色谱峰紫外吸收差异较大。进一步对比研究发现,从摇床发酵产物中分离出9个与发酵罐发酵产物不一样的化合物,经鉴定均为含氮类化合物,包括2个吲哚类化合物,吲哚甲醛(1H-indole-3-carbaldehyde,1)、3-羟基吲哚(3-Hydroxy-1H-indole,2);2个嘧啶类化合物,胸腺嘧啶(Thymine,3)、尿嘧啶(Uiracil,4);5个环二肽类氨基酸,环-(苯丙氨酸-脯氨酸)二肽[Cyclo(Phe-Pro),5]、环-(亮氨酸-缬氨酸)二肽[Cyclo(Leu-Val),6]、环-(丙氨酸-缬氨酸)二肽[Cyclo(Ala-Val),7]、环-(丙氨酸-异亮氨酸)二肽[Cyclo(Ile-Ala),8]、环-(缬氨酸-脯氨酸)二肽[Cyclo(Val-Pro),9]。前期研究发现,发酵罐发酵得到11个化合物,其中有9个新化合物,且均有较好的降血脂活性[11],而摇床发酵得到的化合物大多数为含氮类生物碱,说明不同发酵方式同样也能影响菌株基因的转录和翻译,调控不同的代谢途径,这也是对OSMAC策略的一种补充。推测其原因:一是两者培养基灭菌方式不同,摇瓶是通过外流蒸汽静态加热,发酵罐是培养基直接与蒸汽混合加热,因此影响了培养基的质量;二是两者在发酵过程中溶解氧含量不同,摇瓶发酵处于密封缺氧状态,发酵罐在发酵过程中通入无菌气体并搅拌,具体因素有待进一步研究。本研究结果进一步丰富了放线菌的次级代谢产物研究,并为深海来源创新药物研发提供了重要物质基础和科学依据。
| [1] |
WATVE M G, TICKOO R, JOG M M, et al. How many antibiotics are produced by the genus Streptomyces[J]. Archives of Microbiology, 2001, 176(5): 386-390. DOI:10.1007/s002030100345 |
| [2] |
JAGANNATHAN S V, MANEMANN E M, ROWE S E, et al. Marine actinomycetes, new sources of biotechnological products[J]. Marine Drugs, 2021, 19(7): 365. DOI:10.3390/md19070365 |
| [3] |
MANITA K, PERIYASAMY S, DENG Z, et al. Deep sea actinomycetes and their secondary metabolites[J]. Frontiers in Microbiology, 2017, 8(6): 760. |
| [4] |
XU D, HAN L, LI C, et al. Bioprospecting deep-sea actinobacteria for novel anti-infective natural products[J]. Frontiers in Microbiology, 2018, 9: 787. DOI:10.3389/fmicb.2018.00787 |
| [5] |
杨红文, 程彦伟, 张敬虎. 链霉菌次生代谢和形态分化调控研究进展[J]. 绵阳师范学院学报, 2009, 28(11): 63-68. |
| [6] |
BODE H B, BETHE B, HÖFS R, et al. Big effects from small changes: possible ways to explore nature's chemical diversity[J]. ChemBioChem, 2002, 3(7): 619-627. DOI:10.1002/1439-7633(20020703)3:7<619::AID-CBIC619>3.0.CO;2-9 |
| [7] |
ABDELMOHSEN U R, CHENG C, VIEGELMANN C, et al. Dereplication strategies for targeted isolation of new antitrypanosomal actinosporins A and B from a marine sponge associated-Actinokineospora sp.EG49[J]. Marine Drugs, 2014, 12(3): 1220-1244. DOI:10.3390/md12031220 |
| [8] |
SPROULE A, CORREA H, DECKEN A, et al. Terrosamycins A and B, bioactive polyether ionophores from Streptomyces sp.RKND004 from prince edward island sediment[J]. Marine Drugs, 2019, 17(6): 347. DOI:10.3390/md17060347 |
| [9] |
WU Q, ZHANG G, WANG B, et al. Production and identification of inthomycin B produced by a deep-sea sediment-derived Streptomyces sp.YB104 based on cultivation-dependent approach[J]. Current Microbiology, 2018, 75: 942-951. DOI:10.1007/s00284-018-1469-1 |
| [10] |
GENG H, BELAS R. Expression of tropodithietic acid biosynthesis is controlled by a novel autoinducer[J]. Journal of Bacteriology, 2010, 192(17): 4377-4387. DOI:10.1128/JB.00410-10 |
| [11] |
SU Z, LI K, LUO X, et al. Aromatic acids and leucine derivatives produced from the deep-sea actinomycetes Streptomyces chumphonensis SCSIO 15079 with antihyperlipidemic activities[J]. Marine Drugs, 2022, 20(4): 259. DOI:10.3390/md20040259 |
| [12] |
YANG Q, YE G. A new C-glucoside from commelina communis[J]. Chemistry of Natural Compounds, 2009, 45(1): 59-60. DOI:10.1007/s10600-009-9253-x |
| [13] |
史大永, 韩丽君, 孙杰, 等. 刺状鱼栖苔化学成分研究[J]. 中国中药杂志, 2007, 32(11): 1035-1037. |
| [14] |
ADAMCZESKI M, REED A R, CREWS P. New and known diketopiperazines from the caribbean sponge, Calyx cf.podatypa[J]. Journal of Natural Products, 1995, 58(2): 201-208. DOI:10.1021/np50116a007 |
| [15] |
高昊, 唐金山, 洪葵, 等. 红树林真菌泡盛酒曲霉中的环二肽和核苷类成分[J]. 中草药, 2008, 39(4): 502-504. |
| [16] |
DING Z G, ZHAO J Y, YANG P W, et al. 1H and 13C NMR assignments of eight nitrogen containing compounds from Nocardia alba sp.nov (YIM 30243T)[J]. Magnetic Resonance in Chemistry, 2009, 47(4): 366-370. DOI:10.1002/mrc.2393 |
| [17] |
李旸, 王芳, 张普照, 等. 美洲大蠊化学成分研究[J]. 中药材, 2015, 38(10): 2038-2041. |
| [18] |
王举涛, 张培良, 王刚, 等. 凤丹内生真菌Fusarium oxysporum次生代谢产物的研究[J]. 中草药, 2018, 49(22): 5247-5253. |



