2. 江苏省海洋水产研究所,江苏南通 226007;
3. 江苏省农业种质资源保护与利用平台,江苏南京 210014;
4. 上海海洋大学,上海 201306
2. Jiangsu Marine Fisheries Research Institute, Nantong, Jiangsu, 226007, China;
3. Protection and Utilization of Agricultural Germplasm Resources in Jiangsu Province, Nanjing, Jiangsu, 210014, China;
4. Shanghai Ocean University, Shanghai, 201306, China
条斑紫菜(Neopyropia yezoensis)属红藻门(Rhodophyte)红藻纲(Rhodophyceae)红毛菜目(Bangiales)红毛菜科(Bangiaceae)紫菜属(Neopyropia)[1]。条斑紫菜是中国、日本和韩国主要的紫菜栽培品种,具有较高的经济价值,2020年我国江苏省紫菜行业总产值约200亿元,整个行业从业人员14-15万人(江苏省紫菜协会提供,http://www.jslaver.com/index.php/Home/Index/hydt.html)。此外,条斑紫菜也具有较高的生态修复能力,可以从栽培海区吸收大量的氮、磷,降低富营养化指数,并固定碳,增加海洋碳汇[2]。
绿藻是条斑紫菜栽培中主要的附生杂藻,分布在栽培筏架的毛竹、缆绳、网帘等各处,筏架绿藻生物量具有显著的双峰特征,即每年的9月、11月以及次年的3-5月为筏架绿藻生长旺盛时期[3]。附着在筏架上的绿藻与紫菜竞争生态位、抑制紫菜生长[4]。采收的紫菜中混入绿藻,不仅需要消耗大量人力予以清除,还会降低紫菜质量。目前,清除紫菜养殖筏架绿藻的方法主要有干露法[5-7]、冷藏网技术[8, 9]、氧化除藻剂等方法[10, 11]。此外,酸处理也是一种高效清除筏架绿藻的方法[12-15]。并且酸处理具有杀灭藻体叶表动物(Phytal animals)[16],降低紫菜重金属含量[17],治理赤腐病[18]、Suminori病[19],驱除硅藻与蓝藻[20]以及提高紫菜品质的作用[14]。目前,关于酸处理对条斑紫菜及其附生绿藻活性的影响仍缺乏系统研究,有待进一步完善。
1977年日本千叶县渔民发现浒苔(Ulva prolifera)和紫菜在不同pH值下的致死时间存在差异,建立了紫菜栽培酸处理技术,并以此法处理浒苔。1984年日本水产厅规定了酸处理及后续管理方法,开始用有机酸替代无机酸[18]。韩国则是从20世纪80年代末开始重视紫菜栽培中酸处理的必要性[15],酸处理成本甚至占到了栽培成本的1/2,因此,1995年开始由政府与地方补贴有机酸的费用[21]。而酸处理技术只应用于我国紫菜支柱式栽培业,且目的单一、方法粗放,只是采用浸酸法清除海区出苗期的浒苔,并通过观察紫菜与浒苔颜色变化评估酸处理效果。半浮式与全浮式栽培模式则未有酸处理技术的应用,更缺乏相关技术文献与标准。目前,日本和韩国的条斑紫菜的单产水平显著高于中国,原因除了与品种和海区有关外,结合酸处理技术的栽培方式也是重要因素。因此,国内的紫菜栽培业迫切需要建立并完善紫菜栽培的酸处理技术,推动该技术的落地。
本研究以条斑紫菜及其附着绿藻为研究对象,通过测定经盐酸溶液处理40 s后的条斑紫菜和绿藻的光合效率、光合色素与丙二醛(MDA)含量以及抗氧化酶活性变化,探讨不同pH值的盐酸溶液对条斑紫菜和绿藻光合生理与抗氧化生理的影响,为防治栽培条斑紫菜附生绿藻提供科学基础,提高国内紫菜从业者对酸处理技术的重视程度,从而推动紫菜栽培技术的进步。
1 材料与方法 1.1 实验材料和酸处理方法条斑紫菜与绿藻样品于2021年3月取自江苏南通海域紫菜养殖筏架。条斑紫菜与绿藻样品清洗后分别放入3% PES营养液海水中恢复培养2 d,光照强度60 μmol·m-2·s-1,光周期为12 D∶12 L,温度10 ℃。绿藻样品经形态学鉴定为缘管浒苔(U.linza),挑取健康完整的、长度5-10 cm的条斑紫菜和长度10-30 cm的缘管浒苔藻体进行实验。
使用11.6 mol/L浓盐酸与pH值为8.0的天然灭菌海水配置不同pH值(pH值为1.1、1.4、1.7、1.9) 4个浓度的盐酸溶液(分别记为pH 1.1、pH 1.4、pH 1.7、pH 1.9处理组),并以pH值为8.0的海水作为对照。取一定量条斑紫菜与缘管浒苔浸入5组溶液中搅拌40 s后取出,海水清洗多余盐酸溶液后放入1 m3流动海水中培养,海水pH值保持稳定,培养条件同上。分别于处理前、处理2 d和7 d后对藻体进行观察、拍照,并进行叶绿素荧光参数、色素含量、MDA含量以及抗氧化酶活性测定。
1.2 藻体生长状态与光合色素含量变化取不同处理的条斑紫菜与缘管浒苔藻体,吸干表面水分后称取(0.10±0.02) g,加入液氮充分研磨,再用8 mL 100%甲醇浸提,避光静置24 h后,于4 ℃、5 000 r/min下离心10 min,用紫外可见光分光光度计(UV-2450,日本岛津)测定上清液的吸光值(OD),对照液为100%甲醇。叶绿素a (Chl a)和类胡萝卜素(Car)含量的测定参考Wellburn[22]的方法,具体计算公式如下:
| $ \begin{aligned} & \text { Chl } a(\mathrm{mg} / \mathrm{g})=\left[16.29 \times\left(O D_{665}-O D_{750}\right)-\right. \\ & \left.\left.8.54 \times O D_{652}-O D_{750}\right)\right] V /(1000 F w), \end{aligned} $ |
| $ \begin{aligned} & \text { Car } (\mathrm{mg} / \mathrm{g})=\left\{7.6 \times\left(O D_{480}-O D_{750}\right)-\right. \\ & \left.\left.1.49 \times O D_{510}-O D_{750}\right)\right\} V /(1000 F w), \end{aligned} $ |
其中,OD665、OD750、OD652、OD480、OD510分别代表在波长665、750、652、480、510 nm处的吸光值;V代表提取液体积(mL);Fw表示海藻的鲜重(g)。
1.3 叶绿素荧光参数的测定将紫菜和缘管浒苔置于黑暗条件下处理20 min后用调制叶绿素荧光仪(PAM Ⅱ,德国WALZ)测定藻体光系统Ⅱ(PSⅡ)最大光化学量子效率(Fv/Fm)值,每组实验5个重复。
1.4 抗氧化酶SOD、POD和脂质过氧化产物MDA测定MDA、超氧化物歧化酶(SOD)与过氧化物酶(POD)值均采用南京建成试剂盒测定,设置3个生物学重复。
1.5 线性拟合最佳酸处理条件选取文献[14, 20]中酸处理法杀灭缘管浒苔的最佳pH值、时间与本研究中最佳的pH值、酸处理时间进行线性拟合。选取条件为缘管浒苔细胞死亡率≥90%或Fv/Fm值< 0.2,且条斑紫菜细胞死亡率 < 1%或Fv/Fm值与对照组没有显著差别。
1.6 数据处理采用Origin 7.0软件进行数据处理与作图,用One-way ANOVA检验差异显著水平,设置显著水平为P < 0.05。
2 结果与分析 2.1 酸处理对藻体状态与光合色素的影响条斑紫菜pH 1.9处理组恢复培养7 d内藻体颜色无明显变化(图 1),叶绿素a、类胡萝卜素含量与初始值相比均没有显著区别(表 1)。经pH值为1.1、pH值为1.4和pH值为1.7的盐酸溶液处理的条斑紫菜的叶绿素a与类胡萝卜素含量在第2天显著下降,此时仅pH 1.1处理组颜色变淡,其他处理组条斑紫菜颜色变化不显著。随着pH值降低和恢复培养时间增加,叶绿素a与类胡萝卜素含量呈递减趋势,处理7 d后,条斑紫菜藻体除pH 1.9处理组外,其他处理组颜色均有一定程度变浅。而在酸处理2 d后所有缘管浒苔处理组颜色均显著变为黄绿色,叶绿素a与类胡萝卜素含量均显著下降,在处理7 d后,缘管浒苔藻体均变白,仅有少量藻体呈黄绿色,叶绿素a与类胡萝卜素含量均无法检测到。

|
| Above is N.yezoensis, below is U.linza. 图 1 不同pH值与恢复时间下条斑紫菜与缘管浒苔的状态 Fig. 1 Activities of N.yezoensisand U.linza under different pH value and recovery time |
| n=3, x±SD/(mg/g) | |||||||||||||||||||||||||||||
| 恢复时间/(d) Recovery time/(d) |
处理条件 Treatment condition |
条斑紫菜N.yezoensis | 缘管浒苔U.linza | ||||||||||||||||||||||||||
| Chl a | Car | Chl a | Car | ||||||||||||||||||||||||||
| 0 | Initial value | 0.71±0.00 | 0.29±0.01 | 0.39±0.01 | 0.28±0.01 | ||||||||||||||||||||||||
| 2 | Control | 0.73±0.03 | 0.31±0.02 | 0.40±0.02 | 0.27±0.00 | ||||||||||||||||||||||||
| pH 1.9 | 0.74±0.03 | 0.31±0.02 | 0.21±0.02* | 0.04±0.00* | |||||||||||||||||||||||||
| pH 1.7 | 0.48±0.01* | 0.20±0.00* | 0.16±0.01* | 0.02±0.00* | |||||||||||||||||||||||||
| pH 1.4 | 0.35±0.01* | 0.14±0.02* | 0.12±0.00* | 0.03±0.00* | |||||||||||||||||||||||||
| pH 1.1 | 0.35±0.01* | 0.11±0.01* | 0.07±0.01* | 0.04±0.00* | |||||||||||||||||||||||||
| 7 | Control | 0.72±0.02 | 0.31±0.02 | 0.40±0.01 | 0.26±0.01 | ||||||||||||||||||||||||
| pH 1.9 | 0.73±0.02 | 0.29±0.01 | - | - | |||||||||||||||||||||||||
| pH 1.7 | 0.30±0.04* | 0.13±0.02* | - | - | |||||||||||||||||||||||||
| pH 1.4 | 0.20±0.01* | 0.08±0.00* | - | - | |||||||||||||||||||||||||
| pH 1.1 | 0.09±0.00* | 0.03±0.00* | - | - | |||||||||||||||||||||||||
| Note: * indicate significant differences compared to initial values. | |||||||||||||||||||||||||||||
2.2 酸处理对藻体叶绿素荧光参数的影响
经盐酸溶液处理2 d后,条斑紫菜pH 1.1和pH 1.4处理组Fv/Fm值显著下降,到第7天,Fv/Fm值分别下降至0.167 6±0.543 3、0.266 6±0.049 2;pH 1.7处理组在第2 d未有显著下降,第7天下降至0.632 4±0.036 6;pH 1.9处理组在7 d之内Fv/Fm值均未有显著变化[图 2(a)]。经盐酸溶液处理并恢复培养2 d后,缘管浒苔pH 1.1至pH 1.9处理组Fv/Fm值均呈现显著下降趋势,恢复培养第7天,Fv/Fm值均下降至0.1以下[图 2(b)]。
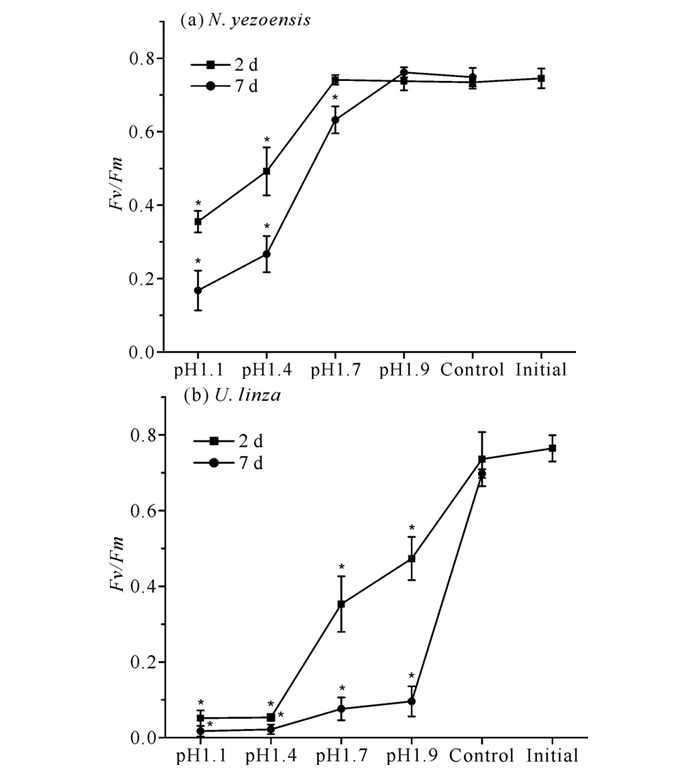
|
| * indicate significant differences compared to initial values. 图 2 不同pH值盐酸溶液处理对藻体Fv/Fm的影响 Fig. 2 Effect of treatment with different pH value of HCl solution on Fv/Fm |
2.3 酸处理对藻体抗氧化系统的影响
经pH值为1.9的盐酸溶液处理2 d与7 d后,条斑紫菜的SOD活性较初始值均未发生显著变化。经pH值为1.7的盐酸溶液处理,条斑紫菜的SOD活性在第2天较初始值显著上升,在第7天显著下降。而条斑紫菜pH 1.1和pH 1.4处理组在恢复培养的2 d与7 d,SOD活性与初始值相比均显著下降[图 3(a)]。pH值为1.1-1.9的盐酸溶液处理的缘管浒苔的SOD活性在第2天与第7天较初始值均显著下降,且随pH值下降与恢复时间增加呈下降趋势[图 3(b)]。
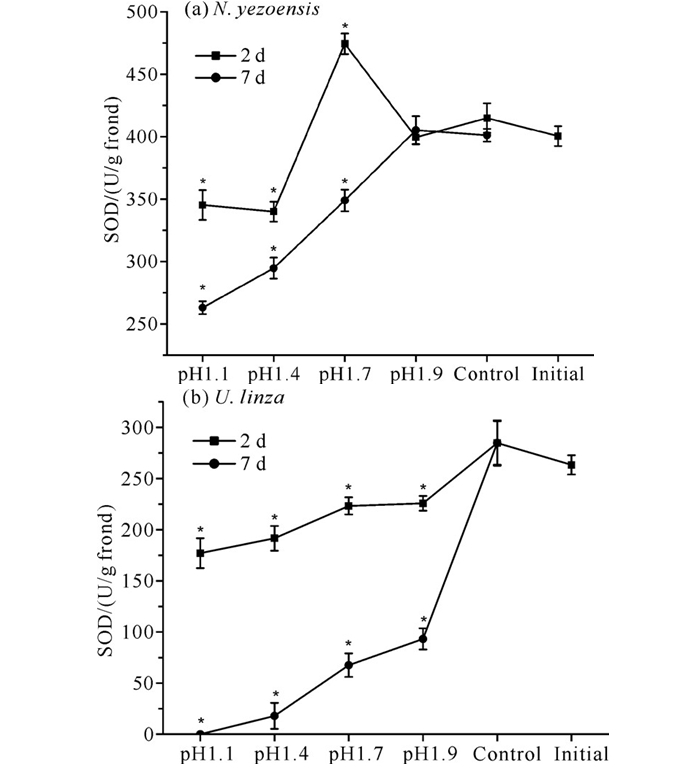
|
| * indicate significant differences compared to initial values. 图 3 不同pH值盐酸溶液处理对藻体SOD活性的影响 Fig. 3 Effect of treatment with different pH value of HCl solution on SOD activity |
除pH 1.9处理组外,条斑紫菜的POD活性随着酸处理pH值的下降与处理时间增加呈下降趋势,其中pH 1.1处理组在第7天的POD活性下降为0 [图 4(a)]。经pH值为1.1-1.9的盐酸溶液处理的缘管浒苔在恢复培养2 d后即无法检测到POD活性[图 4(b)]。
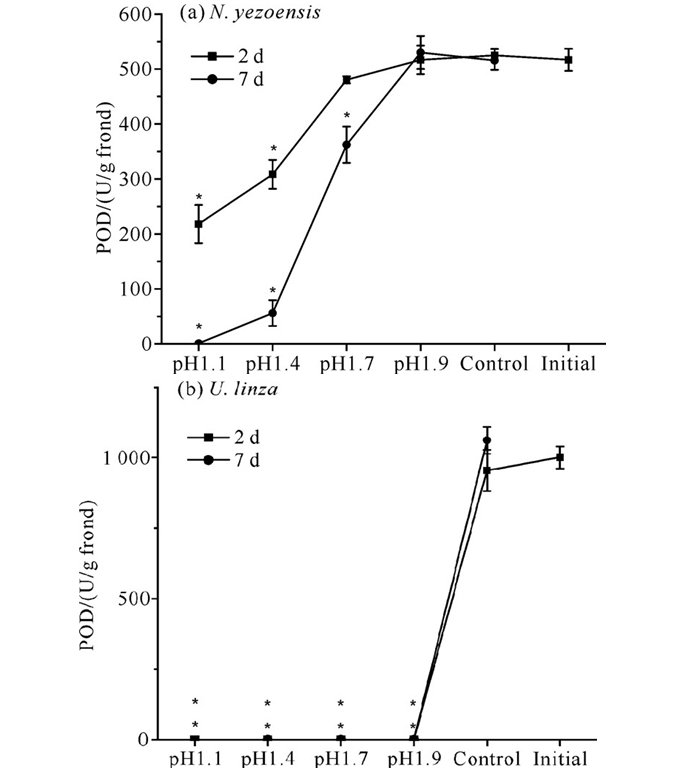
|
| * indicate significant differences compared to initial values. 图 4 不同pH值盐酸溶液处理对紫菜POD活性的影响 Fig. 4 Effect of treatment with different pH value of HCl solution on POD activity |
与SOD活性变化相似,经pH值为1.9的盐酸溶液处理的条斑紫菜在处理后恢复培养第2天与第7天,其MDA含量较初始值均未有显著改变;而pH1.7处理组在第2天的MDA含量较初始值显著上升,在第7天显著下降;pH 1.1、pH 1.4处理组的MDA含量较初始值显著下降[图 5(a)]。缘管浒苔所有处理组的MDA含量在酸处理2 d后就显著下降,且在酸处理7 d后进一步下降[图 5(b)]。
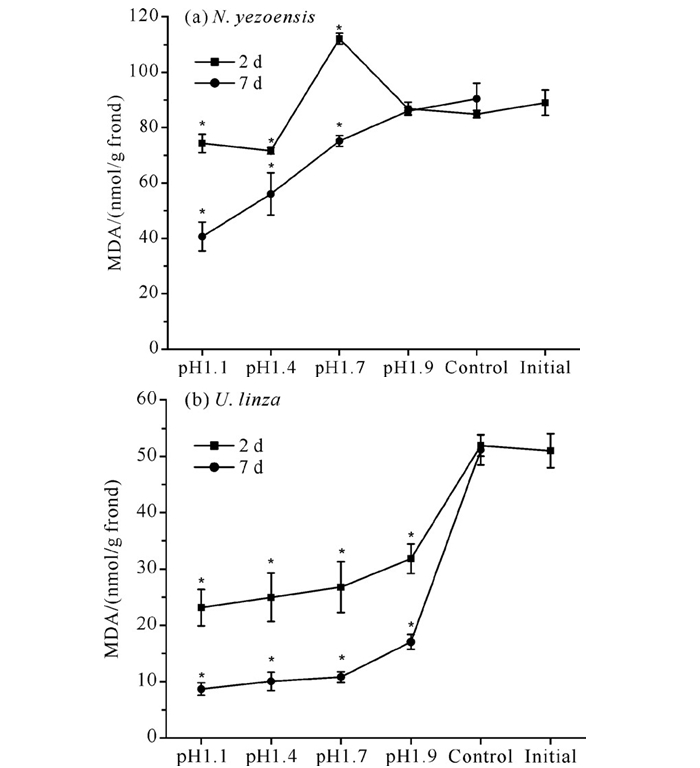
|
| * indicate significant differences compared to initial values. 图 5 不同pH值盐酸溶液处理对藻体MDA含量的影响 Fig. 5 Effect of treatment with different pH value of HCl solution on the MDA content |
2.4 最佳酸处理条件预测
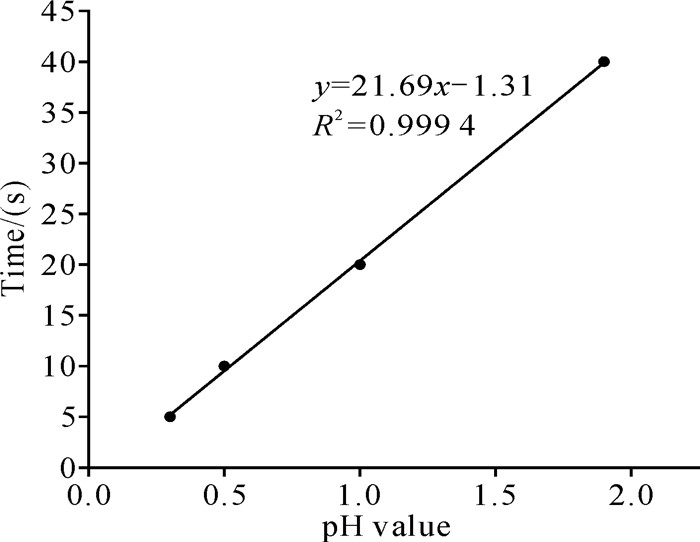
根据Kang等[20]的研究,采用pH值为8.0的海水配置8%、6%的盐酸海水溶液,测得2种溶液pH值分别为0.3、0.5,其处理条斑紫菜中缘管浒苔的最佳时间分别为5、10 s,并结合等[14]的实验处理条件:pH值为1.0的酸溶液处理20 s,以及本研究最佳酸处理条件:pH值为1.9的酸溶液处理40 s,以pH值为横坐标、处理时间为纵坐标进行线性拟合,得到线性方程y=21.69x-1.31,R2=0.999 4。其中y为酸处理时间(s),x为酸处理溶液pH值,R2为线性回归决定系数(图 6)。在pH值为0.3-1.9时,酸处理时间与酸处理溶液pH值呈正相关,pH值越高,所需酸处理时间越长。
|
| 图 6 最佳酸处理条件线性回归方程 Fig. 6 Linear regression equation of optimum acid treatment conditions |
3 讨论 3.1 酸处理对藻体生长状态的影响
判断酸处理对藻体细胞杀灭效果的方式各不相同。이상용等[14]在酸处理后即采用0.1%的赤藓红染色测定藻体细胞死亡率,严兴洪等[12]通过计算酸浸泡后恢复培养96 h的坛紫菜(Porphyra haitanensis)与浒苔的细胞死亡率来分析酸处理效果,Kang等[20]认为酸处理后恢复培养24 h的条斑紫菜与缘管浒苔的生理状态与48 h无异,并采用Fv/Fm值评价缘管浒苔的杀灭效果以及紫菜的恢复状态。本实验中,条斑紫菜在不同浓度盐酸溶液中浸泡40 s后颜色均未发生显著变化,而缘管浒苔颜色由绿色变为黄绿色。恢复培养2 d,pH 1.7及以下处理组的条斑紫菜颜色逐渐变淡,至第7天,仅pH 1.1处理组的条斑紫菜颜色几乎完全变白,视为完全死亡,其他处理组仍呈浅紫黑色,藻体部分细胞死亡,部分仍为正常状态,而缘管浒苔所有处理组恢复培养2 d,大部分细胞仍呈不健康的灰绿色,至第7天颜色才变为浅黄绿色至白色。因此,由于紫菜与绿藻藻体对酸的耐受性差异,短时间恢复效果并不能充分解释酸处理的实际效果,需要延长恢复培养时间并结合不同手段予以判断。
3.2 酸处理对藻体光合系统和光合色素的影响PSⅡ在光合作用的光能吸收和转换中起着重要的作用,而Fv/Fm值可以反映PSⅡ反应中心潜在的最大转换效率[23, 24]。PSⅡ具备一个高效的修复机制,在酸浓度较低或处理时间较短时,PSⅡ可以恢复,但当酸浓度较高或处理时间过长时,PSⅡ的损坏速率远超过修复速率,导致藻体PSⅡ无法修复[24]。Kang等[20]研究了酸处理对条斑紫菜与浒苔光合活性的影响,认为Fv/Fm值为0.183可作为条斑紫菜遭受酸应激后光合活性损伤恢复与否的阈值。在经过浓度分别为8%、6%、4%的盐酸溶液分别处理5、10、20 s后,缘管浒苔的Fv/Fm值降为0,而条斑紫菜的Fv/Fm值则无显著变化。经pH值为4的柠檬酸浸泡与3 h高光处理后恢复培养24 h,浒苔的Fv/Fm值降为0,而条斑紫菜的Fv/Fm值可恢复到对照组的85%[13]。本实验中,条斑紫菜藻体经pH值为1.9的盐酸溶液浸泡40 s后恢复培养7 d,Fv/Fm值与对照组无显著差异。说明条斑紫菜经pH值为1.9的盐酸溶液浸泡40 s后对光合系统没有显著影响。而缘管浒苔经酸处理后恢复培养2 d,Fv/Fm值显著下降,7 d后Fv/Fm值均下降到0.2以下。这可能是由于PSⅡ中的Mn中心被损坏导致能量失衡,从而导致PSⅡ中的D1蛋白裂解,最终使PSⅡ活性下降[13, 25]。pH 1.7及以下处理组在恢复培养7 d后,条斑紫菜与缘管浒苔的Fv/Fm值显著下降,且缘管浒苔的下降幅度大于条斑紫菜,说明在酸胁迫下条斑紫菜的光适应能力强于缘管浒苔。
经盐酸溶液浸泡40 s并恢复培养7 d后,pH 1.1至pH 1.7处理组的条斑紫菜叶绿素a含量下降到0.3 mg/g以下,缘管浒苔无法检测到叶绿素a含量,推测是由于H+置换叶绿素a中心的Mg离子导致叶绿素a结构破坏。且有研究表明类胡萝卜素在逆境下可以被活性氧(ROS)氧化,以减少ROS含量[26],因此藻体类胡萝卜素的下降是类胡萝卜素被ROS氧化导致。而pH 1.9处理组条斑紫菜的叶绿素a含量与类胡萝卜素含量均与对照组无显著区别,说明在酸胁迫下条斑紫菜的光适应能力强于缘管浒苔,且经pH值为1.9的盐酸溶液浸泡40 s对条斑紫菜光合系统无显著影响。
3.3 酸处理对藻体抗氧化系统的影响环境胁迫会诱导植物产生大量ROS,过量的ROS会破坏细胞质膜的结构与功能,导致细胞生理功能紊乱[27],植物通过提高保护酶活性以减少ROS对膜的伤害。SOD可以将ROS歧化为H2O2和O2[28]。POD又可以将SOD歧化产生的H2O2分解成H2O和O2来使细胞质膜免受伤害[29]。在本实验中,经pH值为1.9的盐酸溶液浸泡40 s的条斑紫菜在恢复培养2 d和7 d后,其SOD、POD活性和MDA含量与初始值没有显著性差异,表明条斑紫菜藻体抗氧化酶活性未遭受盐酸溶液胁迫或已恢复初始状态。条斑紫菜恢复培养2 d,pH 1.7处理组的SOD活性与MDA含量较初始值显著上升,恢复培养7 d后SOD、POD活性和MDA含量均显著下降。而条斑紫菜pH 1.4与pH 1.1处理组的SOD、POD活性和MDA含量在第2天即呈显著下降趋势,与缘管浒苔的所有酸处理组相似。推测随着pH值降低,POD活性因过量H+的攻击而下降,这是由于POD为一种含Fe-卟啉的血红蛋白[30],主要存在于细胞壁或细胞的质外体部分,它与膜表面紧密结合[31],H+置换Fe离子造成酶失活。细胞通过产生ROS来降低H+还原势,过量ROS导致膜脂过氧化,MDA是脂质过氧化的重要指标[32, 33],因而MDA含量增加。而条斑紫菜SOD为Mn-SOD型[34],主要作用于线粒体中[27],SOD活性增加以清除多余ROS,当H+量过多或ROS含量超过了细胞的调节能力,细胞活性难以恢复,导致SOD、POD活性与MDA含量较初始值均呈下降趋势。条斑紫菜在不同盐度(35‰-65‰)胁迫下,随着时间(2-12 h)的增加,MDA含量呈现先上升后下降的趋势,但仍高于初始值[35];在失水10%-80%条件下,MDA含量则随失水率逐渐增加[26],说明在此范围内,盐度与失水率的增加造成了条斑紫菜藻体的胁迫,仍未超过条斑紫菜细胞的调节能力,因此MDA含量始终高于初始值。而本研究中,条斑紫菜pH 1.7处理组的MDA含量与SOD活性在恢复培养2 d后高于初始值,说明此时细胞仍处于胁迫后应激反应阶段;7 d后显著低于初始值,说明过多的H+超过了细胞的调节能力,抑制了MDA的生成与SOD的活性。
3.4 酸处理pH值与时间的关系酸处理的浓度与处理时间是影响条斑紫菜及其附生杂藻活性的重要因素。坛紫菜在pH值为2.3的盐酸溶液中浸泡1-5 min细胞成活率均在92%以上,而处理1 min的浒苔细胞成活率为15.1%,处理3 min和5 min的浒苔细胞成活率均低于10%[12]。pH值为1.0的酸处理20 s可以使缘管浒苔细胞死亡率超过90%,而条斑紫菜细胞死亡率小于1%,pH值为1.5的酸处理30 s后缘管浒苔细胞死亡率为67.9%,而条斑紫菜细胞死亡率为0.1%[14]。经0.08 mol/L柠檬酸溶液处理3 min后石莼(U.lactuca)死亡率为100%,而羊栖菜(Sargassum fusiforme)幼苗的Fv/Fm和最大电子传递速率(ETRm)值在恢复培养120 h后均恢复到初始水平[25]。通过上述研究结果可以看出浒苔、缘管浒苔和石莼相较于坛紫菜、条斑紫菜和羊栖菜耐酸性差,这可能是由于石莼属绿藻,细胞壁较薄,使得H+轻易进入藻体并破坏叶绿素结构,导致藻体失去光合能力[25]。在本实验中,经pH值为1.9的盐酸溶液处理后条斑紫菜的光合色素含量以及抗氧化酶活性均与酸处理前没有显著变化,颜色与对照组无异,而缘管浒苔光合色素含量以及抗氧化酶活性均显著下降,藻体颜色变白、死亡。说明在pH值为1.9的盐酸溶液中浸泡40 s可杀灭缘管浒苔而对条斑紫菜藻体没有显著影响。
3.5 酸处理技术应用与展望前期海区酸处理测试中,将半浮筏式紫菜采收筏改造成酸处理筏,采用酸溶液行进式浸泡网帘的方法处理紫菜网帘,以达到除去网帘上杂藻的目的。酸处理筏在辐射沙洲海区进行了安装调试,根据处理筏行进速度,网帘浸入酸溶液至没入海水中的时间为40 s,酸处理最适pH值为1.9。在实际使用酸处理方法时,可根据线性方程y(时间,s)=21.69x(pH值)-1.31选择酸溶液的最佳pH值及其酸处理时间,在pH值为0.3-1.9时,pH值越高,酸处理时间越长。但该线性方程仍需根据紫菜生长期以及天气等具体情况加以调整,并适时添加酸溶液或增减网帘接触酸溶液的时间。随着将来研究数据量的增加,对酸处理pH值及其酸处理时间的预测将更为准确。此外,海水的碱度具有一定缓冲能力,本研究团队也对该海区酸处理前后的海水pH值进行了监测,并未发现酸处理对周围海水酸碱度带来明显影响,但酸处理的即时用酸量是否对海洋浮游生物、游泳动物以及底栖生物等产生影响,有待进一步研究。
| [1] |
YANG L E, DENG Y Y, XU G P, et al. Redefining Pyropia (Bangiales, Rhodophyta): four new genera, resurrection of Porphyrella and description of Calidia pseudolobata sp.nov.from China[J]. Journal of Phycology, 2020, 56(4): 862-879. DOI:10.1111/jpy.12992 |
| [2] |
陆勤勤, 周伟, 邓银银. 条斑紫菜栽培的经济效益与生态效益概述[J]. 中国水产, 2016(1): 53-54. |
| [3] |
谢国兴, 周永东, 鲍胜华, 等. 苏北浅滩半浮筏式条斑紫菜养殖区浒苔生态防治方法的思考[J]. 水产养殖, 2021, 42(1): 69-70. |
| [4] |
张清春, 孔凡洲, 颜天, 等. 苏北浅滩养殖筏架附生绿藻入海过程在黄海绿潮形成中的作用[J]. 海洋与湖沼, 2018, 49(5): 1014-1020. |
| [5] |
HUANG L B, PENG L N, YAN X H. Multi-omics responses of red algae Pyropia haitanensis to intertidal desiccation during low tides[J]. Algal Research, 2021, 58: 102376. DOI:10.1016/j.algal.2021.102376 |
| [6] |
XU D, SONG X W, LI F T, et al. Effects of desiccation, diurnal temperature changes and irradiance on archeospore production of Pyropia yezoensis[J]. Aquaculture, 2019, 509: 167-170. DOI:10.1016/j.aquaculture.2019.05.003 |
| [7] |
LI X S, SUN X, GAO L, et al. Effects of periodical dehydration on biomass yield and biochemical composition of the edible red alga Pyropia yezoensis grown at different salinities[J]. Algal Research, 2021, 56: 102315. DOI:10.1016/j.algal.2021.102315 |
| [8] |
马家海, 张礼明, 吉传礼, 等. 条斑紫菜冷藏网试验及其产品质量分析[J]. 水产学报, 1998(S1): 65-71. |
| [9] |
陈百尧. 条斑紫菜冷藏网技术应用研究[J]. 水产养殖, 1994(3): 18-20. |
| [10] |
朱莹, 张建恒, 华梁, 等. 次氯酸钠对扁浒苔叶绿素荧光特性及光合速率的影响[J]. 上海海洋大学学报, 2014, 23(2): 215-221. |
| [11] |
张浩. 黄海绿潮爆发机制分析及防治研究[D]. 大连: 大连海事大学, 2013.
|
| [12] |
严兴洪, 钟晨辉, 亓庆宝, 等. 鲜冻与酸处理对坛紫菜和浒苔苗存活的影响[J]. 上海海洋大学学报, 2011, 20(5): 697-704. |
| [13] |
LIU X H, HUAN L, GU W H, et al. Acid treatment combined with high light leads to increased removal efficiency of Ulva prolifera[J]. Algal Research, 2020, 45: 101745. DOI:10.1016/j.algal.2019.101745 |
| [14] |
이 상용, 황 미숙, 유 현일, 等. 방 사 무늬김(Pyropia yezoensis) 과 잎파래 (Ulva linza)의유기산활성처리 에대한 최적 pH 와 침지시간[J]. Korean Journal of Fisheries and Aquatic Sciences, 2021, 54(3): 293-297. |
| [15] |
김도희, 김우항, 공용근, 등. 환경친화적인 김 양식장의 산 처리 제 대 체 물 질 개 발[C]//한국어업기술학회 년도 춘계 수산관련학회 공동학술 대회발표요지집, [S. l. ]: 한국 어 업기 술학 회, 2000: 183-184.
|
| [16] |
HWANG E K, YOO H C, BAEK J M, et al. Effect of pH and salinity on the removal of phytal animals during summer cultivation of Sargassum fusiforme and Sargassum fulvellum in Korea[J]. Journal of Applied Phycology, 2015, 27(5): 1985-1989. DOI:10.1007/s10811-014-0511-3 |
| [17] |
목 종수, 손 광태, 이 태식, 等. 산 처리에 의한 김(Pyropia sp.)의 유해 중금속(Cd, Cr, Pb)제거 효과[J]. Korean Journal of Fisheries and Aquatic Sciences, 2016, 49(5): 556-563. |
| [18] |
秋月晃, 久野勝利, 吉田幸史, 等. 再使用酸処理液のアカグサレ菌に及ぼす影響と再利用[J]. Bulletin of Saga Prefectural Ariake Fisheries Research and Development Center, 2009, 24: 49-55. |
| [19] |
三根崇幸. 海苔スミノリ病の発症要因解析と防除法開発に関する研究[D]. かごしまし: かごしまだいがく, 2010.
|
| [20] |
KANG E J, KIM J H. Development of an efficiency criterion for the removal of pest organisms (ulvoid green algae and diatoms) from Neopyropia aquaculture using the acid wash (pH shock) method[J]. Aquaculture, 2022, 548: 737677. DOI:10.1016/j.aquaculture.2021.737677 |
| [21] |
KIM G H, MOON K H, KIM J Y, et al. A revaluation of algal diseases in Korean Pyropia (Porphyra) sea farms and their economic impact[J]. Algae, 2014, 29(4): 249-265. DOI:10.4490/algae.2014.29.4.249 |
| [22] |
WELLBURN A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology, 1994, 144(3): 307-313. DOI:10.1016/S0176-1617(11)81192-2 |
| [23] |
张涛, 沈宗根, 姚春燕, 等. 基于叶绿素荧光技术的紫菜光适应特征研究[J]. 海洋学报(中文版), 2011, 33(3): 140-147. |
| [24] |
TIKKANEN M, MEKALA N R, ARO E M. Photosystem Ⅱ photoinhibition-repair cycle protects Photosystem Ⅰ from irreversible damage[J]. Biochimica et Biophysica Acta, 2014, 1837(1): 210-215. DOI:10.1016/j.bbabio.2013.10.001 |
| [25] |
XU L L, LIN L D, LUO L, et al. Organic acid treatment for removal of epiphytic Ulva L.attached to Sargassum fusiforme seedlings[J]. Aquaculture, 2022, 547: 737533. DOI:10.1016/j.aquaculture.2021.737533 |
| [26] |
李晓蕾, 汪文俊, 梁洲瑞, 等. 野生条斑紫菜(Pyropia yezoensis)叶状体对干出胁迫的抗氧化生理响应特征[J]. 渔业科学进展, 2017, 38(5): 156-163. |
| [27] |
杨舒贻, 陈晓阳, 惠文凯, 等. 逆境胁迫下植物抗氧化酶系统响应研究进展[J]. 福建农林大学学报(自然科学版), 2016, 45(5): 481-489. |
| [28] |
周顺福. 模拟酸雨对4种树种苗木生长及生理的影响[D]. 南宁: 广西大学, 2015.
|
| [29] |
周顺福, 徐圆圆, 刘世男, 等. 模拟酸雨对桉树苗木生长及生理的影响[J]. 林业调查规划, 2017, 42(1): 92-97, 100. |
| [30] |
梁艳荣, 胡晓红, 张颍力, 等. 植物过氧化物酶生理功能研究进展[J]. 内蒙古农业大学学报(自然科学版), 2003, 24(2): 110-113. |
| [31] |
李钦, 郑微云, 王重刚, 等. 有机磷农药对坛紫菜过氧化物酶(POD)活性影响的研究[J]. 厦门大学学报(自然科学版), 2003, 42(2): 201-204. |
| [32] |
MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [33] |
赵天宏, 孙加伟, 付宇. 逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J]. 作物杂志, 2008(3): 10-13. |
| [34] |
王荣, 刘涛, 周晓君, 等. 条斑紫菜锰超氧化物歧化酶基因克隆与序列分析[J]. 高技术通讯, 2006, 16(5): 522-528. |
| [35] |
冯琛, 路新枝, 于文功. 逆境胁迫对条斑紫菜生理生化指标的影响[J]. 海洋湖沼通报, 2004(3): 22-26. |



