2. 广西海洋科学院(广西红树林研究中心), 广西红树林保护与利用重点实验室, 广西北海 536000
2. Guangxi Key Laboratory of Mangrove Conservation and Utilization, Guangxi Academy of Marine Sciences(Guangxi Mangrove Research Center), Beihai, Guangxi, 536000, China
造礁石珊瑚株由珊瑚水螅体群体构成,属构件生物(Modular organism),即复合生物。造礁石珊瑚的生长方式为无限生长,表现为无性繁殖的水螅体的数量扩增[1],其线性增长大致与年龄相关,但造礁石珊瑚个体会因珊瑚部分死亡和分裂而变小,故其大小与年龄并非总是相关[2]。
造礁石珊瑚生长慢、寿命长,无限生长方式使其近乎免于衰老,不会衰老的最有力证据可在水螅身上找到[3, 4]。珊瑚水螅体再生能力强,造礁石珊瑚的死亡风险因水螅体在空间上的分散而降低,造就颇高的珊瑚成活率和累计繁殖力[5]。通常,珊瑚的年龄越大,珊瑚繁殖力越强;水螅体个体大、数量多,则珊瑚繁殖力较强[6-8]。
造礁石珊瑚株的水螅群体源自最初的水螅体,因很难界定遗传个体(基株),甚至分不清基株或无性系分株[5],故其年龄难以知晓。因此,造礁石珊瑚株个体大小比年龄更能反映诸如造礁石珊瑚之类的克隆生物的种群结构特征[9],比如珊瑚生长、死亡和遭遇困境等种群特征和过程[10]。
在不同珊瑚礁场景中,造礁石珊瑚种群的珊瑚大小频率分布堪比一张快照,可阶段性反映珊瑚种群生长和衰退的动态过程。珊瑚种群大小频率分布由两个过程决定,一是珊瑚株大小的增长,二是珊瑚株数量的种群动态。统计分析珊瑚株大小,可揭示珊瑚所面临的压力程度[11]。珊瑚种群的大小频率分布能揭示珊瑚幼体输入模式的变化、珊瑚的局部死亡和珊瑚寿命,用于评估珊瑚状况[12-14]。
涠洲岛珊瑚礁的研究始于20世纪60年代,调查研究成果涉及生物学[15]、地质地貌学[16-20]、保护管理[21-23]、生态环境学[24, 25]等领域。1998-2022年,涠洲岛珊瑚群落结构和景观因自然和人为影响而发生改变,枝状珊瑚死亡严重,珊瑚盖度降低,生物多样性减少[26-28]。涠洲岛石螺口海域受西南季风影响强烈,潜水活动等人为影响相对较少;西北部海域位于北海-涠洲岛航道和西北角码头附近,受船舶航行和曾经的码头建设影响较大;西部海域受风浪作用及海岸、海底侵蚀影响较大[29-31]。2021年2月24-26日,在以往研究着重分析珊瑚盖度的基础上,本研究在涠洲岛西海域石螺口和西北角码头附近开展造礁石珊瑚样带调查,拟通过调查分析涠洲岛局部造礁石珊瑚的大小频率分布,以便更全面深入地了解涠洲岛造礁石珊瑚动态,科学判断其变化原因和趋势。
1 材料与方法 1.1 调查站位本研究设2个调查站位,站位325位于涠洲岛西海域石螺口,站位335位于涠洲岛西北角码头附近海域(图 1)。涠洲岛西北部沿岸活石珊瑚的平均覆盖度较高,西部相对较低[26, 27],每个调查站位设置调查样带一条,站位调查作业开始时间和具体坐标等见表 1。
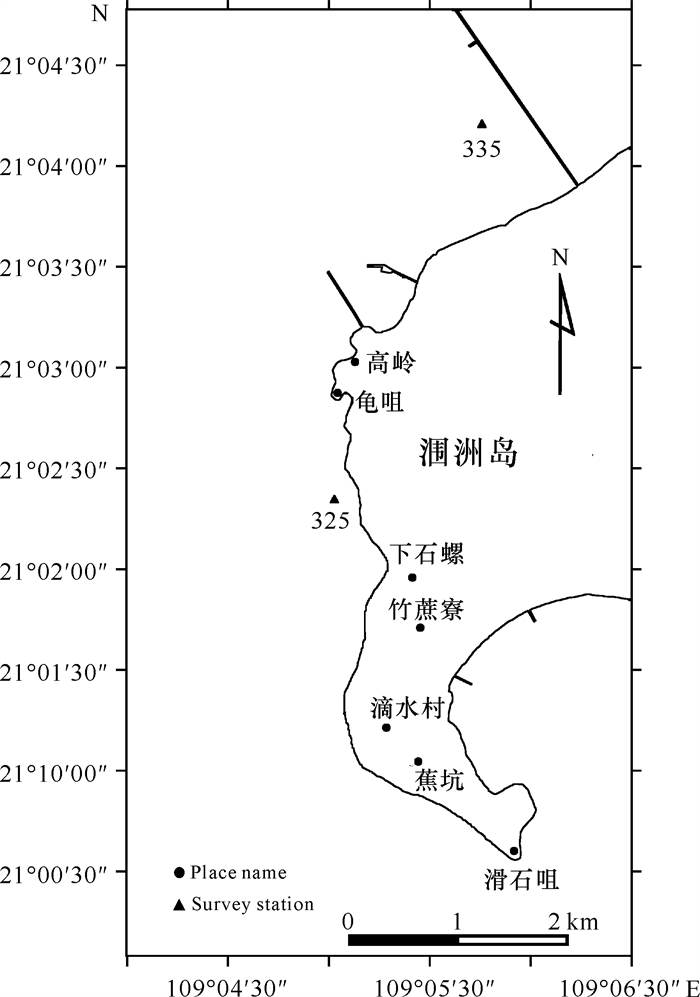
|
| 图 1 涠洲岛珊瑚大小频率分布调查站位示意图 Fig. 1 Schematic diagram of coral size-frequency distribution survey stations in Weizhou Island |
| 样带编号 No.of the transects |
作业日期 Date of survey |
作业开始时间 Beginning time of survey |
站位坐标 Coordinate of station |
高程基准面水深/m Water depth of sea-level datum/m |
| 325 | 2021/02/24 | 15:06:29 | 109°05.0231′ E, 21°02.3332′ N | 1.69 |
| 335 | 2021/02/25 | 14:40:12 | 109°04.6508′ E, 21°01.1964′ N | 2.15 |
1.2 样方
潜水船驶至珊瑚分布区后抛锚,用GPS(GARMIN,GPSMAP® 629sc)定位并记录船只地理坐标,所定点即调查站位坐标,即调查样带起始点。潜水员就地下潜至海底后,沿平行岸线方向布设30 m长样带,以带毫米标尺刻度的50 cm×50 cm样方的一边紧贴样带,从样带端点到终点[32],在样带左右两侧分别连续布置样方并使用防水相机拍摄样方(图 2),样带两侧样方数各60个,每个站位样方总面积(每条样带样方总面积)=60×50 cm×50 cm×2=300 000 cm2。

|
| 图 2 样方照片 Fig. 2 Photos of the quadrats |
1.3 造礁石珊瑚株大小面积和属种判读
用AutoCAD 2014软件加载录入水下拍摄的样方照片,利用软件的图像处理、数据计算功能,严格以图框的尺寸为基准进行照片的整体校正。对校正后的样方照片的影像元素进行目视解译,利用珊瑚礁鉴定图谱进行属种分类的判读分析[33],勾画各属种造礁石珊瑚株轮廓,并统计在样方框中完整的珊瑚株面积。相对于采用点数计算方式统计珊瑚的分布面积,本研究采用样方判读方式计算造礁石珊瑚大小和面积的准确性更高。
1.4 珊瑚盖度计算珊瑚盖度为样方中珊瑚面积之和与样方面积之比[14]。
1.5 造礁石珊瑚株大小频率分布通常,造礁石珊瑚呈现半圆、半球或类似复杂形态增长,种群动态变化属一阶过程(First order process),可用幂函数加以描述。本质上,造礁石珊瑚生长是一个生物过程,并非一个数学计算过程,很难用幂函数方程来揭示。造礁石珊瑚株大小的变化,可通过将造礁石珊瑚株大小替换为造礁石珊瑚生长迭代数来描述,最简单的办法就是将造礁石珊瑚株大小进行对数转换,即可从造礁石珊瑚大小数据中算出造礁石珊瑚生长迭代数。利用造礁石珊瑚株大小的对数转换来分析造礁石珊瑚大小频率的好处颇多,方便比较种内和种间的造礁石珊瑚大小频率分布,极大提高种间差异的分辨率和小个体造礁石珊瑚类别的差异分辨率,另外,造礁石珊瑚株大小频率趋向正态分布,可通过偏斜度、变异系数等参数来说明造礁石珊瑚大小频率分布特征[17]。
假定造礁石珊瑚株面积大小随迭代生长翻倍,则造礁石珊瑚大小变化可通过迭代数来表达,迭代数可比造礁石珊瑚大小更好地描述种间的相对差异。理论上,迭代数(t)可通过造礁石珊瑚指数生长方程计算:
| $ P_t=P_0 2^t \text {, } $ |
其中,Pt为造礁石珊瑚株经过t生长迭代后的大小,以面积(cm2)表示。P0为造礁石珊瑚株初始大小,随迭代翻倍。
本研究中,视所观察到个体最小的造礁石珊瑚大小为P0。对造礁石珊瑚大小取以2为底的对数[17],以造礁石珊瑚大小对数值比P0大小对数值计算迭代数,即
迭代数=lnPt/lnP0。
2 结果与分析 2.1 造礁石珊瑚属种因技术手段所限,本研究的造礁石珊瑚只分类鉴定到属。
样带325样方中观察到的造礁石珊瑚有16个属,即蔷薇珊瑚属Montipora、鹿角珊瑚属Acropora、盔形珊瑚属Galaxea、牡丹珊瑚属Pavona、滨珊瑚属Porites、角孔珊瑚属Goniopora、伯孔珊瑚属Bernardpora、陀螺珊瑚属Turbinaria、刺柄珊瑚属Hydnophora、圆星珊瑚属Astrea(原圆菊珊瑚属Monastraea)、角蜂巢珊瑚属Favites、盘星珊瑚属Dipsastraea(原蜂巢珊瑚属Favia)、扁脑珊瑚属Platygyra、刺星珊瑚属Cyphastrea、刺孔珊瑚属Echinopora、同星珊瑚属Plesiastrea[34]。样带335样方中观察到的造礁石珊瑚有8个属,即盔形珊瑚属、牡丹珊瑚属、滨珊瑚属、角孔珊瑚属、陀螺珊瑚属、角蜂巢珊瑚属、盘星珊瑚属、扁脑珊瑚属(表 2)。
| 造礁石珊瑚属 Genera of scleractinian corals |
样带325 Transect 325 |
样带335 Transect 335 |
| Montipora | + | - |
| Acropora | + | - |
| Galaxea | + | + |
| Pavona | + | + |
| Porites | + | + |
| Goniopora | + | + |
| Bernardpora | + | - |
| Turbinaria | + | + |
| Hydnophora | + | - |
| Astrea | + | - |
| Favites | + | + |
| Dipsastraea | + | + |
| Platygyra | + | + |
| Cyphastrea | + | - |
| Echinopora | + | - |
| Plesiastrea | + | - |
本研究采样区域常见的上述珊瑚属的种类有膨胀蔷薇珊瑚M.turgescens、霜鹿角珊瑚Acropora pruinosa、稀杯盔形珊瑚Galaxea astreata、十字牡丹珊瑚Pavona decussata、叶形牡丹珊瑚P.frondifera、澄黄滨珊瑚Porites lutea、团块滨珊瑚P.lobata、斯氏伯孔珊瑚B.stutchburyi、平角孔珊瑚Goniopora planulata、柱角孔珊瑚G.columna、盾形陀螺珊瑚T.peltata、腐蚀刺柄珊瑚H.exesa、秘密角蜂巢珊瑚F.abdita、中华角蜂巢珊瑚F. chinensis、五边角蜂巢珊瑚F. pentagona、多弯角蜂巢珊瑚F. stylifera、板叶角蜂巢珊瑚F. complanata、海孔角蜂巢珊瑚F. halicora、黄癣盘星珊瑚D.favus、标准盘星珊瑚D.speciosa、翘齿盘星珊瑚D.matthaii,精巧扁脑珊瑚Platygyra daedalea、交替扁脑珊瑚P. crosslandi、锯齿刺星珊瑚C.serailia和多孔同星珊瑚Plesiastrea versipora等[18-27]。
基于这些属的种类生境类型和生长方式相似,形态相近,产卵模式相同,本研究将以上同一属的造礁石珊瑚种类进行单一分析。
2.2 造礁石珊瑚面积和造礁石珊瑚株数样带325、样带335样方中各属造礁石珊瑚的面积、株数及其占比分别见表 3、表 4。
| 造礁石珊瑚属 Genera of scleractinian corals |
面积/cm2
Area/cm2 |
面积占比/%
Proportion of area/% |
造礁石珊瑚株数 Strain number of scleractinian corals |
株数占比%
Proportion of strain number/% |
| Montipora | 550.21 | 0.76 | 4 | 0.61 |
| Acropora | 312.53 | 0.43 | 5 | 0.76 |
| Galaxea | 2 003.08 | 2.75 | 25 | 3.81 |
| Pavona | 90.69 | 0.12 | 2 | 0.30 |
| Porites | 15 177.14 | 20.85 | 84 | 12.79 |
| Goniopora | 7 229.51 | 9.93 | 67 | 10.20 |
| Turbinaria | 1 146.11 | 1.57 | 9 | 1.37 |
| Hydnophora | 385.56 | 0.53 | 4 | 0.61 |
| Astrea | 32.86 | 0.05 | 1 | 0.15 |
| Favites | 31 365.68 | 43.09 | 258 | 39.27 |
| Dipsastraea | 6 289.04 | 8.64 | 128 | 19.48 |
| Platygyra | 5 806.74 | 7.98 | 57 | 8.68 |
| Cyphastrea | 1 882.10 | 2.59 | 11 | 1.67 |
| Echinopora | 368.34 | 0.51 | 1 | 0.15 |
| Plesiastrea | 159.78 | 0.22 | 1 | 0.15 |
| Total | 72 799.37 | 100.00 | 657 | 100.00 |
| 造礁石珊瑚属 Genera of scleractinian corals |
面积/cm2
Area/cm2 |
面积占比/%
Proportion of area/% |
造礁石珊瑚株数 Strain number of scleractinian corals |
株数占比/%
Proportion of strain number/% |
| Galaxea | 565.69 | 1.01 | 2 | 0.16 |
| Pavona | 41 921.25 | 74.66 | 1 109 | 90.90 |
| Porites | 5 607.15 | 9.99 | 49 | 4.02 |
| Oniopora | 144.36 | 0.26 | 1 | 0.08 |
| Urbinaria | 721.05 | 1.28 | 3 | 0.25 |
| Favites | 1 401.60 | 2.50 | 20 | 1.64 |
| Dipsastraea | 3 017.63 | 5.38 | 24 | 1.97 |
| Platygyra | 2 767.95 | 4.93 | 12 | 0.98 |
| Total | 56 146.68 | 100.00 | 1 220 | 100.00 |
2.3 造礁石珊瑚盖度
表 3显示样带325样方中角蜂巢珊瑚属的面积占比最高,为43.09%,滨珊瑚属次之,为20.85%。样带325样方中造礁石珊瑚总面积为72 799.37 cm2,样方总面积为300 000 cm2,可算出造礁石珊瑚盖度为
表 4显示样带335样方中牡丹珊瑚属的面积占比最高,为74.66%,滨珊瑚属次之,为9.99%。样带335样方中造礁石珊瑚总面积为56 146.68 cm2,样方总面积为300 000 cm2,可算出造礁石珊瑚盖度为
针对造礁石珊瑚株大小分布的分析,统计两条样带合计观察到造礁石珊瑚株数25个以上的属,有盔形珊瑚属、牡丹珊瑚属、滨珊瑚属、角孔珊瑚属、角蜂巢珊瑚属、盘星珊瑚属、扁脑珊瑚属7个属,各属造礁石珊瑚最小个体和最大个体大小见表 5。
| Unit: cm2 | |||||||||||||||||||||||||||||
| 造礁石珊瑚属 Genera of scleractinian corals |
最小珊瑚株大小 Minimum size of coral strain |
最大珊瑚株大小 Maximum size of coral strain |
珊瑚株平均大小Mean size of coral strain | ||||||||||||||||||||||||||
| Galaxea | 3.91 | 506.15 | 95.14 | ||||||||||||||||||||||||||
| Pavona | 0.27 | 3 232.62 | 37.82 | ||||||||||||||||||||||||||
| Porites | 1.50 | 1 564.63 | 156.27 | ||||||||||||||||||||||||||
| Goniopora | 2.13 | 1 714.36 | 108.44 | ||||||||||||||||||||||||||
| Favites | 1.06 | 1 138.89 | 117.87 | ||||||||||||||||||||||||||
| Dipsastraea | 1.06 | 746.65 | 61.23 | ||||||||||||||||||||||||||
| Platygyra | 0.98 | 1 014.90 | 124.27 | ||||||||||||||||||||||||||
根据研究所获得的数据,作上述7个属造礁石珊瑚株大小频率分布图(图 3)和造礁石珊瑚株生长迭代直方图(图 4)。
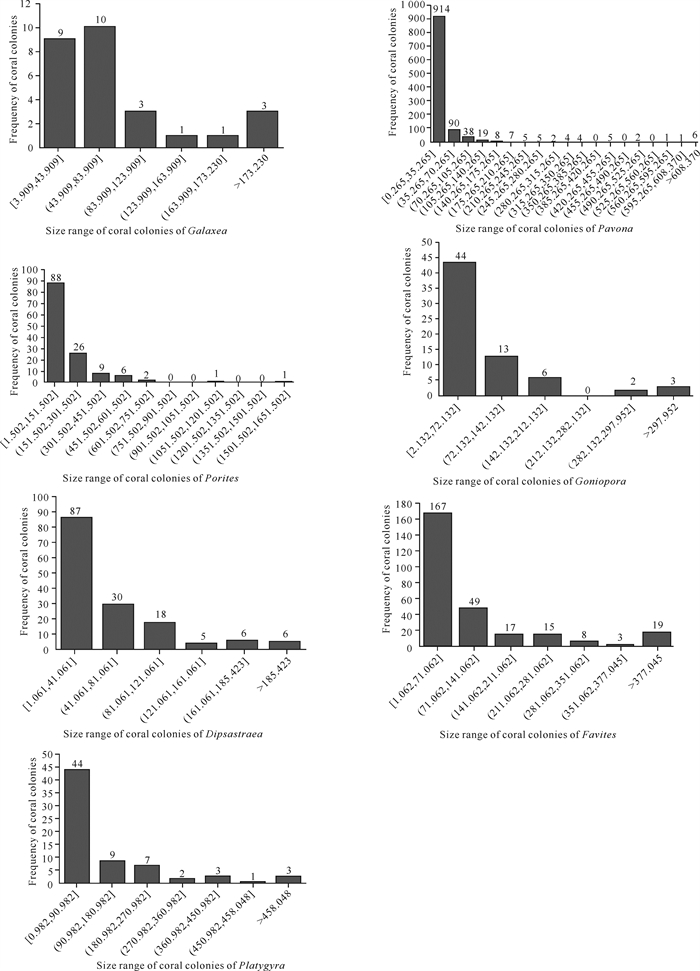
|
| 图 3 造礁石珊瑚株大小频率分布 Fig. 3 Size-frequency distribution of scleractinian coral strains |
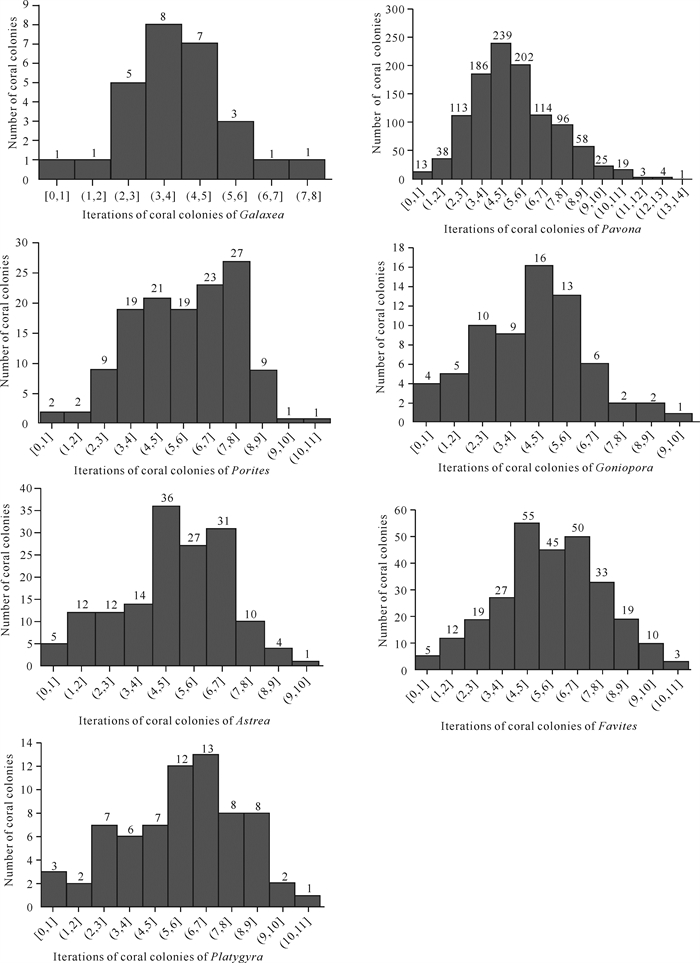
|
| 图 4 造礁石珊瑚生长迭代数直方图 Fig. 4 Iteration histogram of scleractinian coral growth |
用于研究造礁石珊瑚种群动态的参数有经过数据变换后的变异系数、偏斜度、众数或平均值以及标准差[1, 35]。根据造礁石珊瑚生长迭代数据计算出造礁石珊瑚7个属的相关统计参数见表 6。
| 造礁石珊瑚属 Genera of scleractinian corals |
偏斜度 Skewness |
变异系数 CV |
平均值 Mean value |
标准差 Standard deviation |
| Galaxea | -0.601 | 0.354 | 3.807 | 1.348 |
| Pavona | 0.591 | 0.416 | 5.100 | 2.120 |
| Porites | -0.267 | 0.364 | 5.569 | 2.026 |
| Goniopora | 0.127 | 0.479 | 4.199 | 2.013 |
| Favites | -0.124 | 0.384 | 5.446 | 2.090 |
| Dipsastraea | -0.314 | 0.402 | 4.772 | 1.916 |
| Platygyra | -0.319 | 0.395 | 5.655 | 2.235 |
3 讨论 3.1 造礁石珊瑚盖度
样带325和样带335的造礁石珊瑚盖度分别为24.27%和18.72%,主要由块状珊瑚(滨珊瑚属、角蜂巢珊瑚属、盘星珊瑚属、扁脑珊瑚属等)和片状珊瑚(牡丹珊瑚属)所贡献[36]。造礁石珊瑚盖度与造礁石珊瑚株数正相关。样带325的造礁石珊瑚株数与造礁石珊瑚盖度相关系数为0.945 (P=0.023),显著相关;样带335的造礁石珊瑚株数与造礁石珊瑚盖度相关系数为0.996 (P=0.284),显著相关。
近40年来,涠洲岛造礁石珊瑚盖度持续下降,20世纪80年代中期为20%-80%[37],2001年为50%-60%[38],2005年为33.2%-35.30%[39],2007年为8.45%-25.30%[27],2015年深水区为6.04%-17.37% (平均6.02%)[28],2019年西南部海域为5.20%-31.20% (平均16.66%)[18]。本研究所观察断面的造礁石珊瑚盖度低于2005年前的涠洲岛造礁石珊瑚盖度。
通常,造礁石珊瑚盖度高低主要取决于个体大的珊瑚株,而非年幼个体小的珊瑚株,即使年幼造礁石珊瑚株密度较高[40, 41]。个体大的枝状珊瑚的死亡和退化,应是涠洲岛造礁石珊瑚盖度锐减的主要原因,尽管块状珊瑚和片状珊瑚仍在局部正常存活和生长,但不能弥补因枝状珊瑚减少而导致的造礁石珊瑚盖度降低。枝状的鹿角珊瑚属已优势不再且恢复困难,尽管它们长得更快、更大,但因存量极少,对造礁石珊瑚盖度的贡献微乎其微。涠洲岛造礁石珊瑚盖度必然受限于不同造礁石珊瑚的自然生长特性,很难恢复到曾经的80%以上。
3.2 造礁石珊瑚大小及大小频率分布7个属造礁石珊瑚皆有个体小的珊瑚株(<1 cm2)存在,平均大小以下的造礁石珊瑚株占绝大多数(表 5, 图 3),迭代4-6代的造礁石珊瑚株数较多,说明虽有珊瑚补充存在,但未发生阶段性幼体大量补充。迭代约7代后,造礁石珊瑚株数减少,表明珊瑚株趋向部分死亡或裂解,造成迭代多个体大的珊瑚株变少(图 3、图 4)。
通常,造礁石珊瑚幼体死亡率高,造成个体最小级别的珊瑚株数较少。造礁石珊瑚株长大后,全株死亡效应减少[42],但部分死亡和裂变,会限制个体大的造礁石珊瑚株数量,导致个体中等的造礁石珊瑚株涌现[1]。块状珊瑚的大小是造礁石珊瑚重要的种类特性,与诸多繁殖性状以及其他生活史特征或许还有造礁石珊瑚的演化速率相关[43]。
本研究的造礁石珊瑚7个属生长迭代直方图呈正态分布,偏斜不明显,变异系数均小于0.5,呈现大致自然的造礁石珊瑚株大小分布,表明造礁石珊瑚补充、生长、死亡仍基本正常,说明涠洲岛仍存的块状和片状造礁石珊瑚耐受环境变化的本能较强,帮助其度过了未超出其耐受极限的环境变化。
3.3 造礁石珊瑚的存活与生长滨珊瑚(Porites spp.)的水螅体寿命平均不过2-3年,最长5年,但滨珊瑚株寿命超过40年[44],其珊瑚骨架扩展速度几十年都不会系统性降低[45]。涠洲岛澄黄滨珊瑚的平均年龄为21.44年,其中84.34%的澄黄滨珊瑚年龄低于30.00年[33],说明在过去涠洲岛珊瑚礁整体衰退的时期,诸如滨珊瑚等块状珊瑚和片状牡丹珊瑚仍生长正常。
相对稳定的环境更利于个体大的造礁石珊瑚,个体越大,构成造礁石珊瑚的水螅体数量就越多,死亡风险和死亡率就越低,造礁石珊瑚的持续生长就不易被中断,而小型造礁石珊瑚生长的迭代时间较短,似乎更适合生长于欠稳定的生境[46]。
不同种的造礁石珊瑚,珊瑚株大小结构不同,所能达到的最大珊瑚株尺寸也不同[47]。涠洲岛珊瑚礁中,对环境变化耐受性较弱的枝状珊瑚,如鹿角珊瑚等,虽然个体较大,但未能幸免于人为破坏和环境变化所导致的死亡,20多年来衰退严重,至今仍数量稀少,恢复困难[48]。迄今为止,涠洲岛仍有枝状珊瑚零星分布,说明支持枝状珊瑚生存的环境条件依然存在。造礁石珊瑚补充量的高低取决于造礁石珊瑚盖度,并与适宜幼体附着的空间多少成比例[49, 50]。涠洲岛枝状珊瑚盖度极低,幼体能够附着的空间有限[51],枝状珊瑚的自然补充率会极低。
造礁石珊瑚历史悠久,进入21世纪后,它们所处的环境变得不像从前那么适宜,白化、热带气旋等压力事件和人为影响等更为频繁,缩短了珊瑚从压力事件和不利影响中复苏的间隔时间[52]。造礁石珊瑚群落严重受损后,需要10-30年才能恢复[53, 54]。涠洲岛珊瑚礁已退化,诸如鹿角珊瑚在内的复杂珊瑚退化严重[22, 27, 28],须消除不利因素后方能恢复,恢复所需的间隔时间也必须充分,否则,涠洲岛造礁石珊瑚群落的恢复越困难。
4 结论涠洲岛局部块状珊瑚和片状珊瑚的大小频率分布正常,表明目前它们的生长和种群结构正常。
| [1] |
JACKSON J B C. Biology and systematics of colonial animals[M]. New York: Academic Press, 1979: 499-555.
|
| [2] |
HUGHES T P, JACKSON J B C. Do corals lie about their age? Some demographic consequences of partial mortality, fission, and fusion[J]. Science, 1980, 209: 713-715. DOI:10.1126/science.209.4457.713 |
| [3] |
MARTÍNEZ D E. Mortality patterns suggest lack of senescence in hydra[J]. Experimental Gerontology, 1998, 33(3): 217-225. DOI:10.1016/S0531-5565(97)00113-7 |
| [4] |
SCHAIBLE R, SCHEUERLEIN A, DAИKO M J, et al. Constant mortality and fertility over age in hydra[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(51): 15701-15706. |
| [5] |
JACKSON J B C, BUSS L W, COOK R E. Population biology and evolution of clonal organisms[M]. New Haven: Yale University Press, 1985: 259-296.
|
| [6] |
BABCOCK R C. Reproduction and distribution of two species of Goniatrea (Scleractinia) from the Great Barrier Province[J]. Coral Reefs, 1984, 2(4): 187-195. |
| [7] |
SZMANT A M. Reproductive ecology of Caribbean reef corals[J]. Coral Reefs, 1986, 5: 43-53. DOI:10.1007/BF00302170 |
| [8] |
HARRISON P L, WALLACE C C. Ecosystems of the world: coral reefs[M]. Amsterdam: Elsevier, 1990: 133-207.
|
| [9] |
HUGHES T P. Population dynamics based on individual size rather than age: a general model with a reef coral example[J]. The American Naturalist, 1984, 123(6): 778-795. DOI:10.1086/284239 |
| [10] |
HUGHES T P, CONNELL J H. Population dynamics based on size or age? A reef-coral analysis[J]. The American Naturalist, 1987, 129: 818-829. DOI:10.1086/284677 |
| [11] |
BAK R P M, MEESTERS E H. Population structure as a response of coral communities to global change[J]. American Zoology, 1999, 39(1): 56-65. DOI:10.1093/icb/39.1.56 |
| [12] |
VERMEIJ M J A, BAK R P M. Inferring demographic processes from population size structure in corals [C]//Proceedings 9th International Coral Reef Symposium. Bali: International Coral Reef Society, 2000: 589-593.
|
| [13] |
GLASSOM D, CHADWICK N E. Recruitment, growth and mortality of juvenile corals at Eilat, northern Red Sea[J]. Marine Ecology Progress Series, 2006, 318: 111-122. DOI:10.3354/meps318111 |
| [14] |
BAK R P M, MEESTERS E H. Coral population structure: the hidden information of colony size-frequency distributions[J]. Marine Ecology Progress Series, 1998, 162: 301-306. DOI:10.3354/meps162301 |
| [15] |
王丽荣, 赵焕庭. 珊瑚礁生态系的一般特点[J]. 生态学杂志, 2001(6): 41-45. DOI:10.3321/j.issn:1000-4890.2001.06.011 |
| [16] |
黄金森, 张元林. 北部湾涠洲岛珊瑚海岸沉积[C]. 青岛: 中国地质学会海洋地质专业委员会硫酸盐比较沉积学学术讨论会, 1986.
|
| [17] |
王国忠. 南海珊瑚礁区沉积学[M]. 北京: 海洋出版社, 2001.
|
| [18] |
刘敬合, 黎广钊, 农华琼. 涠洲岛地貌与第四纪地质特征[J]. 广西科学院学报, 1991, 7(1): 27-36. |
| [19] |
叶维强, 黎广钊, 庞衍军, 等. 北部湾涠洲岛珊瑚礁海岸及第四纪沉积特征[J]. 海洋科学, 1998(6): 13-17. |
| [20] |
莫永杰. 涠洲岛海岸地貌的发育[J]. 热带地理, 1989, 9(3): 243-248. |
| [21] |
梁文, 黎广钊. 涠洲岛珊瑚礁分布特征与环境保护的初步研究[J]. 环境科学研究, 2002, 15(6): 5-7, 16. DOI:10.3321/j.issn:1001-6929.2002.06.002 |
| [22] |
黄晖, 马斌儒, 练健生, 等. 广西涠洲岛海域珊瑚礁现状及其保护策略研究[J]. 热带地理, 2009, 29(4): 307-312, 318. DOI:10.3969/j.issn.1001-5221.2009.04.001 |
| [23] |
董晓理. 保护涠洲岛珊瑚资源, 维护生态环境[J]. 广西水产科技, 2006(1): 17-21. |
| [24] |
黎广钊, 梁文, 农华琼. 涠洲岛珊瑚礁生态环境条件初步研究[J]. 广西科学, 2004, 11(4): 379-384. DOI:10.3969/j.issn.1005-9164.2004.04.027 |
| [25] |
余克服, 蒋明星, 程志强, 等. 涠洲岛42年来海面温度变化及其对珊瑚礁的影响[J]. 应用生态学报, 2004, 15(3): 506-510. DOI:10.3321/j.issn:1001-9332.2004.03.030 |
| [26] |
梁文, 周浩郎, 王欣, 等. 涠洲岛西南部海域造礁石珊瑚的群落结构特征分析[J]. 海洋学报, 2021, 43(11): 123-135. |
| [27] |
梁文, 黎广钊, 张春华, 等. 20年来涠洲岛珊瑚礁物种多样性演变特征研究[J]. 海洋科学, 2010, 34(12): 78-87. |
| [28] |
王文欢. 近30年来北部湾涠洲岛造礁石珊瑚群落演变及影响因素[D]. 南宁: 广西大学, 2017.
|
| [29] |
黄子眉, 张春华, 申友利, 等. 涠洲岛海域风侯和波侯特征分析[J]. 海洋预报, 2021, 38(2): 62-68. |
| [30] |
张鑫, 李萍, 杨奇铮, 等. 广西北海涠洲岛典型岸滩剖面短期冲淤变化特征[J]. 海洋科学, 2016, 40(6): 77-83. |
| [31] |
杨振雄, 张敬怀, 吕向立, 等. 涠洲岛造礁石珊瑚群落变化特征及其环境影响因子[J]. 生态学报, 2021, 41(18): 7168-7179. |
| [32] |
ADJEROUD M, MAUGUIT Q, PENIN L. The size- structure of corals with contrasting life-histories: a multi-scale analysis across environmental conditions[J]. Marine Environmental Research, 2015, 112: 131-139. |
| [33] |
VERON J E N. Corals of the world: vol.3[M]. Town-ville: Australian Institute of Marine Science, 2000.
|
| [34] |
黄林韬, 黄晖, 江雷. 中国造礁石珊瑚分类厘定[J]. 生物多样性, 2020, 28(4): 515-523. |
| [35] |
MEESTERS E H, HILLTERMAN M, KARDINAAL E, et al. Colony size-frequency distributions of scleractinian coral populations: spatial and interspecific variation[J]. Marine Ecology Progress Series, 2001, 209: 43-54. |
| [36] |
CHAPPELL J. Coral morphology, diversity and reef growth[J]. Nature, 1980, 286: 249-252. |
| [37] |
沙庆安, 李菊英, 王尧. 广西涠洲岛全新世上升海滩沉积及其成岩作用[J]. 沉积学报, 1986, 4(2): 39-46, 135-136. |
| [38] |
余克服, 黎广钊, 梁群, 等. 涠洲岛、斜阳岛珊瑚礁自然保护区(拟建)综合考察报告[R]. 南宁: 广西海洋局, 2001.
|
| [39] |
周浩郎, 黎广钊. 涠洲岛珊瑚礁健康评估[J]. 广西科学院学报, 2014, 30(4): 238-247. |
| [40] |
GUZNER B, NOVOPLANSKY A, CHADWICK N E. Population dynamics of the reef-building coral Acropora hemprichii as an indicator of reef condition[J]. Marine Ecology Progress Series, 2007, 333: 143-150. |
| [41] |
BABCOCK R C. Comparative demography of three species of Scleractinian corals using age-and size-dependent classifications[J]. Ecological Monographs, 1991, 61(3): 225-244. |
| [42] |
BARRY J P, TEGNER M J. Inferring demographic processes from size-frequency distributions: simple models indicate specific patterns of growth and mortality[J]. Fishery Bulletin, 1990, 88(1): 13-19. |
| [43] |
POTTS D C. Evolutionary disequilibrium among Indo-Pacific corals[J]. Bulletin of Marine Science, 1983, 33(3): 619-632. |
| [44] |
DARKE W M, BARNES D J. Growth trajectories of corallites and ages of polyps in massive colonies of reef-building corals of the genus Porites[J]. Marine Biology, 1993, 117: 321-326. |
| [45] |
BUDDEMEIER R W, KINZIE R A. Coral growth[J]. Oceanography and Marine Biology Annual Review, 1976, 14: 183-225. |
| [46] |
SOONG K. Colony size as a species character in massive reef corals[J]. Coral Reefs, 1993, 12(2): 77-83. |
| [47] |
HUGHES T P. Population dynamics based on individual size rather than age: a general model with a reef coral example[J]. The American Naturalist, 1984, 123(6): 778-795. |
| [48] |
梁文, 黎广钊, 范航清, 等. 广西涠洲岛珊瑚礁物种生物多样性研究[J]. 海洋通报, 2010, 29(4): 412-416, 420. |
| [49] |
HUGHES T P, JACKSON J B C. Population-dynamics and life histories of foliaceous corals[J]. Ecological Monographs, 1985, 55(2): 141-166. |
| [50] |
CONNELL J H, HUGHES T P, WALLACE C C. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time[J]. Ecological Monographs, 1997, 67(4): 461-488. |
| [51] |
周浩郎, 王欣, 梁文. 涠洲岛珊瑚礁特点、演变及保护与修复对策的思考[J]. 广西科学院学报, 2020, 36(3): 228-236. |
| [52] |
PANDOLFI J M, CONNOLLY S R, MARSHALL D J, et al. Projecting coral reef futures under global warming and ocean acidification[J]. Science, 2011, 333(6041): 418-422. |
| [53] |
CONNELL J H. Disturbance and recovery of coral assemblages[J]. Coral Reefs, 1997, 16(Suppl 1): S101-S113. |
| [54] |
BRUNO J F, SELIG E R. Regional decline of coral cover in the Indo-Pacific: timing, extent and subregional comparisons[J]. PLoS One, 2007, 2(8): e711. |


