2. 瓦里安医疗系统公司临床应用支持部,北京 102600
2. Clinical Application Department of Varian Medical Systems, Inc., Beijing, 102600, China
近年来,有许多研究表明立体定向放疗(Stereotactic Body Radiation Therapy,SBRT)能快速缓解肿瘤脊柱转移病人疼痛,提高肿瘤局部控制率,而且能降低副反应[1-4]。相比传统模式下的放疗,SBRT治疗时需要其靶区外剂量迅速跌落,以减少对正常组织的伤害[5, 6],RTOG 0813[5]和RTOG 0915[6]对靶区外剂量跌落梯度指数(Gradiet Index,GI)定义如下:50%处方剂量体积与计划靶区体积(Planning Target Volume,PTV)的比例,即剂量梯度指数越小,剂量跌落越迅速,正常组织受损程度越小。对于瓦里安加速器,它的治疗计划系统Eclipse带有正常组织目标(Normal Tissue Objective,NTO)优化工具,可以在靶区周围生成较陡峭的剂量跌落区域。然而很少有文献报道关于Eclipse治疗计划系统中脊柱转移瘤SBRT计划的NTO优化工具参数设置。因此,本文通过设置不同NTO优化工具参数,研究不同参数下靶区剂量和剂量梯度指数的差异,以期为使用NTO优化工具进行脊柱转移瘤SBRT计划设计提供一定的数据参考。
1 材料与方法 1.1 病例选择选取2019年1月至2020年10月广西医科大学第二附属医院收治的10例脊椎转移瘤患者。其中男性4人,女性6人,年龄34-62岁,中位年龄46岁。其中乳腺癌转移2例,鼻咽癌转移3例,肝癌转移2例,肺癌转移3例。脊柱转移瘤位置有9例仅在椎体部位,1例在椎体和同侧锥弓根部位。肿瘤位置分别是胸椎T7、T8、T10各一处,胸椎T6和T11各两处,腰椎T12、L1、L2各一处。靶区体积为33.3-185.0 cc,中位大小为54.3 cc,病例入选的标准参考RTOG 0631报告[7]。
1.2 CT模拟定位患者体位固定采用自然仰卧位,使用美国CIVCO生产厂家的Body Pro-Lok装置进行病人摆位固定。使用Philips大孔径CT(型号:Brilliance Big Bore)实施定位扫描,层厚3 mm,注射碘造影剂进行增强扫描,扫描至少包括病灶上下各10 cm内范围。扫描后将CT图像数据通过网络传送到瓦里安Eclipse治疗计划系统工作站上。
1.3 靶区及危及器官勾画和剂量限值肿瘤靶区体积(GTV)定义为影像学或病例提示的肿瘤病灶,参考脊柱增强核磁共振(MRI)进行勾画。PTV为GTV再向各方向均匀外扩0.3 cm,根据脊髓位置适当调整而形成的。危及器官包括脊髓、马尾、食管、气管、双肺、双肾、胃肠等,至少勾画出脊柱病灶上下各10 cm内范围。PTV处方剂量为40 Gy/5次。根据RTOG 0631报告[7]和AAPM 101报告[8],要求至少90%的PTV接受100%处方剂量。正常器官限制剂量分别为脊髓最大剂量Dmax < 30 Gy,体积限制剂量D0.35cc < 23 Gy,D1.2cc < 14.5 Gy;马尾Dmax < 32 Gy,D5cc < 30 Gy;气管Dmax < 40 Gy,D4cc < 16.5 Gy;食管Dmax < 35 Gy,D5cc < 19.5 Gy;双肺D1000cc < 13.5 Gy,D1500cc < 12.5 Gy;双肾D200cc < 17.5 Gy;胃Dmax < 32 Gy,D10cc < 18 Gy;十二指肠Dmax < 32 Gy,D5cc < 18 Gy,D10cc < 12.5 Gy;空场/回肠Dmax < 35 Gy,D5cc < 19.5 Gy。
1.4 计划设计本研究设计两种类型计划,一种只使用NTO优化工具但不添加环(Ring),为参考计划;另一种只添加环但不使用NTO优化工具,为标准计划。其中标准计划环的设置如下:Ring1距离靶区0 cm,Ring2距离靶区0.2 cm,Ring3距离靶区1 cm。两种类型计划都采用瓦里安Vitalbeam加速器FFF 6MV X线,剂量率为1 400 MU/min。使用两个共面镜像全弧,准直器角度分别为15°和345°。优化计算网格为1.25 mm,算法为AXB。整个受照体积(即Body)限制条件统一如下:Upper dose的Volume为0,Dose为5 200,Piority为500。两种计划的PTV优化限制条件统一如下:Upper dose的Volume为0,Dose为5 200,Piority为200;Lower dose的Volume为100,Dose为4 100,Piority为250。正常器官优化限制条件根据AAPM 101报告[8]进行调整,Piority统一为400。标准计划环的限制条件如下:Ring1的Upper dose的Volume为0,Dose为4 300,Piority为500;Ring2的Upper dose的Volume为0,Dose为3 400,Piority为250;Ring3的Upper dose的Volume为0,Dose为1 950,Piority为500。
1.5 NTO优化工具参数设置Eclipse治疗计划系统的NTO优化工具有5个参数。(1)Priority:NTO优化工具在计划优化时的权重大小,可以设置为0-1 000。(2) Distance from Target Border (rstart):系统开始计算剂量跌落区域距离靶区的距离长度(cm)。(3) Start Dose(F0):PTV的最小Upper值,如该靶区无Upper值,则将最大Lower值的105%被认为开始剂量100%。(4) End Dose (F∞):NTO最远端剂量值,NTO优化工具不会对小于此数值的剂量进行剂量罚分。(5) Fall-off (k):决定NTO曲线形状的陡度,其值越大意味着靶区外剂量越陡峭,其计算公式为(其中r为剂量跌落距离)
| $ \begin{aligned} & F(r)= \\ & \left\{\begin{array}{l} F_0 e^{-k\left(r-r_{\text {start }}\right)}+F_{\infty}\left(1-e^{-k\left(r-r_{\text {start }}\right)}\right), r \geqslant r_{\text {start }} \\ F_0, r<r_{\text {start }} \end{array}\right. \end{aligned}。$ |
本研究对所有参考计划的Distance from Target Border、Start Dose和End Dose 3个参数进行相同设置,原因如下。①所有参考计划的PTV优化条件是相同的。②参数Distance from Target Border设置越小意味着开始计算剂量跌落区域离靶区越小。为保证靶区剂量覆盖,本研究Distance from Target Border统一设置为0.2 cm。③参数Distance from Target Border和Start Dose是相互关系,Distance from Target Border设置越小意味着Start Dose需要设置越高。AAPM 101报告[8]中认为SBRT计划靶区与脊髓方向之间的剂量梯度可以设置为1 mm下降12%处方剂量。考虑到靶区外其他方向的剂量梯度,本研究采用1 mm下降5%处方剂量,即1 mm下降200 cGy的原则,参数Start Dose统一设置为91%处方剂量。④本研究剂量跌落指数针对的是靶区外50%处方剂量体积大小,所以参数End Dose统一设置为49.4%处方剂量,意味着NTO优化工具不会对小于1 976 cGy区域进行罚分。参数Piority代表了NTO优化工具在计划优化时的权重大小,参数Fall-off决定了剂量跌落速度,因此本研究参数Piority设置为100、200、300、500、700、999,参数Fall-off设置为0.01、0.10、0.20、0.30、0.50、1.00。每个病人得到36个计划,共得到360个计划。
1.6 放疗评估指标所有计划最后剂量归一为100%处方剂量覆盖90%PTV,放疗计划评估基于Eclipse治疗计划系统生成的剂量体积直方图(DVH)。基于本次研究病例的肿瘤位置,本研究评估参数为靶区剂量适形度指数(Conformity Index, CI),其表达式为
| $ \mathrm{CI}=\frac{V_{\mathrm{t}, \mathrm{ref}}}{V_{\mathrm{t}}} \times \frac{V_{\mathrm{t}, \mathrm{ref}}}{V_{\mathrm{ref}}}, $ |
式中:Vt, ref为处方剂量线包绕的靶区体积,Vt为靶区体积,Vref为处方剂量线包绕的所有区域体积。GI表达式为
| $ \mathrm{GI}=\frac{V_{50 \%, \mathrm{ptv}}}{V_{\mathrm{ptv}}}, $ |
式中:V50%, ptv为50%处方剂量线包绕的所有区域体积,Vptv为PTV体积。其他评价指标分别为PTV Dmax(%)、机器跳数(MU)、实际治疗时间(加速器出射线时间,不包括摆位时间)。根据RTOG 0631报告[7],超过靶区1 cm区域剂量不能大于105%处方剂量,靶区外105%处方剂量体积不能大于3 cc,靶区外区域剂量不能大于110%处方剂量。根据上述规定以及结合正常组织剂量限制,本研究所有计划如果超过上述规定或者正常组织限制剂量则被认为不合格计划,临床合格率(%)=
对每个计划在Eclipse TPS中创建Portal dose验证计划,在Eclipse TPS的Portal dosimetry工具中将电子射野影响装置(Electronic Portal Imaging Device,EPID)测量的图像与TPS计算的预测剂量图像进行比对分析。根据TG218报告[9]和其他报告[10],γ指数采用更严格的2%/2 mm标准,当γ < 1的点数>90%表示计划验证通过。
1.8 统计学方法采用SPSS 19.0软件对结果进行统计学处理,采用Wilcoxon检验法评价各指标的差异性,检验水准α=0.05,P<0.05表述差异有统计学意义。
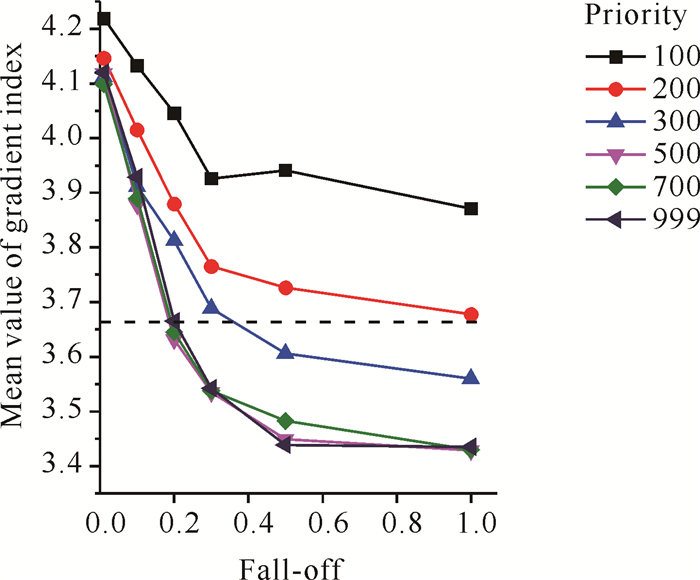
2 结果与分析 2.1 剂量跌落梯度指数图 1显示剂量跌落梯度指数平均值,其值为3.429-4.219。从图中看出随着Priority和Fall-off的增大,GI平均值呈下降趋势。当Fall-off为0.5或者1时,Priority为500、700和999的GI值趋于相似(P>0.05),但小于其他Piority和Fall-off参数的GI值(P < 0.05)。标准计划GI平均值为3.655。
|
| 图 1 不同Fall-off和Priority的剂量跌落梯度指数平均值(虚线代表标准计划的剂量跌落梯度指数) Fig. 1 Mean value of dose drop gradient index from different Fall-off and Priority value (The dotted line represents the dose drop gradient index of the standard plan) |
2.2 适形度指数
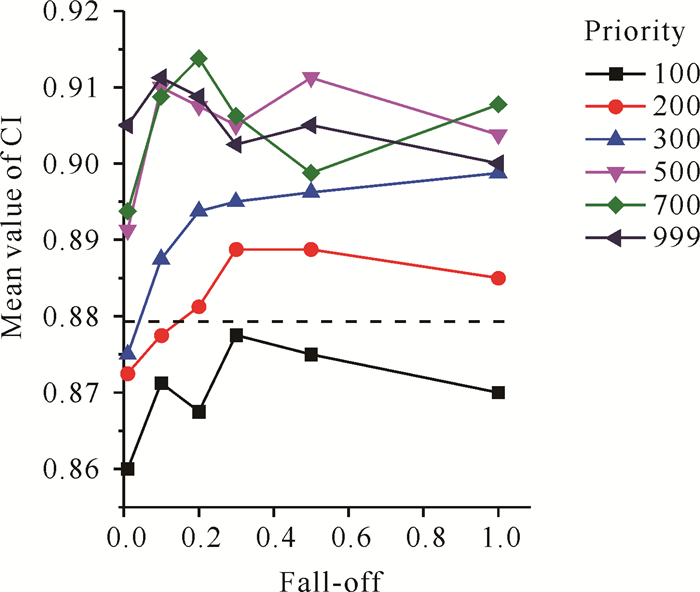
图 2显示靶区剂量适形度指数平均值,其值为0.860-0.914。从图 2可以看出CI值大小与Fall-off、Priority没有对应的下降或者上升趋势,这意味着Fall-off和Priority并不影响靶区CI值。标准计划CI平均值为0.879。
|
| 图 2 不同Fall-off和Priority的适形度指数平均值(虚线代表使用标准计划的适形度指数) Fig. 2 Mean value of conformity index from different Fall-off and Priority (The dotted line represents the conformity index using the standard plan) |
2.3 机器跳数
图 3显示机器跳数平均值,其值为2 626.85-3 209.54。其实际治疗时间(指加速器出射线时间,不包括摆位时间)为2.12 -2.88 min。实际治疗时间并没有明显差异(P>0.05),表明Fall-off和Priority对实际治疗时间没有影响。标准计划机器跳数平均值为2 781.2,实际治疗时间平均值为2.32 min。

|
| 图 3 不同Fall-off和Priority的机器跳数平均值(虚线代表使用标准计划的机器跳数) Fig. 3 Mean value of monitor units from different Fall-off and Priority (The dotted line represents the monitor unit using the standard plan) |
2.4 PTV Dmax
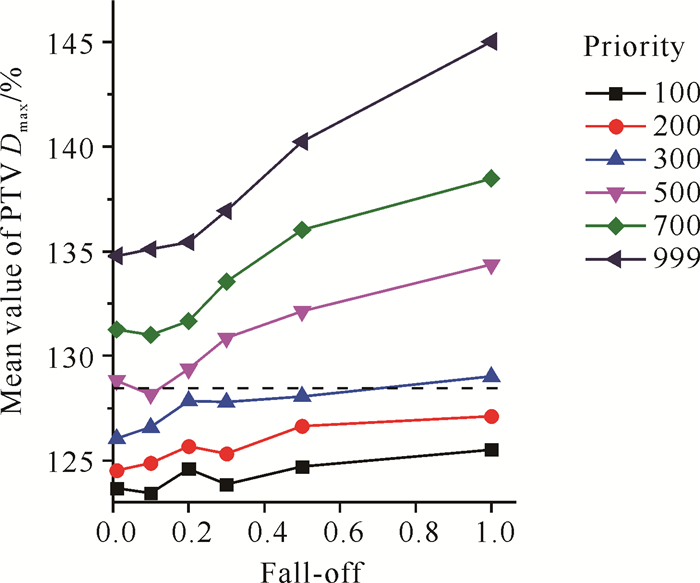
图 4显示PTV Dmax平均值,其值为123.43%-145.04%。从图中看出随着Priority增加,PTV Dmax增加(P < 0.05)。标准计划PTV Dmax平均值为128.8%。
|
| 图 4 不同Fall-off和Priority的PTV Dmax平均值(虚线代表使用标准计划的PTV Dmax) Fig. 4 Mean value of PTV Dmax from different Fall-off and Priority (The dotted line represents the PTV Dmax using the standard plan) |
2.5 50%处方剂量分布
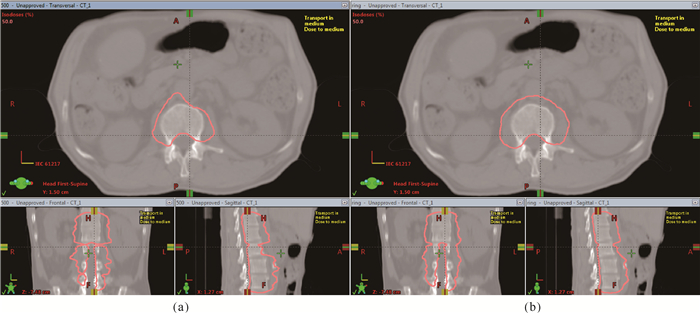
图 5(a)显示一例Priority、Fall-off分别为500和0.5的参考计划的50%处方剂量分布图,图 5(b)为一例标准计划的50%处方剂量分布图。从图 5可以看出,参考计划的50%处方剂量体积小于标准计划,意味着参考计划靶区外剂量跌落更陡峭。
|
| 图 5 参考计划和标准计划的50%处方剂量分布图 Fig. 5 50% prescription dose distributions of reference plan and standard plan |
2.6 计划临床合格率及剂量验证通过率
表 1显示所有参考计划临床合格率,从表中可以看出所有参考计划最高合格率为70%。所有参考计划剂量验证通过率都大于90%,这表示所有参考计划剂量验证都通过。所有标准计划临床合格率为100%,剂量验证通过率为100%。
| Fall-off | 临床合格率/% Clinical passing rate/% |
|||||
| Priority=100 | Priority=200 | Priority=300 | Priority=500 | Priority=700 | Priority=999 | |
| 0.01 | 20 | 30 | 40 | 70 | 60 | 70 |
| 0.10 | 30 | 30 | 70 | 70 | 70 | 70 |
| 0.20 | 20 | 30 | 50 | 50 | 60 | 50 |
| 0.30 | 20 | 40 | 30 | 50 | 70 | 50 |
| 0.50 | 30 | 40 | 50 | 70 | 40 | 30 |
| 1.00 | 0 | 50 | 40 | 30 | 30 | 30 |
3 讨论
晚期肿瘤患者常伴有远处转移,而脊柱是恶性肿瘤发生骨转移的最常见部位。骨转移往往导致骨相关事件(Skeletal Related Events,SRE)的发生[11],如严重疼痛、骨折、脊髓受压引起瘫痪等,明显降低患者的生活质量。近年来,许多研究发现立体定向放射治疗可以快速缓解脊柱肿瘤患者的疼痛,并且能提高其局部控制率, 降低毒性反应[12]。对于立体定向放射治疗,靶区外剂量跌落分布是一个很重要的问题。Lim等[13]对肺部SBRT技术研究发现,考虑到肺功能作用,较大范围的靶区外低剂量区域可能造成明显的副作用。Reynolds等[14]研究显示,脑部立体定向放疗计划的GI值大小与发生脑部不良反应率直接相关。对于脊柱转移瘤SBRT计划,由于靶区与脊髓距离很近,在保证相应的靶区适形度和剂量覆盖下,更陡峭的剂量梯度(更小的GI值)意味着给予脊髓更好的保护。
本研究发现以下结果。①Piority设置大于等于500时,Fall-off参数值大于等于0.5的计划GI值相似(P>0.05),但小于其他Piority和Fall-off参数的GI值(P < 0.05)。②所有计划的CI值和实际治疗时间没有显著性差异(P>0.05)。③随着Priority增加,PTV Dmax增加(P < 0.05)。④参考计划合格率最高为70%,所有参考计划剂量验证通过。因此,Fall-off、Priority分别设置为0.5和500最合适,在这种设置下计划的靶区能够实现较好的适形度、更低的剂量梯度指数、较高的计划合格率以及合适的治疗时间。相比标准计划,设置最适NTO优化工具参数的参考计划的GI值更低(3.449 vs 3.655,P=0.000,Z=-5.334),实际治疗时间无显著差异(2.65 min vs 2.32 min,P=0.068,Z=0.832),PTV Dmax偏大(132.1% vs 128.8%,P=0.002,Z=4.214),CI偏大(0.911 vs 0.879,P=0.151, Z=0.984),这表明设置最适NTO优化工具参数的参考计划优于设置环计划。标准计划的临床合格率为100%,大于最适合NTO参数计划,这可能是由于标准计划限制了靶区外110%处方剂量。
Bell等[15]报道了使用NTO优化工具参数设计肺部SBRT计划,发现当Piority和Fall-off两个参数分别设置为500和0.15时,计划是最合适的。该研究的靶区体积为5-15.1 cc,并且其靶区距离危及器官较远,所以研究者在设计计划时并没有增加限制危及器官条件,仅仅添加权重分别为50和100的靶区Upper dose和Lower dose优化条件。另外,该研究中靶区Upper dose条件设置为处方剂量的140%,NTO优化工具中Distance from Target Border、Start Dose和End Dose参数分别设置为0.1 cm、100%和10%,这种设置意味着NTO优化工具从离靶区0.1 cm处开始罚分剂量跌落,开始罚分剂量为140%处方剂量,停止罚分剂量为14%处方剂量。由于本研究的肿瘤位置紧挨着危及器官如脊髓,在优化计划时必须首先考虑危及器官剂量限制;而且,本研究NTO优化工具从离靶区0.2 cm处开始罚分剂量跌落,开始罚分剂量为91%处方剂量,停止罚分剂量为49.4%处方剂量。这些情况的不同可能导致本研究与Bell等[15]的研究结果不一样。
本研究为在脊柱转移瘤SBRT计划使用Eclipse治疗计划系统提供一种相对省时而高效的方法。然而本研究还存在一定的不足,仍需深入研究。第一,根据RTOG 0631[7]报告和Kim等[16]对椎体转移瘤形状定义,椎体转移瘤位置包括仅椎体/棘突部位、同侧锥弓根和椎体/棘突、双侧椎弓根和椎体/棘突等3种部位。本研究的脊柱转移瘤位置有9例仅在椎体部位,1例包括椎体和同侧锥弓根,但没有包含双侧椎弓根和椎体/棘突靶区。第二,为方便研究,本研究NTO优化工具中Distance from Target Border、Start Dose、End Dose 3个参数是根据经验以及习惯设置的,没有进行其他设置研究。第三,笔者发现不合格参考计划是由于靶区外产生了大于110%处方剂量。笔者对一例不合格计划重新优化,通过限制靶区外最大剂量,最终计划合格,这意味着结合环的使用能够提高参考计划合格率。第四,本研究设置减少靶区外50%处方剂量区域的环距离靶区1 cm,权重为500,在不影响计划合格率、靶区覆盖率和适形度的情况下,改变环的距离以及优化权重,GI值是否会小于本研究最优NTO优化工具参数计划所得出的值,有待进一步研究。
4 结论综上所述,当NTO优化工具中参数Distance from Target Border设置为0.2 cm,Start Dose设置为91%处方剂量,End Dose设置为49.4%处方剂量,Fall-off和Priority分别设置为0.5和500时,脊柱转移瘤立体定向放疗计划能够实现较好的靶区适形度、更低的剂量梯度指数、合适的治疗时间以及较高的合格率。
声明
本研究无任何利益冲突。
| [1] |
BALAGAMWALA E H, ANGELOV L, KOYFMAN S A, et al. Single-fraction stereotactic body radiotherapy for spinal metastases from renal cell carcinoma[J]. Journal of Neurosurgery: Spine, 2012, 17(6): 556-564. DOI:10.3171/2012.8.SPINE12303 |
| [2] |
CHAO S T, KOYFMAN S A, WOODY N, et al. Recursive partitioning analysis index is predictive for overall survival in patients undergoing spine stereotactic body radiation therapy for spinal metastases[J]. International Journal of Radiation Oncology· Biology· Physics, 2012, 82(5): 1738-1743. DOI:10.1016/j.ijrobp.2011.02.019 |
| [3] |
KATSOULAKIS E, JACKSON A, COX B, et al. A detailed dosimetric analysis of spinal cord tolerance in high-dose spine radiosurgery[J]. International Journal of Radiation Oncology·Biology·Physics, 2017, 99(3): 598-607. DOI:10.1016/j.ijrobp.2017.05.053 |
| [4] |
KOYFMAN S A, DJEMIL T, BURDICK M J, et al. Marginal recurrence requiring salvage radiotherapy after stereotactic body radiotherapy for spinal metastases[J]. International Journal of Radiation Oncology· Biology· Physics, 2012, 83(1): 297-302. DOI:10.1016/j.ijrobp.2011.05.067 |
| [5] |
BEZJAK A, PAULUS R, GASPAR L E, et al. Efficacy and toxicity analysis of NRG Oncoloy/RTOG 0813 trial of Stereotactic Body Radiation Therapy (SBRT) for centrally located non-small cell lung cancer (NSLLC)[J]. International Journal of Radiation Oncology·Biology·Physics, 2016, 96(2): S8. DOI:10.1016/j.ijrobp.2016.06.035 |
| [6] |
VIDETIC G, PAULUS R, SINGH A, et al. Long-term follow-up on NRG Oncology RTOG 0915 (NCCTG N0927): a randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stageⅠ peripheral non-small cell lung cancer[J]. International Journal of Radiation Oncology· Biology· Physics, 2019, 103(5): 1077-1084. DOI:10.1016/j.ijrobp.2018.11.051 |
| [7] |
RYU S, PUGH S L, GERSZTEN P C, et al. RTOG 0631 phase 2/3 study of image guided stereotactic radiosurgery for localized (1-3) spine metastases: phase 2 results[J]. Practical Radiation Oncology, 2014, 4(2): 76-81. DOI:10.1016/j.prro.2013.05.001 |
| [8] |
BENEDICT S H, YENICE K M, FOLLOWILL D, et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101[J]. Medical Physics, 2010, 37(8): 4078-4100. DOI:10.1118/1.3438081 |
| [9] |
MIFTEN M, OLCH A, MIHAILIDIS D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA: recommendation of AAPM Task Group No.218[J]. Medical Physics, 2018, 45(4): e53-e83. DOI:10.1002/mp.12810 |
| [10] |
PARK J L, PARK J M, KIM J, et al. Gamma-index method sensitivity for gauging paln delivery accuracy of volumetric modulated arc therapy[J]. Physica Medica, 2015, 31(8): 1118-1122. DOI:10.1016/j.ejmp.2015.08.005 |
| [11] |
BARTELS R H M A, VAN DER LINDEN Y M, VAN DER GRAAF W T A. Spinal extradural metastasis: review of current treatment options[J]. CA: A Cancer Journal for Clinicians, 2008, 58(4): 245-259. DOI:10.3322/CA.2007.0016 |
| [12] |
SPRATT D E, BEELER W H, DE MORAES F Y, et al. An integrated multidisciplinary algorithm for the management of spinal metastases: an International Spine Oncology Consortium report[J]. The Lancet Oncology, 2017, 18(12): e720-e730. |
| [13] |
LIM D H, YI B Y, MIRMIRAN A, et al. Optimal beam arrangement for stereotactic body radiation therapy delivery in lung tumors[J]. Acta Oncologica, 2010, 49(2): 219-224. DOI:10.3109/02841860903302897 |
| [14] |
REYNOLDS T A, JENSEN A R, BELLAIRS E E, et al. Dose gradient index for stereotactic radiosurgery/radiation therapy[J]. International Journal of Radiation Oncology· Biology· Physics, 2020, 106(3): 604-611. DOI:10.1016/j.ijrobp.2019.11.408 |
| [15] |
BELL J P, PATEL P, HIGGINS K, et al. Fine-tuning the normal tissue objective in eclipse for lung sterotactic body radiation therapy[J]. Medical Dosimetry, 2017, 43(4): 344-350. DOI:10.1016/j.meddos.2017.11.004 |
| [16] |
KIM J, KIM M, WOO J, et al. Stereotactic body radiation therapy for metastatic spine tumors: helical tomotherapy achieved high conformity for multiple lesions[J]. International Journal of Radiation Oncology· Biology· Physics, 2012, 84(3): S810. DOI:10.1016/j.ijrobp.2012.07.2167 |


