2. 广西中医药研究院, 广西中药质量标准研究重点实验室, 广西南宁 530022
2. Guangxi Key Laboratory of Traditional Chinese Medicine Quality Standards, Guangxi Institute of Traditional Medical and Pharmaceutical Sciences, Nanning, Guangxi, 530022, China
海洋真菌是指生活在海洋环境中的真菌,按来源可分为动物来源、红树林来源、海藻来源、珊瑚礁来源、海水来源及沉积物来源等[1]。由于长期处在高盐、高压、寡营养等独特的海洋生境下,海洋真菌形成了独特的代谢途径和防御机制。与海洋细菌相比,海洋真菌的生命层次更高,具有更复杂的代谢能力,能产生大量骨架多样、结构新颖的代谢产物,具有抗肿瘤、抗菌、抗病毒等多种生物活性[2-4]。因此,海洋真菌一直以来都是化学和药学等领域研究的焦点,是药物研发新型先导化合物的重要资源宝库[5-7]。
广西管辖的北部湾海域位于中国南海的西北部,地处热带和亚热带,海域面积2.8万平方千米,分布有红树林、珊瑚礁和海草床三大典型海洋生态系统,是海洋微生物生长的理想温床[8, 9]。虽然蕴含着丰富的海洋微生物资源,但是关于北部湾广西海域海洋真菌的物种多样性及其生物活性潜力的研究起步较晚。徐新亚等[10]统计显示北部湾已发现海洋细菌1 843种,而真菌仅197种,且这些真菌绝大部分来源于红树林植物及其根际土壤,针对海绵、海藻和珊瑚等海洋生物相关的微生物研究相对较少[11, 12]。近年来,卢护木等[13]从涠洲岛珊瑚和海藻等生物样本中分离获得了40株海洋真菌,其中5株真菌具有丰富的次生代谢产物和显著的抗耐甲氧西林金黄色葡萄球菌(Methicillin-Resistant Staphylococcus aureus, MRSA)活性。陆春菊等[14]采用4种培养基从10个涠洲岛柳珊瑚样本中分离得到191株共附生真菌,其中11种真菌具有抑菌活性,尤其是7种真菌可抑制表皮葡萄球菌(Staphylococcus epidermidis)生物被膜形成。上述研究表明北部湾广西海域中的微生物资源有着广阔的开发前景。基于此,本研究对北部湾广西海域海绵、珊瑚和沉积物等样品的真菌进行分离,并对其抗肿瘤、抗菌能力进行评估,为发现海洋来源的新型药物先导化合物奠定材料基础。
1 材料与方法 1.1 材料 1.1.1 样本来源海底沉积物、海绵、海螺和珊瑚等样品分别采集于涠洲岛(21.028 939 89°N,109.075 839 17°E)、沙田镇(21.503 406 99°N, 109.619 726 78°E)及北海附近(21.559 623 72°N, 108.928 553 71°E)的海域(图 1),样品于水下装入无菌封口袋密封,置于冰盒中保存,运输至实验室后于4 ℃冰箱中低温保藏并用于真菌的分离。
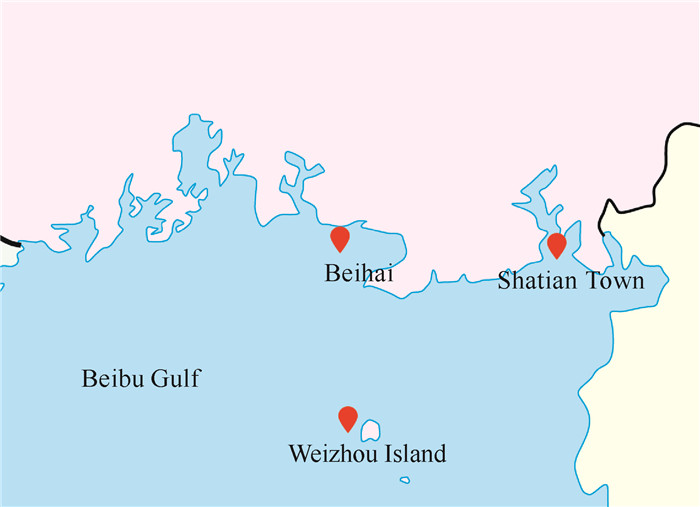
|
| 图 1 采样区域位置示意图 Fig. 1 Schematic diagram of sampling location |
1.1.2 仪器与试剂
MLS-3781L-PC高压蒸汽灭菌锅(SANYO公司),N-1300旋转蒸发仪(日本东京理化器械株式会社),KQ-800DE超声波清洗器(昆山市超声仪器有限公司),SHP-250生化培养箱(上海精宏实验设备有限公司),C1002 PCR扩增仪(美国Bio-Rad公司),DYY-6D核酸电泳仪(北京六一生物科技有限公司),ZWYR-2102立式恒温培养振荡器(上海智诚分析仪器制造有限公司)。Lysis Buffer for Microorganism to Direct PCR试剂盒[宝日医生物技术(北京)有限公司],buffer、ITS1/ITS4引物、Taq酶[生工生物(上海)工程股份有限公司],提取用试剂乙酸乙酯、甲醇等均为分析纯(广东光华科技股份有限公司),细胞培养级二甲基亚砜(DMSO,北京索莱宝科技有限公司)。
1.1.3 培养基真菌分离马铃薯葡萄糖琼脂(PDA)培养基:马铃薯提取粉6.0 g,葡萄糖20.0 g,琼脂粉20.0 g,海盐20.0 g,萘啶酮酸0.025 g,新生霉素0.025 g,蒸馏水1 L,置121 ℃高压灭菌20 min,待温度降至60 ℃以下,于超净工作台中倒平板,冷却后待用。
马铃薯葡萄糖肉汤(PDB)培养基:马铃薯提取粉6.0 g,葡萄糖20.0 g,海盐20.0 g,蒸馏水1 L,置121 ℃高压灭菌20 min后待用。
大米培养基:于1 L的三角瓶中加入大米80.0 g,海盐2.0 g,蒸馏水120 mL,透气膜封口后,置于121 ℃高压灭菌20 min后待用。
溶菌肉汤(LB)培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,琼脂粉20.0 g,蒸馏水1 L,置121 ℃高压灭菌20 min,待温度降至60 ℃以下,于超净工作台中倒平板,冷却后待用。
1.1.4 指示菌及细胞株病原菌:表皮葡萄球菌(Staphylococcus epidermidis),金黄色葡萄球菌(S.aureus),耐甲氧西林金黄色葡萄球菌(Methicillin-Resistant S.aureus ATCC-25923, MRSA),甘蔗梢腐镰刀菌(Fusarium sp.LD-12)。
细胞:人结直肠癌细胞SW480,人结直肠癌细胞HT29,人正常肝细胞LO-2。
1.2 方法 1.2.1 样品预处理及真菌的分离培养海洋生物样品:在超净台取海绵、珊瑚、海螺样品的新鲜组织,剪成约1 cm×1 cm大小的碎片;用无菌人工海水洗涤后,在研钵中充分研磨;采用无菌人工海水按1∶10的比例逐级稀释。沉积物:称量海泥样品1.0 g,加入1 mL无菌人工海水按1∶10的比例逐级稀释。
取不同稀释度(原浆,10-1,10-2)的菌悬液200 μL分别均匀涂布于分离PDA平板上,每个稀释度涂布3个平板,于28 ℃培养箱中倒置培养3-10 d。待平板上菌落长出后,挑取形态、颜色不同的单菌落至无萘啶酮酸和新生霉素的PDA平板中继续纯化培养。将纯化好的菌株一份接入斜面培养基,存放于4 ℃冰箱;另一份接入含20%甘油的液体培养基中,于-80 ℃冰箱保藏。
1.2.2 海洋真菌的分子鉴定用无菌牙签挑取少量真菌菌丝体,置于1.5 mL离心管中,采用Lysis Buffer for Microorganism to Direct PCR试剂盒对菌体进行裂解,采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[15]。PCR反应条件:94 ℃预变性4 min; 94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环; 最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。基因测序委托生工生物工程(上海)股份有限公司完成。将测序结果在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中进行基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)分析,根据检索序列的相似性初步鉴定菌株的种属。结合形态学观察和序列比对结果对真菌进行排重,采用Mega-X构建系统发育树。
1.2.3 真菌发酵粗提物的制备将纯化培养所得的菌株接种于PDB培养基中。透气封口膜封口后置于摇床中,28 ℃、180 r/min条件下活化3-5 d。取10 mL菌液接种至大米培养基中,室温下静置发酵30 d。发酵结束后,将大米培养基捣碎,加入600 mL乙酸乙酯,40 kHz超声提取3次,每次1 h。真空抽滤,合并滤液,减压浓缩后得到发酵粗提物。粗提物用DMSO溶液溶解,配置成10 mg/mL的供试品溶液,备用。
1.2.4 粗提物的抑菌活性测试采用滤纸片琼脂扩散法测试粗提物对表皮葡萄球菌、金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、甘蔗梢腐镰刀菌的抑菌活性。将上述指示菌均匀涂布到LB培养基上,并用镊子将直径为6 mm的无菌滤纸片贴于培养基表面,轻按固定。用移液器吸取粗提物供试品溶液3 μL于滤纸片上,并以氨苄霉素或青霉素作为阳性对照,DMSO为阴性对照。加药后的平板于28 ℃的恒温培养箱倒置培养12-24 h,观察有无抑菌圈产生。
1.2.5 粗提物的细胞毒活性测试采用MTT比色法[16]测试粗提物对人结直肠癌细胞SW480、HT29和人正常肝细胞LO-2的细胞毒活性。将真菌发酵粗提物供试品溶液稀释至100 μg/mL并给药,以0.1% DMSO作为阴性对照,实验设3个重复。给药72 h后,用酶标仪测定490 nm处的吸光度(OD值),计算各组细胞增殖抑制率。抑制率(%)=[(OD阴性-OD粗提物)/OD阴性]×100%。
2 结果与分析 2.1 菌株鉴定结果及多样性分析从来源于北部湾广西海域的7份海绵、2份珊瑚、1份海螺和2份沉积物样品中分离得到54株海洋真菌,经菌落形态差异排重后得到45株。基于N-J法的系统发育树(图 2)显示45株真菌分布在17个属(表 1),其中青霉属(Penicillium)和曲霉属(Aspergillus)为优势种群,分别占26.7%和24.4%,其次为木霉属(Trichoderma),占11.1%。此外,菌株Myrothecium gramineum GXIMD01018与其近缘菌株ITS基因的最高相似度低于97%,推测其是潜在的新种。
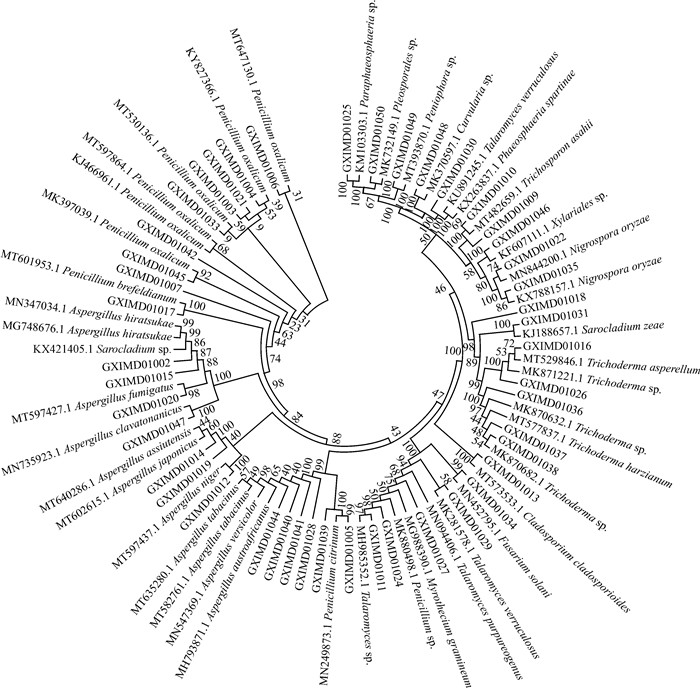
|
| 图 2 基于ITS测序的系统发育树 Fig. 2 Phylogenetic tree based on ITS sequences |
| 菌株编号Strain code | 鉴定结果Identification results | ITS序列相似度/% ITS sequence similarity/% | GeneBank登录号GeneBank accession numbers | 真菌来源Source of fungi |
| GXIMD01002 | Aspergillus hiratsukae | 100.00 | OP303266 | Coral 1 |
| GXIMD01003 | Penicillium oxalicum | 100.00 | OP303267 | Coral 1 |
| GXIMD01004 | P.oxalicum | 100.00 | OP303268 | Coral 1 |
| GXIMD01005 | P.citrinum | 99.61 | OP303269 | Coral 1 |
| GXIMD01006 | P.oxalicum | 100.00 | OP303270 | Coral 1 |
| GXIMD01007 | Penicillium sp. | 99.46 | OP303271 | Coral 2 |
| GXIMD01009 | Trichosporon asahii | 100.00 | OP303272 | Coral 2 |
| GXIMD01010 | T.asahii | 100.00 | OP303273 | Coral 2 |
| GXIMD01011 | Talaromyces sp. | 99.78 | OP303274 | Sponge 1 |
| GXIMD01012 | Aspergillus niger | 100.00 | OP303275 | Sponge 1 |
| GXIMD01013 | Cladosporium cladosporioides | 99.78 | OP303276 | Sponge 1 |
| GXIMD01014 | Aspergillus japonicus | 100.00 | OP303277 | Sponge 1 |
| GXIMD01015 | A.hiratsukae | 100.00 | OP303278 | Sponge 2 |
| GXIMD01016 | Trichoderma asperellum | 100.00 | OP303279 | Sponge 2 |
| GXIMD01017 | Penicillium brefeldianum | 100.00 | OP303280 | Sponge 2 |
| GXIMD01018 | Myrothecium gramineum | 96.06 | OP303281 | Sponge 2 |
| GXIMD01019 | Aspergillus assiutensis | 100.00 | OP303282 | Sponge 2 |
| GXIMD01020 | A.fumigatus | 100.00 | OP303283 | Sponge 2 |
| GXIMD01021 | Penicillium oxalicum | 100.00 | OP303284 | Sponge 2 |
| GXIMD01022 | Nigrospora oryzae | 100.00 | OP303285 | Sponge 2 |
| GXIMD01024 | Talaromyces sp. | 99.79 | OP303286 | Sponge 3 |
| GXIMD01025 | Paraphaeosphaeria sp. | 100.00 | OP303287 | Sponge 3 |
| GXIMD01026 | Trichoderma sp. | 100.00 | OP303288 | Sponge 3 |
| GXIMD01027 | Penicillium sp. | 100.00 | OP303289 | Sponge 3 |
| GXIMD01028 | Aspergillus tabacinus | 100.00 | OP303290 | Sponge 3 |
| GXIMD01029 | Talaromyces verruculosus | 100.00 | OP303291 | Sponge 3 |
| GXIMD01030 | Phaeosphaeria spartinae | 100.00 | OP303292 | Sponge 3 |
| GXIMD01031 | Sarocladium zeae | 100.00 | OP303293 | Sponge 4 |
| GXIMD01033 | Penicillium oxalicum | 100.00 | OP303294 | Sponge 4 |
| GXIMD01034 | Fusarium solani | 100.00 | OP303295 | Sponge 4 |
| GXIMD01035 | Nigrospora oryzae | 100.00 | OP303296 | Sponge 4 |
| GXIMD01036 | Trichoderma harzianum | 100.00 | OP303297 | Sponge 5 |
| GXIMD01037 | Trichoderma sp. | 100.00 | OP303298 | Sponge 5 |
| GXIMD01038 | Trichoderma sp. | 100.00 | OP303299 | Sponge 5 |
| GXIMD01039 | Penicillium sp. | 100.00 | OP303300 | Sponge 6 |
| GXIMD01040 | Aspergillus tabacinus | 100.00 | OP303301 | Sponge 6 |
| GXIMD01041 | A.austroafricanus | 100.00 | OP303302 | Sponge 6 |
| GXIMD01042 | Penicillium oxalicum | 100.00 | OP303303 | Sponge 7 |
| GXIMD01044 | Aspergillus versicolor | 100.00 | OP303304 | Conch |
| GXIMD01045 | Penicillium oxalicum | 98.67 | OP303305 | Sediment 1 |
| GXIMD01046 | Xylariales sp. | 99.30 | OP303306 | Sediment 1 |
| GXIMD01047 | Aspergillus clavatonanicus | 100.00 | OP303307 | Sediment 1 |
| GXIMD01048 | Curvularia sp. | 100.00 | OP303308 | Sediment 1 |
| GXIMD01049 | Peniophora sp. | 100.00 | OP303309 | Sediment 1 |
| GXIMD01050 | Pleosporales sp. | 100.00 | OP303310 | Sediment 2 |
2.2 细胞毒活性筛选
45株真菌大米发酵后的乙酸乙酯粗提物对人结直肠癌细胞SW480、HT29及人正常肝细胞的细胞毒活性见表 2。结果表明菌株Penicillium oxalicum GXIMD01021对SW480和HT29两种人结直肠癌细胞均有显著的细胞毒活性,抑制率大于79%,且对正常细胞(LO-2)的毒性较低(抑制率 < 50%);Aspergillus japonicus GXIMD01014、Talaromyces purpureogenus GXIMD01024、Trichoderma sp.GXIMD01026、Fusarium solani GXIMD01034、Trichoderma sp.GXIMD01038对SW480具有较显著的细胞毒活性;菌株Penicillium oxalicum GXIMD01004、Aspergillus niger GXIMD01012、Paraphaeosphaeria sp.GXIMD01025、Sarocladium sp.GXIMD01031对癌细胞和正常细胞均有毒性。
| 菌株编号Strains code | 抑制率/% Inhibition ratio/% | 菌株编号Strains code | 抑制率/% Inhibition ratio/% | |||||
| SW480 | HT29 | LO-2 | SW480 | HT29 | LO-2 | |||
| GXIMD01003 | 71.38 | < 50.00 | < 50.00 | GXIMD01025 | 83.41 | 74.57 | 75.94 | |
| GXIMD01004 | 86.97 | 86.36 | 81.93 | GXIMD01026 | 84.63 | < 50.00 | < 50.00 | |
| GXIMD01006 | 78.73 | < 50.00 | < 50.00 | GXIMD01030 | 76.28 | < 50.00 | < 50.00 | |
| GXIMD01007 | 68.93 | < 50.00 | < 50.00 | GXIMD01031 | 87.19 | 82.58 | 70.90 | |
| GXIMD01012 | 86.75 | 76.30 | 89.71 | GXIMD01034 | 83.96 | < 50.00 | < 50.00 | |
| GXIMD01014 | 86.75 | 62.12 | < 50.00 | GXIMD01038 | 82.85 | < 50.00 | < 50.00 | |
| GXIMD01018 | 74.61 | < 50.00 | < 50.00 | GXIMD01045 | 78.62 | < 50.00 | < 50.00 | |
| GXIMD01021 | 85.97 | 79.55 | < 50.00 | GXIMD01047 | 76.50 | < 50.00 | < 50.00 | |
| GXIMD01024 | 79.62 | 55.30 | < 50.00 | Others | < 50.00 | < 50.00 | < 50.00 | |
2.3 抑菌活性筛选
测试45株真菌大米发酵后的粗提物对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、表皮葡萄球菌及甘蔗梢腐致病菌的抑制作用,共筛选出6株真菌对至少一种病原菌具有一定的抑菌作用,其中菌株Talaromyces purpureogenus GXIMD01024和菌株Penicillium oxalicum GXIMD01004的发酵产物分别对MRSA菌株、甘蔗梢腐镰刀菌具有一定的抑制作用(表 3)。
| 菌株编号Strains code | 金黄色葡萄球菌S.aureus | 耐甲氧西林金黄色葡萄球菌MRSA | 表皮葡萄球菌S.epidermidis | 甘蔗梢腐镰刀菌Fusarium sp. |
| GXIMD01004 | - | - | - | ++ |
| GXIMD01006 | - | - | - | + |
| GXIMD01010 | - | - | - | + |
| GXIMD01024 | + | ++ | - | - |
| GXIMD01025 | + | - | + | - |
| GXIMD01048 | + | - | + | + |
| Others | - | - | - | - |
| Blank | - | - | - | - |
| Positive | +++ | +++ | +++ | +++ |
| Note: “-”indicates inactive, “+”indicates weak activity, “++”indicates medium activity, “+++”indicates significant activity. | ||||
3 结论
本研究采用稀释分离法从北部湾广西海域采集的海绵、珊瑚等样品中,分离纯化获得45株真菌,其中Myrothecium gramineum GXIMD01018是一潜在新种。通过滤纸片琼脂扩散法和MTT法对菌株代谢产物的抗菌、抗肿瘤活性进行初步筛选,发现菌株Penicillium oxalicum GXIMD01021对两种人结直肠癌细胞均具有显著的细胞毒活性,Aspergillus japonicus GXIMD01014等5株菌株对人结直肠癌细胞SW480具有显著的细胞毒活性,菌株Talaromyces purpureogenus GXIMD01024的发酵产物具有一定的抗MRSA活性,P.oxalicum GXIMD01004对甘蔗梢腐镰刀菌具有一定的抑制效果。然而,目前仅对菌株的发酵粗提物进行了活性研究,菌株中具体的药效物质仍需要进行系统的化学和生物活性评价研究。后续将对上述菌株的次级代谢产物进行深入研究, 为北部湾广西海域来源的新型药物先导化合物的发现提供理论基础和参考依据。
| [1] |
马丽丽, 田新朋, 李桂菊, 等. 海洋微生物来源天然产物研究现状与态势[J]. 热带海洋学报, 2021, 40(5): 134-146. |
| [2] |
王庆琳, 陈水浩, 陈冬妮, 等. 中国南海海洋真菌资源及其活性次级代谢产物研究评述[J]. 生物资源, 2020, 42(5): 505-514. |
| [3] |
吴泽宏, 马民, 陈建良. 海洋真菌活性次级代谢产物研究进展[J]. 广东药科大学学报, 2017, 33(5): 687-699. |
| [4] |
付逸群, 于颖敏, 马瑞遥, 等. 海洋来源真菌生物活性物质研究进展[J]. 山东化工, 2019, 48(22): 63-65, 67. |
| [5] |
CARROLL A R, COPP B R, DAVIS R A, et al. Marine natural products[J]. Natural Product Reports, 2019, 36(1): 122-173. DOI:10.1039/C8NP00092A |
| [6] |
张善文, 黄洪波, 桂春, 等. 海洋药物及其研发进展[J]. 中国海洋药物, 2018, 37(3): 77-92. |
| [7] |
冯贻东, 冯汉林. 现代海洋药物研发进展与浅析[J]. 应用海洋学学报, 2021, 40(2): 366-371. |
| [8] |
王盟. 广西北部湾海洋环境现状及治理对策思考[J]. 南方国土资源, 2017(11): 40-42, 45. |
| [9] |
于清武. 北部湾(广西海域)海洋微生物多样性研究现状与对策[J]. 南方农业学报, 2014, 45(12): 2293-2296. |
| [10] |
徐新亚, 杨宏, 宁小清, 等. 北部湾海洋微生物物种多样性与化学多样性研究进展[J]. 广西科学, 2020, 27(5): 433-450, 461. |
| [11] |
王聪, 苏艳, 高谕康, 等. 广西北部湾来源抗菌活性真菌菌株的分离筛选及活性产物鉴定[J]. 国际药学研究杂志, 2019, 46(4): 270-276. |
| [12] |
高程海, 夏家朗, 梁考云, 等. 北部湾海洋植物及其共附生微生物次级代谢产物研究进展[J]. 广西植物, 2022, 42(8): 1259-1272. |
| [13] |
卢护木, 詹振宇, 李蜜, 等. 涠洲岛珊瑚礁海洋真菌的分离鉴定及其抗MRSA活性筛选[J]. 广西科学, 2020, 27(5): 520-525. |
| [14] |
陆春菊, 陆玫霖, 刘昕明, 等. 广西涠洲岛柳珊瑚共附生真菌多样性及其抑菌活性[J]. 热带海洋学报, 2021, 40(5): 45-52. |
| [15] |
ZHAO G, ZHAI H, YUAN Q, et al. Rapid and sensitive diagnosis of fungal keratitis with direct PCR without template DNA extraction[J]. Clinical Microbiology and Infection, 2014, 20(10): 776-782. |
| [16] |
DENIZOT F, LANG R. Rapid colorimetric assay for cell growth and survival: modifications to the tetrazolium dye procedure giving improved sensitivity and reliability[J]. Journal of Immunological Methods, 1986, 89(2): 271-277. |



