2. 广西海洋研究所有限责任公司, 广西北海 536000
2. Guangxi Institute of Oceanology Co., Ltd., Beihai, Guangxi, 536000, China
浮游动物是水体中重要的次级生产者,其作为水生生态系统的重要组成部分,不仅在水生食物网中占据中心位置,而且在生态系统结构、功能和生源要素循环中起着重要作用[1, 2]。浮游动物个体小,对水体环境变化敏感,不仅能反映水体生态环境状况、评估水体营养状况的变化,而且还可以作为一些经济水产动物的主要饵料[3-5]。因此,探究浮游动物群落与水产动物的关系,对水产养殖和水体生态系统健康具有重要意义。
鲢鱼(Hypophthalmichthys molitrix)和鳙鱼(Aristichthys nobilis)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae),为中上层的滤食性鱼类,主要以藻类、轮虫和甲壳动物的枝角类为食,滤食功能由鳃耙、鳃褶及咽上器官共同完成[6]。鲢鱼、鳙鱼是我国重要的经济鱼类,在养殖水体中,鲢鱼主要摄食藻类,对微囊藻去除率较高[7],鳙鱼主要摄食浮游动物,两者合理混养有利于水质的调节并维持生态平衡[8-10]。在长江流域湖泊(太湖、巢湖和东湖等)和高原湖泊(滇池和洱海湖等)已验证,放养鲢鳙可有效缓解或避免湖泊水体富营养化[11-13]。有研究报道,4∶1的鲢鳙配比对水体浮游植物的控制效果比较明显[14],3∶1的鲢鳙配比能有效避免东湖的藻华现象[12]。杨卓等[15]研究发现适当增大鳙鱼的放养比例有助于降低水体总氮含量,从而优化水质。另外,鲢鳙与其他鱼类如光倒刺鲃(Spinibarbus hollandi)混养可以控制丝状藻水绵(Spirogyra sp.)生物量,有效改善水质[16],但与罗非鱼混养会使浮游动物群落趋于小型化[17]。从上述内容可知,鲢鳙与其他鱼类混养和较高的鲢鱼放养比例对浮游植物有较大影响,因此本研究进一步探讨增加鳙鱼放养比例对浮游动物群落结构的影响。
多种鱼类共存混养模式可充分利用养殖水体的饵料和空间资源,提升养殖品种的产量。邢丽荣等[18]通过对多种鱼类共存混养模式、单养模式和立体养殖模式下的环境与经济效益比较发现,多种鱼类共存混养模式环境成本最低、经济效益最高。有研究表明,鲢鳙与细鳞斜颌鲴(Plagiognathops microlepis Bleeker)混养可丰富生物种类和食物链结构,提高经济效益[19];与虾蟹鳜混养能够充分利用水体空间和饵料资源,优化养殖结构,增加单位面积产量[20];与尼罗罗非鱼(Oreochromis niloticus)和麦瑞加拉鲮鱼(Cirrhinus mrigala)混养可以提高饲料和养殖效能[21]。因此,探究多种类鱼类混养塘中不同鲢鳙配比对浮游动物和养殖效能的影响,筛选并建立基于良水质和佳效能的鲢鳙配比模式,不仅可以提高水体生态环境质量,而且对充分利用养殖水体的生物饵料和空间资源、增加养殖效能有重要意义。
迄今,对于鲢鱼、鳙鱼混养的研究主要集中在其对于浮游生物的控制效果方面,对于基于不同鲢鳙配比的多品种混养池塘的浮游动物群落结构的健康和各混养品种鱼类的养殖效能研究还未见报道。本研究通过实时监测分析养殖塘水体浮游动物的动态变化,运用生物多样性指数探讨池塘生态健康状况,比较分析、评价不同鲢鳙配比条件下的池塘浮游动物群落结构和养殖效能,拟为健全鲢鳙等多品种鱼类混养池塘生态养殖技术提供理论依据,为合理开发和高效利用全国丰富的池塘水资源、保障养殖水体生态安全和养殖产品质量安全提供技术支撑。
1 材料与方法 1.1 试验鱼和饲料试验主养鱼为鲢鱼和鳙鱼,配养青鱼(Mylopharyngodon piceus)、鲫鱼(Carassius auratus)、鲤鱼(Cyprinus carpio)、鲮鱼(Cirrhinus molitorella)和胡子鲇(Clarias fuscus),所用鱼苗种均购于广西南宁市某养殖场,其规格见表 1。试验期间所用饲料均为海大鱼苗专用沉性配合饲料(粗蛋白≥35%,粗纤维≤10.0%,粗脂肪≥3.0%,粗灰分≤15.0%,赖氨酸≥1.80%,总磷0.70%-1.60%,水分≤10.0%)。
| 鱼苗种类 Fish species |
体质量/g Body weight/g |
体长/cm Body length/cm |
| H.molitrix | 3.15±0.68 | 7.27±0.48 |
| A.nobilis | 6.81±1.92 | 9.06±0.76 |
| Mylopharyngodon piceus | 4.29±0.23 | 9.79±0.28 |
| Carassius auratus | 4.41±0.41 | 9.60±0.37 |
| Cyprinus carpio | 4.74±0.36 | 9.81±0.39 |
| Cirrhinus molitorella | 4.95±0.33 | 9.98±0.45 |
| Clarias fuscus | 6.48±0.38 | 10.55±0.52 |
1.2 试验塘
试验塘为广西南宁市西乡塘区某水产养殖公司的6口生产性养殖池塘。各池塘均为长方形土质塘,面积0.13-0.40 ha,平均水深约1.5 m。池塘用水以集雨水为主,抽提地下水为辅。各塘均未配备增氧设备。
1.3 试验设计和养殖管理设A、B、C 3个试验组,A组鲢鳙配比为1∶1,B组鲢鳙配比为3∶7,C组鲢鳙配比为1∶9。每个试验组设2个重复(A1、A2;B1、B2;C1、C2),各试验塘配养鱼品种、规格和放养密度相同(表 2)。鱼苗放养前,各组池塘均泼洒生石灰进行彻底清塘和消毒,生石灰用量为1 799 kg/ha。养殖试验期内实行“四定”投饲,日投饲率为1.5%-3.5%。各试验塘按主养鱼放养量和平均体质量估算的养殖对象存塘量来计算日投饲量,并根据池塘水温、鱼类生长及摄食状况适时调整日投饲量。每日投饲两次(9:00前后和17:00前后各投喂1次)。定时巡塘,观察水色和鱼类摄食情况,试验周期194 d。
| 池塘 Pond |
面积/ha Area/ha |
鱼苗种放养量/(尾/ha) Stocking number of fry species/(Fish/ha) |
总放养量/kg Total amount of stocking/kg |
||||||
| 鲢鱼 H.molitrix |
鳙鱼 A.nobilis |
青鱼 Mylopharyngodon piceus |
鲫鱼 Carassius auratus |
鲤鱼 Cyprinus carpio |
鲮鱼 Cirrhinus molitorella |
胡子鲇 Clarias fuscus |
|||
| A1 | 0.30 | 3 750 | 3 750 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 36.42 |
| A2 | 0.40 | 3 750 | 3 750 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 48.56 |
| B1 | 0.27 | 5 250 | 2 250 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 31.30 |
| B2 | 0.23 | 5 250 | 2 250 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 26.66 |
| C1 | 0.20 | 6 750 | 750 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 22.08 |
| C2 | 0.13 | 6 750 | 750 | 1 800 | 3 300 | 900 | 1 800 | 7 500 | 14.35 |
1.4 浮游动物样品采集及相关指标测定 1.4.1 浮游动物样品采集和处理
养殖试验期间每月进行一次浮游动物采集,共7次。每口塘以投饵台为基点按对角线法设两个采样点,均距离塘堤约2 m。浮游动物定性样本使用网目64 μm的25号浮游生物网进行采集,加4%甲醛固定后带回实验室用于种类鉴定。定量样本使用1 L的有机玻璃采水器于水下0.5 m深处采集,加入15 mL鲁哥氏液固定,带回实验室静置沉淀24 h后浓缩、定容至50 mL,取0.1 mL用计数框视野计数法在10×40倍光学显微镜下观察计数。
浮游动物密度计算公式为
| $ N=\frac{n \times v}{M \times V}, $ |
式中,N为1 L水样中的浮游生物个数(ind./L),n为计数所获得的个体数(ind.),v为沉淀样品体积(mL);M为计数体积(mL),V为浮游生物样品采集体积(L)。
1.4.2 浮游生物多样性分析参照朱佳志等[22]的方法对浮游生物优势度(Y)、Shannon-Wiener多样性指数(H)、Margalef丰富度指数(D)及Pielou均匀度指数(J)进行计算分析。上述评价指标的计算公式分别如下:
| $ \begin{aligned} & Y=n_i / N \times f_i, \\ & H=-\sum\limits_{i=1}^N P_i \log _2 P_i, \\ & D=(S-1) / \ln N, \\ & J=H / \log _2 S, \end{aligned} $ |
上述各式中:ni为第i种浮游生物个体数,N为全部浮游生物个体数之和,fi为第i种浮游生物出现的频率,Pi为第i种浮游生物个体数占全部浮游生物个体数的比例,S为浮游生物种类数。Y≥0.02表示该物种为优势种[23],H、D和J的评价标准[24]见表 3。
| 生物多样性指数 Biodiversity index |
重污染 Heavy pollution |
α-中污染 α-moderate pollution |
β-中污染 β-moderate pollution |
轻污染 Light pollution |
| H | 0-1 | 1-2 | 2-3 | >3 |
| D | 0-1 | 1-2 | 2-3 | >3 |
| J | 0.0-0.3 | 0.3-0.4 | 0.4-0.5 | >0.5 |
1.5 鱼类生长指标测定
各塘放养的同种类鱼苗种均为同批次、同规格苗种。鱼种放养当天每种鱼均随机抽样30尾,测定鱼苗种初始体质量和体长。试验期末用地笼诱捕,各塘每种鱼均随机抽样30尾,测定鱼期末体质量和体长。参考龚福来等[25]的方法计算增重率(WGR)、特定生长率(SGR)、肥满度(CF)、饲料系数(FCR)和体质量均匀度(WE),计算公式分别如下:
| $ \begin{aligned} & \operatorname{WGR}(\%)=100 \times\left(W_1-W_0\right) / W_0, \\ & \operatorname{SGR}(\%)=100 \times\left(\ln W_1-\ln W_0\right) / d, \\ & \operatorname{CF}(\%)=100 \times\left(W / L^3\right), \\ & \operatorname{FCR}=100 \% \times \mathrm{TF} /\left(W_1-W_0\right), \\ & \mathrm{WE}(\%)=100 \times W_{\min } / \bar{w}, \end{aligned} $ |
式中,W0为鱼苗种初始体质量(g),W1为成鱼末体质量(g),W为鱼体质量(g),L为鱼体长(cm),TF为投饲量(g),d为养殖天数,Wmin为成鱼末体质量最小值(g),w为成鱼末体质量平均值(g)。
1.6 数据分析试验数据采用Microsoft office Excel 2019和SPSS 26.0软件进行单因素方差分析(One-way ANOVA)、多重比较(LSD法)和作图,并判断在0.05水平上的差异显著性,以显著水平P>0.05为差异不显著,P<0.05为差异显著。所得结果数据均采用“平均数±标准差”的形式表示。
2 结果与分析 2.1 鲢鳙配比对各组浮游动物群落结构特征的影响各组浮游动物群落组成见表 4。从表 4可知,A、B、C组共鉴定出浮游动物4类30种,其中A组4类25种,轮虫类最多,占比为56.00%;B组4类27种,轮虫类最多,占比为55.56%;C组4类26种,轮虫类最多,占比为57.69%。总体上,B组的浮游动物种数最多,比A组和C组分别高8.00%和3.85%。
| 种类 Species |
A组Group A | B组Group B | C组Group C | |||||
| 种数 Number of species |
百分比/% Percentage/% |
种数 Number of species |
百分比/% Percentage/% |
种数 Number of species |
百分比/% Percentage/% |
|||
| Protozoa | 6 | 24.00 | 6 | 22.22 | 6 | 23.08 | ||
| Rotifer | 14 | 56.00 | 15 | 55.56 | 15 | 57.69 | ||
| Cladocera | 1 | 4.00 | 2 | 7.41 | 1 | 3.85 | ||
| Copepoda | 4 | 16.00 | 4 | 14.81 | 4 | 15.38 | ||
| Summation | 25 | 100.00 | 27 | 100.00 | 26 | 100.00 | ||
2.2 浮游动物密度和生物量动态变化情况
各组浮游动物密度动态变化情况如图 1所示。由图 1可知,A、B、C组浮游动物密度分别为68-253、57-250、64-225 ind./L,其中C组变幅最小,B组变幅最大;3组浮游动物平均密度分别为118、124、120 ind./L,其中B组最高,A组最低,各组之间差异不显著(P>0.05,下同);随着养殖时间的增加,A、B、C组浮游动物密度分别在11月、8月和11月降到最低。

|
| 图 1 各组浮游动物密度动态变化 Fig. 1 Dynamic changes of zooplankton density in each group |
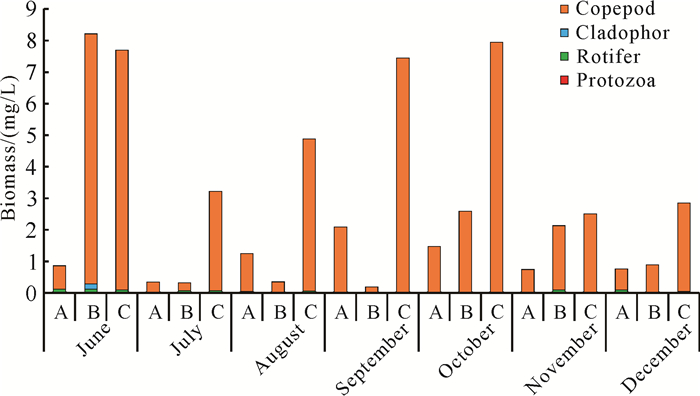
各组浮游动物生物量动态变化情况见图 2。由图 2可知,A、B、C组浮游动物生物量分别为0.34-2.09、0.32-8.22、2.51-7.95 mg/L,其中A组变幅最小,B组变幅最大;3组浮游动物平均生物量分别为1.11、1.44、4.81 mg/L,其中C组最高,A组最低,3组间差异不显著;随着试验的进行,A、B、C组浮游动物生物量均呈波浪式升降状态。上述结果表明,随着鳙放养比例的上升,浮游动物的平均密度呈先增加后降低的趋势,平均生物量逐渐增大。
|
| 图 2 各组浮游动物生物量动态变化 Fig. 2 Dynamic changes of zooplankton biomass in each group |
2.3 浮游动物优势种及优势度
各组浮游动物优势种如表 5所示。由表 5可知,3组池塘共检测到浮游动物优势种8种,隶属于原生动物、轮虫、枝角类动物和桡足类动物,各组优势种数相同。A组和C组的萼花臂尾轮虫(Brachionus calyciflorus)优势度高于对应组的其他种,B组无节幼体(Naupilus)优势度高于对应组的其他种。
| 种类 Species |
A组 Group A |
B组 Group B |
C组 Group C |
| Difflugia globulosa Dujardin |
0.11 | 0.05 | 0.04 |
| B.calyciflorus | 0.19 | 0.14 | 0.23 |
| Filinia longiseta | 0.05 | 0.03 | - |
| Polyarthra vulgaris | 0.03 | 0.11 | 0.07 |
| Trichocerca bicristata | 0.16 | 0.04 | 0.10 |
| Sinocalanus dorrii | - | - | 0.13 |
| Mesocyclops leuckarti | - | - | 0.07 |
| Naupilus | 0.16 | 0.19 | - |
2.4 浮游动物多样性指数
从表 6可知,B组的浮游动物Shannon-Wiener多样性指数(H)均值最高,A组最低,B组较A组和C组分别高4.39%和0.47%,但各组间无显著差异。3组浮游动物H分别为1.61-2.40、1.62-2.65、1.84-2.31,其中B组变幅最大,C组变幅最小;3组浮游动物H数值变化均呈先升高后降低的趋势。依据H对水质进行评价,3组池塘水质均为β-中污染;从水质评价中不同等级出现的频次看,A组显示出2次α-中污染、5次β-中污染,B组显示出3次α-中污染、4次β-中污染,C组显示出1次α-中污染、6次β-中污染。
| 指标 Index |
时间/月 Time/Month |
A组Group A | B组Group B | C组Group C | |||||
| 特征值 Eigenvalue |
水质评价 Water quality evaluation |
特征值 Eigenvalue |
水质评价 Water quality evaluation |
特征值 Eigenvalue |
水质评价 Water quality evaluation |
||||
| Shannon-Wiener diversity index (H) | 6 | 1.76 | α-moderate pollution | 1.62 | α-moderate pollution | 2.11 | β-moderate pollution | ||
| 7 | 1.61 | α-moderate pollution | 1.99 | α-moderate pollution | 2.31 | β-moderate pollution | |||
| 8 | 2.16 | β-moderate pollution | 2.24 | β-moderate pollution | 2.30 | β-moderate pollution | |||
| 9 | 2.40 | β-moderate pollution | 2.28 | β-moderate pollution | 2.23 | β-moderate pollution | |||
| 10 | 2.31 | β-moderate pollution | 2.27 | β-moderate pollution | 2.12 | β-moderate pollution | |||
| 11 | 2.02 | β-moderate pollution | 2.65 | β-moderate pollution | 1.84 | α-moderate pollution | |||
| 12 | 2.12 | β-moderate pollution | 1.90 | α-moderate pollution | 2.02 | β-moderate pollution | |||
| Mean value | 2.05 | β-moderate pollution | 2.14 | β-moderate pollution | 2.13 | β-moderate pollution | |||
| Margalef richness index (D) | 6 | 0.92 | Heavy pollution | 0.63 | Heavy pollution | 0.74 | Heavy pollution | ||
| 7 | 0.67 | Heavy pollution | 0.73 | Heavy pollution | 0.98 | Heavy pollution | |||
| 8 | 0.90 | Heavy pollution | 1.13 | α-moderate pollution | 1.02 | α-moderate pollution | |||
| 9 | 1.08 | α-moderate pollution | 1.04 | α-moderate pollution | 1.06 | α-moderate pollution | |||
| 10 | 1.01 | α-moderate pollution | 1.02 | α-moderate pollution | 1.00 | Heavy pollution | |||
| 11 | 0.96 | Heavy pollution | 1.37 | α-moderate pollution | 0.84 | Heavy pollution | |||
| 12 | 1.11 | α-moderate pollution | 0.85 | Heavy pollution | 0.83 | Heavy pollution | |||
| Mean value | 0.95 | Heavy pollution | 0.97 | Heavy pollution | 0.92 | Heavy pollution | |||
| Pielou evenness index (J) | 6 | 0.68 | Light pollution | 0.72 | Light pollution | 0.91 | Light pollution | ||
| 7 | 0.64 | Light pollution | 0.92 | Light pollution | 0.90 | Light pollution | |||
| 8 | 0.90 | Light pollution | 0.93 | Light pollution | 0.86 | Light pollution | |||
| 9 | 0.94 | Light pollution | 0.93 | Light pollution | 0.91 | Light pollution | |||
| 10 | 0.94 | Light pollution | 0.92 | Light pollution | 0.86 | Light pollution | |||
| 11 | 0.88 | Light pollution | 0.91 | Light pollution | 0.85 | Light pollution | |||
| 12 | 0.84 | Light pollution | 0.77 | Light pollution | 0.79 | Light pollution | |||
| Mean value | 0.83 | Light pollution | 0.87 | Light pollution | 0.87 | Light pollution | |||
浮游动物的Margalef丰富度指数(D)在B组最高,C组最低,各组间无显著差异,B组较A组和C组分别高2.11%和5.43%。3组浮游动物D分别为0.67-1.11、0.63-1.37、0.74-1.06,其中B组变幅最大,C组变幅最小。依据D对水质进行评价,A、B、C组池塘水质均为重污染;从水质评价中不同等级出现的频次看,A组显示出3次α-中污染、4次重污染,B组显示出4次α-中污染、3次重污染,C组显示出2次α-中污染、5次重污染。
浮游动物Pielou均匀度指数(J)在A组最小,B组和C组均大于A组,各组间无显著差异,A组较B组和C组均降低4.60%;3组浮游动物J分别为0.64-0.94、0.72-0.93、0.79-0.91,其中A组变幅最大,C组变幅最小;依据J对水质进行评价,A、B、C组池塘水质均为轻污染,组间无明显差异。
上述结果表明,随着鳙放养比例的上升,浮游生物多样性呈现先升高后降低趋势,即鲢鳙配比为3:7时,浮游生物多样性最高,水质受污染程度最低;鲢鳙配比为1:1和1:9时,浮游生物多样性较低,水质受污染程度较高。
2.5 养殖效能 2.5.1 生长效能各组实验鱼生长效能见表 7。由表 7可知,鲢鱼的增重率、特定生长率、肥满度均在B组达到最大,增重率和特定生长率较C组有显著提升(P<0.05,下同),分别提高24.92%和3.81%,与A组无显著差异;体重均匀度在C组最高,较A组和B组分别高出13.09%和11.51%。鳙鱼的增重率、特定生长率、肥满度均在A组最大,增重率和特定生长率较C组显著提升,分别提高18.43%和3.50%,但与B组无显著差异;A组的肥满度显著大于B组和C组;体重均匀度在C组最高,比A组和B组分别高10.77%和3.61%。青鱼的增重率和特定生长率在B组最大,且增重率较C组差异显著,与A组差异不显著,各试验组特定生长率均无显著差异;肥满度在A组最大,且显著高于其他两组。鲫鱼的增重率和特定生长率在B组最大,较A组和C组显著增加,各组间肥满度和体重均匀度均无显著差异。鲤鱼的增重率、特定生长率和体重均匀度各组间均无显著差异。鲮鱼的增重率在B组最大,且较其他各组有显著提升。A组和B组胡子鲇的增重率和特定生长率显著大于C组,而肥满度表现为C组显著大于A组和B组,但体重均匀度各组间差异不显著。
| 品种 Species |
组别 Group |
增重率/% Weight gain rate/% |
特定生长率/% Special growth rate/% |
肥满度/% Condition factor/% |
体重均匀度/% Weight evenness/% |
| H.molitrix | A | 32 659.38±4 187.50a | 2.99±0.06a | 1.81±0.11 | 87.22 |
| B | 33 709.38±3 903.13a | 3.00±0.06a | 1.83±0.03 | 88.46 | |
| C | 26 984.38±368.75b | 2.89±0.01b | 1.80±0.02 | 98.64 | |
| A.nobilis | A | 17 297.06±3 472.06a | 2.66±0.10a | 1.99±0.12a | 80.04 |
| B | 15 823.53±2 298.53ab | 2.61±0.08ab | 1.81±0.11b | 85.57 | |
| C | 14 605.88±1 667.65b | 2.57±0.06b | 1.87±0.09b | 88.66 | |
| Mylopharyngodon piceus | A | 16 713.52±901.54ab | 2.63±0.04a | 2.39±0.10a | 93.58 |
| B | 17 878.63±814.66b | 2.68±0.04a | 2.09±0.05b | 92.31 | |
| C | 16 319.58±546.55a | 2.63±0.03a | 1.88±0.04c | 96.96 | |
| Carassius auratus | A | 8 872.79±365.44a | 2.32±0.02a | 3.18±0.03 | 97.30 |
| B | 9 667.66±349.64b | 2.36±0.02b | 3.16±0.03 | 98.66 | |
| C | 8 818.37±391.13a | 2.31±0.02a | 3.20±0.10 | 88.99 | |
| Cyprinus carpio | A | 16 909.49±1 134.32 | 2.64±0.04 | 2.61±0.05a | 93.64 |
| B | 16 800.84±1 284.14 | 2.64±0.05 | 2.76±0.05b | 87.75 | |
| C | 16 058.723±1 315.68 | 2.59±0.05 | 2.72±0.06b | 86.04 | |
| Cirrhinus molitorella | A | 21 473.74±2 134.97b | 2.77±0.04 | 1.60±0.06a | 78.38 |
| B | 22 265.66±2 414.73a | 2.79±0.04 | 1.64±0.07 | 85.36 | |
| C | 20 518.18±1 644.59b | 2.75±0.03 | 1.70±0.05 | 93.08 | |
| Clarias fuscus | A | 1 663.89±214.05a | 1.48±0.03a | 1.28±0.03c | 78.74 |
| B | 1 626.00±175.88a | 1.47±0.03a | 1.52±0.02b | 84.94 | |
| C | 1 386.11±125.95b | 1.39±0.02b | 1.62±0.02a | 88.27 | |
| Average | A | 16 512.84±1 772.84a | 2.50±0.05 | 2.12±0.07 | 86.99 |
| B | 16 824.53±1 605.82a | 2.51±0.05 | 2.12±0.05 | 89.01 | |
| C | 14 955.82±865.76b | 2.45±0.03 | 2.11±0.05 | 91.52 | |
| Note:there is no lowercase letter in the shoulder label of peer data and no significant difference in the expression of the same lowercase letter(P>0.05).Different lowercase letters indicate significant differences (P<0.05). | |||||
总体上,养殖鱼类的平均增重率在B组达到最大,较C组有显著提升,较A组无显著差异;平均特定生长率在B组最大,各组间无显著差异;平均肥满度和体重均匀度在各组之间无显著差异。上述结果表明,随着鳙放养比例的上升,养殖对象生长效能呈现先升高后降低的趋势,即鲢鳙配比为3∶7时,养殖对象生长效能较高; 鲢鳙配比为1∶1和1∶9时,养殖对象生长效能较低。
2.5.2 饲料效能各试验组饲料效能见表 8。由表 8可知,存活率在B组最高,为93.90%,比C组提高1.90%,与C组差异显著,但与A组差异不显著。由于各组放养量不同,因此总产量在A组最高,且各组间差异显著;单位面积产量在B组最高,达1.42 kg/m2,比C组提高19.33%,与C组差异显著,与A组差异不显著;单位面积投饲量在C组最高,C组分别高出A组和B组6.1%和7.5%;饲料系数在B组最低,为1.04,较C组(1.30)降低20%,与C组差异显著,但与A组差异不显著。由饲料系数可知,随着鳙放养比例的上升,饲料效能呈现先升高后降低趋势,当鲢鳙配比为3∶7时,养殖对象饲料效能和产量较高,鲢鳙比为1∶1和1∶9时,养殖对象饲料效能较低。
| 实验组 Test group |
总放养量/kg Total amount of stocking/kg |
存活率/% Survival rate/% |
总产量/kg Total output/kg |
单位面积产量/(kg/m2) Output per square meter/(kg/m2) |
总增重量/kg Total weight gain/kg |
单位面积投饲量/(kg/m2) Feeding quantity per square meter/(kg/m2) |
饲料系数 Feed conversion rate |
| Group A | 42.49±8.58a | 92.75±1.15ab | 4 889.59±448.82a | 1.40±0.13a | 4 847.13±440.24a | 1.48±0.12 | 1.07±0.11a |
| Group B | 28.98±3.28ab | 93.90±0.87a | 3 542.39±406.54b | 1.42±0.16a | 3 510.68±403.55b | 1.46±0.10 | 1.04±0.10a |
| Group C | 18.21±5.47b | 92.15±1.45b | 2 029.55±219.18c | 1.19±0.13b | 2 007.48±212.94c | 1.57±0.13 | 1.30±0.12b |
3 讨论 3.1 浮游动物群落结构特征
已有研究表明,在我国湖泊、水库、河流等内陆水域的浮游动物群落中,浮游动物整体倾向于小型化(小型轮虫为主要优势类群,大型枝角类和桡足类缺乏)已成为普遍现象[26-28]。如在渭河陕西段浮游动物以轮虫为主,种类有18种,占比43.9%,大型浮游动物种类数所占比例偏低,占比不足10%[29];以鲢鳙放养为主的武山湖中发现浮游动物趋于小型化,小型种类轮虫占据较多,浮游甲壳动物种类和丰度均较少[30];在鲢鳙与青鱼混养的水体中也有这种现象[31]。本研究中,不同鲢鳙配比下池塘的浮游动物均以轮虫为主,3组池塘轮虫种类数分别为14、15和15种,占比均在55%以上,枝角类、桡足类种类数和丰度较少。导致这种现象的可能原因:一是滤食杂食性鱼类能够显著影响浮游动物群落结构,个体较大的种类受到的影响较大,最后导致浮游动物群落的小型化[17, 32, 33],本研究主养对象鳙鱼成长后规格较大,其主要以枝角类和桡足类等大型浮游动物为食,对轮虫等小型浮游动物过滤摄食量较小;二是实验投饲过程的残饵在一定程度上促进了轮虫等小型浮游动物的增殖。
研究发现,在南湖[34]、白石水库和观音阁水库[35]中,浮游动物平均密度分别为529.6、1 043.85、379.44 ind./L,平均生物量分别为1.420、1.77、2.08 mg/L。本研究中,A、B、C 3组试验塘浮游动物平均密度分别为118、124、120 ind./L,平均生物量分别为1.11、1.44、4.81 mg/L,各组相差不大。各试验塘浮游动物的生物量均为桡足类最大,由于桡足类中汤匙华哲水蚤湿重远大于轮虫和原生动物,且只有C组汤匙华哲水蚤为优势种,因此在密度相差不大的情况下,C组试验塘浮游动物总密度较低,生物量最高。
在浮游动物群落结构研究中,通常用生物多样性指数来判断水质状况,H、J和D越高,水生生态系统越稳定,水质越好。杨智景等[36]研究发现,在青虾和河蟹共养池塘中,养殖水体水质接近β-中污型。在本研究中,依据H对水质进行评价,综合7个月份来看,3组试验塘均为β-中污染,其中A组2次α-中污染、B组3次α-中污染、C组1次α-中污染,因此A组和B组水质优于C组。依据D对水质进行评价,3组均为重污染,其中A、B、C组重污染次数分别为4、3、5次,因此B组水质优于A组和C组。依据J对水质进行评价,3组均为轻污染,组间无明显差异。综合来看,H、J和D均值均在B组最高,3∶7的鲢鳙配比下池塘水质自我调节能力较强,水质较好。
3.2 不同鲢鳙配比对养殖效能的影响在生态养殖中不仅需要注重养殖水体的健康,养殖效能的高低也尤为重要。养殖效能主要包括生态效能、生长效能、饲料效能及经济效能。将不同种类鱼类进行合理混养可以充分利用水体饵料和空间资源,从而促进养殖系统中的物质循环,提高能量转化效率,增加养殖效能。此外,合适的放养比例和数量才能满足鱼类生理生态的要求[37]。Yan等[38]研究表明,3∶7的鲢鳙配比能够降低养殖水体富营养化水平,并提高贻贝的生长性能;崔志辉等[39]发现在5种鲢鳙配比(100∶0,70∶30,50∶50,30∶70和0∶100)模式下,30∶70的比例能够促进蚌的生长,并且还能提高鱼产量,增加经济价值。本研究发现,鲢鳙配比为3∶7时,鲢鱼、青鱼、鲫鱼和鲮鱼的增重率及特定生长率最高;鲢鳙配比为1∶1时,鳙鱼、鲤鱼和胡子鲇的增重率及特定生长率最高,表明不同的鲢鳙放养比例下,各种鱼类的生长存在差异,这可能是由于鲢鳙放养比例的改变、鱼类之间竞争饵料及生存空间所致。鲢鳙配比为3∶7时,饲料系数最低,存活率及单位面积产量最高,表明在本试验条件下,鲢鳙配比为3∶7是最佳放养比例。
鱼类生长存在阶段性差异,体质量和体长的增长尤其明显。鲢、鳙苗种阶段生长较快,每10 d体质量增加的倍数为5-6倍;而在100 d的培育期内,每10 d体质量增加的倍数仅为1倍[40]。在石斑鱼(Epinephelus lanceolatus×E.fuscoguttatus)[41]、似刺鳊鮈(Paracanthobrama guichenoti)[42]、赤眼鳟(Squaliobarbus curriculus)[43]、团头鲂(Megalobrama amblycephala)[44]、白斑狗鱼(Esox lucius)[45]和兴凯湖翘嘴鲌(Culter alburnus)[46]的研究中也发现,其体质量体长的增长均呈现先上升后下降的趋势。本研究结果显示,试验期末鳙的绝对增重量组间均值为1 082 g,鲢的绝对增重量组间均值则为996 g,鳙的绝对增重量高于鲢,但相对体重增长率则为鲢(31118%)高于鳙(15909%)。从表 1可知,鳙的初体质量为6.8 g,鲢的初体质量为3.2 g,前者较后者重113%,基于前述鱼类不同阶段生长速度“先快后慢”的一般性特点推测,本研究出现的鳙与鲢绝对增重量和相对体质量增长率“增长趋势不同步”现象主要是鳙、鲢苗种放养规格差异所致。
本研究在池塘主养鲢鱼、鳙鱼,配养青鱼、鲫鱼、鲤鱼、鲮鱼、胡子鲇。其中鲢鳙放养量配比、养殖产量的高低、出塘成鱼产品规格的大小和均匀度、饲料系数的高低是决定养殖成败的关键因素。从单位面积产量看,B组产量最高;而且,C组主养对象鳙的末体重在3个试验组中最小,即在放养规格相同的情况下,出塘(成鱼产品)规格随鳙放养比例的升高而下降,饲料系数则随鳙放养比例的升高先降低后升高。考虑到本研究中各塘均未安装动力增氧设备,养殖过程全靠“天然水”和浮游植物光合作用供氧。基于“良水质”与“高产量”协调性视角推测,在B组(鲢∶鳙=3∶7)和A组(鲢∶鳙=1∶1)的“鲢鳙比”之间,适当降低鳙放养量(尾数)、提高鲢放养量(尾数),同时在养殖塘中安装动力增氧设备,通过人工增氧促进主养鱼的摄食和生长,可能实现高效益养殖鲢、鳙。
4 结论3组试验塘共鉴定出浮游动物4类30种,均为轮虫类最多;浮游动物优势种和生物多样性指数表明,养殖水体水质处于中污染状态,在鲢鳙配比为3∶7的模式下池塘水质相对较优;试验鱼平均增重率、存活率和单位面积产量均在B组最高,饲料系数在B组最低,因此在鲢鳙配比为3∶7的模式下养殖效能最大。综上,鲢鳙配比为3∶7时的多种类鱼类混养池塘,有利于浮游动物群落的多样性和水体生态健康,提高养殖效能。
| [1] |
WANG L, CHEN J, SU H, et al. Is zooplankton body size an indicator of water quality in (sub)tropical reservoirs in China?[J]. Ecosystems, 2022, 25(2): 308-319. DOI:10.1007/s10021-021-00656-2 |
| [2] |
李开枝, 尹健强, 黄良民. 河口浮游动物生态学研究进展[J]. 海洋科学, 2007, 31(3): 72-75. DOI:10.3969/j.issn.1000-3096.2007.03.015 |
| [3] |
高欣, 景泓杰, 赵文, 等. 凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征[J]. 大连海洋大学学报, 2017, 32(1): 44-50. |
| [4] |
GARCÍA-CHICOTE J, ARMENGOL X, ROJO C. Zooplankton abundance: a neglected key element in the evaluation of reservoir water quality[J]. Limnologica, 2018, 69: 46-54. DOI:10.1016/j.limno.2017.11.004 |
| [5] |
蔡志龙, 秦美川, 赵文, 等. 两种混养模式海水池塘浮游生物的群落结构及其粒径特征[J]. 大连海洋大学学报, 2016, 31(6): 663-672. |
| [6] |
ZENG Q F, GU X H, MAO Z G, et al. In situ growth and photosynthetic activity of Cyanobacteria and phytoplankton dynamics after passage through the gut of silver carp (Hypophthalmichthys molitrix), bighead carp (Aristichthys nobilis), and Nile tilapia (Oreochromis niloticus)[J]. Hydrobiologia, 2014, 736(1): 51-60. DOI:10.1007/s10750-014-1886-5 |
| [7] |
ZHANG X, XIE P, HUANG X P. A review of nontraditional biomanipulation[J]. The Scientific World Journal, 2008, 8: 1184-1196. DOI:10.1100/tsw.2008.144 |
| [8] |
张根芳, 邓闽中, 方爱萍, 等. 蚌、鱼混养对几种水污染指标的影响[J]. 上海水产大学学报, 2005, 14(2): 156-161. |
| [9] |
COOKE S L, HILL W R, MEYER K P. Feeding at different plankton densities alters invasive bighead carp (Hypophthalmichthys nobilis) growth and zooplankton species composition[J]. Hydrobiologia, 2009, 625(1): 185-193. DOI:10.1007/s10750-009-9707-y |
| [10] |
杨丽丽, 何光喜, 胡忠军, 等. 鲢鳙占优势的千岛湖浮游动物群落结构特征及其与环境因子的相关性[J]. 水产学报, 2013, 37(6): 894-903. |
| [11] |
XIE P, LIU J K. Practical success of biomanipulation using filter-feeding fish to control cyanobacteria blooms: a synthesis of decades of research and application in a subtropical hypereutrophic lake[J]. The Scientific World Journal, 2001, 1: 337-356. DOI:10.1100/tsw.2001.67 |
| [12] |
谢平. 鲢鱼和鳙鱼, 以及其在控制藻类水华方面的应用[M]. 北京: 科学出版社, 2003.
|
| [13] |
YI C, GUO L, NI L, et al. Silver carp exhibited an enhanced ability of biomanipulation to control cyanobacteria bloom compared to bighead carp in hypereutrophic Lake Taihu mesocosms[J]. Ecological Engineering, 2016, 89: 7-13. DOI:10.1016/j.ecoleng.2016.01.022 |
| [14] |
GUO L, WANG Q, XIE P, et al. A non-classical biomanipulation experiment in Gonghu Bay of Lake Taihu: control of Microcystis blooms using silver and bighead carp[J]. Aquaculture Research, 2015, 46(9): 2211-2224. DOI:10.1111/are.12375 |
| [15] |
杨卓, 陈日钊, 李文红, 等. 鲢鳙+绿狐尾藻处理的罗非鱼养殖池塘浮游植物群落特征及水质评价[J]. 西南农业学报, 2021, 34(4): 880-888. |
| [16] |
张饮江, 黎臻, 王芳, 等. 光倒刺鲃、白鲢协同投放抑制丝状藻(水绵)藻华围隔研究[J]. 环境科学学报, 2015, 35(3): 780-788. |
| [17] |
陈炳辉, 刘正文. 滤食杂食性鱼类放养对浮游动物群落结构的影响[J]. 生态科学, 2012, 31(2): 161-166. |
| [18] |
邢丽荣, 徐翔. 水产养殖的经济效益与环境影响: 池塘罗非鱼不同养殖模式的比较[J]. 生态经济, 2016, 32(7): 143-147. |
| [19] |
陈玲玲. 鲴鲢鳙鱼联合操纵生态系统对水体富营养化的治理[D]. 苏州: 苏州科技大学, 2019.
|
| [20] |
毛国庆. 蟹虾鳜鲢鳙同池高效养殖试验[J]. 当代水产, 2014, 39(2): 81-82. |
| [21] |
KUMAR M S, BINH T T, BURGESS S N, et al. Evaluation of optimal species ratio to maximize fish polyculture production[J]. Journal of Applied Aquaculture, 2005, 17(1): 35-49. |
| [22] |
朱佳志, 刘明典, 黄福江, 等. 西双版纳南腊河浮游植物群落结构及其与水环境因子的关系[J]. 淡水渔业, 2015, 45(6): 39-45, 69. |
| [23] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. |
| [24] |
杨潇, 马吉顺, 张欢, 等. 鄱阳湖不同水文期浮游生物群落结构特征和影响因素及水质评价[J]. 水生生物学报, 2021, 45(5): 1093-1103. |
| [25] |
龚福来, 林雪, 王红权. 不同维生素C源对吉富罗非鱼生长性能、抗氧化能力和免疫力的影响[J]. 动物营养学报, 2021, 33(4): 2378-2389. |
| [26] |
吴利, 冯伟松, 张堂林, 等. 湖北省西凉湖浮游动物群落周年动态变化及其与环境因子的关系[J]. 湖泊科学, 2011, 23(4): 619-625. |
| [27] |
陈佳琪, 赵坤, 曹玥, 等. 鄱阳湖浮游动物群落结构及其与环境因子的关系[J]. 生态学报, 2020, 40(18): 6644-6658. |
| [28] |
赵睿智, 赵红雪, 邱小琮. 黑河干流浮游动物与水环境因子关系的多元分析[J]. 水生态学杂志, 2020, 41(6): 81-88. |
| [29] |
白海锋, 王怡睿, 宋进喜, 等. 渭河陕西段浮游动物群落结构时空特征及其驱动因子[J]. 生态学杂志, 2022, 41(8): 1602-1610. |
| [30] |
张佳敏, 高健, 杨诚, 等. 以鲢、鳙放养为主的武山湖后生浮游动物群落结构特征[J]. 长江流域资源与环境, 2021, 30(8): 1848-1857. |
| [31] |
龚进玲, 李学梅, 何勇凤, 等. 青鱼-鲢、鳙生态池塘浮游生物群落结构特征及其与环境因子的关系[J]. 水产科学, 2022, 41(4): 517-526. |
| [32] |
杨宇峰, 黄祥飞. 鲢鳙对浮游动物群落结构的影响[J]. 湖泊科学, 1992, 4(3): 78-86. |
| [33] |
胡春英. 围圈养鱼对浮游动物多样性的影响[J]. 水生生物学报, 2000, 24(5): 430-433. |
| [34] |
吴延志, 陈宗永. 南湖浮游动物季节变化与鳙鱼鱼产潜力估算[J]. 水产养殖, 2020, 41(7): 13-16, 28. |
| [35] |
丘宇慧. 白石水库与观音阁水库浮游动物群落结构及鱼产潜力分析[D]. 武汉: 华中农业大学, 2021.
|
| [36] |
杨智景, 冯亚明, 顾海龙, 等. 青虾对河蟹养殖水体中浮游动物及水环境因子的影响[J]. 江苏农业学报, 2022, 38(4): 1026-1033. |
| [37] |
陈洁. 主养草鱼池塘三种混养模式对鱼类生长和血液指标的影响[D]. 武汉: 华中农业大学, 2011.
|
| [38] |
YAN L L, ZHANG G F, LIU Q Q. Optimization of culturing the freshwater pearl mussels, Hyriopsis cumingii with filter feeding Chinese carps (bighead carp and silver carp) by orthogonal array design[J]. Aquaculture, 2009, 292(1/2): 60-66. |
| [39] |
崔志辉, 周小玉, 张根芳, 等. 鲢鳙混养对三角帆蚌生长和养殖水质影响的围隔实验[J]. 水产学报, 2012, 36(2): 278-283. |
| [40] |
王武. 鱼类增养殖学[M]. 北京: 中国农业出版社, 2006.
|
| [41] |
赵书燕, 林黑着, 黄忠, 等. 不同蛋白水平对2种规格石斑鱼生长性能、血清生化及肌肉品质的影响[J]. 南方水产科学, 2017, 13(4): 87-96. |
| [42] |
徐钢春, 顾若波, 李晓莉, 等. 池养条件下似刺鳊鮈早期发育阶段的摄食与生长特性[J]. 动物学杂志, 2009, 44(1): 99-105. |
| [43] |
陈炎超, 林岗. 赤眼鳟的生长特性及养殖技术[J]. 广西农业科学, 2007, 38(1): 97-100. |
| [44] |
姚林杰, 叶元土, 蔡春芳, 等. 团头鲂两个生长阶段适宜蛋白/脂肪比的需要量[J]. 水产学报, 2014, 38(6): 861-868. |
| [45] |
霍堂斌, 袁美云, 阿达可白克·可尔江, 等. 白斑狗鱼与黑斑狗鱼生长特性的比较研究[J]. 水产学杂志, 2010, 23(3): 31-36. |
| [46] |
杨虹, 李敏, 张晓光, 等. 池塘养殖兴凯湖翘嘴鲌生长特性的研究[J]. 渔业经济研究, 2009, 12(4): 32-36. |



