2. 桂林医学院智能医学与生物技术学院, 广西桂林 541004;
3. 广西医科大学基础医学院, 广西南宁 530021
2. School of Intelligent Medicine and Biotechnology, Guilin Medical University, Guilin, Guangxi, 541004, China;
3. School of Basic Medical Sciences, Guangxi Medical University, Nanning, Guangxi, 530021, China
前列腺癌(Prostate Cancer,PCa)是全球男性第二常见的恶性肿瘤,也是男性因癌症死亡的主要原因[1]。近年来,我国前列腺癌发病率明显增加,是男性泌尿系统中发病率增长最快的恶性肿瘤[2]。雄激素剥夺疗法(Androgen Deprivation Therapy,ADT)是治疗晚期PCa患者的基本方法,但研究证实几乎所有的PCa患者都会对雄激素阻断产生耐药性,发展为去势抵抗性前列腺癌(Castration-Resistant Prostate Cancer,CRPC)[3],发生转移的CRPC(Metastatic Castration-Resistant Prostate Cancer,mCRPC)患者的中位生存期仅为16-24个月[4],目前尚无有效治疗mCRPC的药物[5]。现有用于治疗mCRPC的药物主要为雄激素受体靶向药物,如阿比特龙及恩杂鲁胺,但约20%的mCRPC患者会出现原发性耐药,导致治疗缓解期短[6],因此亟需研发治疗mCRPC的新兴药物。
中医药能够改善中晚期肿瘤患者的临床症状,稳定肿瘤病灶及提高患者生存质量[7]。有研究表明,中医药在治疗PCa及改善患者生存质量方面具有独特的优势[8]。据报道,女贞子(Ligustrum lucidum)-黄芪(Astragalus membranaceus)在乳腺癌保乳术后调强放射治疗及胃癌辅助治疗中起重要作用,可以明显改善患者的生活质量,降低放疗与化疗的毒副作用,提高患者生存率[9, 10]。但女贞子-黄芪是否可以作为治疗mCRPC的潜在药物,目前尚无相关研究报道。本研究拟利用网络药理学方法,对女贞子-黄芪治疗mCRPC的作用靶点与潜在机制进行探讨,为mCRPC药物研发提供参考。
1 材料与方法 1.1 活性成分及作用靶点筛选基于中药系统药理学(Traditional Chinese Medicine Systems Pharmacology,TCMSP) 数据库与分析平台,以口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug-Like,DL)≥0.18为标准[11],筛选女贞子-黄芪的活性成分及作用靶点。
1.2 mCRPC相关的差异表达基因分析从GEO数据库(https://www.ncbi.nlm.nih.gov/)下载芯片数据集GSE77930表达谱数据及相应的临床信息,该芯片数据集包含171个样本,其中CRPC样本22个,mCRPC样本149个。利用limma包对数据进行分析,以差异倍数的绝对值(|Fold Change,FC|)≥1.5倍,且P<0.05为标准[12],筛选mCRPC与CRPC之间差异表达的基因,并绘制热图及火山图。
1.3 女贞子-黄芪活性成分-药物靶点网络的构建对筛选得到的女贞子-黄芪作用靶点和mCRPC相关的差异表达基因取交集,获得女贞子-黄芪治疗mCRPC的潜在作用靶点,利用Cytoscape 3.8.0软件构建女贞子-黄芪活性成分-mCRPC作用靶点网络。利用Cytoscape 3.8.0软件中Bisogenet和CytoNCA插件,选取HRPD、BIND、DIP、BIOGRID、INTACT和MINT 6个数据库,构建女贞子-黄芪活性成分与mCRPC靶点的蛋白质-蛋白质相互作用(Protein-Protein Interaction,PPI) 网络。以度中心性(Degree Centrality,DC)>61,介数中心性(Betweenness Centrality,BC)>600为标准[13],筛选核心网络。
1.4 核心靶点GO富集分析将筛选得到的交集靶点导入clusterProfiler包,进行GO富集分析,包括分子功能(Molecular Function,MF)、生物过程(Biological Process,BP)和细胞组分(Cellular Component,CC)3个方面[14]。
1.5 KEGG分析及靶点-通路网络构建使用R语言,根据基因富集的数量和显著性,将富集得到信号通路结果导入Cytoscape 3.8.0软件,根据度值(Degree)的大小进行排序,显示前20条通路。利用Perl 5.30.0和Cytoscape 3.8.0构建靶点-通路网络[15],进一步分析女贞子-黄芪治疗mCRPC的核心靶点与信号通路。
2 结果与分析 2.1 女贞子-黄芪的活性成分及作用靶点在TCMSP数据库与分析平台中,依据OB≥30% 和DL≥0.18筛选女贞子和黄芪的活性成分及作用靶点,获得女贞子的活性成分13个、黄芪的活性成分20个,包括槲皮素(Quercetin)、山奈酚(Kaempferol)、木犀草素(Luteolin)、异鼠李素(Isorhamnetin)、芒柄花黄素(Formononetin)、圣草酚(Eriodictyol)和女贞果苷D (Lucidumoside D)等,其中山奈酚和槲皮素是女贞子和黄芪两种中药共有的活性成分(表 1)。女贞子作用靶点1 025个,黄芪作用靶点968个。
| 药物 Drug |
分子编号 Molecular ID |
名称 Name |
口服生物利用度 (OB)/% Oral Bioavailability (OB)/% |
类药性(DL) Drug-Like (DL) |
| A.membranaceus | MOL000211 | Mairin | 55.38 | 0.78 |
| A.membranaceus | MOL000239 | Jaranol | 50.83 | 0.29 |
| A.membranaceus | MOL000296 | Hederagenin | 36.91 | 0.75 |
| A.membranaceus | MOL000033 | (3S, 8S, 9S, 10R, 13R, 14S, 17R)-10, 13-dimethyl-17-[(2R, 5S)-5-propan-2-yloctan-2-yl]-2, 3, 4, 7, 8, 9, 11, 12, 14, 15, 16, 17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol | 36.23 | 0.78 |
| A.membranaceus | MOL000354 | Isorhamnetin | 49.60 | 0.31 |
| A.membranaceus | MOL000371 | 3, 9-di-O-methylnissolin | 53.74 | 0.48 |
| A.membranaceus | MOL000374 | 5′-hydroxyiso-muronulatol-2′, 5′-di-O-glucoside | 41.72 | 0.69 |
| A.membranaceus | MOL000378 | 7-O-methylisomucronulatol | 74.69 | 0.30 |
| A.membranaceus | MOL000379 | 9, 10-dimethoxypterocarpan-3-O-β-D-glucoside | 36.74 | 0.92 |
| A.membranaceus | MOL000380 | (6aR, 11aR)-9, 10-dimethoxy-6a, 11a-dihydro-6H-benzofurano[3, 2-c] chromen-3-ol | 64.26 | 0.42 |
| A.membranaceus | MOL000387 | Bifendate | 31.10 | 0.67 |
| A.membranaceus | MOL000392 | Formononetin | 69.67 | 0.21 |
| A.membranaceus | MOL000398 | Isoflavanone | 109.99 | 0.30 |
| A.membranaceus | MOL000417 | Calycosin | 47.75 | 0.24 |
| A.membranaceus | MOL000422 | Kaempferol | 41.88 | 0.24 |
| A.membranaceus | MOL000433 | Folic acid | 68.96 | 0.71 |
| A.membranaceus | MOL000438 | (3R)-3-(2-hydroxy-3, 4-dimethoxyphenyl) chroman-7-ol | 67.67 | 0.26 |
| A.membranaceus | MOL000439 | Isomucronulatol-7, 2′-di-O-glucosiole | 49.28 | 0.62 |
| A.membranaceus | MOL000442 | 1, 7-dihydroxy-3, 9-dimethoxy pterocarpene | 39.05 | 0.48 |
| A.membranaceus | MOL000098 | Quercetin | 46.43 | 0.28 |
| L.lucidum | MOL000358 | β-sitosterol | 36.91 | 0.75 |
| L.lucidum | MOL000422 | Kaempferol | 41.88 | 0.24 |
| L.lucidum | MOL004576 | Taxifolin | 57.84 | 0.27 |
| L.lucidum | MOL005146 | Lucidumoside D | 48.87 | 0.71 |
| L.lucidum | MOL005147 | Lucidumoside D_qt | 54.41 | 0.47 |
| L.lucidum | MOL005169 | (20S)-24-ene-3β, 20-diol-3-acetate | 40.23 | 0.82 |
| L.lucidum | MOL005190 | Eriodictyol | 71.79 | 0.24 |
| L.lucidum | MOL005195 | Syringaresinol diglucoside_qt | 83.12 | 0.80 |
| L.lucidum | MOL005209 | Lucidusculine | 30.11 | 0.75 |
| L.lucidum | MOL005211 | Olitoriside | 65.45 | 0.23 |
| L.lucidum | MOL005212 | Olitoriside_qt | 103.23 | 0.78 |
| L.lucidum | MOL000006 | Luteolin | 36.16 | 0.25 |
| L.lucidum | MOL000098 | Quercetin | 46.43 | 0.28 |
2.2 mCRPC相关的差异表达基因
与未发生转移的CRPC相比,在mCRPC患者中差异表达的基因一共有1 067个,其中表达上调的基因424个,表达下调的基因643个(图 1)。

|
| 图 1 mCRPC相关的差异表达基因 Fig. 1 Differentially expressed genes associated with mCRPC |
2.3 女贞子-黄芪活性成分-mCRPC作用靶点网络
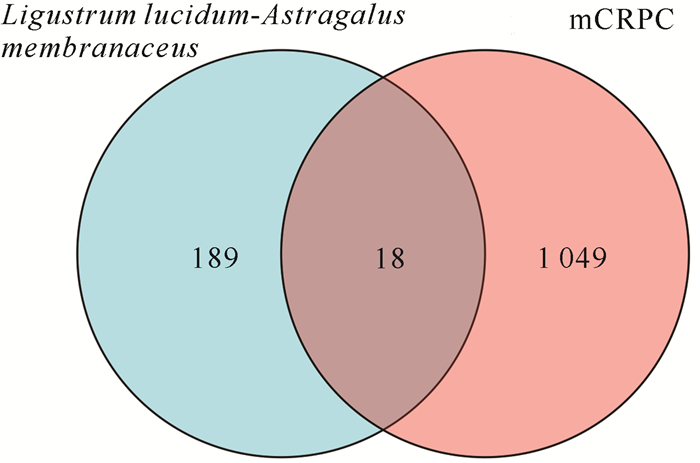
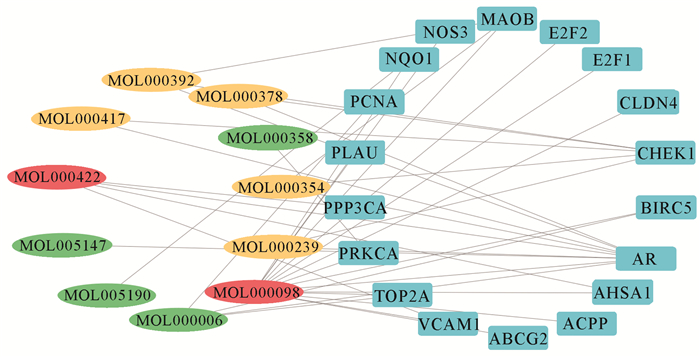
按不同靶点对应有效成分的数目分类展示,共获得女贞子-黄芪治疗mCRPC的潜在作用靶点18个(图 2)。对应的女贞子-黄芪有效成分11个(图 3,其中绿色表示女贞子的有效成分,黄色表示黄芪的有效成分,红色为女贞子-黄芪两者共有的有效成分,蓝色表示靶点基因),槲皮素的作用靶点最多,为15个;β-谷甾醇、圣草酚和女贞果苷D(苷元)的作用靶点最少,只有1个作用靶点。
|
| 图 2 女贞子-黄芪治疗mCRPC的靶点韦恩图 Fig. 2 Venn diagram of targets for L.lucidum-A.membranaceus in the treatment of mCRPC |
|
| 图 3 女贞子-黄芪的活性成分与关键作用靶点网络 Fig. 3 Active ingredients and key target networks of L.lucidum-A.membranaceus |
2.4 女贞子-黄芪治疗mCRPC的作用靶点PPI网络
将女贞子-黄芪作用靶点与mCRPC相关的差异基因取交集后,利用Cytoscape 3.8.0中的Bisogenet插件绘制PPI网络图,得到一个由1 629个节点和40 875条边组成的网络(图 4)。在此网络图的基础上,利用Bisogenet和CytoNCA插件,以DC>61作为初级筛选条件,获得一个由435个节点和17 187条边组成的网络[图 5(a)中的黄色色块,即图 5(b)]。将BC>600作为第二次筛选条件,最终得到一个由64个节点和941条边组成的核心网络[图 5(b)中的黄色色块,即图 5(c)],主要包括雄激素受体(Androgen Receptor,AR)、增殖细胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)和血管细胞黏附因子(Vascular Cell Adhesion Molecule 1,VCAM1)等关键靶点(图 5中的红色色块)。

|
| 图 4 女贞子-黄芪治疗mCRPC的作用靶点PPI网络 Fig. 4 PPI network of targets by L.lucidum-A.membranaceus in the treatment of mCRPC |

|
| 图 5 PPI网络拓扑图 Fig. 5 Network topology map of PPI |
2.5 作用靶点GO富集分析
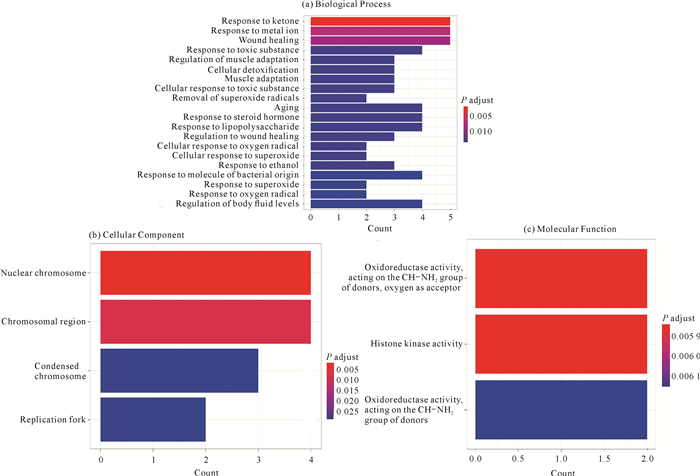
利用R语言对女贞子-黄芪治疗mCRPC的核心靶点进行GO富集分析,共得到GO条目82个。BP条目75个,主要参与酮体反应(Response to ketone)、对金属离子的反应(Response to metal ion)、伤口愈合(Wound healing)等生物学过程[图 6(a)]。CC条目4个,主要富集在核染色体(Nuclear chromosome)、染色体区(Chromosomal region)、凝集的染色体(Condensed chromosome)和复制叉处(Replication fork)[图 6(b)]。MF条目3个,涉及氧化还原酶活性(Oxidoreductase activity)和组蛋白激酶活性(Histone kinase activity)[图 6(c)],提示女贞子-黄芪可能通过调节多种生物学过程发挥其治疗mCRPC的功效。
|
| 图 6 核心靶点GO富集分析 Fig. 6 GO enrichment analysis for key targets |
2.6 KEGG信号通路与核心靶点互作网络
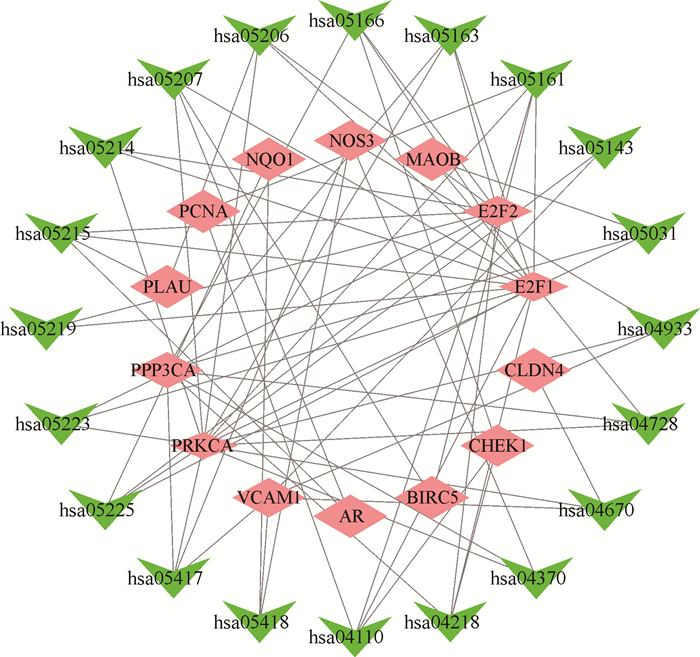
KEGG分析结果表明,女贞子-黄芪治疗mCRPC的作用靶点主要涉及乙型肝炎(Hepatitis B)、前列腺癌、细胞周期(Cell cycle)、Vascular Endothelial Growth Factor (VEGF)信号通路(VEGF signaling pathway)和细胞衰老(Cellular senescence)等通路(图 7)。对获得的信号通路和作用靶点构建相互作用网络,结果发现,PRKCA、E2F1、E2F2和PPP3CA等核心靶点与多条信号通路密切相关,分别涉及了14、12、11及7个信号通路(图 8),提示女贞子-黄芪可能通过多种有效成分作用于多个靶点,通过多个信号通路发挥其治疗mCRPC的作用。

|
| 图 7 靶点的KEGG分析 Fig. 7 KEGG analysis for key targets |
|
| 图 8 KEGG信号通路与核心靶点相互作用网络 Fig. 8 Interaction network between KEGG signaling pathways and key targets |
3 讨论
网络药理学基于系统生物学和大数据分析,通过构建药物-靶点-疾病网络,探索药物发挥作用的机制,为中医药的现代化研究提供了新途径和新依据[16]。本研究将GEO芯片数据挖掘与网络药理学相结合,探讨女贞子-黄芪治疗mCRPC的作用靶点及潜在作用机制,结果发现女贞子-黄芪的有效成分包括槲皮素、山奈酚、木犀草素、异鼠李素和芒柄花黄素等,其中槲皮素在拓扑网络中的度值较大,作用靶点最多。有研究报道,槲皮素在体外可抑制前列腺癌、宫颈癌、乳腺癌、肝癌、肺癌以及食管癌等多种肿瘤细胞的增殖与转移,诱导肿瘤细胞凋亡[17]。因此,槲皮素可能是女贞子-黄芪治疗mCRPC的核心成分。
通过构建蛋白互作拓扑网络图,可知女贞子-黄芪治疗mCRPC的18个潜在作用靶点中,在PPI网络发挥关键调控作用的靶点为AR、PCNA和VCAM1。Qiu等[18]研究证实,AR在PCa的发展、进展和转移中起着重要作用。PCNA是细胞增殖的标志物,其表达上调与肿瘤细胞的恶性增殖密切相关[19]。Juríková等[20]研究报道,PCNA高表达增加乳腺癌细胞的迁移和侵袭的危险性。Huang等[21]发现,VCAM1高表达与高级别浆液性卵巢癌的发生和预后不良密切相关。Ding等[22]发现VCAM1与肿瘤血管生成密切相关,胃癌中VCAM1阳性组织的微血管密度高于VCAM1阴性组织。Zhang等[23]报道,VCAM1高表达促进结直肠癌细胞的侵袭和转移。上述研究结果证实, AR、PCNA、VCAM1与肿瘤的发生、进展密切相关,表明女贞子-黄芪可能通过靶向mCRPC关键基因发挥治疗作用。
对女贞子-黄芪治疗mCRPC的作用靶点进行KEGG分析发现,作用靶点主要富集在乙型肝炎、前列腺癌、细胞周期、VEGF信号通路和细胞衰老等通路。Krystyna等[24]研究报道,有肝炎的男性患前列腺癌风险显著增加。Sarkar等[25]发现,乙型肝炎病毒感染与前列腺癌的发展有密切的关系,乙型肝炎病毒能促进AR信号传递。闫浩等[26]发现,前列腺癌信号通路激活能够促进AR靶基因的转录,促进细胞的增殖和转移。Ghafouri-Fard等[27]认为,槲皮素通过调节p21 CDK抑制剂和抑制pRb磷酸化,抑制细胞增殖。另外,槲皮素可通过靶向VEGFR-2介导的血管生成途径,抑制下游调节因子AKT的表达,从而抑制肿瘤生长[28, 29]。这些研究提示女贞子-黄芪可能通过调控以上信号通路发挥其治疗mCRPC的作用,表明女贞子-黄芪在治疗mCRPC方面极具潜力,但结果仍需进一步的实验验证。
4 结论槲皮素、山奈酚、木犀草素、异鼠李素和芒柄花黄素等成分可能是女贞子-黄芪治疗mCRPC的重要药效物质。女贞子-黄芪可能通过影响与mCRPC相关的多个信号通路发挥其治疗mCRPC的作用。本研究利用GEO芯片数据挖掘与网络药理学相结合的方法系统探讨女贞子-黄芪治疗mCRPC的作用机制,为临床应用提供了一定的依据,但本研究中只纳入一个mCRPC数据集进行分析,研究结果还有待进一步证实。
| [1] |
RAGHALLAIGH H N, EELES R. Genetic predisposition to prostate cancer: an update[J]. Familial Cancer, 2022, 21(1): 101-114. DOI:10.1007/s10689-021-00227-3 |
| [2] |
CHEN W Q, SUN K, ZHENG R S, et al. Cancer incidence and mortality in China, 2014[J]. Chinese Journal of Cancer Research, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] |
WATSON P A, ARORA V K, SAWYERS C L. Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer[J]. Nature Reviews Cancer, 2015, 15(12): 701-711. DOI:10.1038/nrc4016 |
| [4] |
MEHTÄLÄ J, ZONG J, VASSILEV Z, et al. Overall survival and second primary malignancies in men with metastatic prostate cancer[J]. PLoS One, 2020, 15(2): e0227552. DOI:10.1371/journal.pone.0227552 |
| [5] |
LIN Z, ZHANG Z, YE X, et al. Based on network pharmacology and molecular docking to predict the mechanism of Huangqi in the treatment of castration-resistant prostate cancer[J]. PLoS One, 2022, 17(5): e0263291. DOI:10.1371/journal.pone.0263291 |
| [6] |
JAYARAM A, WINGATE A, WETTERSKOG D, et al. Plasma tumor gene conversions after one cycle abiraterone acetate for metastatic castration-resistant prostate cancer: a biomarker analysis of a multicenter international trial[J]. Annals of Oncology, 2021, 32(6): 726-735. DOI:10.1016/j.annonc.2021.03.196 |
| [7] |
陈逸菲, 李笑. 基于网络药理学分析四逆散活性成分对肿瘤血管新生调节作用的分子机制探析[J]. 沈阳药科大学学报, 2022, 39(3): 306-317, 332. |
| [8] |
贾英杰, 李小江, 杨佩颖, 等. 中医外治法治疗前列腺癌的研究进展[J]. 中医肿瘤学杂志, 2021, 3(5): 83-87, 93. |
| [9] |
王楠, 尹立杰, 丁田贵. 乳腺癌保乳术后调强放疗联合贞芪扶正颗粒治疗的临床分析[J]. 中国中医药现代远程教育, 2020, 18(6): 113-115. DOI:10.3969/j.issn.1672-2779.2020.06.045 |
| [10] |
陈晓霞, 路晓庆, 刘向荣, 等. 女贞子-黄芪抗胃癌研究及作用机制的探讨[J]. 中国药物与临床, 2021, 21(23): 3801-3804. |
| [11] |
董培良, 李慧, 韩华. 中药网络药理学的应用与思考[J]. 中国实验方剂学杂志, 2020, 26(17): 204-211. |
| [12] |
张颖, 邱汉波, 侯恩存, 等. 基于网络药理学-分子对接研究益气逐淤汤针对胃癌的作用机制[J]. 世界中医药, 2021, 16(23): 3484-3490. DOI:10.3969/j.issn.1673-7202.2021.23.014 |
| [13] |
邹孟龙, 黄晓燕, 陈雅璐, 等. GEO芯片分析联合网络药理学探讨雷公藤治疗溃疡性结肠炎的分子机制[J]. 中国药理学通报, 2021, 37(12): 1743-1749. |
| [14] |
汤姝, 吴占申, 李纳, 等. 基于网络药理学探讨隐丹参酮抗非小细胞肺癌的作用机制[J]. 中国药理学通报, 2022, 38(1): 119-125. |
| [15] |
全无瑕, 缪延栋. 基于网络药理学分析参附苓桂术甘汤加减治疗缺血性心肌病的药理过程和分子机制[J]. 中西医结合心脑血管病杂志, 2021, 19(21): 3645-3653. DOI:10.12102/j.issn.1672-1349.2021.21.003 |
| [16] |
程斌, 沈安, 楼招欢, 等. 基于生信学数据挖掘和实验研究的银芍散抗高脂血症的研究[J]. 中药药理与临床, 2020, 36(3): 186-193. |
| [17] |
李聪, 胡强, 张燕翔, 等. 槲皮素的药理学活性研究进展[J]. 湖北中医杂志, 2018, 40(6): 63-66. |
| [18] |
QIU X M, WANG H, WANG Z, et al. Expression of PCNA, Ki-67 and COX-2 in breast cancer based on DCE-MRI image information[J]. Journal of Infection and Public Health, 2020, 13(12): 2032-2037. |
| [19] |
陈蛟, 郝景程. 长链非编码RNA在肝癌中的作用研究进展[J]. 解放军医学杂志, 2020, 45(7): 786-790. |
| [20] |
JURÍKOVÁ M, DANIHEL Ł, POLÁK Š, et al. Ki67, PCNA, and MCM proteins: markers of proliferation in the diagnosis of breast cancer[J]. Acta Histochemica, 2016, 118(5): 544-552. |
| [21] |
HUANG J, ZHANG J, LI H, et al. VCAM1 expression correlated with tumorigenesis and poor prognosis in high grade serous ovarian cancer[J]. American Journal of Translational Research, 2013, 5(3): 336-346. |
| [22] |
DING Y B, CHEN G Y, XIA J G, et al. Association of VCAM-1 overexpression with oncogenesis, tumor angiogenesis and metastasis of gastric carcinoma[J]. World Journal of Gastroenterology, 2003, 9(7): 1409-1414. |
| [23] |
ZHANG D, BI J, LIANG Q, et al. VCAM1 promotes tumor cell invasion and metastasis by inducing EMT and transendothelial migration in colorectal cancer[J]. Frontiers in Oncology, 2020, 10: 1066. |
| [24] |
KRYSTYNA A, SAFI T, BRIGGS W M, et al. Correlation of hepatitis C and prostate cancer, inverse correlation of basal cell hyperplasia or prostatitis and epidemic syphilis of unknown duration[J]. International Brazilian Journal of Urology, 2011, 37(2): 223-230. |
| [25] |
SARKAR P, MALIK S, BANERJEE A, et al. Differential microbial signature associated with benign prostatic hyperplasia and prostate cancer[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 894777. |
| [26] |
闫浩, 刘潇潇, 孙轲强, 等. 基于网络药理学和分子对接研究枳实薤白桂枝汤治疗心血管疾病的作用机制[J]. 中国药师, 2021, 24(3): 405-415, 420. |
| [27] |
GHAFOURI-FARD S, SHABESTARI F A, VAEZI S, et al. Emerging impact of quercetin in the treatment of prostate cancer[J]. Biomedicine & Pharmacotherapy, 2021, 138: 111548. |
| [28] |
PRATHEESHKUMAR P, BUDHRAJA A, SON Y O, et al. Quercetin inhibits angiogenesis mediated human prostate tumor growth by targeting VEGFR-2 regulated AKT/mTOR/P70S6K signaling pathways[J]. PLoS One, 2012, 7(10): e47516. |
| [29] |
BALAKRISHNAN S, BHAT F A, SINGH P R, et al. Gold nanoparticle-conjugated quercetin inhibits epithelial-mesenchymal transition, angiogenesis and invasiveness via EGFR/VEGFR-2-mediated pathway in breast cancer[J]. Cell Proliferation, 2016, 49(6): 678-697. |



