2. 广西中药质量标准研究重点实验室, 广西南宁 530022
2. Guangxi Key Laboratory of Traditional Chinese Medicine Quality Standard, Nanning, Guangxi, 530022, China
中药材广西莪术是姜科(Zingiberaceae)姜黄属(Curcuma)植物广西莪术(Curcuma kwangsiensis)的干燥根茎,习称桂莪术、毛莪术,广西百色、钦州、南宁、贵港、玉林等地均有产出[1],是壮族民间常用药材,与姜科植物蓬莪术(C.phaeocaulis)、温郁金(C.wenyujin)共同作为《中国人民共和国药典(一部)》(2020年版)(以下简称《中国药典》)[2]和《广西壮族自治区壮药质量标准》[3]中莪术的药物来源,近年来逐渐成为市场上流通最大的莪术品种,是广西遴选确定的“桂十味”道地药材之一[4]。莪术味辛、苦,性温,归肝、脾经,具有消积止痛、破血祛瘀的功效,民间常用来治疗跌打损伤、闭经腹痛、癌瘤、食积胀痛及血瘀所致的胸痹腹胀等[5]。
本课题组长期致力于广西莪术的资源开发和研究利用,先后从化学成分、抗血栓成分和机制、质量分析等方面对广西莪术进行了深入的研究[6-18]。广西莪术药用历史悠久、使用广泛、药材产业规模庞大,具有极好的药用价值和经济价值,而化学成分复杂、作用机制不清晰、植物基源多样等方面的因素限制了该药的应用和开发。本文在中医理论指导下全面综述广西莪术的化学成分、药理作用、质量分析方法及临床应用,为药物的安全使用、科学质量评价、药材产业的有序发展提供参考。
1 化学成分广西莪术的药效成分主要是挥发油和姜黄素,按结构类型可分为倍半萜、单萜、二萜、三萜、二苯基庚烷类和有机酸等。
1.1 挥发油广西莪术富含挥发油,《中国药典》在莪术药材的含量测定中明确规定,莪术中含挥发油不得少于1.5%[2]。许多报道证实,莪术挥发油具有抗炎、镇痛、抗肿瘤、抗病毒等药理作用,是莪术最主要的药效成分群,市场上已出现由温郁金为药材制成的产品“莪术油”,其标准收载于《中国药典》[2],但尚未有广西莪术制成的莪术油产品及产品标准。广西莪术挥发油是以吉玛烷型、愈创木烷型、榄烷型、桉烷型等结构为代表的一系列萜类化合物,详见表 1和图 1。
| 序号 No. |
化合物 Compounds |
分子式 Molecular formula |
参考文献 References |
| 1 | Linderazulene | C15H14O | [16] |
| 2 | α-Pinene | C10H16 | [19] |
| 3 | Curzerenone | C15H18O2 | [19] |
| 4 | Camphene | C10H16 | [19] |
| 5 | 1, 8-Cineole | C10H18O | [19] |
| 6 | Linalool | C10H18O | [19] |
| 7 | DL-Isoborneol | C10H18O | [19] |
| 8 | Borneol oil | C10H18O | [19] |
| 9 | β-Elemene | C15H24 | [19] |
| 10 | δ-Elemene | C15H24 | [19] |
| 11 | α-Caryophyllene | C15H24 | [19] |
| 12 | β-Caryophyllene | C15H24 | [19] |
| 13 | Curzerene | C15H20O | [19] |
| 14 | Germacrone | C15H22O | [19] |
| 15 | Curcumol | C15H24O2 | [19] |
| 16 | Curdione | C15H24O2 | [19] |
| 17 | D-Limonene | C10H16 | [19] |
| 18 | 2-Nonanol | C9H20O | [19] |
| 19 | Vumsuliol | C13H20O3 | [20] |
| 20 | Dehydrovomifoliol | C13H18O3 | [20] |
| 21 | Acomadendrane-4β, 10β-diol | C15H26O2 | [20] |
| 22 | Curkwangsien A | C17H26O4 | [20] |
| 23 | Curkwangsien B | C17H26O4 | [20] |
| 24 | (4S)-Hydroxy-(8S)-methoxy-(5S)-(H)-guaia 1(10),7(11)-dien-12, 8-oli | C16H22O4 | [21] |
| 25 | (1R, 4R, 5S, 8S, 9Z)-4-Hydroxy-1, 8-epoxy-5H-guai-7(11), 9-dien-12, 8-olide | C15H19O5 | [21] |
| 26 | 2-Oxoguaia-1(10), 3, 5, 7(11), 8-pentaen-12, 8-olide | C15H12O3 | [21] |
| 27 | (1R)-2, 3, 3aα, 7, 8, 8aα-Hexahydro-1α-hydroxy-1, 4-dimethyl-7-(1-methylethylidene)azulen-6(1H)-one | C15H22O2 | [22] |
| 28 | Curcumenol | C15H22O2 | [22] |
| 29 | Wenyujinin I | C15H24O3 | [22] |
| 30 | Alismoxide | C15H26O2 | [22] |
| 31 | Wenyujinin A | C15H24O3 | [22] |
| 32 | Phaeocaulisin I | C15H20O4 | [22] |
| 33 | Kwangsiensis B | C15H20O3 | [22] |
| 34 | Kwangsiensis A | C15H22O2 | [22] |
| 35 | 1α, 8α-Epidioxy-4α-hydroxy-5α-H-guai-7(11),9-dien-12,8-olide | C15H18O5 | [22] |
| 36 | Curdionolide A | C15H20O4 | [22] |
| 37 | Curdionolide B | C15H20O3 | [22] |
| 38 | Souliene A | C16H22O4 | [22] |
| 39 | Dehydrocurdione | C15H22O2 | [22] |
| 40 | Aeruginolactone | C15H20O3 | [22] |
| 41 | 8β-Hydroxy-isogermafureolide | C15H20O3 | [22] |
| 42 | Phacadinane D | C15H18O4 | [22] |
| 43 | Curcumolide | C15H22O3 | [22] |
| 44 | Labda-8(17),13(14)-dien-15,16-olide | C20H30O2 | [22] |
| 45 | (E)-Labda-8(17),12-dien-15(16)-olide | C20H30O2 | [22] |
| 46 | Furanodiene | C15H20O | [23] |
| 47 | Zederone | C15H18O3 | [23] |
| 48 | Furanodienone | C15H18O2 | [23] |
| 49 | D-Camphor | C10H16O | [24] |
| 50 | β-Pinene | C10H16 | [24] |
| 51 | 2-Heptanol | C7H16O | [24] |
| 52 | Sabinene | C10H16 | [24] |
| 53 | (3R, 6E, 10S)-6, 10α-Dimethyl-3-isopropyl-6-cyclodecene-1, 4-dione | C15H24O2 | [24] |
| 54 | Terpinen-4-ol | C10H18O | [24] |
| 55 | β-Eudesmol | C15H26O | [24] |
| 56 | Calarene | C15H24 | [24] |
| 57 | Alloaromadendrene | C15H24 | [24] |
| 58 | α-Terpineol | C10H18O | [24] |
| 59 | Terpinolene | C10H16 | [24] |
| 60 | β-Myrcene | C10H16 | [25] |
| 61 | α-Terpinene | C10H16 | [25] |
| 62 | β-Phellandrene | C10H16 | [25] |
| 63 | 3-Carene | C10H16 | [25] |
| 64 | α-Terpinolene | C10H16 | [25] |
| 65 | Valencene | C15H24 | [25] |
| 66 | Benzofuran | C8H6O | [26] |
| 67 | Germacrene-B | C15H24 | [26] |
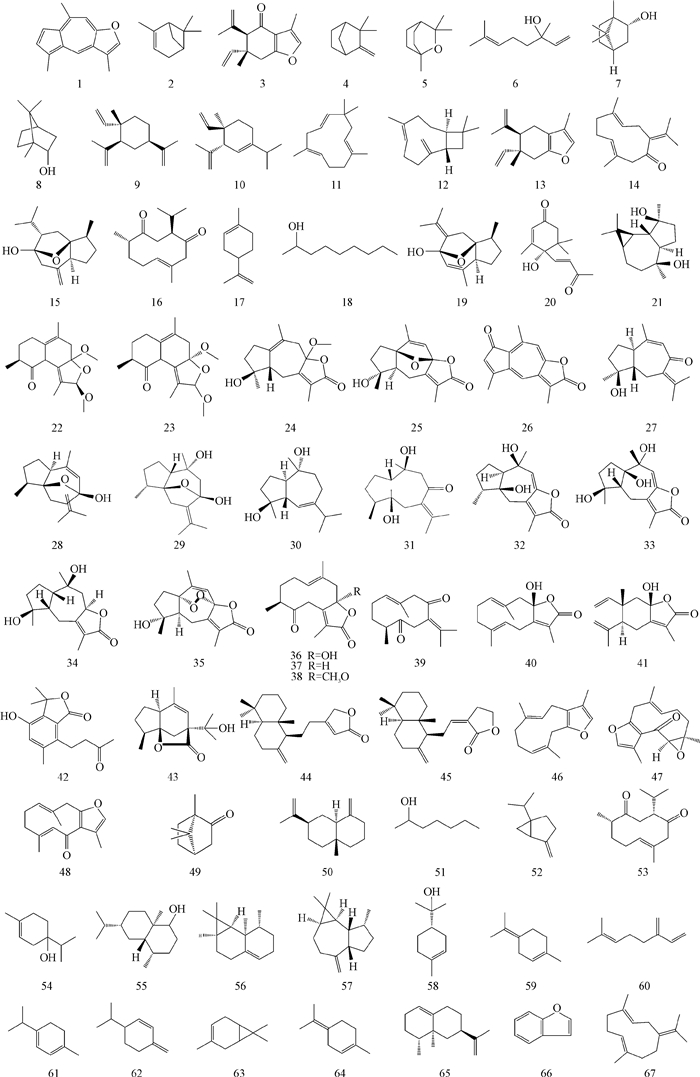
|
| 图 1 广西莪术挥发油成分 Fig. 1 Structures of volatile oil from C.kwangsiensis |
1.2 姜黄素类成分
广西莪术中另一类药效成分是姜黄素类成分,其结构特点是以二苯基庚烷为骨架的一系列衍生物,根据其结构中苯环上有无酚羟基可分为酚性和非酚性两类。姜黄素作为广西莪术的主要成分,在抗肿瘤、保肝等方面具有显著的疗效,对于其成分的研究和开发有着重大的价值,近年来许多学者应用层析色谱、紫外光谱、红外光谱、质谱、核磁共振光谱等方法分离分析了广西莪术中多种二苯基庚烷类成分,具体见表 2和图 2。
| 序号 No. |
化合物 Compounds |
分子式 Molecular formula |
参考文献 References |
| 68 | 2, 3, 5-trihydroxy-1-(3-methoxy-4-hydroxyphenyl)-7-(3, 5-dimethoxy-4-hydroxyphenyl) heptane | C22H30O8 | [27] |
| 69 | 2, 3, 5-trihydroxy-1-(4-hydroxyphenyl)-7-(3, 5-dimethoxy-4-hydroxyphenyl)heptane | C21H28O7 | [27] |
| 70 | (3R, 5S)-3, 5-dihydroxy-1-(4-hydroxy-3-methoxyphenyl)-7-(3, 4-dihydroxyphenyl)heptane | C20H26O6 | [27] |
| 71 | (3R, 5S)-3, 5-dihydroxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptane | C19H24O5 | [28] |
| 72 | (3R, 5S)-3, 5-dihydroxy-1-(4-hydroxy-3-methoxyphenyl)-7-(4-hydroxyphenyl)heptane | C20H26O5 | [28] |
| 73 | (3R, 5S)-3, 5-dihydroxy-1-(3-methoxyphenyl-4, 5dihydroxy-)-7-(4-hydroxyphenyl)heptane | C20H26O6 | [28] |
| 74 | (5S)-5-hydroxy-1-(4-hydroxyphenyl)-7-phenyl-3-heptanone | C19H22O3 | [28] |
| 75 | (5S)-5-hydroxy-1-(4-hydroxyphenyl)-7-(3, 4-dihy-droxyphenyl)-3-heptanone | C19H22O5 | [28] |
| 76 | (5S)-5-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-7-(4-hydroxyphenyl)heptan-3-heptanone | C20H24O5 | [28] |
| 77 | (5S)-5-hydroxy-1, 7-bis(4-hydroxyphenyl)heptan-3-one | C19H22O4 | [28] |
| 78 | (5S)-5-hydroxy-1-(4-hydroxy-3-methoxy-phenyl)-7-(3, 4-dihydroxyphenyl)heptan-3-one | C20H24O6 | [28] |
| 79 | (3R, 5R)-3-acetoxy-5-hydroxy-1, 7-bis(4-hydroxyphenyl)heptane | C21H26O5 | [28] |
| 80 | (3R, 5R)-3-acetoxy-5-hydroxy-1, 7-bis(3, 4-dihydroxyphenyl)heptane | C21H26O7 | [28] |
| 81 | (3R, 5R)-3, 5-diacetoxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptanemethoxy-4, 5-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptane | C23H28O7 | [28] |
| 82 | (3R, 5R)-3-acetoxy-5-hydroxy-1(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptane | C21H26O6 | [28] |
| 83 | (3R, 5R)-3, 5-dihy-droxy-1-(4-hydroxy-3-methoxyphenyl)-7-(3, 4-dihydroxyphenyl)-heptane | C20H26O6 | [28] |
| 84 | (3R, 5R)-3, 5-diacetoxy-1, 7-bis(3, 4-dihydroxyphenyl)heptane | C23H28O8 | [28] |
| 85 | (3S, 5S)-3-acetoxy-5-hydroxy-1-(3, 4-dihydroxyphenyl)-7(4-hydroxyphenyl)heptane | C21H26O6 | [28] |
| 86 | (3R, 5R)-3, 5-dihydroxy-1, 7-bis(4-hydroxyphenyl)heptane | C19H24O4 | [28] |
| 87 | (3R, 5R)-3, 5-dihydroxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptane | C19H24O5 | [28] |
| 88 | 3, 5-dihydroxy-1, 7-bis(3, 4-dihydroxyphenyl)heptane | C19H24O6 | [28] |
| 89 | (3S, 5S)-3, 5-dihydroxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptane | C19H24O5 | [28] |
| 90 | (3R)-1, 7-bis(4-hydroxyphenyl)-(6E)-6-hepten-3-ol | C19H22O3 | [29] |
| 91 | (3S)-1, 7-bis(4-hydroxyphenyl)-(6E)-6-hepten-3-ol | C19H22O3 | [29] |
| 92 | (3R)-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)-(6E)-6-hepten-3-ol | C19H22O4 | [29] |
| 93 | (3S)-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)-(6E)-6-hepten-3-ol | C19H22O4 | [29] |
| 94 | (3R)-1-(3, 4-dihydroxyphenyl)-7-phenyl-(6E)-6-hepten-3-ol | C19H22O3 | [29] |
| 95 | (3S)-1-(3, 4-dihydroxyphenyl)-7-phenyl-(6E)-6-hepten-3-ol | C19H22O3 | [29] |
| 96 | (3R)-3-acetoxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)-(6E)-6-heptene | C21H24O5 | [29] |
| 97 | (3S)-3-acetoxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)-(6E)-6-heptene | C21H24O5 | [29] |
| 98 | (3R)-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptan-3-ol | C19H24O4 | [29] |
| 99 | (3S)-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxyphenyl)heptan-3-ol | C19H24O4 | [29] |
| 100 | (3R)-3-acetoxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxy-phenyl)heptanes | C21H26O5 | [29] |
| 101 | (3S)-3-acetoxy-1-(3, 4-dihydroxyphenyl)-7-(4-hydroxy-phenyl)heptanes | C21H26O5 | [29] |
| 102 | 1, 7-bis(4-hydroxyphenyl)-3-heptone | C19H22O3 | [29] |
| 103 | 1-(4-hydroxy-3-methoxyphenyl)-7-(4-hydroxyphenyl)3-heptone | C20H24O4 | [29] |
| 104 | (E)-1, 7-bis(4-hydroxyphenyl)-6-hepten-3-one | C19H20O3 | [29] |
| 105 | 1-(4-hydroxyphenyl)7-phenyl-(6E)-6-heptene-3-one | C19H20O2 | [29] |
| 106 | 1, 7-bis(4-hydroxyphenyl)hepten-4, 6-diene-3-one | C19H18O3 | [29] |
| 107 | 1-(4-hydroxy-3-methoxyphenyl)-7-(4-hydroxyphenyl)-(4E)-4-hepten-3-one | C20H22O4 | [29] |
| 108 | (1S, 3S, 5S)-1, 5-epoxy-3-hydroxy-1-(4-hydroxy-3, 5-dimethoxyphenyl)-7-(4-hydroxyphenyl)heptane | C21H25O6 | [30] |
| 109 | (1S, 5R)-1, 5-epoxy-1-(4-hydroxyphenyl)-7-(3-methoxy-4-hydroxyphenyl)heptane | C20H23O4 | [30] |
| 110 | (1R, 2S, 5S)-1, 5-epoxy-2-hydroxy-1, 7-bis(3, 4-dihydroxyphenyl)heptane | C19H21O6 | [30] |
| 111 | (3R, 5S)-3, 5-dihydroxy-1-(4-hydroxy-3, 5-dimethoxyphenyl)-7-(4-hydroxyphenyl)heptane | C21H28O6 | [30] |
| 112 | (3R, 5S)-3, 5-dihydroxy-1-(4-hydroxy-3-methoxyphenyl)-7-(4-hydroxyphenyl)heptane | C20H26O5 | [30] |
| 113 | (3R, 5S)-3, 5-dihydroxy-1, 7-bis(4-hydroxyphenyl)heptane | C19H24O4 | [30] |
| 114 | (3R, 5S)-3, 5-diacetyl-1, 7-bis(4-hydroxyphenyl)heptane | C23H27O6 | [30] |
| 115 | (3R, 5R)-3-diacetyl-5-hydroxy-1-(3, 4-dihydroxyphenyl)-7-phenyl-heptane | C21H25O5 | [30] |
| 116 | (3R, 5R)-3, 5-dihydroxy-1-(3, 4-dihydroxyphenyl)-7-phenyl-heptane | C19H23O4 | [30] |
| 117 | (3R, 5R)-3-acetoxy-5-hydroxy-1, 7-bis(3, 4-dihydroxyphenyl)-heptane | C21H26O7 | [30] |
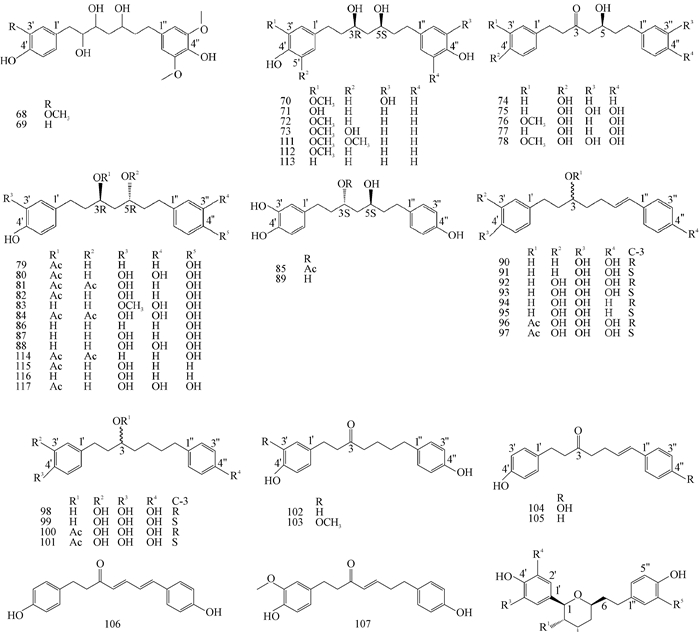
|
| 图 2 广西莪术二苯庚烷类成分 Fig. 2 Diphenylheptanes from C.kwangsiensis |
1.3 其他成分
除上述报道的化学成分外,广西莪术中还含有对羟基苯甲酸、对羟基桂皮酸[23]、表木栓醇、熊果酸、白桦脂酸、钝叶醇[27]、β-谷甾醇、豆甾醇、羽扇豆醇[31]等化合物。
2 药理作用莪术具有破血行气、消积止痛之效,莪术药用历史悠久,炮制品的应用已有数百年的历史,其炮制方法首次在《雷公炮炙论》[32]中有详细记录。莪术生品长于行气,经过醋制后其破血功效增强。莪术的化学成分具有抗癌、抗炎、抗心肌损伤、抗纤维化、抗血栓等多种生物活性。
2.1 抗癌作用近年来莪术及其挥发油在肿瘤治疗中取得较好的疗效。现代研究发现广西莪术对肝癌、肺癌、卵巢癌、乳腺癌等多种类型癌症均有治疗作用,其挥发油中的莪术醇等倍半萜类成分是主要药效物质,主要作用于肿瘤细胞蛋白表达阶段,能够抑制肿瘤细胞增殖、阻碍肿瘤细胞转移、加速肿瘤细胞凋亡[33-50],详见表 3。
| 肿瘤类型 Tumor type |
肿瘤细胞 Tumor cell |
有效成分 Active ingredient |
作用机制 Action mechanism |
参考文献 References |
| Hepatoma | HepG2 | Zedoaria extract | Suppress Wnt/β-Catenin signaling pathway inhibits the proliferation and migration of liver cancer cells | [33] |
| H22 | Elemene | Upregulation of Caspase-3 protein and Caspase-3 mRNA expression, while downregulation of Survivin protein and Survivin mRNA expression in tumor tissue promotes cell apoptosis | [34] | |
| HepG2 | Curdione | Inhibiting the VEGF/VEGFR2 signaling pathway, altering the microenvironment of tumor cells, and inhibiting tumor proliferation | [35] | |
| HepG2 | Curcumenol | Inhibiting the PI3K/AKT pathway promotes tumor cell apoptosis | [36] | |
| HepG2 | Curcumenol | Enhancing the activity of the p53 signaling pathway causes cell G0/G1 phase cycle arrest, thereby inducing aging in HepG2 cells | [37] | |
| HepG2 | Curcumenol | Inhibition of miR-629 and miR-24 on tumor cell proliferation | [38] | |
| Lung cancer | Walker-256 | Zedoaria extract | Inhibition of tumor growth by blocking the expression of STAT5 and STAT3 proteins in the JAK-STAT signaling pathway | [39] |
| A549,H1299 | Curcumenol | Inhibiting the JAK1/STAT3 signaling pathway to inhibit tumor cell proliferation | [40] | |
| A549 | Curcumenol | Suppress Wnt/β-Activation of the catenin pathway hinders epithelial mesenchymal transformation, invasion, and migration of lung cancer A549 cells | [41] | |
| Oophoroma | SKOV3 | Curcumenol | Downregulation of AKT and PI3K protein expression in cells hinders the invasion and migration of SKOV3 cells | [42] |
| SKOV3 | Oil of zedoary | The expression of STAT3, mTOR, and VEGFA is blocked, inhibiting the proliferation of ovarian cancer cells | [43] | |
| Breast cancer | MCF-7 | Curcumenol | Reduce Bcl-2/Bax expression and induce apoptosis in MCF-7 tumor cells | [44] |
| MCF-7 | Curcumenol | Blocking STAT3 expression, thereby inhibiting JAK2/STAT3 signaling and inhibiting tumor cell proliferation | [45] | |
| Endometrial cancer | HEC-1-B | Oil of zedoary | Promoting the expression of Bax and Caspase-3 proteins while inhibiting the expression of Bcl-2 protein, hindering the proliferation of HEC-1-B cells | [46] |
| Renal carcinoma | ACHN | Curdione | Blocking the expression of p-Akt, Bcl-2, and p-PI3K proteins, promoting the expression of Caspase-3, Bax, and P53 proteins, thereby inhibiting the proliferation of ACHN cells and inducing their apoptosis | [47] |
| Osteocarcinoma | MG-63, U2OS | Curcumenol | Inhibition the stability of β-catenin can inhibit the proliferation, migration, and invasion of osteosarcoma MG-63 and U2OS cells, and induce cell apoptosis | [48] |
| Human neuroblastoma | SK-N-SH | Curcumenol | Promotes the expression of p27 mRNA and protein, while inhibiting the expression of PCNA mRNA and inhibiting the growth of neuroblastoma SK-N-SH cells | [49] |
| Glioma | A172, U251 | Curcumenol | Curcumol downregulates the expression of FoxD2-AS1 gene and reduces the reversal of drug resistance in glioma cells | [50] |
2.2 抗血栓作用
血栓栓塞是血栓性疾病的主要诱因,临床上致死率、致残率较高,发病率逐年增加。本课题组曾对广西莪术抗血栓作用及其机制进行深入研究,发现广西莪术的乙酸乙酯提取成分具有明显的抗血栓作用,其作用机理是通过调节血栓素B2和内皮素1来降低全血黏度和血浆黏度,并通过提高6-keto-PGF1α、NO水平产生保护血管的作用[12]。Fang等[51]发现莪术中的莪术二酮可通过影响AMP-活化蛋白激酶- vinculin/talin-integrin αIIbβ3信号通路,从而抑制凝血酶诱导的血小板聚集。上述研究表明广西莪术作为抗血栓和抗血小板形成药物,在预防血栓性疾病方面具有很大的潜力。
2.3 抗炎作用莪术提取物可治疗单纯疱疹病毒性脑炎(Herpes Simplex Encephalitis,HSE)。范新立等[52]发现莪术提取物能够通过影响Nrf2/HO-1信号通路,使脑血流指数升高,减轻HSE模型小鼠脑组织中的氧化应激反应,修复损伤脑组织。王芳等[53]通过实验证实莪术中的莪术油能下调病毒性脑炎小鼠TNF-α、S100B及TLR2 mRNA蛋白的表达,降低炎症反应。
2.4 抗肝纤维化作用莪术是中医治疗肝纤维化及肝硬化的常用中药,何梅雅等[54]发现莪术能够抑制Ptch-1和Gli1表达,从而减轻胆管结扎诱导的肝纤维化小鼠的炎症反应。郑洋等[55-57]研究莪术醇与肝星状细胞(Hepatic Stellate Cell,HSC)PIBK/AKT/mTOR信号通路的关系,结果显示莪术醇能够阻碍PI3K、AKT、mTOR蛋白及mRNA的表达,并能诱导HSC凋亡和自噬,从而起到抗肝纤维化的作用;莪术醇还能够抑制TLR4/NF-κB和TGF-β1/Smad信号通路的活动,发挥抗肝纤维化的作用。王佳慧等[58]发现莪术醇能够影响miR-125b/NLRPS信号通路,继而发挥其抗肝纤维化作用。Liu等[59]研究发现莪术二酮可抑制成纤维细胞向肌成纤维细胞分化,从而产生抗肺纤维化作用。刘露露等[60]发现莪术油能抑制mRNA、Smad2、Smad3及TGF-β1蛋白的表达,从而降低血瘀证肝纤维化小鼠的肝纤维化程度。顾燕兰等[61]发现莪术醇能够下调大鼠肺组织中PAI-1和TGF-β1的表达,缓解博来霉素诱导的大鼠肺纤维化。
2.5 治疗子宫内膜异位作用莪术中的莪术醇常用于治疗子宫内膜异位症(Endometriosis,EMS)。聂晓博等[62]研究发现莪术醇能显著抑制腹腔微环境中的炎症反应,从而改善实验大鼠EMS的症状。赵静等[63]通过试验发现莪术醇可使子宫腺肌病异位子宫内膜基质细胞(Ectopic Endometrial Stromal Cells, EESCs)迁移和增殖受阻,从而促使细胞凋亡,具有潜在的治疗子宫腺肌病作用。此外,刘帅等[64]发现莪术醇可通过影响SDF-1/CXCR4轴的活动抑制子宫内膜异位症的发展。
2.6 改善肾功能作用慢性肾功能衰竭(Chronic Renal Failure,CRF)是指肾脏呈现明显萎缩,不能维持其基本功能的现象。CRF致病原因呈多样性,为慢性进行性肾实质损害,故该病又称慢性肾功能不全。Zhong等[65]研究发现莪术中的莪术烯醇可使5/6肾切除术后CRF大鼠的肾功能得到显著改善,其机制可能与影响SIRT1/NF-κB信号通路的活动有关。
2.7 治疗心肌损伤作用莪术酮具有心脏保护作用。Ma等[66]研究结果显示,莪术二酮能够降低异丙肾上腺素(Isoproterenol,ISO)诱导的血清肌酸激酶同工酶MB (CK-MB)和乳酸脱氢酶(LDH)水平,从而减轻形态学损伤。此外,莪术二酮通过调节Nrf2/SOD1/HO-1信号通路,让线粒体功能正常运转,使ISO诱导的细胞凋亡受阻,逆转ISO诱导的活性氧(ROS)积累,调节Bax和Bcl-2蛋白的表达,从而起到治疗心肌损伤的作用。
3 质量分析方法现行广西莪术药材质量标准中仅对莪术挥发油的总量做出了要求,其定量方法未细化到具体成分[2, 3]。挥发油是由几十甚至上百种化学成分组成的混合物,并且很多药材都含有挥发油,仅对挥发油总量进行质量控制难以保障莪术药材的品质。莪术药材基源多样,有蓬莪术、广西莪术、温郁金之分。据文献考证,蓬莪术主产于四川,药用历史可追溯至唐朝,至宋明时期确定了蓬莪术、广西莪术、温郁金3个品种基源和四川、两广、江浙3个主产区,其中蓬莪术、温郁金品质佳但产量低,两广的广西莪术产量最高、品质较好,渐渐成为主流品种[67]。莪术的用药部位较易混淆,以广西莪术为例,同一植株其根茎作为莪术用药,块根则作为郁金用药,存在一株两药的现象,两药从药性、用法、主治方面均有较大差异,使用不当会危害病人生命健康。因此,细化药材成分,建立更全面的质量控制体系,才能更好地反映药材品质,从而保障临床用药安全。
李泽宇等[68]对广西莪术化学成分的相关研究成果进行归纳整理,结合网络药理学,以质量标志物的概念对广西莪术的化学成分进行分析,认为姜黄素和吉马酮生物活性强、作用机制明确,在广西莪术品种中含量较高,适合作为广西莪术质量控制的指标性成分。现代分析方法中对莪术成分的测定主要有高效液相色谱(HPLC)法、气相色谱(GC)法、气质联用色谱(GC-MS)法等,其中HPLC法可对姜黄素类等不易挥发的化学成分进行定量分析[69],GC法可用来测定莪术中的易挥发成分,GC-MS法兼顾定性定量分析,可用来测定莪术中多种已知或未知的挥发性成分。林薇等[70]通过测定姜黄素、莪术醇、吉马酮、呋喃二烯4种成分的含量来评价四川、广西、云南各地莪术品质,结果显示四川温江的莪术品质最佳,广西灵山次之。高红宁等[71]采用HPLC法测定浙江、四川、广西3个产地莪术饮片中姜黄素、双去甲氧基姜黄素和去甲氧基姜黄素的含量,结果显示浙江产的莪术3种成分含量最高,四川次之,广西产莪术含量较低。蓝振威等[72]采用GC-MS法对蓬莪术、温郁金、广西莪术的挥发油成分进行定性定量分析,结果显示各植物种间所含化学成分基本接近,含量有所差异,其中温郁金的特征性成分为莪术二酮和芳樟醇,蓬莪术的特征性成分为甲基正壬酮,广西莪术的特征性成分为蛇麻烯、γ-selinene和蓬莪术环氧酮。覃葆等[73]采集广西平南、邕宁、钦州等9个产地的广西莪术样品,采用HPLC法测得其吉马酮成分的平均含量为0.93 mg/g,其中灵山产莪术含量最高,为1.22 mg/g。
4 临床应用肝主疏泄、藏血,脾主转运、摄血,若肝失疏泄、脾失固摄,易造成气滞血瘀。莪术归肝、脾二经,醋制后入肝经之力更甚,药性辛温,善走窜; 入肝脏可疏肝气、破血瘀,入脾脏可提振脾气、导滞除积。《本草纲目》记载:“莪术入肝,治气中之血,与郁金稍为不同。莪术行气破血之力较强,需却有淤血者用。”组方上莪术常与活血行气药配伍,治疗气滞血瘀所引发的诸般病症;与三棱(Sparganium stolonierum)、当归(Angelica sinensis)、香附(Cyperus rotundus)等配伍,可治癥瘕痞块;与当归、红花(Carthamus tinctorius)、牡丹(Paeonia suffruticosa)皮配伍,可治血瘀经闭;与丹参(Salvia miltiorrhiza)、川芎(Ligusticum chuanxiong)配伍,可治胸痹心痛;与青皮(Citrus reticulata)、槟榔(Areca catechu)配伍,可治食积腹胀。莪术药用历史悠久,古今医药名家根据其药性主治,亦整理出诸多经典方剂,详见表 4。
| 药物形式 Form of drugs |
指示性症状 Indicative symptoms |
处方组成 Prescription composition |
用法 Usage |
参考文献 References |
| 散剂 | 寒证所致心绞痛 | 木香 | 醋水送服 | [74] |
| 汤剂 | 经闭腹痛 | 香附(醋炒)、当归(酒洗)、白芍(Paeonia lactiflora)、赤芍(P.veitchii)、青皮、乌药(Lindera aggregata)、肉桂(Cinnamomum cassia)、三棱(醋炒)、苏木(Caesalpinia sappan)、红花 | 米酒调服 | [75] |
| 汤剂 | 跌打损伤 | 三棱、赤芍、骨碎补(Drynaria fortunei)、当归、延胡索(Corydalis yanhusuo)、木香(Aquilaria sinensis)、乌药、青皮、桃仁(Prunus persica)、苏木 | 内服 | [76] |
| 散剂 | 妇人血气游走及腰痛 | 干漆(Toxicodendron vernicifluum) | 酒送服 | [77] |
| 汤剂 | 吞酸吐酸 | 川黄连(Coptis chinensis)、吴茱萸(Evodia rutaecarpa) | 内服 | [77] |
| 散剂 | 腹痛,奔豚疝瘕 | 肉桂、小茴香(Foeniculum vulgare) | 内服 | [77] |
| 汤剂 | 血瘀经闭 | 三棱、香附、马鞭草(Verbena officinalis) | 内服 | [78] |
| 汤剂 | 腹部积块 | 三棱、青皮、枳壳(Citrus aurantium) | 内服 | [79] |
| 汤剂 | 阴道炎 | 三棱、补骨脂(Psoralea corylifolia)、白鲜皮(Dictamnus dasycarpus)、苦参(Sophora flavescens)、蛇床子(Cnidium monnieri)、红花、大黄(Rheum palmatum)、益母草(Leonurus japonicus)、制首乌(Polygonum multiflorum)、白芷(Angelica dahurica) | 外用熏洗 | [80] |
| 汤剂 | 月经不调,小腹包块 | 三棱、肉桂、木香、熟地(Rehmannia glutinosa)、白芍、当归、延胡索、川芎 | 内服 | [81] |
| 汤剂 | 气滞血瘀的癓瘕积聚 | 三棱、红花、牡丹皮、鳖甲(Trionyx sinensis)、炮山甲、党参(Codonopsis pilosula)、黄芪(Astragalus memeranaceus var.mongholicus)、当归 | 内服 | [81] |
| 汤剂 | 心血瘀阻的胸痹 | 三棱、党参、麦冬(Ophiopogon japonicus)、五味子(Schisandra chinensis)、桂枝(Cinnamomum cassia)、瓜蒌(Trichosanthes kirilowii)、枣仁(Ziziphus jujuba)、田七(Panax notoginseng)、丹参、川芎、赤芍、菖蒲(Acorus tatarinowii) | 内服 | [81] |
| 汤剂 | 消化不良、腹胀 | 三棱、麦芽(Hordeum vulgare)、神曲、佛手(Citrus medica var.sarcodactylis)、大腹皮(Areca catechu)、莱菔子(Raphanus sativus) | 内服 | [81] |
| 汤剂 | 子宫肌瘤 | 三棱、牡蛎(Ostrea gigas)、浙贝(Fritillaria thunbergii)、元参(Scrophularia ningpoensis)、白花蛇舌草(Herba hedyotis)、山慈菇、黄药子(Dioscorea bulbifera)、枯球(Prunella vulgaris)、昆布(Laminariae japonica)、海藻(Sargassum pallidum) | 内服 | [81] |
| 汤剂 | 慢性盆腔炎 | 败酱草(Patrinia scabiosaefolia)、鱼腥草(Houttuynia cordata)、蒲公英(Taraxacum mongolicum)、连翘(Forsythia suspensa)、当归、香附、红花、鸡内金(Gallus gallus domesticus)、桂枝 | 外用灌入 | [82] |
| 汤剂 | 癓瘕痞块、食积气滞 | 黄芪、党参、白术、生山药(Dioscorea opposita)、天花粉(Trichosanthes kirilowii)、知母(Anemarrhena asphodeloides)、三棱、生鸡内金 | 加少许醋内服 | [83] |
| 散剂 | 疱疹、全身燎泡 | 三棱 | 酒送服 | [84] |
| 汤剂 | 瘀阻宗脉型耳鸣、耳聋 | 葛根(Pueraria lobata)、川芎、当归、赤芍、石菖蒲、三棱、香附、红花、郁金(Curcuma kwangsiensis)、路路通(Liquidambar formosana)、威灵仙(Clematis chinensis)、地龙(Pheretima aspergillum) | 内服 | [85] |
| 汤剂 | 清热退疣,治疗扁平疣 | 黄芪、薏苡仁(Coix lacryma-jobi var.mayuen)、夏枯草、苦参(Sophora flavescens)、败酱草、山豆根(S.tonkinensis)、柴胡(Bupleurum chinense)、紫草(Arnebia euchroma)、白术、地肤子(Kochia scoparia)、防风(Saposhnikovia divaricata)、蝉蜕(Cryptotympana pustulata)、寒水石(Calcitum gypsum) | 内服 | [86] |
| 汤剂 | 清热散结,治疗扁平疣 | 板蓝根(Isatis indigotica)、大青叶、虎杖(Polygonum cuspidatum)、生薏苡仁、苍耳子(Xanthium sibiricum)、赤芍、甘草(Glycyrrhiza uralensis) | 内服 | [86] |
| 酊剂 | 清热散结,治疗扁平疣 | 紫草、赤芍、丹参、板蓝根、三棱、香附、夏枯草、红花、75%酒精 | 外擦 | [86] |
现代临床方面,莪术多被用于抗菌消炎以及治疗妇科疾病、心脑血管疾病、消化系统疾病、癌症等病症。蒋薇等[87]利用复方莪术油栓治疗宫颈糜烂患者65例,有效率大于93%。郗超等[88]使用莪术消癥丸治疗乳腺增生患者71例,取得较好疗效。柴惠玲[89]用改良少腹逐瘀汤治疗慢性盆腔炎患者65例,疗效显著。李建民[90]用三棱莪术汤治疗冠心病稳定型心绞痛患者30例,治疗效果优于硝酸甘油对照组。刘惠斌等[91]用莪术注射液配合腹腔镜治疗单纯性粘连性肠梗阻患者63例,取得较好的疗效。魏学琴等[92]用莪术油治疗小儿秋季腹泻患者46例,有效44例,无不良反应。现代制剂领域围绕莪术开发了许多中成药制剂,如儿童清热导滞丸、九气拈痛丸、小儿化食口服液、开胸顺气丸、云香祛风止痛酊、木香分气丸、止痛化癥片、丹香清脂颗粒、丹桂香颗粒、妇炎康片、乳康胶囊、保妇康栓等,均获得较好的临床疗效。
5 展望莪术作为行气破血、消积止痛的良药,传承历史悠久,因其副作用小而被广泛使用。古今名医根据其药性作用总结出大量经典名方,现代医者在莪术原有药用基础上又开发出诸多具有新的治疗作用的中成药制剂。现代研究表明莪术具有抗血栓、抗炎、抗肿瘤等多种功效,其有效成分主要是莪术二酮、吉马酮、莪术醇、莪术油和β-榄香烯等挥发油类物质,以及以二苯基庚烷为母核的姜黄素类化合物。近年来有学者不断探索莪术的质量分析方法,围绕莪术活性成分建立了以气相色谱和液相色谱为主的测定方法,从化学成分的角度对蓬莪术、广西莪术、温郁金的品质进行评价。现代研究成果从科学角度揭开了中药莪术的神秘面纱,但从技术层面广西莪术仍有诸多问题待解决。
作用机制上,有关莪术抗肿瘤活性的研究很多,莪术及其有效成分具有抗肝癌、肺癌、卵巢癌和乳腺癌等多种癌症的作用,但其抗癌机制、作用信号通路等尚不明确。药效成分方面,有关莪术成分的研究多集中在挥发油方面,关于姜黄素类成分的药效研究报道较少。姜黄素作为另一主要药效成分,药效作用和构效关系还不明确。质量分析方面,莪术油已被临床证实具有良好的抗肿瘤、抗炎作用,现有莪术油产品中仅有以温郁金为基源的莪术油产品和质量标准,蓬莪术和广西莪术尚未有莪术油产品及质量标准,极大地限制了广西莪术的产品深加工。解决上述问题,对于广西莪术的进一步开发利用具有重要意义。
从产业角度上看,广西莪术一直以来都是药材市场上的主流品种,其规模多年来领先全国,但其优势主要是产量高价格低,品质上并不占优势。究其原因主要有以下3个方面。第一是药材基源和种植规范。莪术品质以香气浓郁为佳,现代研究中常以挥发油、姜黄素等活性成分含量评价莪术品种的优劣,其中四川产蓬莪术和浙江产温郁金油细胞丰富且气味更浓,近年来科研工作者对蓬莪术品种进行多次优选改良,先后培育出产量更高、适应性更强、药效成分含量更高的“川蓬1号”和“川蓬2号”莪术品种[93, 94]。广西科研工作者虽然对广西莪术的株系进行大量培育研究,并取得了较好的成果,但相比之下还具备提升潜力[95]。种植方面,经纬度、海拔、光照、温湿度、微生物环境等对植物药效成分(植物次级代谢产物)有重要影响。莪术生长在温暖湿润的丘陵地带,喜湿怕涝,充足的光照有利于其挥发油的产生。种植过程要注意预防“烂苓”,以及由大豆拟茎点种腐病菌(Phomopsis longicolla)引发的叶斑病,同时也要防范姜弄蝶(Udaspes folus)和桃蛀螟(Dichocrocis punctiferalis)等害虫的侵害[96]。采收季节对莪术药效成分也有影响,11-12月采收药效成分含量最高,1-3月采收含量较低[97]。第二是炮制和质量控制。炮制过程中蒸煮的时间、烘干温度时长等因素均能够影响莪术中挥发油、姜黄素等药效成分的含量[98, 99]。质量控制上,现行《中国药典》对中药莪术的检测指标并不严格,仅以挥发油的含量评价药材品质,并没有细化至化学成分,其定量限度不高,仅能对药材的真伪和基本安全进行保障,无法客观评价莪术药材的品质高低,形成市场上莪术品种泛滥、品质良莠不齐的现象。第三是消费市场。莪术的使用主要为两个方面,一是医院饮片处方,二是药企采购制剂。基于市场上莪术品质良莠不齐,许多企业从成本角度考虑,药材采购过程中在符合国家标准前提下选择价格更低的产品,无形中影响中成药的品质,而主流市场上品质不佳的莪术品种销量大增也会倒逼生产方盲目扩大产能而忽视质量,形成劣币驱逐良币的局面,最后还会波及饮片市场,而饮片品质的波动也会影响临床方剂治疗效果。
针对上述问题,若要进一步发展莪术产业,打造桂药名片,应从提升药材品质着手,集中政府、科研机构、医疗机构、企业、种植户等多方面力量,推动广西莪术品质的提升。政府应做好统筹规划,学习莪术优势产区的经验,引进人才和优质种源,鼓励科学研究,加强药材生产流通环节的监管,加强道地药材的宣传力度。科研机构应加强广西莪术化学成分及作用机制的研究,突出广西莪术的成分特点,挖掘药效机制,选育药效更佳的植物品种,建立更合理的种植炮制规范体系,开展深加工与质量标准研究,建立更科学准确的质量控制方法。医疗机构应更多地探索广西莪术临床应用方向,总结用药经验,指导患者安全合理用药。药企应在国家标准基础上提高企业的内控标准,严把原料药材品质,升级生产工艺,保证中成药的品质。药材种植产区应本着长远的目光,根据自身经验并结合科研成果,规范种植、采收、加工技术,通过提高产品品质增加收入。只有凝聚多方面力量,才能使广西莪术从“以量取胜”向“质量俱佳”转变,让莪术产业创造出更多的经济效益和社会效益,带动广西“桂十味”等道地药材的发展,打造广西“中药强区”口碑。
| [1] |
广西中药资源普查办公室. 广西中药资源名录[M]. 南宁: 广西民族出版社, 1993: 272.
|
| [2] |
国家药典委员会. 中华人民共和国药典: 一部[M]. 2020年版. 北京: 中国医药科技出版社, 2020.
|
| [3] |
广西壮族自治区食品药品监督管理局. 广西壮族自治区壮药质量标准: 第一卷[M]. 南宁: 广西科学技术出版社, 2008: 158-159.
|
| [4] |
邓家刚, 韦松基. 广西道地药材[M]. 北京: 中国中医药出版社, 2007: 364-372.
|
| [5] |
梁启成, 钟鸣. 中国壮药学[M]. 南宁: 广西民族出版社, 2005: 318-319.
|
| [6] |
黄艳, 柴玲, 蒋秀珍, 等. 毛郁金的化学成分研究[J]. 中草药, 2014, 45(16): 2307-2311. |
| [7] |
刘布鸣, 苏小川, 白懋嘉, 等. 两种不同提取方法所得莪术油的成分对比分析[J]. 香料香精化妆品, 2014(5): 1-7. DOI:10.3969/j.issn.1000-4475.2014.05.001 |
| [8] |
陈晓军, 蒋珍藕, 韦洁, 等. 莪术50%乙醇大孔树脂洗脱部位抗血栓作用及其机制研究[J]. 中药药理与临床, 2017, 33(4): 82-85. |
| [9] |
陈晓军, 蒋珍藕, 韦洁, 等. 广西莪术抗血栓作用有效部位的筛选[J]. 中国医院药学杂志, 2017, 37(24): 2436-2438. |
| [10] |
陈晓军, 农云开, 韦洁, 等. 广西莪术不同极性部位提取物抗血栓实验研究[J]. 中医药导报, 2018, 24(4): 63-65. |
| [11] |
陈晓军, 蒋珍藕, 韦洁, 等. 广西莪术70%乙醇洗脱部位对血栓模型大鼠抗血栓作用及机制研究[J]. 中药材, 2018, 41(3): 725-729. |
| [12] |
陈晓军, 韦洁, 蒋珍藕, 等. 广西莪术乙酸乙酯部位的抗血栓作用[J]. 中成药, 2018, 40(6): 1238-1242. |
| [13] |
陈晓军, 韦洁, 农云开, 等. 广西莪术水提取物抗血栓形成作用的实验研究[J]. 中国中医药科技, 2018, 25(4): 495-497. |
| [14] |
梁冰, 覃兰芳, 赖茂祥, 等. 高效液相色谱法测定广西壮药毛郁金中姜黄素的含量[J]. 广西科学, 2012, 19(2): 149-151. DOI:10.3969/j.issn.1005-9164.2012.02.015 |
| [15] |
刘偲翔, 黄艳, 蒋秀珍, 等. 一测多评法测定毛郁金中姜黄素和去甲氧基姜黄素含量[J]. 中国药业, 2019, 28(13): 19-21. DOI:10.3969/j.issn.1006-4931.2019.13.005 |
| [16] |
姜达衢, 濮全龙, 黄平, 等. 桂莪术化学成分的研究[J]. 药学学报, 1989, 24(5): 357-359. DOI:10.3321/j.issn:0513-4870.1989.05.009 |
| [17] |
陈晓军, 韦洁, 苏华, 等. 莪术药理作用的研究新进展[J]. 药学研究, 2018, 37(11): 664-668, 682. |
| [18] |
黄云峰, 徐传贵, 韦贵元. 广西莪术的研究进展[J]. 贵州农业科学, 2020, 48(8): 104-110. DOI:10.3969/j.issn.1001-3601.2020.08.023 |
| [19] |
陈旭, 曾建红, 戴平, 等. 广西莪术挥发油化学成分的分析[J]. 药物生物技术, 2008, 15(4): 293-295. DOI:10.3969/j.issn.1005-8915.2008.04.015 |
| [20] |
WANG J T, GE D, QU H F, et al. Chemical constituents of Curcuma kwangsiensis and their antimigratory activities in RKO cells[J]. Natural Product Research, 2019, 33(24): 3493-3499. DOI:10.1080/14786419.2018.1484463 |
| [21] |
PHAN M G, TRAN T T N, PHAN T S, et al. Guaianolides from Curcuma kwangsiensis[J]. Phytochemistry Letters, 2014, 9: 137-140. DOI:10.1016/j.phytol.2014.05.009 |
| [22] |
YUAN H L, ZHAO Y L, DING C F, et al. Anti-inflammatory and antinociceptive effects of Curcuma kwangsiensis and its bioactive terpenoids in vivo and in vitro[J]. Journal of Ethnopharmacology, 2020, 259: 112935. DOI:10.1016/j.jep.2020.112935 |
| [23] |
朱凯, 李军, 罗桓, 等. 广西莪术化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2009, 26(1): 27-29. |
| [24] |
靳雅惠. 广西莪术高油种质GC-MS分析[J]. 陕西农业科学, 2020, 66(2): 60-62, 66. DOI:10.3969/j.issn.0488-5368.2020.02.014 |
| [25] |
赵应学, 莫莹, 贺兰芝, 等. 4种不同品系广西莪术挥发油的比较[J]. 中国药师, 2020, 23(2): 223-226. DOI:10.3969/j.issn.1008-049X.2020.02.003 |
| [26] |
王建, 赵应学. 不同种质类型广西莪术挥发油成分多样性研究[J]. 药物分析杂志, 2010, 30(6): 1072-1075. |
| [27] |
LI J, LIU Y, LI J Q, et al. Chemical constituents from the rhizomes of Curcuma kwangsiensis[J]. Chinese Journal of Natural Medicines, 2011, 9(5): 329-333. |
| [28] |
LI J, LIAO C R, WEI J Q, et al. Diarylheptanoids from Curcuma kwangsiensis and their inhibitory activity on nitric oxide production in lipopolysaccharide-activated macrophages[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(18): 5363-5369. |
| [29] |
LI J, ZHAO F, LI M Z, et al. Diarylheptanoids from the rhizomes of Curcuma kwangsiensis[J]. Journal of Natural Products, 2010, 73(10): 1667-1671. DOI:10.1021/np100392m |
| [30] |
CHEN S D, GAO J T, LIU J G, et al. Five new diarylheptanoids from the rhizomes of Curcuma kwangsiensis and their antiproliferative activity[J]. Fitoterapia, 2015, 102: 67-73. DOI:10.1016/j.fitote.2015.02.004 |
| [31] |
王柳萍, 梁灿明, 李月儿, 等. 广西莪术化学成分研究[J]. 广西中医药, 2016, 39(2): 78-80. |
| [32] |
雷敩. 雷公炮炙论[M]. 南京: 江苏科学技术出版社, 1985.
|
| [33] |
袁雪芳, 王巧晗, 顾薇, 等. 生、醋莪术对大鼠原发性肝癌模型的治疗作用研究[J]. 时珍国医国药, 2018, 29(7): 1622-1624. |
| [34] |
李慧乐, 莫传伟, 赵春辉, 等. 莪术提取物榄香烯对肝癌H22荷瘤小鼠的抑瘤作用[J]. 中国临床药理学杂志, 2018, 34(11): 1345-1348. |
| [35] |
曹如柔, 周坚, 王其美, 等. 莪术二酮通过VEGF/VEGFR2信号通路对肝癌HepG2细胞微环境下HHSEC增殖的影响[J]. 湖南中医药大学学报, 2021, 41(12): 1835-1839. |
| [36] |
吴皓, 李政, 彭信幸. 莪术醇通过调控PI3K/AKT通路促进人肝癌HepG2细胞凋亡[J]. 中南药学, 2019, 17(1): 11-14. |
| [37] |
黄岚珍, 杨飞城, 阳晶, 等. 莪术醇诱导人肝癌HepG2细胞衰老及其机制研究[J]. 广西植物, 2018, 38(7): 894-902. |
| [38] |
黎桂玉, 林基勇. 莪术醇对肝细胞癌miR-629、miR-24、miR-130a、miR-17的影响[J]. 医学信息, 2022, 35(1): 107-110. |
| [39] |
赵明哲, 刘海英, 张晓玲. 莪术对肺癌大鼠肿瘤抑制作用及对JAK-STAT信号通路的影响[J]. 现代中西医结合杂志, 2020, 29(33): 3658-3661, 3665. |
| [40] |
张琰, 马娜, 王芳, 等. 莪术醇抑制JAK1/STAT3信号通路对肺癌细胞增殖、凋亡和侵袭的影响[J]. 临床医学研究与实践, 2021, 6(34): 10-15. |
| [41] |
周微, 韩景兰, 李太红. 莪术醇对非小细胞肺癌A549细胞侵袭、迁移及上皮间质转化的影响[J]. 中医学报, 2019, 34(8): 1675-1680. |
| [42] |
戴凌虹, 孙云, 陈祥艳. 莪术醇对人卵巢癌SKOV3细胞增殖、迁移、侵袭及凋亡的影响[J]. 温州医科大学学报, 2019, 49(10): 740-743. |
| [43] |
曹知勇, 陈静芹, 吕挺, 等. 莪术油对卵巢癌VEGFA, STAT3, mTOR的调控机制[J]. 中国实验方剂学杂志, 2021, 27(14): 70-80. |
| [44] |
郭芳, 黎莉莉, 臧林泉. 莪术醇通过下调Bcl-2蛋白表达介导抗乳腺癌的机制研究[J]. 中国临床药理学杂志, 2018, 34(10): 1175-1178. |
| [45] |
马春兰, 张宝亮, 张常虹. 莪术醇对乳腺癌细胞增殖凋亡及JAK2/STAT3信号通路的影响[J]. 肿瘤学杂志, 2020, 26(7): 616-620. |
| [46] |
李伟宏, 田莉, 刘俊保. 莪术油对人子宫内膜癌HEC-1-B细胞增殖、凋亡及Caspase-3、Bax、Bcl-2蛋白表达的影响[J]. 河南中医, 2021, 41(3): 384-387. |
| [47] |
王鹏, 赵文兵, 王毅东. 基于PI3K/Akt通路探讨莪术二酮诱导人肾癌ACHN细胞凋亡的实验研究[J]. 中国中医药科技, 2020, 27(2): 196-199. |
| [48] |
江宁, 郭钧, 刘铖, 等. 莪术醇抑制人骨肉瘤细胞系的增殖和促凋亡[J]. 基础医学与临床, 2022, 42(8): 1200-1205. |
| [49] |
谭雪瑛, 田仁富, 潘轲. 莪术醇对人神经母细胞瘤SK-N-SH细胞生长、增殖的影响及机制研究[J]. 脑与神经疾病杂志, 2023, 31(6): 375-381. |
| [50] |
黄开颜, 吕旭阳, 周叙强, 等. 莪术醇下调FoxD2-AS1逆转胶质瘤细胞替莫唑胺化疗耐药的作用研究[J]. 浙江中医药大学学报, 2021, 45(4): 391-397, 419. |
| [51] |
FANG H, GAO B, ZHAO Y, et al. Curdione inhibits thrombin-induced platelet aggregation via regulating the AMP-activated protein kinase-vinculin/talin-integrin αⅡbβ3 sign pathway[J]. Phytomedicine, 2019, 61: 152859. |
| [52] |
范新立, 安菊岩, 黄虹. 莪术提取物对单纯疱疹病毒性脑炎模型小鼠脑血流动力学及氧化应激的作用[J]. 卒中与神经疾病, 2022, 29(6): 497-502. |
| [53] |
王芳, 侯自立, 韩冰, 等. 莪术油对病毒性脑炎小鼠TNF-α、TLR2 mRNA和S100B蛋白表达的影响[J]. 中国现代应用药学, 2019, 36(23): 2919-2922. |
| [54] |
何梅雅, 何志刚. 莪术对胆管结扎致肝纤维化小鼠的影响[J]. 中国临床药理学杂志, 2019, 35(18): 2030-2032. |
| [55] |
郑洋, 邓青梅, 陈豪, 等. 基于PI3K/AKT/mTOR信号通路探讨莪术醇抗肝纤维化的分子机制[J]. 中药药理与临床, 2021, 37(4): 36-40. |
| [56] |
郑洋, 徐灿丽, 卢能源, 等. 基于肝星状细胞自噬和凋亡探讨莪术醇抗肝纤维化的作用机制[J]. 中国中药杂志, 2022, 47(3): 730-736. |
| [57] |
郑洋, 王嘉孺, 刘露露, 等. 基于Toll样受体4/核因子-κB信号通路研究莪术醇抗肝纤维化的分子机制[J]. 临床肝胆病杂志, 2020, 36(7): 1508-1513. |
| [58] |
王佳慧, 郭新华, 郑博文, 等. 基于miR-125b/NLRP3信号通路探讨莪术醇抗肝纤维化的作用机制[J]. 中华中医药学刊, 2022, 40(11): 95-99. |
| [59] |
LIU P, MIAO K, ZHANG L, et al. Curdione ameliorates bleomycin-induced pulmonary fibrosis by repressing TGF-β-induced fibroblast to myofibroblast differentiation[J]. Respiratory Research, 2020, 21(1): 58. |
| [60] |
刘露露, 吕贝贝, 彭岳, 等. 莪术油对血瘀证肝纤维化小鼠TGF-β1、Smad 2、Smad 3表达的影响[J]. 时珍国医国药, 2019, 30(6): 1284-1287. |
| [61] |
顾燕兰, 张雅琴, 孙钢. 莪术醇对大鼠肺纤维化模型的干预作用及对TGF-β1和PAI-1表达的影响[J]. 中医药导报, 2019, 25(10): 27-31. |
| [62] |
聂晓博, 马怡坤, 赵娜, 等. 莪术醇对子宫内膜异位症模型大鼠炎症因子的影响[J]. 天津医药, 2019, 47(9): 913-917. |
| [63] |
赵静, 周江妍, 万腊根. 莪术醇对子宫腺肌症异位子宫内膜间质细胞增殖、凋亡及迁移的影响[J]. 南昌大学学报(医学版), 2019, 59(4): 12-16. |
| [64] |
刘帅, 曹保利. 莪术油对大鼠子宫内膜异位症基质细胞衍生因子-1及其受体表达的影响[J]. 西部中医药, 2018, 31(3): 26-29. |
| [65] |
ZHONG G, CAI X, WEI R, et al. Curcumenol improves renal function in 5/6 nephrectomy-induced chronic renal failure rats via the SIRT1/NF-κB pathway[J]. Anatomical Record, 2023, 306(12): 3189-3198. |
| [66] |
MA Y, WANG P, WU Z, et al. Curdione relieved isoproterenol-induced myocardial damage through inhibiting oxidative stress and apoptosis[J]. The American Journal of Chinese Medicine, 2023, 51(1): 73-89. |
| [67] |
林敬祯, 黄鼎, 谭勇, 等. 中药莪术本草考证[J]. 亚太传统医药, 2023, 19(3): 189-192. |
| [68] |
李泽宇, 曹瑞, 郝二伟, 等. 广西莪术化学成分和药理作用的研究进展及其质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(15): 4687-4699. |
| [69] |
戚爱棣. HPLC法测定姜黄、郁金、广西莪术中姜黄素的含量[J]. 中草药, 2002, 33(6): 510-512. |
| [70] |
林薇, 朱宗萍, 廖婉, 等. 基于熵权-正态云模型的多产地蓬莪术质量评价研究[J]. 中草药, 2021, 52(20): 6373-6380. |
| [71] |
高红宁, 殷奕, 毛春芹, 等. HPLC法测定不同产地醋莪术饮片中姜黄素、双去甲氧基姜黄素和去甲氧基姜黄素的含量[J]. 中国医药科学, 2021, 11(3): 67-70. |
| [72] |
蓝振威, 王绿虹, 李琦婷, 等. 基于GC-MS与化学计量学的不同种莪术特征性挥发油成分分析[J]. 中国中药杂志, 2021, 46(14): 3614-3624. |
| [73] |
覃葆, 江海燕, 刘英丽, 等. 不同产地广西莪术的质量研究[J]. 安徽农业科学, 2011, 39(24): 14602-14603, 14606. |
| [74] |
陈虎彪, 杨全. 800种中草药彩色图鉴[M]. 福州: 福建科学技术出版社, 2020: 450.
|
| [75] |
龚廷贤. 寿世保元[M]. 北京: 中国中医药出版社, 1993: 419.
|
| [76] |
赵兰亭. 救伤秘旨[M]. 上海: 上海科学技术出版社, 1958: 46.
|
| [77] |
国家中医药管理局. 中华本草[M]. 上海: 上海科学技术出版社, 1999: 7765.
|
| [78] |
黄燮才. 妇科病中草药识别与应用[M]. 南宁: 广西科学技术出版社, 2017: 131.
|
| [79] |
黄杰之, 黄绍琪. 实用壮药手册[M]. 南宁: 广西科学技术出版社, 2017: 41.
|
| [80] |
胡永盛. 民间偏方奇效方[M]. 长春: 吉林科学技术出版社, 2016: 140.
|
| [81] |
曾礼仁. 腋裘集: 中医验案选[M]. 北京: 中医古籍出版社, 2016: 220-221.
|
| [82] |
张俊庭. 中国中医特治新法大全[M]. 北京: 中国中医药出版社, 1996: 751.
|
| [83] |
薛天奎. 中医临床方剂[M]. 天津: 天津科学技术出版社, 2021: 312.
|
| [84] |
吴钢. 类经证治本草[M]. 北京: 中国中医药出版社, 2016: 161.
|
| [85] |
孙溥泉. 中国历代长寿方精选[M]. 北京: 中国中医药出版社, 2015: 282.
|
| [86] |
宋兆友. 皮肤病中药内用制剂[M]. 北京: 中国中医药出版社, 2015: 70.
|
| [87] |
蒋薇, 贾文洁. 复方莪术油栓治疗宫颈糜烂的临床观察[J]. 中国疗养医学, 2010, 19(6): 541-542. |
| [88] |
郗超, 张茂新. 莪术消癥丸治疗乳腺增生病36例临床观察[J]. 吉林医学, 2010, 31(24): 4101-4102. |
| [89] |
柴惠玲. 改良少腹逐瘀汤治疗慢性盆腔炎65例临床观察[J]. 实用医技杂志, 2009, 16(10): 816. |
| [90] |
李建民. 三棱莪术汤治疗冠心病稳定型心绞痛临床观察[J]. 天津中医药, 2007, 24(6): 470-471. |
| [91] |
刘惠斌, 赵海军, 李炳禄. 莪术油注射液配合腹腔镜治疗单纯性粘连性肠梗阻63例临床观察[J]. 河北中医, 2015, 37(9): 1391-1392. |
| [92] |
魏学琴, 张善云, 刘西, 等. 莪术油治疗小儿秋季腹泻46例临床观察[J]. 四川医学, 2006, 27(2): 198. |
| [93] |
李敏, 夏琴, 杨昭武, 等. 蓬莪术新品种'川蓬1号'[J]. 园艺学报, 2015, 42(7): 1425-1426. |
| [94] |
何金晓, 陶玲, 殷莉丽, 等. 蓬莪术新品种"川蓬2号" 的选育研究[J]. 中药材, 2018, 41(3): 509-513. |
| [95] |
杨妮, 苏伟敏, 莫明月, 等. 优良广西莪术株系筛选及其挥发油成分比较[J]. 江苏农业科学, 2015, 43(9): 283-285. |
| [96] |
吴庆华, 黄宝优. 广西莪术栽培研究概述[J]. 现代中药研究与实践, 2018, 32(6): 83-86. |
| [97] |
程若敏, 胡晓玲, 周改莲, 等. 采挖期内不同月份对广西桂莪术挥发油的影响[J]. 海峡药学, 2017, 29(7): 27-29. |
| [98] |
胡晓玲, 李健, 赖国校, 等. 不同炮制方法对广西莪术挥发油的影响[J]. 时珍国医国药, 2017, 28(9): 2139-2142. |
| [99] |
陈琪瑶. 温莪术产地加工与炮制生产一体化关键技术研究[D]. 武汉: 湖北中医药大学, 2017.
|



