美花石斛(Dendrobium loddigesii),又称粉花石斛、环草石斛,为兰科(Orchidaceae)石斛属(Dendrobium)多年生附生草本植物,以新鲜或干燥茎入药,在中国传统药用石斛应用中具有悠久的历史,其加工品在中国台湾、香港以及东南亚等地享有很高的声誉[1]。多糖类成分是美花石斛中的主要成分,现代药理学研究证明其具有抗肿瘤、增强免疫力的作用[2-4]。美花石斛广泛分布在我国两广地区、海南、云南南部、贵州西南部,历史上又以我国贵州省兴义市所产美花石斛质量优、产量高,但由于长期不合理的采收利用,加之喀斯特地貌的环境变化,导致其野生资源濒临枯竭[5],1987年被列为中国三级珍稀濒危保护植物,2021年被列为国家二级重点保护野生植物[6]。美花石斛的种子中不含胚乳,球状原胚直接被一层透明种皮包裹,自然状态下种子因缺乏营养物质难以萌发,繁殖率极低,与其他药用石斛种类相比,植株生长更加缓慢,更新恢复周期长,野生资源分布稀少[1]。通过多年的试验研究,虽然现已经成功培育出美花石斛试管苗[7-9],但是还存在着试管苗的数量、质量难以保证和移栽成活率低等问题[10],因此保护野生资源,加强美花石斛人工栽培技术的研究非常迫切[11],如何提高美花石斛试管苗质量仍需深入研究。
光照是植物组织培养的关键因素,光照强度对组培植物的形态、光合作用、内源激素及叶片结构具有显著影响[12, 13]。研究表明,不同强度的光照能通过调节不同类型的、与光合作用有关的叶绿体蛋白质复合物的形成,以及光系统Ⅰ(PSⅠ)和光系统Ⅱ (PSⅡ)间的电子传递来影响植株的生长[14, 15]。植物所表现出的生长现象、发育规律和生理生化特性是遗传基因和环境因子共同作用的结果[11, 16],植物对不同调控措施所做出的形态和生理等反应会决定生产目标的数量和质量。国内外已有学者对不同光照处理的菊花(Chrysanthemum morifolium)[17]、文心兰(Oncidium flexuosum)[13]、黄瓜(Cucumis sativus)[18]、番茄(Solanum lycopersicum)[19]和金娃娃萱草(Hemerocallis fulva ‘Golden Dolli’)[20]等进行研究,并取得初步成果,但有关光照强度对美花石斛试管苗生理生化特性影响的研究尚未见报道。本文通过研究不同光照强度处理下美花石斛试管苗的生长发育、多糖含量、光合特性和荧光特性等变化,探索美花石斛试管苗对光照强度的需求特性,为美花石斛优质种苗培育提供参考。
1 材料与方法 1.1 材料成熟的美花石斛种子由贵州吉仁堂药业公司提供。种子经消毒后,在无菌条件下播种于种子萌发生长培养基[MS+0.2 mg/L萘乙酸(NAA)+3%白砂糖+15%马铃薯提取液+0.8%琼脂粉,pH值为5.8]表面,萌发生长2个月后,将其转接到分化生长培养基上(MS+0.5 mg/L NAA+3%白砂糖+20%马铃薯提取液+0.8%琼脂粉,pH值为5.8),培养条件均为光照强度18 μmol·m-2·s-1,光照时间12 h/d,温度为(25±2) ℃[21]。2个月后,选苗高约0.5 cm,长有1-2片真叶、1-2条短根的试管苗转接至生根壮苗培养基(MS+0.5 mg/L NAA+3%白砂糖+20%马铃薯提取液+0.8%琼脂粉,pH值为5.8)。分别设置18 μmol·m-2·s-1(G1)、36 μmol·m-2·s-1(G2)、54 μmol·m-2·s-1(G3)的光照强度处理试管苗,光照时间12 h/d,温度为(25±2) ℃。接种玻璃瓶规格为直径7 cm,高9 cm,接种密度10株/瓶,每处理接种20瓶。光照处理2个月(播种生长6个月)和光照处理4个月(播种生长8个月)时分别取样,测定美花石斛试管苗生长指标、多糖含量、光合特性和荧光特性指标。
1.2 方法 1.2.1 生长指标的测定光照处理2个月和光照处理4个月时分别取样,每处理随机抽取10瓶,再从中随机取30株,用直尺测定株高和根长,用游标卡尺测量根与茎连接处的茎粗,并将鲜样品置于50 ℃烘箱烘至恒重后用电子天平称重。
1.2.2 多糖含量的测定采用苯酚-硫酸法测定多糖含量[22]。
1.2.3 叶绿素含量的测定称取0.5 g叶片,将其浸泡在12 mL 80%丙酮溶剂中,一定时间(约4 d,以叶片变白为宜)后用瑞士Kontron公司生产的UV810/812型紫外可见分光光度计,分别测定645 nm和663 nm处的吸收值,计算出叶绿素a、b的含量以及总含量[23]。每处理重复测定3株,每株3个叶片,计算平均值。
1.2.4 表观光合速率的测定参照Xu等[24]的方法并加以修改。采用英国Hansatech公司生产的Oxy-Lab氧电极自动测定系统测定,反应体积为2 mL,反应介质为100 mmol/L磷酸缓冲液、20 mmol/L NaHCO3,测定时每2 mL反应介质加入0.05 g叶片。当光照强度为300 μmol·m-2·s-1时,测定反应液中O2浓度的变化,单位时间内每克叶片的反应液中O2变化的摩尔数,即为表观光合速率。每处理重复测定3株,每株3个叶片,计算平均值。
1.2.5 叶绿素荧光参数的测定选择光照处理2个月和光照处理4个月为测定时间点,于上午9:00-11:30进行测定。选取从上往下数完全展开的第1片叶。每处理重复测定3株,每株3片叶,计算平均值。所用仪器为德国Heinz Walz GmbH公司生产的PAM-2100脉冲调制式荧光仪,在室温下进行荧光动力学曲线的测定。将叶片暗适应20 min,在弱调制测量光(650 nm,脉冲光时间0.8 s,0.1 μmol·m-2·s-1)下诱导产生初始荧光Fo,随后用强饱和脉冲光(650 nm,脉冲光时间0.8 s,8 000 μmol·m-2·s-1)激发产生最大荧光Fm。当荧光从Fm降低至Fo水平时,用光化光(665 nm,脉冲光时间10 s,600 μmol·m-2·s-1)诱导美花石斛生成荧光动力学曲线,进行荧光参数测定。在测定过程中光化光-饱和脉冲光-远红光-黑暗交替作用,测定光适应下的稳态荧光Fs、最大荧光Fm′、最小荧光Fo′等参数,进而计算出PSⅡ的最大光化学效率Fv/Fm=(Fm-Fo)/Fm,PSⅡ的实际光化学量子效率Y(Ⅱ)=ΔF/Fm′=(Fm′-Fs)/Fm′,光化学猝灭系数qP=(Fm′-Fs)/(Fm′-Fo′),非光化学猝灭系数qN=1-(Fm′-Fo′)/(Fm-Fo)。在完成荧光诱导曲线测定后,立即进行光合电子传递速率(ETR)-光化光(PAR)荧光光响应曲线的测定,测定过程与诱导生成荧光动力学曲线测定过程基本相同,有所不同的是PAR强度从11 μmol·m-2·s-1依次增加到483 μmol·m-2·s-1,每个强度的PAR持续时间为10 s,最后通过所得的各个荧光参数,利用公式ETR=Y(Ⅱ)×PAR×0.5×0.84计算出光合电子传递速率ETR。
1.2.6 数据处理使用GraphPad Prism 9软件进行数据整理和制图,采用SPSS 17.0统计软件对试验数据进行分析。
2 结果与分析 2.1 光照强度对美花石斛试管苗生长发育的影响由表 1可知,随着光照强度增大,光照处理2个月的试管苗苗高、叶片数、根长、茎叶干重及多糖含量均显著增大,而光照处理4个月的试管苗除叶片数和根长外,其余各指标均随着光照强度增大而显著增加。
| 处理时间 Proce-ssing time |
处理编号 Proce-ssing number |
苗高/cm Seedling height/cm |
茎粗/cm Stem thick-ness/cm |
叶片数/(片·株- 1) Number of blades/(Leaf·plant-1) |
根数/(条·株- 1) Root number/(Strip·plant-1) |
根长/cm Root length/cm |
茎叶干重/(mg·株- 1) Stem and leaf dry weight/(mg·plant-1) |
根干重/(mg·株- 1) Root dry weight/(mg·plant-1) |
多糖含量/% Polysa-ccharide content/% |
| Two months | G1 | 3.13±0.12c | 0.17±0.02b | 4.00±0.20c | 1.80±0.09b | 2.54±0.12c | 2.17±0.06c | 0.38±0.03b | 2.36±0.06c |
| G2 | 3.74±0.21b | 0.16±0.02b | 4.17±0.29b | 1.90±0.05a | 3.13±0.21a | 2.74±0.12b | 0.47±0.05a | 2.64±0.14b | |
| G3 | 3.82±0.15a | 0.20±0.01a | 4.93±0.12a | 1.80±0.02b | 2.85±0.05b | 3.72±0.14a | 0.47±0.04a | 3.12±0.10a | |
| Four months | G1 | 3.89±0.05c | 0.21±0.02c | 4.50±0.30b | 3.90±0.10c | 2.48±0.13b | 14.33±0.77c | 3.44±0.05c | 2.71±0.05c |
| G2 | 4.14±0.07b | 0.24±0.02b | 5.00±0.00a | 4.30±0.26b | 3.17±0.15a | 15.94±0.31b | 3.87±0.06b | 3.28±0.07b | |
| G3 | 4.22±0.03a | 0.26±0.01a | 4.80±0.20a | 4.60±0.15a | 3.24±0.10a | 17.71±1.03a | 4.45±0.07a | 3.66±0.34a | |
| Note:significant differences were denoted by different letters; determined using one-way ANOVA with Newman-Keuls′ test (P<0.05). | |||||||||
2.2 光照强度对美花石斛试管苗光合特性的影响 2.2.1 光照强度对美花石斛试管苗叶绿素含量的影响
由图 1可知,光照处理2个月时,试管苗的叶绿素总含量随着光照强度的增大而减弱;不同光照强度处理间,叶绿素a/b的值均在2.0-2.1范围内浮动,变化较小。光照处理4个月时,G2、G3处理的试管苗叶绿素总含量较高,分别为25.7 μg·g-1和23.0 μg·g-1,与G1处理(16.8 μg·g-1)相比差异显著;不同光照强度处理间,叶绿素a/b的值均在2.0-2.5范围内,且G1、G2处理的叶绿素a/b的值显著高于G3处理。光照处理2个月时,中、低光照强度处理的试管苗叶绿素总含量高于高光照强度处理的试管苗;光照处理4个月时,中、高光照强度处理的试管苗叶绿素总含量高于低光照强度处理。随着试管苗生长时间的延长,各处理间叶绿素a/b比值的差异增大,光照处理4个月试管苗的叶绿素a/b比值均高于对应光照强度处理2个月试管苗的水平。

|
| Significant differences were denoted by different letters. 图 1 光照强度对美花石斛试管苗叶绿素总含量及叶绿素a/b的值的影响 Fig. 1 Effect of light intensity on chlorophyll content and chlorophyll a/b of D.loddigesii in vitro |
2.2.2 光照强度对美花石斛试管苗表观光合速率的影响
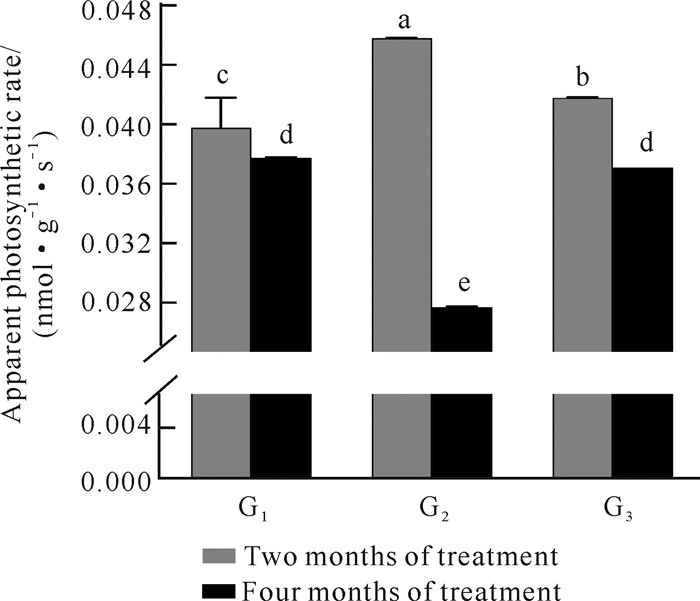
由图 2可知,3种光照强度条件下,处理2个月试管苗的表观光合速率均比处理4个月试管苗的高。光照处理2个月时,各处理间的表观光合速率差异显著,并随着光照强度增大表现出先升高再降低的趋势,其中G2处理的表观光合速率最大,为0.045 9 nmol·g-1·s-1。光照处理4个月时,3种光照强度下试管苗的表观光合速率值的变化情况与光照处理2个月时的相反,以G2处理的表观光合速率值最低,而G1与G3处理的表观光合速率较为接近。上述结果说明不同光照强度下,美花石斛试管苗的光合能力不相同,且不同发育时期的试管苗对光照强度的适应性也有所不同。
|
| Significant differences were denoted by different letters. 图 2 光照强度对美花石斛试管苗表观光合速率的影响 Fig. 2 Effect of light intensity on the apparent photosynthetic rate of D.loddigesii in vitro |
2.3 光照强度对美花石斛试管苗荧光特性的影响
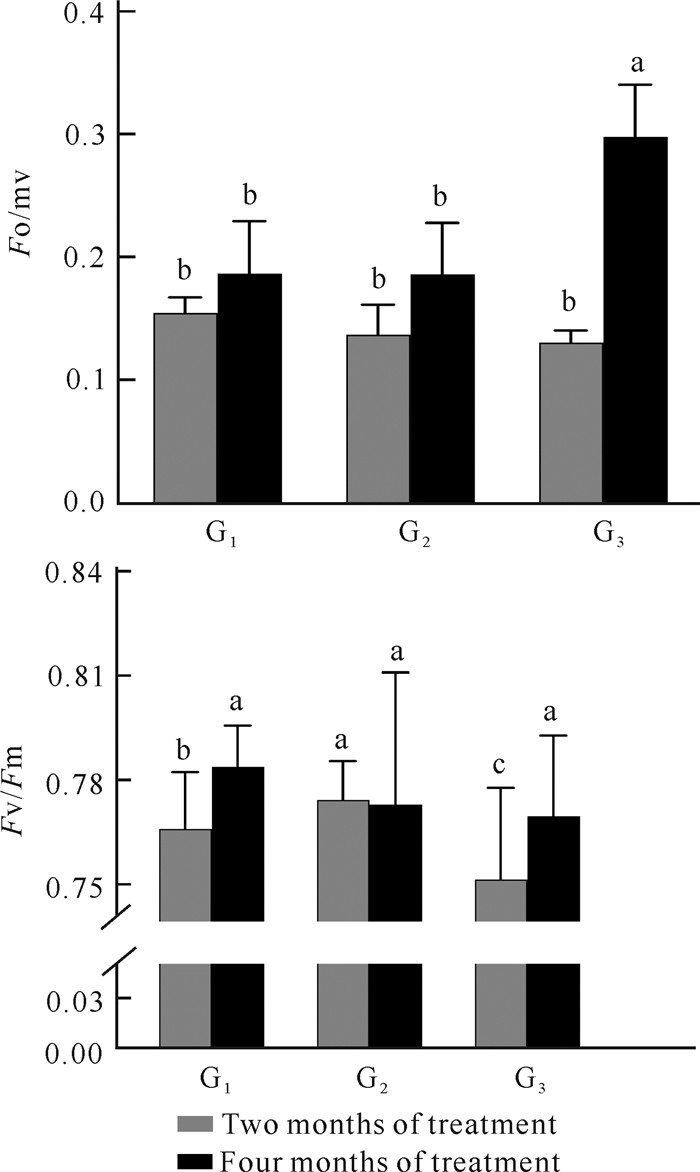
由图 3可知,3种光照强度条件下,光照处理2个月试管苗的Fo在各处理间差异不显著;而PSⅡ的Fv/Fm以G2处理最高,G3处理最低,各处理间差异显著。光照处理4个月,G1、G2处理试管苗的Fo与G3处理差异较大,而PSⅡ的Fv/Fm以G1处理较高,但各处理间差异不显著。从Fo、Fv/Fm的变化情况来看,不同生长发育时期,美花石斛试管苗对3种强度的光照的响应不同。
|
| Significant differences were denoted by different letters. 图 3 光照强度对美花石斛试管苗荧光参数Fo、Fv/Fm的影响 Fig. 3 Effect of light intensity on fluorescence parameters (Fo, Fv/Fm) of D.loddigesii in vitro |
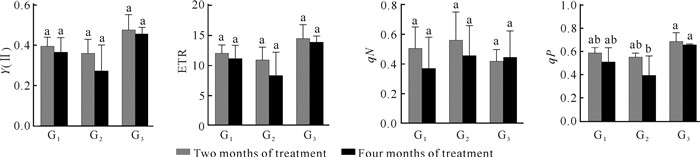
从图 4可知,3种光照强度条件下,光照处理2个月和处理4个月试管苗的Y(Ⅱ)和ETR均以G3处理最高,且处理2个月的Y(Ⅱ) 和ETR均高于对应光照强度下处理4个月的。光照处理2个月和处理4个月试管苗的qN均以G2处理最高,但光照处理2个月的以G3处理最低,光照处理4个月的以G1处理最低。光照处理2个月和处理4个月试管苗qP均以G3处理最高。不同光照和处理时间下的Y(Ⅱ)和ETR的结果表明,G3处理的光照有利于PSⅡ实际光化学量子效率和非环式电子传递速率的提高,而这两个参数是由Fv/Fm和碳循环速率共同决定的,表明随着不同光照的光照强度和处理时间的增加,在所发生的、实际光化学量子效率提高这个过程中,碳循环的变化可能起主导作用。另外,qN的变化情况可反映两个时期美花石斛试管苗热耗散的变化,G2处理的光照对播种生长6个月试管苗的热耗散系统的建立较为有利,而G2和G3处理的光照对播种生长8个月试管苗热耗散系统的建立较为有利。qP的变化结果与Y(Ⅱ)的结果相似,表明G3处理的光照有利于PSⅡ反应中心将光能转化为电势能。
|
| 图 4 光照强度对美花石斛试管苗荧光参数Y(Ⅱ)、ETR、qN和qP的影响 Fig. 4 Effect of light intensity on fluorescence parameters [Y(Ⅱ), ETR, qN and qP] of D.loddigesii in vitro |
3 讨论
美花石斛试管苗移栽初期,是从无菌、温度和光照强度恒定、湿度饱和的环境向有菌的、不稳定的自然环境过渡,因此,在移栽前对其进行壮苗培养尤为重要。故本研究设计的时间点选择在美花石斛转移到生根壮苗培养基上开始,以分析不同光照强度对美花石斛根上部生长的影响并探讨碳同化作用。
光照强度直接影响植物的光合作用,进而影响植物的生长发育。较低光照强度会影响试管苗对培养基中氮素和磷素的吸收[25],同时影响叶片的气孔发育[26],进而影响光合速率。在前期实地调查中发现,生产中组培室内美花石斛试管苗壮苗培养光照强度在27 μmol·m-2·s-1左右,但此壮苗培养条件下美花石斛试管苗生长发育状况差,故本研究设置18-54 μmol·m-2·s-1的梯度变化来考察光照强度对美花石斛试管苗生长的影响。光合色素能够吸收、传递和转化光能,是植物进行光合作用的物质基础[20],叶绿素的含量、比例是植物适应环境和利用环境资源的重要指标,叶绿素总含量高、叶绿素a/b的值小的植物具有较强的耐阴性。本研究结果表明,随着光照强度加大和培养时间延长,G3处理的美花石斛试管苗的生长量如苗高、茎粗等,生物量积累如茎叶干重、根干重和多糖含量等均高于G1处理。不同生长时期、不同光照强度下美花石斛试管苗的叶绿素a/b的值均小于3,这符合阴生植物的特性[27]。随着光照强度处理时间延长,美花石斛试管苗叶片叶绿素a/b的比值逐渐增大;光照处理2个月时,G1处理的光照比G2、G3处理的更有利于试管苗叶绿素的合成,而光照处理4个月时,G2处理的光照强度更有利于试管苗叶绿素的合成。根据课题组前期研究基础,从美花石斛试管苗的气孔发育考虑,可能与18 μmol·m-2·s-1的光照强度阻碍了美花石斛的试管苗气孔发育有关[28],即18 μmol·m-2·s-1的光照强度下,生长前期的美花石斛试管苗已受弱光胁迫,当时该光照强度虽然能短暂满足该阶段试管苗的光合能力需求,但是随着处理时间的增加,其未正常发育的气孔便会影响后期试管苗的光合能力。
Krause等[29]研究表明,Fo来自叶绿素a,即在正常情况下,一定范围内Fo的大小与叶绿素a的含量呈正相关。随着光照处理时间延长,处理4个月时G1、G2处理的Fo与G3处理之间差异显著。随着光照处理时间从2个月到4个月,各处理间的PSⅡ最大光化学效率差异从显著变为不显著,这表明美花石斛试管苗的PSⅡ最大光化学效率在发育初期对光照的反应比较敏感,一旦光反应系统形态建成后,其受光照调节的幅度逐渐减小。从Fv/Fm的变化结果来看,播种生长6个月时36 μmol·m-2·s-1的光照强度有利于试管苗PSⅡ最大光化学效率的提高。随着光照处理时间延长,试管苗的Y(Ⅱ)、ETR和qP值逐渐减小,但2次取样均以G3最高;qP的变化结果与Y(Ⅱ)的结果相似,表明G3处理的光照有利于PSⅡ反应中心将光能转化为电势能;qN的变化进一步反映两个时期美花石斛试管苗对不同强度的光照的响应不同,G2处理的光照有利于播种生长6个月试管苗热耗散系统的建立。综合荧光参数的变化,36 μmol·m-2·s-1光照强度有利于播种生长6个月试管苗PSⅡ最大光化学效率的提高和热耗散能力的增强。播种生长8个月时的试管苗的qP值以54 μmol·m-2·s-1的光照强度处理下最高,这表明该光照强度有利于PSⅡ反应中心将光能向电势能转化。考虑植物呼吸速率和荧光相关参数对光反应系统的影响,即54 μmol·m-2·s-1的光照强度处理下的试管苗的表观光合速率显著高于36 μmol·m-2·s-1光照强度处理下的试管苗,且Fo比36、18 μmol·m-2·s-1光照强度下高,这表明54 μmol·m-2·s-1的光照强度更有利于播种生长8个月的美花石斛试管苗光反应系统的完善。qN在G2、G3处理下都较高,且测定值较为接近,表明36、54 μmol·m-2·s-1光照强度对8个月试管苗的热耗散系统的建立都很有利。考虑植物呼吸速率对热耗散系统的影响,即54 μmol·m-2·s-1光照强度处理下的试管苗的表观光合速率显著高于36 μmol·m-2·s-1下的试管苗,认为54 μmol·m-2·s-1的光照强度更有利于播种生长8个月的美花石斛试管苗热耗散系统的能力增强。由于条件限制,本研究所设置的光照强度梯度有限,在G3与G2处理条件下所测得的美花石斛部分叶绿素荧光参数差异不显著,是否更大的光照强度会显著影响美花石斛试管苗的光合作用参数,还需后续进一步研究。
4 结论光照强度对美花石斛试管苗的生长发育,尤其是光系统建成具有重要影响。在不同的生长发育时期美花石斛试管苗对光照强度的需求不同,随着生长时间的延长其对光照强度的要求有所增大。培育过程中可根据试管苗的生长节律适度进行光照强度的调节,以促进优质壮苗的培育。
| [1] |
冉懋雄. 名贵中药材绿色栽培技术: 石斛[M]. 北京: 科学技术文献出版社, 2002: 28-33.
|
| [2] |
曾宇馨, 张悦, 祝天添, 等. 美花石斛和铁皮石斛试管苗物质含量比较[J]. 中国现代中药, 2020, 22(4): 577-584. |
| [3] |
王莎, 杜致辉, 陈之林. 基于GC-MS代谢组学技术2种香型美花石斛代谢物的对比分析[J]. 分子植物育种, 2021, 19(9): 3081-3089. |
| [4] |
MA R J, YANG L, BAI X, et al. Phenolic constituents with antioxidative, tyrosinase inhibitory and anti-aging activities from Dendrobium loddigesii Rolfe[J]. Natural Products and Bioprospecting, 2019, 9(5): 329-336. DOI:10.1007/s13659-019-00219-y |
| [5] |
白音, 包英华, 金家兴, 等. 我国药用石斛资源调查研究[J]. 中草药, 2006, 37(9): 1440-1442. |
| [6] |
国家林业和草原局农业农村部. 国家林业和草原局农业农村部公告(2021年第15号): 国家重点保护野生植物名录[EB/OL]. (2021-09-08)[2023-03-02]. https://www.forestry.gov.cn/main/3457/20210915/143259505655181.html?eqid=c377f719000806fe0000000464685c13.
|
| [7] |
LÀINN T, SƠNP H, HẢIV M, et al. Nghiên cứu nhân giống lan Hoàng thảo Nghệ tâm (Dendrobium loddigesii Rolfe) bằng phương pháp nuôi cấy lát mỏng tế bào[J]. Bản B của Tạp chí K hoa học và Công nghệ Việt Nam, 2018, 60(5): T.60 S.5. |
| [8] |
卢文芸, 张宇斌, 唐金刚, 等. 环草石斛(D.loddigesii Rolfe.)快速繁殖研究[J]. 贵州师范大学学报(自然科学版), 2004, 22(4): 15-18. |
| [9] |
乙引, 张宇斌. 粉花石斛的组织培养和植株再生[J]. 植物生理学通讯, 2004, 40(1): 64. |
| [10] |
LIANG Z S, LIU W T. A study on the cultivation of Danshen[M]//YAN X J. Dan Shen (Salvia miltiorrhiza) in medicine. Dordrecht: Springer, 2014: 49-68.
|
| [11] |
VICKERS M H, BREIER B H, MCCARTHY D, et al. Sedentary behavior during postnatal life is determined by the prenatal environment and exacerbated by postnatal hypercaloric nutrition[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2003, 285(1): R271-R273. DOI:10.1152/ajpregu.00051.2003 |
| [12] |
LIAN M L, MURTHY H N, PAEK K Y. Effects of light emitting diodes (LEDs) on the in vitro induction and growth of bulblets of Lilium oriental hybrid 'Pesaro'[J]. Scientia Horticulturae, 2002, 94(3/4): 365-370. |
| [13] |
SHIN K S, MURTHY H N, HEO J W, et al. The eff-ect of light quality on the growth and development of in vitro cultured Doritaenopsis plants[J]. Acta Physiologiae Plantarum, 2008, 30(3): 339-343. DOI:10.1007/s11738-007-0128-0 |
| [14] |
KIM J H, GLICK R E, MELIS A. Dynamics of photosystem stoichiometry adjustment by light quality in chloroplasts[J]. Plant Physiology, 1993, 102(1): 181-190. DOI:10.1104/pp.102.1.181 |
| [15] |
PATIL G G, OI R, GISSINGER A, et al. Plant morphology is affected by light quality selective plastic films andalternating day and night temperature[J]. Gartenbauwissenschaft, 2001, 66(2): 53-60. |
| [16] |
HIRSCHHORN J N, LOHMUELLER K, BYRNE E, et al. A comprehensive review of genetic association studies[J]. Genetics in Medicine, 2002, 4(2): 45-61. DOI:10.1097/00125817-200203000-00002 |
| [17] |
张欢, 徐志刚, 崔瑾, 等. 不同光谱能量分布对菊花试管苗增殖及生根的影响[J]. 园艺学报, 2010, 37(10): 1629-1636. |
| [18] |
徐文栋, 刘晓英, 焦学磊, 等. 不同红蓝配比的LED光调控黄瓜幼苗的生长[J]. 植物生理学报, 2015, 51(8): 1273-1279. |
| [19] |
FAN X X, XU Z G, LIU X Y, et al. Effects of light intensity on the growth and leaf development of young tomato plants grown under a combination of red and blue light[J]. Scientia Horticulturae, 2013, 153: 50-55. DOI:10.1016/j.scienta.2013.01.017 |
| [20] |
尚文倩, 王政, 何松林, 等. 不同红蓝光质比和光照强度对金娃娃萱草试管苗生长的影响[J]. 西北农林科技大学学报(自然科学版), 2017, 45(7): 90-96. |
| [21] |
孙志蓉, 陈明颖, 王美云, 等. 环草石斛试管苗生长节律及分级标准研究[J]. 中草药, 2009, 40(3): 443-447. |
| [22] |
李满飞, 徐国钧, 平田义正, 等. 中药石斛类多糖的含量测定[J]. 中草药, 1990, 21(10): 10-12, 46. |
| [23] |
SUN Z R, ZHU N N, CHENG L L, et al. Comparison of photosynthesis and fluorescent parameters between Dendrobium officinale and Dendrobium loddigesii[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(8): 13163-13170. |
| [24] |
XU Q, JUNG Y S, CHITNIS V P, et al. Mutational analysis of photosystem Ⅰ polypeptides in Synechocystis sp.PCC 6803.Subunit requirements for reduction of NADP+ mediated by ferredoxin and flavodoxin[J]. Journal of Biological Chemistry, 1994, 269(34): 21512-21518. DOI:10.1016/S0021-9258(17)31834-3 |
| [25] |
KERBAUY G B, TAKAHASHI C A, LOPEZ A M, et al. Crassulacean acid metabolism in epiphytic orchids: current knowledge, future perspectives[M/OL]//NAJAFPOUR M M. Applied photosynthesis. IntechOpen Rijeka, Croacia, 2012: 81-104. http://dx.doi.org/10.5772/2444.
|
| [26] |
孙志蓉, 王美云, 张宏桂, 等. 环草石斛和铁皮石斛试管苗叶片气孔特征比较(英文)[J]. Agricultural Science & Technology, 2011, 12(8): 1161-1165. |
| [27] |
李玲, 贾书华, 金青, 等. 光对霍山石斛试管苗光合特性、生长及有效成分积累的影响[J]. 植物生理学报, 2014, 50(7): 989-994. |
| [28] |
ZHANG Z, HE D, NIU G, et al. Concomitant CAM and C3 photosynthetic pathways in Dendrobium officinale plants[J]. Journal of the American Society for Horticultural Science, 2014, 139(3): 290-298. DOI:10.21273/JASHS.139.3.290 |
| [29] |
KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |



