2. 广西科学院, 广西海洋科学院(广西红树林研究中心), 广西近海海洋环境重点实验室, 广西南宁 530007;
3. 北部湾海洋产业研究院, 广西防城港 538000;
4. 广西大学海洋学院, 广西南宁 530004
2. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Marine Sciences (Guangxi Mangrove Research Center), Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. Beibu Gulf Marine Industry Research Institute, Fangchenggang, Guangxi, 538000, China;
4. College of Oceanology, Guangxi University, Nanning, Guangxi, 530004, China
有害藻华(Harmful Algal Blooms,HABs)是在特定环境条件下,海水中的藻类快速增殖或聚集形成的生态异常现象。球形棕囊藻(Phaeocystis globosa)是全球海洋广泛分布的有害藻华原因种,多年来以其独特的形态特征和复杂的异型生活史被世人关注[1],一直是国际上有害藻华研究的热点之一。近年来,广西北部湾近海富营养化态势日趋显现[2, 3],球形棕囊藻藻华频繁暴发,而且暴发的规模和持续时间都明显增加[4]。调查结果显示,自2008年以来,广西北部湾海域多数点位氮磷比常年大于Redfield比值,处于磷限制状态[5],与广西北部湾海域出现球形棕囊藻的时间点一致[6]。研究表明海洋水体中氮磷比过高是导致球形棕囊藻藻华频繁暴发的重要环境因素[7],不同营养盐比例限制对球形棕囊藻的生长影响不同[8, 9]。此外,球形棕囊藻藻华频繁暴发还与它的生理生化特性有关[10]。球形棕囊藻具有复杂的异型生活史,包含单细胞和群体细胞两种不同的生活形态。两种生活形态具有不同的生理生态特征[7]。根据染色体倍性,球形棕囊藻分为只有游离单细胞形态的单倍体和以群体细胞形态为优势的二倍体[11, 12]。研究发现单倍体细胞和二倍体细胞在生长率和营养盐利用方面存在明显差别[13]。
球形棕囊藻的群体细胞形态表现为具有囊体结构[14]。球形棕囊藻囊体形态和结构被认为是其保持生存竞争优势的原因[10, 15]。二倍体囊体形态是由细胞分泌的黏性胶凝结形成,其主要成分为胞外多糖(Extracellular Polysaccharide,EPS)[16]。在群体细胞形成过程中胞外多糖的分泌可能起到关键作用[10]。关于营养盐对微囊藻生长及多糖产量的影响,国内已有大量研究报道。许铭本[11]研究了营养盐胁迫对球形棕囊藻囊体形成和多糖产量的影响,孙梦家[17]研究发现氮、磷限制对同一种微囊藻的群体和单细胞生长及胞外多糖合成的影响均不同。但上述研究都没有比较不同形态细胞之间的多糖产量差异,微囊藻在胁迫环境下的能量分配及生存策略并不清晰。对不同倍性球形棕囊藻在营养盐胁迫环境下的多糖产量差异及能量分配策略进行研究,有助于认识球形棕囊藻复杂异型生活史中不同生活形态细胞的转换机制。
浮游植物产生的胞外多糖是水体中透明胞外聚合颗粒物(Transparent Exopolymer Particles,TEP)的主要来源[18, 19]。由于TEP呈现透明或半透明的生理状态,很多研究者认为它大量存在于海洋中,但无法定量描述,所以常常被人们忽视[20]。TEP是介于溶解有机物和颗粒有机物的中间形态[21],可促进溶解有机物或小颗粒物形成凝聚体,加快有害藻华后期固体颗粒、微生物和浮游植物的凝聚沉降过程[18]。浮游植物产生TEP的能力受其生长环境条件制约。Mari等[19]研究发现营养盐是影响TEP释放的关键因子,球形棕囊藻藻华释放TEP的过程受磷限制的影响较大。Pedrotti等[22]的研究结果显示TEP体积随营养剂量的增加而增加。近年来国内有关球形棕囊藻TEP释放的研究较少。郭康丽等[23]对两种海洋硅藻TEP释放进行比较,发现TEP的产生具有种间差异性。薛思佑等[24]和郭聪聪[25]对不同海洋区域TEP分布研究做了补充。营养盐胁迫环境对北部湾球形棕囊藻不同形态细胞的TEP释放和应激响应尚未见报道。
本研究通过对不同形态的球形棕囊藻单倍体和二倍体细胞进行氮、磷限制培养试验,比较其细胞生长变化、生长期内多糖含量和TEP释放差异,探究北部湾球形棕囊藻在营养胁迫环境下的应激响应及能量分配策略,从一个新的视角阐明球形棕囊藻的生态适应机制,为球形棕囊藻藻华形成和消亡过程以及灾害防治提供理论依据。
1 材料与方法 1.1 藻种培养及试验设计球形棕囊藻单倍体(Haploid)和二倍体(Diploid)细胞由广西科学院广西海洋科学院(广西红树林研究中心)藻种室提供, 试验全部采用盐度为30的人工海水,经0.45 μm混合纤维膜过滤后于高温灭菌锅中121 ℃灭菌30 min,室温下冷却后备用。在光照强度为50 μmol·m-2·s-1,光暗比为12 h∶12 h,温度为20 ℃的培养条件下,将不同倍性球形棕囊藻细胞在f/10培养基中进行扩种及驯化培养。驯化2-3个世代周期后的藻细胞用于正式培养试验。
取对数生长期的藻细胞进行接种前处理。将单倍体藻液缓慢摇匀,经10 μm筛绢自然滤除细胞杂质,收集单细胞用于单倍体接种。将二倍体藻液囊体缓慢摇碎,经10 μm筛绢自然过滤,去除囊体碎片,收集单细胞用于二倍体接种。藻细胞接种初始密度均为1×104 cells·mL-1。如表 1所示,设置氮限制组(N-limited,N/P=4.0∶1.0)、对照组(Control,N/P=24.5∶1.0)和磷限制组(P-limited,N/P=64.0∶1.0),每组3个平行。按比例定量加入KH2PO4、NaNO3,其他按f/10培养基添加微量元素和维生素。试验条件与扩种培养条件保持一致,无菌培养20 d。为防止细胞沉底贴壁死亡,每天定时摇匀3次。每间隔3 d,于上午10:00取样测定各生理生化指标。
| 组别 Group |
细胞类型 Cell type |
NO3-/ (μmol·L -1) |
PO43-/ (μmol·L-1) |
氮磷比 N/P |
初始密度/(cells·mL-1) Initial density/(cells·mL-1) |
| N-limited | Diploid | 28.80 | 7.20 | 4.0∶1.0 | 1×104 |
| N-limited | Haploid | 28.80 | 7.20 | 4.0∶1.0 | 1×104 |
| Control | Diploid | 176.40 | 7.20 | 24.5∶1.0 | 1×104 |
| Control | Haploid | 176.40 | 7.20 | 24.5∶1.0 | 1×104 |
| P-limited | Diploid | 176.40 | 2.75 | 64.0∶1.0 | 1×104 |
| P-limited | Haploid | 176.40 | 2.75 | 64.0∶1.0 | 1×104 |
1.2 各生理生化指标的测定 1.2.1 藻细胞密度及生长率
选择荧光检测波长为(675±25) nm的FL4通道,使用流式细胞仪(BD Accuri C6,美国BD公司)对藻细胞丰度进行计数。每瓶取1 mL藻液,经10 μm筛绢自然过滤后,收集游离单细胞进行计数。另取1 mL二倍体细胞藻液至24孔细胞培养板,在倒置显微镜(Eclipse Ti,尼康株式会社)下观察囊体数量、囊体内细胞数并测量囊体直径[26]。每个样品随机计量20个囊体,少于20个则全部计量。二倍体总细胞密度包括游离单细胞和囊体内单细胞。细胞生长率(μ)根据下式计算:
| $ \mu=\ln \left(N_2 / N_1\right) /\left(t_2-t_1\right), $ |
其中,N1、N2分别为时间t1、t2下的藻细胞密度,单位为d-1。
1.2.2 叶绿素a和营养盐浓度取30 mL藻液过滤至25 mm GF/F膜,将滤膜浸泡在6 mL 90%丙酮中,于4 ℃黑暗萃取24 h。离心15 min后,取3 mL上清液,用紫外分光光度计(Cary 100,美国Agilent公司)分别测定波长为630、647、664、750 nm下的吸光值,计算叶绿素a的含量[27]。
收集叶绿素a提取过程中的滤液30 mL,加入50 μL CHCl3固定后于-20 ℃保存。用营养盐自动分析仪(Sanplus,荷兰Skalar公司)测定营养盐浓度,无机氮和无机磷的检测下限分别为0.07和0.03 μmol·L-1[28]。
1.2.3 藻细胞多糖根据多糖存在形态的类型,将球形棕囊藻多糖分为溶解性胞外多糖(Soluble Exopolysaccharide,sEPS)、固着性胞外多糖(Bound Exopolysaccharide,bEPS)和胞内多糖(Intracellular Polysaccharide,IPS)[29]。本研究参照此分类方法对3种不同类型的藻多糖进行测定。将10 mL藻液于4 ℃条件下以4 204 r·min-1离心15 min,取2 mL上清液测定sEPS。离心后的藻团加入10 mL用0.5 moL/L NaOH溶液调节pH值为10的超纯水。摇匀后放置于45 ℃温水中,以150 r·min-1振荡4 h。在4 ℃条件下以4 204 r·min-1离心15 min,取2 mL上清液测定bEPS。收集第二次离心后的藻团,加入10 mL pH值为10的超纯水,通过超声波破碎细胞7 min,放置沸水浴10 min。样品冷却后,加入2 mL 85% C2HCl3O2溶液沉淀色素和蛋白。在4 ℃条件下以4 204 r·min-1离心15 min,取2 mL上清液测定IPS。
采用苯酚-硫酸法测定藻多糖含量[11]。在上述待测上清液中分别加入1 mL 5%苯酚,摇匀后加入5 mL浓硫酸,迅速摇匀。室温放置20 min后,测定490 nm处的吸光度。根据葡萄糖浓度标准曲线和藻细胞密度,计算单个细胞的IPS和EPS (包括sEPS和bEPS)含量(pg·cell-1)。
1.2.4 透明胞外聚合颗粒物取10 mL藻液,用聚碳酸酯滤膜(直径为25 mm,孔径为0.4 μm)在低负压下(< 0.2 MPa)过滤,收集TEP。用超纯水洗涤膜上颗粒物3次,去除盐分。接着在滤膜上滴加500 μL 0.02%阿利新蓝(pH值为2.5,8 GX,美国Sigma公司)-0.06%乙酸溶液。利用阿利新蓝染色剂将TEP染色,染色时间小于2 s。用超纯水洗涤膜上颗粒物2次,去除过剩染料。
将含有TEP的滤膜转移至15 mL试管中,加入6 mL 80% H2SO4溶液,浸泡洗脱2 h。期间,每25 min摇匀一次,确保染料全部洗脱至溶液中。在1.2.3节离心的藻液中,取3 mL上清液,转入1 cm玻璃吸收池中,测定787 nm处的吸光度。TEP含量(CTEP)以具备相同阿利新蓝染色能力的黄原胶等量物表示,根据下式计算:
| $ C_{\mathrm{TEP}}=\left(E_{787}-B_{787}\right) \times\left(V_f\right)^{-1} \times f_x, $ |
其中,E787表示样品在787 nm处的吸光度值,B787是空白样在787 nm处的吸光度值;Vf是海水过滤体积(dm3);fx是质量校正因子[30],由TEP标准曲线斜率求倒数得到,用于表征单位质量黄原胶的染色能力。根据TEP标准曲线和藻细胞密度计算单个细胞TEP含量(pg·cell-1)。
1.3 数据处理使用SPSS 26.0软件对试验数据进行统计学分析,数据以“平均值±标准差”的形式表示。各生理生化指标组间参数比较在符合正态分布(或近似正态分布)及方差齐性的前提下进行。采用单因素方差分析(One-way ANOVA)比较分析营养盐和藻细胞的丰度变化、藻细胞多糖与TEP释放的差异性,显著性水平为P < 0.05。采用Origin 2022绘制参数变化图。
2 结果与分析 2.1 培养液中氮、磷营养盐浓度的变化试验开始时,球形棕囊藻单倍体和二倍体细胞氮、磷营养盐初始浓度相同(图 1)。在氮限制组中,单倍体细胞和二倍体细胞均在第4天将溶解无机氮消耗殆尽。在对照组中,单倍体细胞的溶解无机氮下降到第4天后,于第8天升高至(211.51±7.55) μmol·L-1,试验结束时,降至(5.20±5.20) μmol·L-1。二倍体细胞在试验开始后迅速消耗水中溶解无机氮,于第12天消耗殆尽。磷限制组的单倍体细胞在前12 d消耗溶解无机氮情况与对照组的单倍体细胞相同,试验结束时,消耗了46.01%。二倍体细胞的溶解无机氮在试验开始后缓慢下降,直至试验结束时,消耗了62.66%[图 1: (a)、(b)]。
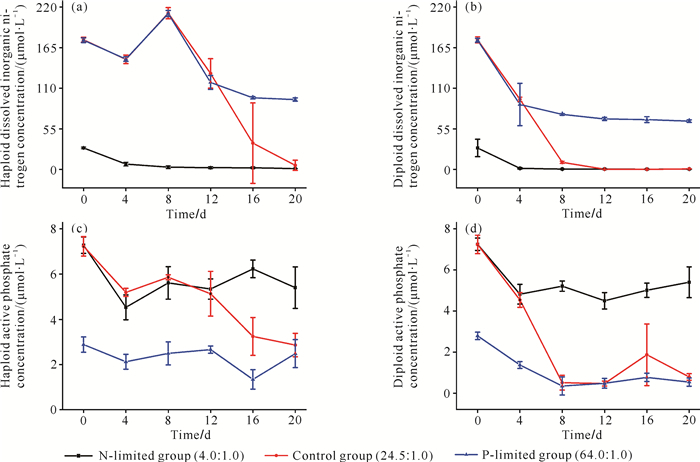
|
| 图 1 氮、磷限制条件下不同倍性球形棕囊藻培养试验中溶解性无机盐浓度的变化 Fig. 1 Variations of dissolved inorganic nutrients in culture experiments of different ploidy of P.globosa under N-limited and P-limited conditions |
单倍体细胞在氮限制组于第4天消耗活性磷酸盐至最低点,在磷限制组和对照组中分别于第16、20天消耗活性磷酸盐至最低点。二倍体细胞的对照组和磷限制组在试验开始后迅速消耗水中活性磷酸盐,于第8天消耗完全,进入衰亡期。在氮限制组中,二倍体细胞于第12天消耗磷酸盐至最低点,试验结束时,消耗了25.62%[图 1: (c)、(d)]。
2.2 氮、磷限制条件下球形棕囊藻细胞生长变化氮、磷营养盐限制对不同倍性球形棕囊藻细胞生长影响不同。对照组对球形棕囊藻细胞生长的影响显著大于氮、磷限制组(P < 0.05)。氮限制组的单倍体细胞生长密度显著低于磷限制组(P < 0.05),氮、磷限制组的二倍体细胞生长密度无显著差异(P>0.05)。二倍体在试验开始后迅速增殖,于第8天进入稳定期;单倍体延长了对数生长期,更利于后期的暴发性生长。球形棕囊藻叶绿素a含量的变化与细胞密度的变化相似(图 2)。
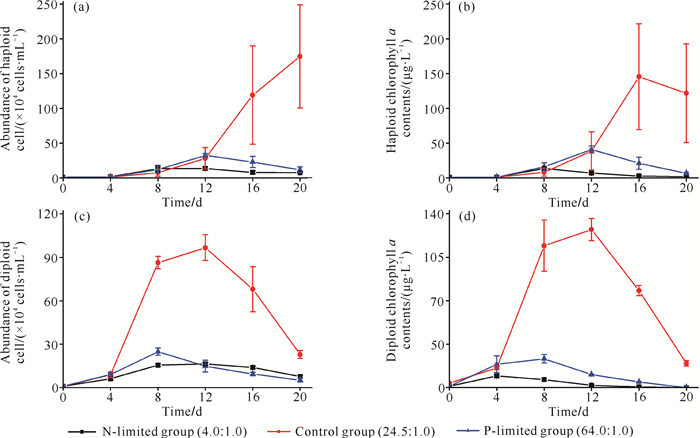
|
| 图 2 氮、磷限制条件下不同倍性球形棕囊藻细胞丰度和叶绿素a含量的变化 Fig. 2 Variations of cell abundance and chlorophyll a content of different ploidy of P.globosa under N-limited and P-limited conditions |
二倍体细胞生长率显著高于单倍体细胞生长率(P < 0.05)。氮限制组的单倍体和二倍体细胞生长率最低,分别为0.22和0.35 d-1。对照组的单倍体细胞生长率最高,为0.38 d-1,是氮限制组的1.73倍。二倍体细胞生长率最高的是对照组,为0.56 d-1,是二倍体细胞生长率最低的氮限制组的1.60倍。对照组和磷限制组的细胞生长率显著高于氮限制组(P < 0.05)(图 3)。
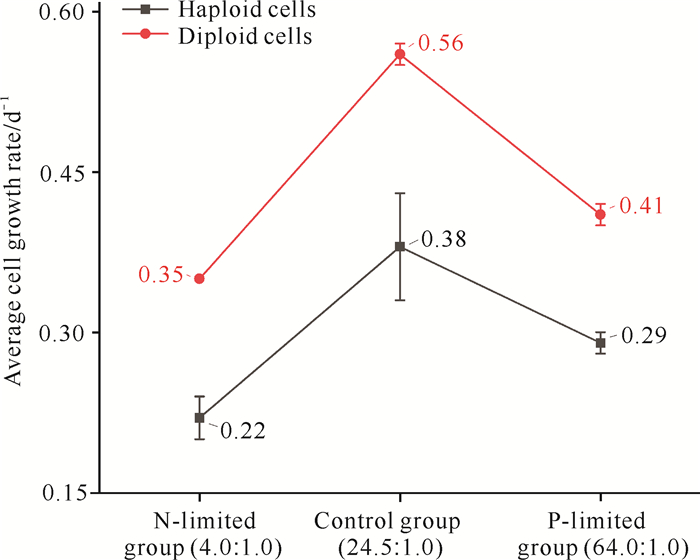
|
| 图 3 氮、磷限制条件下球形棕囊藻单倍体和二倍体在对数生长期的最大细胞生长率变化 Fig. 3 The maximum cell growth rate variations of haploid and diploid of P.globosa in logarithmic growth period under N-limited and P-limited conditions |
2.3 氮、磷限制条件下藻细胞多糖组成及含量变化
球形棕囊藻细胞分泌的多糖主要以sEPS为主,占总糖含量的32%-80%;其次是IPS,占总糖含量的8%-60%;bEPS最低,占总糖含量的2%-45%。在氮、磷限制条件下,单倍体细胞的sEPS随培养时间整体呈升高趋势,其中磷限制组的促进作用更强;单倍体细胞的IPS和bEPS随培养时间整体呈降低趋势,其中磷限制组对IPS的抑制作用更强[图 4(a)]。二倍体细胞的bEPS随培养时间呈升高趋势。二倍体细胞的sEPS从试验开始到第12天(稳定期)逐步增加,而后在衰亡期开始减少。二倍体细胞的IPS变化与其sEPS趋势相反[图 4(b)]。
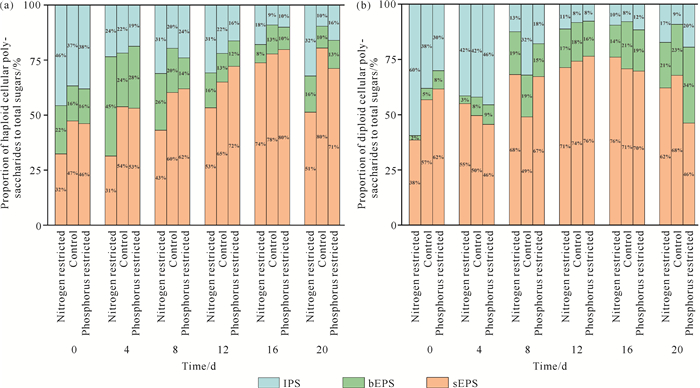
|
| 图 4 氮、磷限制条件下球形棕囊藻单倍体(a)和二倍体细胞(b)的3种形态多糖比例变化 Fig. 4 Variations in the proportion of three forms of polysaccharides in haploid (a) and diploid (b) of P.globosa under N-limited and P-limited conditions |
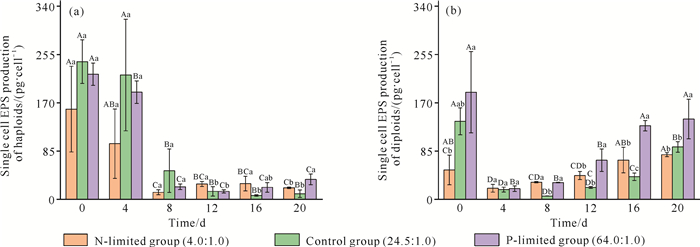
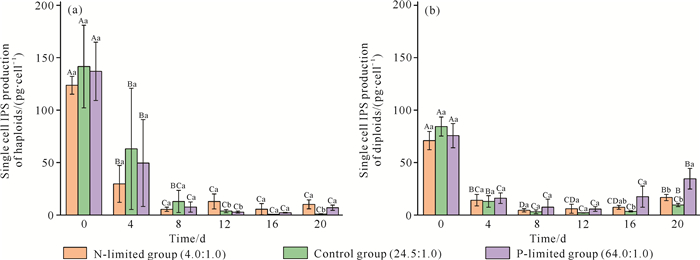
氮、磷限制条件下球形棕囊藻单倍体和二倍体单细胞的EPS、IPS产量分别见图 5、图 6。在单倍体培养试验中,氮限制组的第0天单细胞EPS产量与第8、12、16、20天差异显著(P < 0.05)。对照组中的第0、4天单细胞EPS产量与第8、12、16、20天均有显著性差异(P < 0.05)。在磷限制组中,第0、4天的单细胞EPS产量与其他5组培养时间均有显著性差异(P < 0.05)。第12、16天,氮限制组的单细胞EPS产量与对照组差异显著(P < 0.05)。在试验第20天,磷限制组的单细胞EPS产量与对照组、氮限制组差异显著(P < 0.05)[图 5(a)]。氮限制组、磷限制组的第0天和第4天的单细胞IPS产量与其他5组培养时间均有显著性差异(P < 0.05)。在对照组中,第0天和第4天的单细胞IPS产量与第12、16、20天差异显著(P < 0.05)。第0、4、8、16天,3个营养盐限制试验组的单细胞IPS产量均无显著差异(P>0.05)。第12天,氮限制组的单细胞IPS产量与对照组和磷限制组差异显著(P < 0.05)[图 6(a)]。在二倍体培养试验中,磷限制组的第0、16、20天单细胞EPS产量与第4、8、12天均有显著性差异(P < 0.05)。在对照组中,第0天和第20天的单细胞EPS产量与其他5组培养时间均有显著性差异(P < 0.05)。第4天,3个营养盐限制试验组的单细胞EPS产量处在同一水平,三者间无显著差异(P>0.05)。第0、12、16、20天,磷限制组的单细胞EPS产量与对照组、氮限制组差异显著(P < 0.05)[图 5(b)]。氮限制组和对照组在第0天单细胞IPS产量与其他5组培养时间差异显著(P < 0.05)。在磷限制组中,第0天和第20天的单细胞IPS产量与其他5组培养时间均有显著性差异(P < 0.05)。第0、4、8、12天的3个试验组单细胞IPS产量均无显著差异(P>0.05)。第16、20天的磷限制组单细胞IPS产量与对照组差异显著(P < 0.05)[图 6(b)]。
|
| Capital letters indicate the difference in polysaccharide yield of single cells at different culture time in the same nutrient restriction group.Different letters indicate significant difference (P < 0.05), and the same letters indicate no significant difference (P>0.05).Lowercase letters indicate the difference in single cell polysaccharide production between the three nutrient groups at the same culture time, different letters indicate significant difference (P < 0.05), and the same letter indicates no significant difference (P>0.05). 图 5 氮、磷限制条件下球形棕囊藻单倍体(a)和二倍体(b)的单细胞EPS产量变化 Fig. 5 Variations in single cell EPS production of haploid (a) and diploid (b) of P.globosa under N-limited and P-limited conditions |
|
| Capital letters indicate the difference in polysaccharide yield of single cells at different culture time in the same nutrient restriction group.Different letters indicate significant difference (P < 0.05), and the same letters indicate no significant difference (P>0.05).Lowercase letters indicate the difference in single cell polysaccharide production between the three nutrient groups at the same culture time, different letters indicate significant difference (P < 0.05), and the same letter indicates no significant difference (P>0.05). 图 6 氮、磷限制条件下球形棕囊藻单倍体(a)和二倍体(b)的单细胞IPS产量的变化 Fig. 6 Variations in single cell IPS production of haploid (a) and diploid (b) of P.globosa under N-limited and P-limited conditions |
2.4 营养盐限制条件下球形棕囊藻细胞TEP产量的变化
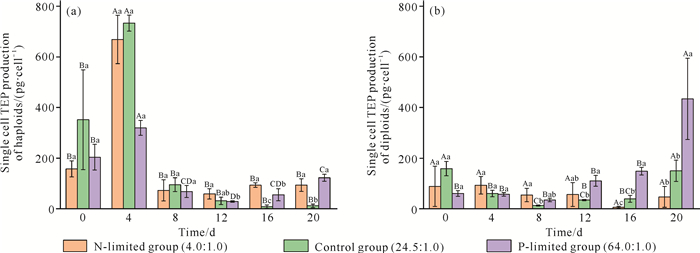
在氮、磷限制培养条件下,球形棕囊藻的TEP产量与EPS产量呈相似的变化趋势。在单倍体培养试验中,氮限制组、对照组的第4天单细胞TEP产量与其他5组培养时间差异显著(P < 0.05)。在磷限制组中,第0、4天的单细胞TEP产量与其他5组培养时间均有显著性差异(P < 0.05)。第0、4、8天的3个试验组单细胞TEP产量均无显著差异(P>0.05)。第16、20天对照组的单细胞TEP产量与氮限制组、磷限制组差异显著(P < 0.05)[图 7(a)]。
|
| Capital letters indicate the difference in TEP yield of single cells at different culture time in the same nutrient restriction group.Different letters indicate significant difference (P < 0.05), and the same letters indicate no significant difference (P>0.05).Lowercase letters indicate the difference in single cell TEP production between the three nutrient groups at the same culture time, different letters indicate significant difference (P < 0.05), the same letter indicates no significant difference (P>0.05). 图 7 氮、磷限制条件下球形棕囊藻单倍体(a)和二倍体(b)的单细胞TEP产量的变化 Fig. 7 Variations in single cell TEP production of haploid (a) and diploid (b) of P.globosa under N-limited and P-limited conditions |
在二倍体培养试验中,氮限制组中6组培养时间的单细胞TEP产量均无显著差异(P>0.05)。对照组中第0、20天的单细胞TEP产量与第4、8、12、16天均有显著性差异(P < 0.05)。磷限制组中第20天的单细胞TEP产量与其他5组培养时间差异显著(P < 0.05)。第0、4天的3个试验组单细胞TEP产量均无显著差异(P>0.05)。第8天的氮限制组单细胞TEP产量与对照组差异显著(P < 0.05)。第12、16、20天,磷限制组的单细胞TEP产量与对照组差异显著(P < 0.05)[图 7(b)]。
3 讨论 3.1 营养盐限制对不同倍性球形棕囊藻细胞生长的影响氮、磷营养盐是影响海洋浮游植物生长和藻华发生的关键物质基础[12, 31]。与Redfield比值中的氮磷比(16∶1)最为接近的对照组较氮、磷限制组具有更高的细胞丰度(图 2)。氮磷比为4.0∶1.0和64.0∶1.0时,藻细胞密度峰值相对较低。适宜的氮磷比会促进藻类的生长,氮、磷限制均会抑制球形棕囊藻细胞的生长[26, 31]。在对照组中,二倍体细胞于第8天将营养盐消耗殆尽[图 1: (b)、(d)],单倍体细胞于第16天营养盐消耗至最低水平[图 1: (a)、(c)]。氮、磷营养对二倍体细胞前期生长的促进作用强于单倍体细胞。单倍体细胞生长率显著低于二倍体细胞生长率(P < 0.05)。可见,棕囊藻属(Phaeocystis)藻类可以形成较低细胞生长率的单倍体以适应贫营养条件的生长环境[32, 33],与Peperzak等[13]的研究结果一致。二倍体更偏向于具有较高营养盐吸收速率的暴发性生长策略者[34]。单倍体和二倍体在磷限制组中的细胞生长率显著高于氮限制组(P < 0.05, 图 3),说明球形棕囊藻细胞对氮限制更敏感,而在磷限制环境中均具有相对较高的生物量[8, 35]。氮限制组的单倍体细胞生长率小于二倍体细胞生长率,说明球形棕囊藻单倍体受氮限制的生长影响比二倍体更敏感。
3.2 氮、磷限制对不同倍性球形棕囊藻细胞多糖与TEP产量的影响试验结果显示,球形棕囊藻细胞分泌的多糖主要以sEPS为主,其次是IPS,bEPS占总糖比例最低;营养盐胁迫会改变藻细胞的多糖组成。单倍体细胞与二倍体细胞的bEPS分泌趋势相反。在图 2(a)、2(c)对照组中,单倍体细胞在生长后期的细胞密度还维持在最高水平,但bEPS产量却是相对最低水平。试验后期,二倍体细胞丰度明显下降,但bEPS产量呈上升趋势。有研究表明,藻细胞中bEPS的含量决定了微囊藻的细胞形态[36]。二倍体细胞bEPS含量的增加可以有效提高细胞与细胞之间的黏附能力,形成更稳定的群体细胞以应对后期的环境胁迫。随着囊体的生长,细胞需要产生更多的多糖来维持囊体结构。单倍体细胞bEPS含量减少,细胞附着能力下降,难以形成群体细胞形态,这也是单倍体细胞作为微囊藻在培养试验过程中只有游离单细胞,很难形成囊体形态的原因之一。由此可推断球形棕囊藻单倍体细胞转变为二倍体细胞时,EPS产量增加以利于聚集群体细胞。
研究发现,球形棕囊藻在不同营养盐限制条件下的多糖产量和能量分配策略不尽相同[11]。单倍体的单细胞EPS和IPS产量随培养时间呈降低趋势,氮、磷限制组对单倍体单细胞EPS和IPS产量均无显著差异[P>0.05, 图 5(a)、图 6(a)],说明单倍体细胞把更多物质和能量用于细胞生长,降低多糖分泌。试验后期,磷限制组的二倍体单细胞EPS、IPS产量显著高于对照组(P < 0.05),且磷限制组的单细胞多糖产量最高[图 5(b)、图 6(b)],说明磷限制环境刺激二倍体细胞EPS和IPS产生。二倍体细胞倾向于把更多物质和能量用于群体细胞构建,降低单细胞密度,增加多糖产量分泌,以应对恶化环境。其中,二倍体多糖产量对磷限制的响应更敏感。一方面,低磷浓度导致藻细胞可利用的碳源比例增加,细胞把剩余的碳合成更多的多糖[17];另一方面,磷限制组将磷酸盐消耗殆尽后,氮磷比增加,球形棕囊藻在磷胁迫环境下采取优化能量分配策略,将更多的能量分配于多糖合成,抵御不利环境[11]。
在氮、磷限制条件下,球形棕囊藻的TEP产量与EPS产量呈相似的变化趋势(图 5、图 7)。有研究表明,TEP是水体中一类以离散粒子形式出现的特殊EPS[30],可与sEPS和bEPS相互转化[37, 38]。图 7显示,球形棕囊藻在整个生长阶段均能够释放TEP,不同生长阶段的TEP释放响应特征并不一样。在试验的第16、20天,单倍体细胞在氮、磷限制组的单细胞TEP产量显著高于对照组(P < 0.05),但氮、磷限制组彼此之间的单细胞TEP产量差异显著性并无规律[图 7(a)]。一方面,说明后期营养胁迫环境对单倍体细胞TEP释放具有一定促进作用;另一方面,说明TEP的产生不一定与营养物质的可用性有关,更容易受环境中整个营养盐相对存量的影响。在稳定期和衰亡期,磷限制组的二倍体单细胞TEP产量显著高于氮限制组和对照组[P < 0.05, 图 7(b)],说明二倍体细胞TEP释放对磷限制的响应更敏感。在试验后期,磷限制组的二倍体单细胞TEP产量显著高于单倍体细胞(P < 0.05)。有研究表明,球形棕囊藻的囊体更容易受到磷限制的影响[9, 39]。由于单倍体细胞只有游离单细胞,二倍体细胞具有囊体结构,磷限制可以有效刺激衰老囊体破裂,释放多糖黏液以增加TEP浓度[19]。这与笔者在试验培养过程中观察到的磷限制组球形棕囊藻囊体于衰亡期变得薄弱、易变形和破裂的现象相符。另外,氮限制组的6组培养时间二倍体单细胞TEP产量均无显著差异(P>0.05),从另一个角度说明了磷限制刺激囊体破裂释放的多糖黏液对二倍体单细胞TEP产量贡献较大。
4 结论营养盐胁迫刺激球形棕囊藻EPS和TEP的产生。EPS和TEP的产生不一定与营养物质的可用性有关,更容易受环境中整个营养盐相对存量的影响。北部湾球形棕囊藻细胞多糖产量与TEP释放存在细胞倍性差异。二倍体细胞的多糖产量和TEP释放对磷限制的响应比单倍体细胞更敏感。TEP的峰值通常与球形棕囊藻藻华关系密切[40]。因此,在广西北部湾海域球形棕囊藻藻华灾害防治过程中,应加强控磷减氮排放管理,避免产生大量TEP等黏性多糖聚合物破坏海洋生态。
| [1] |
沈萍萍, 齐雨藻, 欧林坚. 中国沿海球形棕囊藻(Phaeocystis globosa)的分类、分布及其藻华[J]. 海洋科学, 2018, 42(10): 146-162. DOI:10.11759/hykx20171225004 |
| [2] |
党二莎, 唐俊逸, 周连宁, 等. 珠江口近岸海域水质状况评价及富营养化分析[J]. 大连海洋大学学报, 2019, 34(4): 580-587. |
| [3] |
康建华, 林毅力, 王雨, 等. 钦州湾海洋环境的富营养化水平评价及其对浮游植物叶绿素a的影响[J]. 海洋开发与管理, 2020, 37(11): 67-74. DOI:10.3969/j.issn.1005-9857.2020.11.012 |
| [4] |
覃仙玲, 陈宪云, 赖俊翔, 等. 钦州湾表层海水中总溶解态氮磷分布特征及季节变化[J]. 海洋环境科学, 2017, 36(3): 349-353. |
| [5] |
杨静, 张仁铎, 赵庄明, 等. 近25年广西北部湾海域营养盐时空分布特征[J]. 生态环境学报, 2015, 24(9): 1493-1498. |
| [6] |
姜宁. 广西北部湾海域赤潮演变趋势分析及其防控思路[J]. 海洋开发与管理, 2019, 36(11): 82-85. DOI:10.3969/j.issn.1005-9857.2019.11.014 |
| [7] |
陈菊芳, 徐宁, 江天久, 等. 中国赤潮新记录种: 球形棕囊藻(Phaeocystis globosa)[J]. 暨南大学学报(自然科学与医学版), 1999, 20(3): 124-129. |
| [8] |
王艳, 邓坤, 王小冬. 球形棕囊藻囊体形成中光照、营养盐和共存硅藻的影响[J]. 生态科学, 2013, 32(2): 165-170. DOI:10.3969/j.issn.1008-8873.2013.02.005 |
| [9] |
涂俊杰, 高配配, 刘春颖, 等. 不同氮磷比对球形棕囊藻释放含硫化合物及DMSP降解途径的影响[J]. 中国海洋大学学报(自然科学版), 2022, 52(4): 87-96. |
| [10] |
WHIPPLE S J, PATTEN B C, VERITY P G. Life cycle of the marine alga Phaeocystis: a conceptual model to summarize literature and guide research[J]. Journal of Marine Systems, 2005, 57(1/2): 83-110. |
| [11] |
许铭本. 影响北部湾球形棕囊藻游离单细胞丰度与囊体形成的关键因子研究[D]. 南宁: 广西大学, 2022.
|
| [12] |
沈萍萍, 王艳, 齐雨藻, 等. 球形棕囊藻的生长特性及生活史研究[J]. 水生生物学报, 2000, 24(6): 635-643. |
| [13] |
PEPERZAK L, DUIN R N M, COLIJN F, et al. Grow-th and mortality of flagellates and non-flagellate cells of Phaeocystis globosa (Prymnesiophyceae)[J]. Journal of Plankton Research, 2000, 22(1): 107-120. |
| [14] |
李杰, 陆家昌, 赖俊翔, 等. 球形棕囊藻游离单细胞的密度与囊体形成的关系研究[J]. 植物科学学报, 2022, 40(1): 84-95. |
| [15] |
JR SMITH W O, LIU X, TANG K W, et al. Giantism and its role in the harmful algal bloom species Phaeocystis globosa[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2014, 101: 95-106. |
| [16] |
VAN RIJSSEL M, HAMM C E, GIESKES W W C. Phaeocystis globosa (Prymnesiophyceae) colonies: hollow structures built with small amounts of polysaccharides[J]. European Journal of Phycology, 1997, 32(2): 185-192. |
| [17] |
孙梦家. 不同营养条件对单细胞和群体微囊藻胞外多糖产率以及群体形成的影响[D]. 南京: 南京大学, 2014.
|
| [18] |
PASSOW U. Transparent exopolymer particles (TEP) in aquatic environments[J]. Progress in Oceanography, 2002, 55(3/4): 287-333. |
| [19] |
MARI X, RASSOULZADEGAN F, BRUSSAARD C P D, et al. Dynamics of transparent exopolymeric particles (TEP) production by Phaeocystis globosa under N- or P-limitation: a controlling factor of the retention/export balance[J]. Harmful Algae, 2005, 4(5): 895-914. |
| [20] |
孙军. 海洋中的凝集网与透明胞外聚合颗粒物[J]. 生态学报, 2005, 25(5): 1191-1198. |
| [21] |
VERDUGO P, ALLDREDGE A L, AZAM F, et al. The oceanic gel phase: a bridge in the DOM-POM continuum[J]. Marine Chemistry, 2004, 92(1/2/3/4): 67-85. |
| [22] |
PEDROTTI M L, PETERS F, BEAUVAIS S, et al. Effects of nutrients and turbulence on the production of transparent exopolymer particles: a mesocosm study[J]. Marine Ecology Progress Series, 2010, 419: 57-69. |
| [23] |
郭康丽, 陈洁, 王小冬, 等. 两种海洋硅藻透明胞外聚合颗粒物的产生及其生态学意义[J]. 海洋环境科学, 2019, 38(5): 649-655. |
| [24] |
薛思佑, 胡佶, 韩正兵, 等. 夏季闽东沿海水体中透明胞外聚合颗粒物的分布特征及影响因素[J]. 海洋学报, 2021, 43(8): 17-30. |
| [25] |
郭聪聪. 东印度洋透明胞外聚合颗粒物浓度分布及其沉降特性[D]. 天津: 天津科技大学, 2020.
|
| [26] |
WANG X, WANG Y, JR SMITH W O. The role of nitrogen on the growth and colony development of Phaeocystis globose (Prymnesiophyceae)[J]. European Journal of Phycology, 2011, 46(3): 305-314. |
| [27] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范: 第6部分海洋生物调查: GB/T 12763.6—2007 [S]. 北京: 中国标准出版社, 2008.
|
| [28] |
赖俊翔, 俞志明, 宋秀贤, 等. 利用特征色素研究长江口海域浮游植物对营养盐加富的响应[J]. 海洋科学, 2012, 36(5): 42-52. |
| [29] |
YANG Z, KONG F X, SHI X L, et al. Changes in the morphology and polysaccharide content of Microcystis aeruginosa (Cyanobacteria) during flagellate grazing[J]. Journal of Phycology, 2008, 44(3): 716-720. |
| [30] |
PASSOW U, ALLDREDGE A L. A dye-binding assay for the spectrophotometric measurement of transparent exopolymer particles (TEP)[J]. Limnology and Oceanography, 1995, 40(7): 1326-1335. |
| [31] |
VELDHUIS M J W, COLIJN F, ADMIRAAL W. Phosphate utilization in Phaeocystis pouchetii (Haptophyceae)[J]. Marine Ecology, 1991, 12(1): 53-62. |
| [32] |
PEPERZAK L, GÄBLER-SCHWARZ S. Current knowledge of the life cycles of Phaeocystis globosa and Phaeocystis antarctica (Prymnesiophyceae)[J]. Journal of Phycology, 2012, 48(3): 514-517. |
| [33] |
IMIS V, VELDHUIS M J W, ADMIRAAL W, et al. Chemical and physiological changes of phytoplankton during the spring bloom, dominated by Phaeocystis pouchetii (Haptophyceae): observations in Dutch coastal waters of the North Sea[J]. Netherlands Journal of Sea Research, 1986, 20(1): 49-60. |
| [34] |
DUCOBU H, HUISMAN J, JONKER R R, et al. Competition between a prochlorophyte and a cyanobacterium under various phosphorus regimes: comparison with the droop model[J]. Journal of Phycology, 1998, 34(3): 467-476. |
| [35] |
邓坤. 光照、营养盐限制及硅藻和甲藻对球形棕囊藻生活史的影响[D]. 广州: 暨南大学, 2013.
|
| [36] |
代晓炫, 朱伟, 李明. 营养盐对微囊藻细胞组分及多糖组成的影响[J]. 湖泊科学, 2013, 25(2): 277-282. |
| [37] |
XU C, CHIN W C, LIN P, et al. Comparison of microgels, extracellular polymeric substances (EPS) and transparent exopolymeric particles (TEP) determined in seawater with and without oil[J]. Marine Chemistry, 2019, 215: 103667. |
| [38] |
BERMAN T. Transparent exopolymer particles as critical agents in aquatic biofilm formation: implications for desalination and water treatment[J]. Desalination and Water Treatment, 2013, 51(4/5/6): 1014-1020. |
| [39] |
莫钰, 蓝彩碧, 许铭本, 等. 氮磷营养变化对钦州湾球形棕囊藻藻体生长的影响[J]. 海洋科学, 2022, 46(5): 30-41. |
| [40] |
AMARA R, FILIPUCI I, VINCENT D, et al. Do transparent exopolymeric particles (TEP) derived from Phaeocystis globosa bloom impact the physiological performances of European Sea bass juveniles[J]. Aquaculture, 2013, 414(414/415): 149-154. |



