苏铁类植物含2科10属,是现存种子植物最原始的类群之一,具有重要的科学研究和保护价值,其中苏铁科(Cycadaceae)只有苏铁属(Cycas)一属,约120种。我国苏铁属植物种类丰富,是世界苏铁属物种多样性中心之一,我国有苏铁属植物约20种,主要分布在云南、四川、贵州、广西、广东、海南、福建及台湾8个省区,其中云南和广西是我国苏铁种质资源最丰富的省区[1, 2]。广西的苏铁种质资源主要分布在其西部地区,该地区也是我国苏铁分类研究较混乱的地区之一,其中石山苏铁(C.sexseminifera)复合群的分类争议最大,因此有学者对它们进行了归并处理;Chen[3]把长孢苏铁(C.longisporophylla)、刺孢苏铁(C.spiniformis)、七籽苏铁(C.septemsperma)和短叶苏铁(C.brevipinnata)连同六籽苏铁(C.miqueli)一起作为石山苏铁的异名处理。
石山苏铁生长在我国广西西部及越南北部石灰岩地区,广西当地称其为“山菠萝”或“神仙米”[4]。此类植物为小型灌木,生长非常缓慢,树高多数在1 m以下,树干光滑呈银灰色或灰褐色,与苏铁(C.revoluta)外形较接近,但树干不明显,基部膨大成卵状茎或盘状茎,上部逐渐缩成圆柱形或卵状圆柱形[5]。石山苏铁在广西是个体数量最多、分布面积最广的一类苏铁植物,大多数生长在陡峭的石壁之上,少数见于疏林下或灌丛中。但是人为盗采和生境的破坏使其生存繁衍受到了严重的威胁,被列为国家一级重点保护野生植物。目前,对石山苏铁的基础研究工作还比较少,急需对石山苏铁开展保护生物学研究。因此,本研究采用Simple Sequence Repeats (SSR)分子标记技术进行石山苏铁的引物设计和遗传多样性检测分析,拟了解石山苏铁的遗传水平和种群结构,并揭示现存遗传多样性高的重点野生种群及其生境,为石山苏铁的保护提供科学理论依据。
1 材料与方法 1.1 试验材料试验材料来自广西南宁市、崇左市、百色市6个野生种群和1个广西壮族自治区中国科学院广西植物研究所(以下简称“广西植物研究所”)引种保育种群,各种群详细信息如表 1所示。采集93株野生植株和21株保育植株,共计114株样品的叶置于变色硅胶中干燥保存。所采集的样品由广西植物研究所韦发南研究员鉴定。
| 地点 Location |
种群代号 Population code |
经纬度 Latitude and longitude |
数量/个 Number of samples/ind. |
| Xinhui in Long′an,Nanning | XH | 107°28′17″E,23°03′33″N | 16 |
| Longhuai in Long′an,Nanning | LH | 107°27′25″E,23°04′39″N | 12 |
| Guanghe in Jiangzhou,Chongzuo | GH | 107°27′30″E,23°36′29″N | 15 |
| Zhonggan in Jiangzhou,Chongzuo | ZG | 107°21′05″E,23°37′17″N | 20 |
| Pairu in Jiangzhou,Chongzuo | PR | 107°24′41″E,22°33′49″N | 22 |
| Zuodeng in Tiandong,Baise | ZD | 107°03′33″E,23°29′38″N | 8 |
| Guangxi Institute of Botany,Guilin | ZWS | 110°18′03″E,25°04′10″N | 21 |
1.2 DNA提取和检测
采用默克磁珠法DNA提取试剂盒对石山苏铁DNA进行提取,使用1%琼脂糖凝胶电泳检测DNA纯度,并用Nanodrop 2000微量分光光度计检测DNA的浓度和质量,将检测合格的DNA样品保存于-20 ℃冰箱用于后续实验。
1.3 引物合成和荧光PCR扩增根据简化基因组序列分析设计SSR引物,引物采用接头法合成,即合成时在上游引物前加上21 bp的接头序列。采用接头法进行PCR扩增时,第一步将带接头的上游引物、下游引物与模板结合,扩增得到带有接头序列的PCR产物;第二步将带荧光基团的接头引物、下游引物与第一步实验所得的PCR产物结合,扩增得到带有荧光基团和21 bp接头序列的PCR产物。
在Veriti 384 PCR仪上进行DNA扩增。PCR扩增程序设置如下:95 ℃预变性5 min;95 ℃变性30 s,62-52 ℃梯度退火30 s,72 ℃延伸30 s,运行10个循环;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,运行25个循环;72 ℃延伸20 min,最后4 ℃保存。PCR反应结束后,通过PCR产物的带型来判断SSR引物扩增的特异性,通过PCR产物条带的亮度来判断SSR引物的扩增效率,按照样本上机检测浓度的要求,对各荧光PCR产物进行稀释,得到浓度均一的荧光PCR产物并上测序仪进行SSR样品检测。
1.4 原始数据分析首先使用ABI 3730xl仪器检测分析获得的样品位点信息,并进行数据分类归档,然后将分类好的数据分别导入到GeneMarker分析软件中,读取基因型数据。
1.5 遗传多样性分析在GenAlEx version 6.501软件中[6],计算SSR引物位点多态性的各项遗传多样性指标,包括观测等位基因(Na)、有效等位基因(Ne)、Shannon指数(I)、观测杂合度(Ho)、期望杂合度(He)、多态性信息指数(PIC)和固定系数(F)。在GenAlEx version 6.501软件中计算群体的各项遗传多样性指标,包括观测等位基因(Na)、有效等位基因(Ne)、Shannon指数(I)、观测杂合度(Ho)、期望杂合度(He)、遗传分化系数(Fst),同时进行分子方差分析(AMOVA)和显著性检验;使用主坐标分析(PCoA)来计算样品主坐标成分。基因流(Nm)按下述公式来计算:Nm=0.25(1-Fst)/Fst。使用软件Structure v2.3[7]对全部个体进行群体遗传结构分析,假定分群数(K)为1-20,Burn-in周期为10 000,MCMC (Markov Chain Monte Carlo)设为100 000,每个K值重复运行10次。利用在线工具Structure Harvester[8],根据最佳K值确定最佳分群数。利用软件Powermarker对群体间的遗传距离进行计算[9]。采用基于Nei遗传距离的非加权组平均法(UPGMA方法)进行聚类分析,并绘制聚类图。
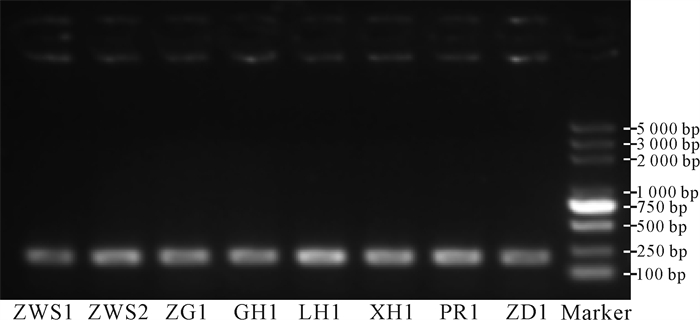
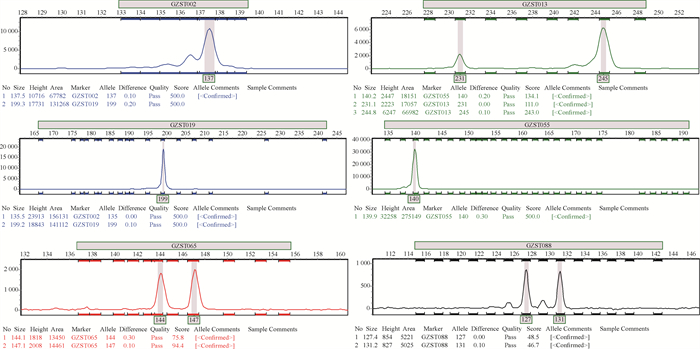
2 结果与分析 2.1 引物筛选结果如图 1所示,石山苏铁DNA条带清晰,说明其含量合适、纯度适中,适合进行PCR扩增。从基因组序列中一共筛选出6对峰型良好、扩增成功的引物,其PDF分型峰如图 2所示,具体的引物信息如表 2所示。
|
| 图 1 部分DNA扩增电泳图 Fig. 1 Electrophoretogram of partial DNA amplification |
|
| Numerical values in the vertical axis represent fluorescence intensities,and those in the horizontal axis represent the size of the amplified fragment. 图 2 分型峰图 Fig. 2 Peak chart |
| 位点名称 Name of locus |
重复单元 Repeat unit |
上游引物(5′→3′) Forward primer (5′→3′) |
下游引物(5′→3′) Reverse primer (5′→3′) |
等位基因区间 Allelic interval |
| GZST002 | (GA)6 | TGTGGAACGTGGAATGGTAA | AGGAATCCCGAAGGAAGAAA | 158-160 |
| GZST019 | (ATAA)5 | GATGAGGAAGCCTACGCAGT | GAAAGACCTCACCATCCGAG | 212-221 |
| GZST055 | (AT)6 | TCATGAAGATGGCAACCAAC | TCCCTTCCAAGCAAATGTCT | 161-184 |
| GZST013 | (GAG)5 | ACCGGTCGACTAGATGGATG | AGGTCCGAAGCTTTCCTCTC | 252-265 |
| GZST088 | (AG)7 | TGGCTTTCGATTTCCACACT | GAACGCTCGCTCTCTCTCTC | 136-159 |
| GZST065 | (CGA)5 | GCTTGGCTGTACCGTTCTTT | CGCCATTGACAACAACAGAC | 157-174 |
2.2 引物多态性分析
由表 3可以看出,6对引物共检测出37个观测等位基因(Na),其中最小观测等位基因数目为3,最大观测等位基因数目为12,平均每个位点的观测等位基因数目为6.167。有效等位基因(Ne,等位基因在群体中分布得越均匀,Ne越接近实际检测到的等位基因的个数)总数为18.285,数值为1.233(GZST013)-5.250(GZST088),平均每个位点的有效等位基因数目为3.048。位点GZST002、GZST055、GZST065、GZST088是高度多态性位点(PIC>0.50),位点GZST013是低度多态性位点(PIC≤0.25)。I为0.356(GZST013)-1.925(GZST088),平均值为1.191;Ho为0.009(GZST002)-0.723 (GZST088),平均值为0.429;He为0.189(GZST013)-0.810(GZST088),平均值为0.593;PIC为0.173(GZST013)-0.788(GZST088),平均值为0.547;固定系数F平均值为0.448,数值为-0.277(GZST019)-0.988(GZST002)。从表 3的结果来看,6对引物中有5对显著偏离了哈温平衡(HWE),即实测的引物基因型频率偏离了理论上的基因型频率。但在群体哈温检验中,GH种群的哈温平衡检验结果显示,只有引物GZST002在检验中呈现差异极显著,表明其他引物在GH群体的基因型频率符合哈温平衡;LH种群的哈温平衡检验差异不显著,表明引物在LH群体的基因型频率符合哈温平衡;其余种群中引物出现不同程度的显著性差异(表 4),即P值小于0.05,该群体检验不符合哈温平衡,反之,如果P值大于0.05,说明该群体检验符合哈温平衡。
| 位点 Locus |
Na | Ne | I | Ho | He | F | PIC | P值 P value |
显著性 Significant |
| GZST002 | 5 | 3.755 | 1.381 | 0.009 | 0.734 | 0.988 | 0.685 | 0.000 | *** |
| GZST013 | 3 | 1.233 | 0.356 | 0.209 | 0.189 | -0.107 | 0.173 | 0.682 | ns |
| GZST019 | 3 | 1.926 | 0.710 | 0.614 | 0.481 | -0.277 | 0.374 | 0.000 | *** |
| GZST055 | 9 | 3.174 | 1.495 | 0.414 | 0.685 | 0.395 | 0.650 | 0.000 | *** |
| GZST065 | 5 | 2.947 | 1.277 | 0.604 | 0.661 | 0.086 | 0.612 | 0.042 | * |
| GZST088 | 12 | 5.250 | 1.925 | 0.723 | 0.810 | 0.107 | 0.788 | 0.000 | *** |
| Mean | 6.167 | 3.048 | 1.191 | 0.429 | 0.593 | 0.199 | 0.547 | ||
| St Dev. | 3.600 | 1.409 | 0.566 | 0.274 | 0.226 | 0.448 | |||
| Note: ns means not significant, i.e.the population conforms to HWE; * indicates significant difference,P<0.05;*** indicates significant difference,P<0.001. | |||||||||
| 种群 Population |
位点 Locus |
DF | ChiSq | Prob | 显著性 Significant |
| GH | GZST002 | 6 | 30.024 | 0.000 | *** |
| GH | GZST013 | 1 | 0.355 | 0.551 | ns |
| GH | GZST019 | 1 | 3.649 | 0.056 | ns |
| GH | GZST055 | 15 | 17.517 | 0.289 | ns |
| GH | GZST065 | 6 | 3.441 | 0.752 | ns |
| GH | GZST088 | 21 | 15.683 | 0.787 | ns |
| LH | GZST002 | Monomorphic | |||
| LH | GZST013 | 1 | 0.245 | 0.621 | ns |
| LH | GZST019 | 1 | 3.127 | 0.077 | ns |
| LH | GZST055 | 6 | 1.891 | 0.929 | ns |
| LH | GZST065 | 10 | 3.847 | 0.954 | ns |
| LH | GZST088 | 21 | 32.333 | 0.054 | ns |
| PR | GZST002 | Monomorphic | |||
| PR | GZST013 | 1 | 0.787 | 0.375 | ns |
| PR | GZST019 | 1 | 18.340 | 0.000 | *** |
| PR | GZST055 | 21 | 77.853 | 0.000 | *** |
| PR | GZST065 | 3 | 1.658 | 0.646 | ns |
| PR | GZST088 | 15 | 17.355 | 0.298 | ns |
| XH | GZST002 | Monomorphic | |||
| XH | GZST013 | 3 | 0.549 | 0.908 | ns |
| XH | GZST019 | 1 | 5.760 | 0.016 | * |
| XH | GZST055 | 6 | 3.360 | 0.762 | ns |
| XH | GZST065 | 10 | 10.491 | 0.399 | ns |
| XH | GZST088 | 21 | 37.375 | 0.015 | * |
| ZD | GZST002 | 1 | 8.000 | 0.005 | ** |
| ZD | GZST013 | Monomorphic | |||
| ZD | GZST019 | 3 | 8.047 | 0.045 | * |
| ZD | GZST055 | 1 | 5.000 | 0.025 | * |
| ZD | GZST065 | 3 | 1.050 | 0.789 | ns |
| ZD | GZST088 | 10 | 11.800 | 0.299 | ns |
| ZG | GZST002 | Monomorphic | |||
| ZG | GZST013 | 1 | 0.013 | 0.909 | ns |
| ZG | GZST019 | 1 | 0.126 | 0.723 | ns |
| ZG | GZST055 | 21 | 49.524 | 0.000 | *** |
| ZG | GZST065 | 6 | 8.027 | 0.236 | ns |
| ZG | GZST088 | 28 | 25.980 | 0.574 | ns |
| ZWS | GZST002 | 3 | 42.000 | 0.000 | *** |
| ZWS | GZST013 | 1 | 0.124 | 0.724 | ns |
| ZWS | GZST019 | 1 | 0.399 | 0.528 | ns |
| ZWS | GZST055 | 10 | 26.982 | 0.003 | ** |
| ZWS | GZST065 | 10 | 14.307 | 0.159 | ns |
| ZWS | GZST088 | 28 | 43.571 | 0.031 | * |
| Note: ns means not significant, i.e.the population conforms to HWE; * indicates significant difference,P<0.05;** indicates significant difference,P<0.01;*** indicates significant difference,P<0.001. | |||||
2.3 遗传多样性分析
种群遗传多样性参数如表 5所示。石山苏铁各种群的I为0.630(ZD)-1.025(ZWS),平均值为0.828。Ho为0.254(ZD)-0.516(XH),平均值为0.417。He为0.330 (XH)-0.533 (ZWS),7个种群的He值大小顺序为广西植物研究所引种(ZWS)>崇左广河(GH)>崇左排汝(PR)>隆安陇怀(LH)>崇左中干(ZG)>百色作登(ZD)>隆安新会(XH);平均值为0.444,低于叉叶苏铁(C.bifida,0.543)、德保苏铁(C.debaoensis,0.484)、长叶苏铁(C.dolichophylla,0.466),高于四川苏铁(C.szechuanensis,0.247)、贵州苏铁(C.guizhouensis,0.419)、攀枝花苏铁(C.panzhihuaensis,0.328)[1]。野生种群中LH、PR、ZD和ZG种群的I值低于所有种群的平均水平,ZWS种群的I最高(1.025),其余6个野生种群的I值大小顺序为GH>XH>PR=ZG>LH>ZD,表明迁地保护的方法能高效保存和保留石山苏铁的遗传多样性。固定系数(F)为-0.161(PR)-0.480 (ZD),其中LH、PR、XH 3个野生种群F值均为负值,表明这3个种群杂合子过剩;GH、ZD、ZG 3个野生种群的F值都大于0,表明这3个种群纯合子过剩;石山苏铁的平均F值为0.074,意味着观测到的杂合子频率比理论上少7.4%,在随机交配的情况下,位点上的两个等位基因的相关性小。Shannon指数越大,生物多样性越高;杂合度也是基因多样性的体现。因此,综合各个遗传指标,石山苏铁需要重点保护和引种的野生种群是遗传多样性相对较高的崇左广河(GH)种群。
| 种群 Population |
Na | Ne | I | Ho | He | F |
| GH | 4.167 | 2.069 | 0.881 | 0.433 | 0.469 | 0.096 |
| LH | 3.500 | 2.088 | 0.796 | 0.486 | 0.435 | -0.129 |
| PR | 3.500 | 2.267 | 0.804 | 0.498 | 0.453 | -0.161 |
| XH | 3.667 | 2.364 | 0.852 | 0.516 | 0.330 | -0.143 |
| ZD | 2.667 | 1.788 | 0.630 | 0.254 | 0.353 | 0.480 |
| ZG | 4.000 | 2.232 | 0.804 | 0.344 | 0.408 | 0.100 |
| ZWS | 4.167 | 2.918 | 1.025 | 0.390 | 0.533 | 0.236 |
| Mean | 3.667 | 2.247 | 0.828 | 0.417 | 0.444 | 0.074 |
2.4 种群遗传分化分析
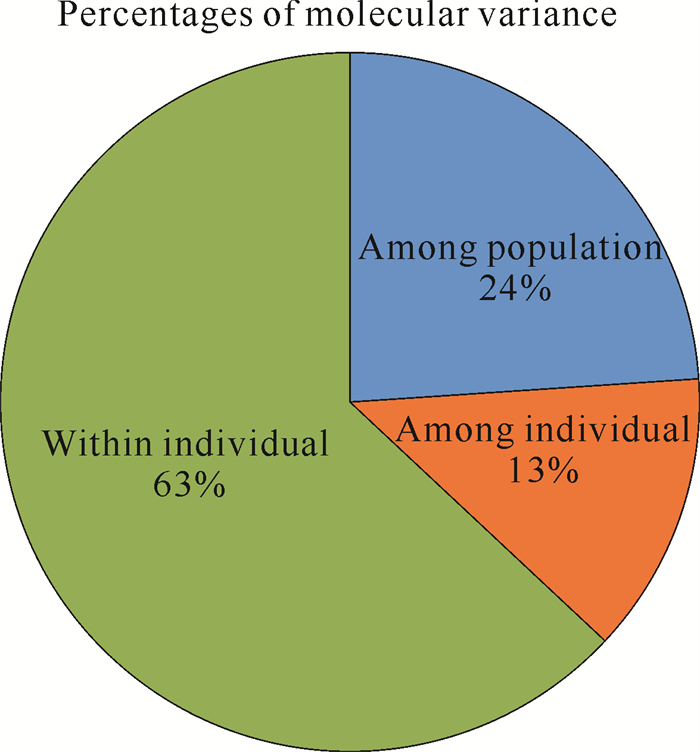
由表 6可知,种群ZD和LH之间的遗传分化系数最大,为0.248;种群GH与PR之间的遗传分化系数最小,为0.038。由此可知,石山苏铁的遗传分化系数高于中国苏铁属遗传分化系数的平均水平(22.0%),同时也高于叉叶苏铁(11.6%)、德保苏铁(0.114)和贵州苏铁(0.138),但低于四川苏铁(0.386)、攀枝花苏铁(0.331)、长叶苏铁(0.260)[1]。基因流最大的是种群PR与GH,为6.303, 这与两个种群之间离地距离较近有关;另外,XH和LH之间的基因流同样也较大,也与两者间的地理距离近有关,表明近距离的野生石山苏铁种群之间基因交流频繁;基因流最小的是种群ZD与LH,为0.757。AMOVA表明24%的遗传变异来源于种群间,有76%的遗传变异来源于个体,来源个体的变异是总变异的主要来源(图 3)。基于7个种群对石山苏铁进行AMOVA,其整体的遗传分化系数Fst为0.240,表明石山苏铁遗传分化较大;种群间存在较大的遗传差异,差异性最大的达到0.248;种群间较大的遗传差异说明石山苏铁属经历了种群缩减事件[1, 3]。
| GH | LH | PR | XH | ZD | ZG | ZWS | |
| GH | - | 1.199 | 6.303 | 1.447 | 0.967 | 1.434 | 3.029 |
| LH | 0.173 | - | 0.921 | 4.866 | 0.757 | 0.970 | 1.339 |
| PR | 0.038 | 0.213 | - | 0.929 | 0.946 | 0.976 | 1.777 |
| XH | 0.147 | 0.049 | 0.212 | - | 0.805 | 1.098 | 2.052 |
| ZD | 0.205 | 0.248 | 0.209 | 0.237 | - | 0.917 | 1.864 |
| ZG | 0.148 | 0.205 | 0.204 | 0.185 | 0.214 | - | 3.136 |
| ZWS | 0.076 | 0.157 | 0.123 | 0.109 | 0.118 | 0.074 | - |
|
| 图 3 种群的分子方差分析 Fig. 3 Molecular variance analysis of population |
2.5 群体遗传结构
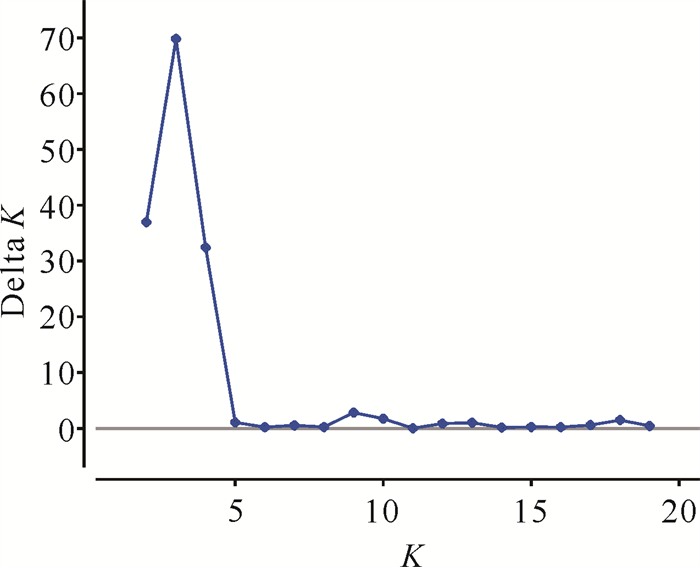
利用6对SSR引物对114个样本的群体遗传结构进行评估。根据似然值最大原则,按最佳K值确定最佳分群数,当K值等于3时为最佳(图 4),可以将114个样本划分为3个亚群(图 5)。种群LH和XH划为一个亚群,种群PR与GH划为一个亚群,种群ZD和ZG划为一个亚群。种群ZWS为引种种群,分布于各个亚群,但集中分布于ZD与ZG的亚群,说明种群ZWS引种的种源多来自这些种群。
|
| 图 4 Structure分析时的Delta K值分布 Fig. 4 Delta K value distribution of structure analysis |

|
| 图 5 K=3时114个样品的种群遗传结构 Fig. 5 Population genetic structure of 114 samples at K=3 |
PCoA通过直观地比较坐标轴中样本之间的直线距离,即可反映2个(组)样本之间的差异性,2个(组)样本之间的直线距离较近,则表示这2个(组)样本的差异性较小;相反,若2个(组)样本之间的直线距离较远,则表示它们之间差异性较大。由图 6可以看出,种群XH、LH、ZG、ZWS、ZD集中在一起,其种群距离较近;种群PR、GH聚集在一起,表明这2个种群距离较近。
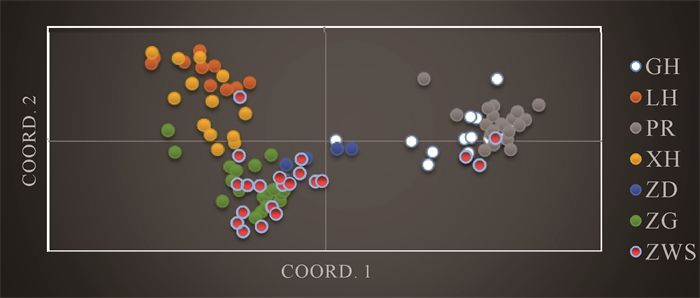
|
| 图 6 114个样本的主坐标分析 Fig. 6 Principal coordinate analysis of 114 samples |
2.6 遗传距离与聚类分析
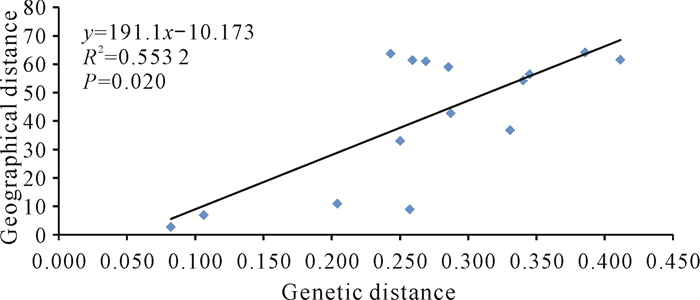
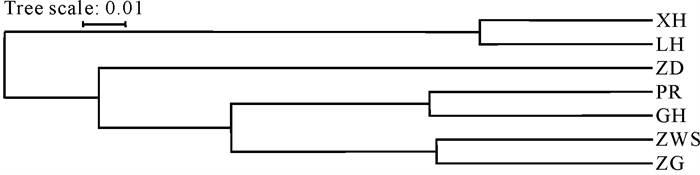
6个野生种群地理距离最近的是LH和XH,相聚2.75 km;距离最远的是ZD与XH,两者距离64.06 km(表 7)。6个野生群体间遗传距离最大为0.411 (LH与ZD),最小为0.082 (LH与XH)。根据Mantel检验,石山苏铁的遗传距离和地理距离具有显著性的关系(P=0.02 < 0.05,图 7),地理隔离是造成种群之间高度种间分化的主要因素。采用UPGMA进行聚类分析,结果显示LH和XH聚类在一起,ZD单独分支,PR和GH聚类在一起后再与ZWS、ZG种群聚类在一起(图 8)。
| GH | ZD | ZG | LH | XH | PR | |
| GH | - | 0.287 | 0.204 | 0.286 | 0.269 | 0.106 |
| ZD | 42.59 | - | 0.250 | 0.411 | 0.386 | 0.331 |
| ZG | 10.99 | 32.97 | - | 0.259 | 0.243 | 0.257 |
| LH | 58.96 | 61.56 | 61.39 | - | 0.082 | 0.340 |
| XH | 61.01 | 64.06 | 63.66 | 2.75 | - | 0.345 |
| PR | 6.87 | 36.71 | 8.86 | 54.22 | 56.39 | - |
|
| 图 7 石山苏铁野生群体间的遗传距离和地理距离的Mantel检验 Fig. 7 Mantel test for genetic distance and geographical distance among wild populations of C.sexseminifera |
|
| 图 8 7个种群的UPGMA聚类结果 Fig. 8 UPGMA clustering results of 7 populations |
3 讨论
SSR又称为微卫星DNA,是基于简单重复序列多态性的一种分子标记,是基因组遗传图谱和物理图谱的理想界标[10-12]。SSR标记目前已广泛应用于遗传多样性检测[13, 14]、遗传图谱的构建[15, 16]、基因定位[17, 18]、种质鉴定[19]、品种选育[20]、系谱分析、物种起源与进化分析[21, 22]等领域。一般来说,一个物种的遗传多样性水平越高,面对环境变化时的适应性就越强[23, 24]。对石山苏铁的保护遗传学研究显示:石山苏铁各种群的I平均值为0.828,He平均值为0.444,超过了中国苏铁属植物He的平均水平(0.442)[1],表明石山苏铁遗传多样性处于中等水平。GH、ZD、ZG 3个种群的Ho小于He,说明这些种群的基因特征是由环境而非遗传引起的,也意味着遗传多样性的降低可能是由于环境的变化导致种群为适应特殊的生存环境而减少遗传多样性,并造成种群生长不健康、种群年龄结构不合理等问题。LH、PR、XH 3个种群的Ho大于He,表明这些种群的基因特征是由遗传变异引起的,意味着群体内部存在较高的遗传多样性,这可能更有利于个体的健康。苏铁属不同物种间并没有一套通用的SSR-PCR反应体系,建立适合石山苏铁的PCR反应体系十分必要。因此,建立适合石山苏铁PCR的最佳反应体系、反应程序,以及设计更多特异性强的SSR引物,可为石山苏铁的遗传多样性分析提供足够多的信息位点。对石山苏铁及其争议种之间进行遗传鉴定及亲缘关系研究,特别是对石山苏铁复合群亲缘关系的鉴定具有十分重要的意义。
根据分析结果和样品地点可知,受自然保护区保护的PR和ZG大种群的遗传多样性没有预期高,保护区外未受保护的GH小种群的遗传多样性也没预期低;相反,GH小种群的多样性甚至高于PR和ZG大种群的遗传多样性,而且迁地保护的种群遗传多样性高于野生种群,这些结果显示亟需开展野生种群的人工杂交授粉,并收集野生石山苏铁种子进行迁地保护,进而有利于小居群种群数量的增加、生境恢复和重建。
随着广西经济的快速发展,愈演愈烈的毁林开荒、开山采矿、劈山开路及大量盗挖等活动使得石山苏铁的生境遭到了严重破坏,苏铁分布区被分割得支离破碎,使得其种群数量急剧减少。1996年以前,石山苏铁在崇左江洲区、扶绥县、龙州县、隆安县、大新县和百色平果县的分布面积广、植株数量多,保守估计种群植株个体数量很可能超过5 000株[4]。由于石山苏铁树干基部圆盘状,适合用于制作盆景,人们大量采挖,2001-2004年福建、湖南、湖北等省的商贩从广西收购的石山苏铁累计有66 t[25],而2022年南宁隆安县警方从不法分子手中追回1 972株石山苏铁[26]。除在保护区外,现已经很难在其他分布区找到1 m以上的石山苏铁植株。生境的严重破坏和非法盗挖现象使得石山苏铁野生分布区迅速缩小,种群现存个体数量急剧减少,种群结构被破坏,成年苏铁植株急剧减少。同时,受雌球花和雄球花的花期不一致、雌雄比例严重失衡的影响,石山苏铁授粉率和结实率低,这些现象导致石山苏铁种群内的基因交流缓慢,遗传多样性降低,最终可能导致种群灭绝[27]。
基于石山苏铁的遗传多样性及各种群的遗传结构、种群动态及濒危特征提出相应的保护策略在石山苏铁保护工作中十分必要。因此,建议采用就地保护与迁地保护相结合的方式对石山苏铁进行保护。(1)就地保护。石山苏铁所在的桂西南石灰岩地区是我国优先保护的17个生物多样性关键地区之一,该地区主导的生态功能就是生物多样性保护,并已经建立了相当数量的自然保护区,比如弄岗国家级自然保护区、广西崇左白头叶猴国家级自然保护区、隆安龙虎山自然保护区等,因此石山苏铁得到了较好的保护[2, 27]。石山苏铁在百色平果县的分布面积较广、植株数量多,但平果县是我国重要的铝矿生产地,开山采矿使得石山苏铁面临着巨大的生境破坏的危险。而相近的南宁隆安县同样分布有大量的石山苏铁,河池大化县分布有锈毛苏铁(C. ferruginea),因此建议在百色平果县、百色田阳区、南宁隆安县、河池大化县三市四县区建立一个苏铁植物的专类保护区,以便更好地保护广西野生石山苏铁类群。(2)迁地保护。在遗传多样性分析检测的基础上,筛选出遗传多样性高的优良种群和个体进行迁地保护,通过优良种群开展石山苏铁传粉机制、繁育系统、种苗扩繁等基础研究。(3)回归保护。积极开展种苗繁育后的回归工作,建立专门的人工培育基地,保存重要的苏铁种质基因,通过生物技术使其复壮并扩大野生种群数量。(4)加强群众的宣传教育力度,依法保护国家重点保护野生植物。充分利用官媒和自媒体多种形式进行科普宣传,提高人们对野生苏铁保护重要性的认识。同时,加大苏铁植物线上和线下违法销售的执法力度,严厉打击破坏野生苏铁资源的行为。
4 结论石山苏铁遗传分化较大,种群间存在较大的遗传差异,同一物种具有不同遗传学特征的种群应分别进行重点保护和保育,优先保护遗传多样性较高、单倍型独特的种群。6个野生种群的He值大小顺序为崇左广河(GH)>崇左排汝(PR)>隆安陇怀(LH)>崇左中干(ZG)>百色作登(ZD)>隆安新会(XH),因此需要重点保护和引种的是崇左广河(GH)这一遗传多样性高的野生种群。6对SSR引物中有5对显著偏离了HWE,但是不同种群的哈温平衡不一致,由此推断石山苏铁遗传多样性丧失既有自身因素,又有人类干扰下栖息地丧失的原因,因此亟需对石山苏铁的传粉机制、交配系统和生态适应性机理开展保护生物学研究。
| [1] |
席辉辉, 王祎晴, 潘跃芝, 等. 中国苏铁属植物资源和保护[J]. 生物多样性, 2022, 30(7): 73-85. |
| [2] |
ZHENG Y, LIU J, FENG X Y, et al. The distribution, diversity, and conservation status of Cycas in China[J]. Ecology and Evolution, 2017, 7(9): 3212-3224. DOI:10.1002/ece3.2910 |
| [3] |
CHEN C J. Taxonomical and biogeographical studies on Cycas L. (Cycadaceae) in China[C]//Biology and conservation of Cycads. Proceedings of the fourth international conference on Cycad biology. [S. l. ]: International Academic Publishers, 1999, 1: 10-128.
|
| [4] |
钱丹. 广西石山苏铁复合体的资源调查和分类学研究[D]. 广州: 中山大学, 2009.
|
| [5] |
ZHANG H D, ZHONG Y C. New species of Cycas from Guangxi[J]. Journal of Sun Yat-sen University (Natural Science Edition), 1997, 36(3): 69-71. |
| [6] |
WANG Z F, YE W H, CAO H L, et al. Identification and characterization of EST-SSRs and cpSSRs in endangered Cycas hainanensis[J]. Conservation Genetics, 2008, 9(4): 1079-1081. DOI:10.1007/s10592-007-9461-5 |
| [7] |
PRITCHARD J K, STEPHENS M, DONNELLY P. Inference of population structure using multilocus genotype data[J]. Genetics, 2000, 155(2): 945-959. DOI:10.1093/genetics/155.2.945 |
| [8] |
EVANNO G, REGNAUT S, GOUDET J. Detecting the number of clusters of individuals using the software structure: a simulation study[J]. Molecular Ecology, 2005, 14(8): 2611-2620. DOI:10.1111/j.1365-294X.2005.02553.x |
| [9] |
YANG Y, LI Y, LI L F, et al. Isolation and characterization of microsatellite markers for Cycas debaoensis Y.C.Zhong et C.J.Chen (Cycadaceae)[J]. Molecular Ecology Resources, 2008, 8(4): 913-915. DOI:10.1111/j.1755-0998.2008.02114.x |
| [10] |
边境, 王晓楠, 曹焜, 等. 大麻EST-SSR遗传结构分析及指纹图谱构建[J]. 植物遗传资源学报, 2023, 24(6): 1794-1808. |
| [11] |
ZHANG Y, SLEDGE M K, BOUTON J H. Genome mapping of white clover (Trifolium repens L.) and comparative analysis within the Trifolieae using cross-species SSR markers[J]. Theoretical and Applied Genetics, 2007, 114(8): 1367-1378. DOI:10.1007/s00122-007-0523-3 |
| [12] |
秦惠珍, 杨秀德, 唐健民, 等. 极小种群野生植物十万大山苏铁SSR和ISSR反应体系建立及引物筛选[J]. 分子植物育种, 2022, 20(8): 2689-2698. |
| [13] |
PURWOKO D, CARTEALY I C, TAJUDDIN T, et al. SSR identification and marker development for sago palm based on NGS genome data[J]. Breeding Science, 2019, 69(1): 1-10. DOI:10.1270/jsbbs.18061 |
| [14] |
GONG W, GU L, ZHANG D X. Low genetic diversity and high genetic divergence caused by inbreeding and geographical isolation in the populations of endangered species Loropetalum subcordatum (Hamamelidaceae) endemic to China[J]. Conservation Genetics, 2010, 11: 2281-2288. DOI:10.1007/s10592-010-0113-9 |
| [15] |
ZRAIDI A, STIFT G, PACHNER M, et al. A consensus map for Cucurbita pepo[J]. Molecular Breeding, 2007, 20(4): 375-388. DOI:10.1007/s11032-007-9098-6 |
| [16] |
施平丽, 严华兵, 曹升, 等. 基于SSR的29份栽培葛遗传多样性分析[J/OL]. 分子植物育种, 2023: 1-19[2023-08-17]. http://kns.cnki.net/kcms/detail/46.1068.S.20230707.0940.008.html.
|
| [17] |
王宣, 陈秋夏, 刘宇, 等. 海滨木槿EST-SSR分子标记开发及群体遗传多样性评价[J/OL]. 分子植物育种, 2023: 1-12[2023-08-17]. http://kns.cnki.net/kcms/detail/46.1068.S.20230615.1851.019.html.
|
| [18] |
高铖铖, 燕丽萍, 吴德军, 等. 基于SSR标记的白蜡群体遗传多样性和群体结构分析[J]. 中南林业科技大学学报, 2023, 43(6): 69-78. |
| [19] |
刘金洋, 周琰琰, 林云, 等. 南方90份秋播区蚕豆粒型性状的SSR关联分析[J]. 植物遗传资源学报, 2023, 24(6): 1602-1618. |
| [20] |
苏群, 王虹妍, 刘俊, 等. 基于SSR荧光标记构建睡莲核心种质[J]. 园艺学报, 2023, 50(10): 2128-2138. |
| [21] |
MARYAM J, MITTAL A. Foreign direct investment into BRICS: an empirical analysis[J]. Transnational Corporations Review, 2020, 12(1): 1-9. |
| [22] |
UENO S, YOSHIMARU H, TOMARU N, et al. Development and characterization of microsatellite markers in Camellia japonica L.[J]. Molecular Ecology, 1999, 8(2): 335-336. |
| [23] |
王峥峰, 彭少麟, 任海. 小种群的遗传变异和近交衰退[J]. 植物遗传资源学报, 2005, 6(1): 101-107. |
| [24] |
秦惠珍, 盘波, 赵健, 等. 极小种群野生植物白花兜兰ISSR遗传多样性分析[J]. 广西科学, 2022, 29(6): 1134-1140. |
| [25] |
黎德丘. 广西野生苏铁资源现状与保护对策[J]. 中南林业调查规划, 2004, 23(3): 33-36. |
| [26] |
广西警方追回1972株石山苏铁, 这是国家一级重点保护植物![Z/OL]. (2022-03-14)[2023-06-02]. https://m.163.com/dy/article/H2ECUSO20517CDN2.html?spss=adap_pc.
|
| [27] |
龚丽莉, 杨永琼, 余志祥, 等. 苏铁属植物资源的保护及建议[J]. 中国林副特产, 2022(1): 85-87. |



