2. 广西科学院防城港分院, 北部湾海洋产业研究院, 广西防城港 538001;
3. 广西巴马鑫坚实业集团有限公司, 广西壮族自治区重要鱼类遗传育种与生态渔业产业技术工程研究中心, 广西河池 547500
2. Beibu Gulf Marine Industrial Research Institute, Fangchenggang Branch of Guangxi Academy of Sciences, Fangchenggang, Guangxi, 538001, China;
3. Guangxi Engineering Research Center for Important Fish Genetic Breeding and Ecological Fishery Industry Technology, Guangxi Bama Xinjian Industrial Group Co., Ltd., Hechi, Guangxi, 547500, China
倒刺鲃属(Spinibarbus)鱼类共有5个有效种,包括中华倒刺鲃(S.sinensis)、倒刺鲃(S.denticulatus)、光倒刺鲃(S.hollandi, 与刺鲃、黑脊倒刺鲃S.caldwelli同种异名)、多鳞倒刺鲃(S.polylepis)和云南倒刺鲃(S.yunnanensis)[1, 2]。其中,中华倒刺鲃、倒刺鲃和光倒刺鲃深受消费者喜爱,显示出较为强劲的市场潜力,现已成为福建、广东、广西、江西等省区的重要养殖品种之一[2, 3]。根据市场调研,福建光倒刺鲃的年需求量约为500万尾,广西的倒刺鲃和光倒刺鲃的年需求量约为300万尾。倒刺鲃属鱼类的繁殖技术早有报道,熊天寿等[4]在1976-1983年进行了中华倒刺鲃的人工繁殖试验;1999年,罗钦洪等[5]报道了光倒刺鲃的人工繁殖技术;江林源等[6]在2002-2006年进行了倒刺鲃人工繁殖技术的研究。尽管倒刺鲃属鱼类的人工繁殖技术早已成熟,但其鱼苗仍不能满足养殖的需求,捕捞会对野生倒刺鲃属鱼类造成压力。为了保护野生倒刺鲃属鱼类资源,国家有关部门在倒刺鲃属鱼类原产地建立保护区进行保护,如漓江光倒刺鲃金线鲃国家级水产种质资源保护区、嘉陵江岩原鲤中华倒刺鲃国家级水产种质资源保护区、增江光倒刺鲃大刺鳅国家级水产种质资源保护区、流溪河光倒刺鲃水产种质资源国家级保护区、永春湖洋溪黑脊倒刺鲃国家级水产种质资源保护区、龙江河光倒刺鲃国家级水产种质资源保护区等。
人工养殖的鱼类通常不能自行产卵,必须进行人工催产[7]。催产激素在人工繁殖中起着至关重要的作用,其中催产激素的合理使用尤为重要,如催产激素的合理组合、注射次数、注射间距,鱼类的成熟度、年龄、是否初产以及水温、水流等[8]。此外,在生产中倒刺鲃属鱼类也必须进行人工催产才能人工授精,催产激素在倒刺鲃属鱼类人工繁殖中起到决定性作用。本文综述了鱼用催产激素在倒刺鲃属(Spinibarbus)鱼类人工繁殖中的应用进展,为倒刺鲃属鱼类规模化生产提供参考。
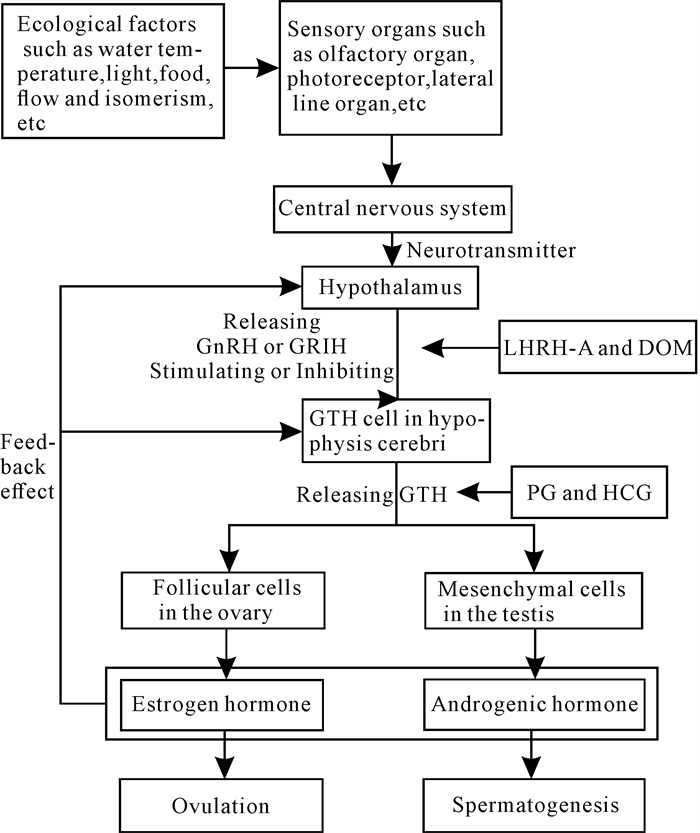
1 神经系统和内分泌激素对鱼类性腺发育成熟的调节鱼类周期性生殖生理活动是由一系列神经内分泌激素调控的[7],是通过下丘脑-脑垂体-性腺轴进行有机调节[9, 10](图 1)。鱼类的感觉器官(嗅觉器官、视觉器官和侧线器官等)把环境生态因子(水温、光照、水流、食物和异性等)的变化传递到脑,使下丘脑分泌促性腺激素释放激素(Gonadotropin Releasing Hormone,GnRH),并激发脑垂体分泌促性腺激素(Gonadotropin Hormone,GTH),它刺激性腺产生性类固醇激素,从而促使性腺发育成熟排出精子和卵子[7]。性类固醇激素除了对生殖细胞产生直接影响外,还可通过反馈作用调节神经激素和GTH的分泌活动[9]。
在生产实践中,从业者采用注射激素的方式对鱼类下丘脑-脑垂体-性腺轴进行调控, 促进其性腺成熟以及排卵、受精。鲤科(Cyprinidae)鱼类脑垂体(Pituitary Gland,PG)和人绒毛膜促性腺激素(HCG)是外源的GTH[7, 11-14],它们的作用途径是刺激性腺细胞发育和产生性类固醇激素[10]。促黄体激素释放激素类似物(Luteininzing Hormone Releasing Hormone Analogue,LHRH-A)和地欧酮(Domperidone,DOM)主要作用于脑垂体[8, 9]。LHRH-A诱发被催产亲鱼的脑垂体分泌内源GTH,由内源GTH诱发滤泡细胞和间质细胞产生性类固醇激素[9]。鲤科鱼类起主要作用的神经激素是GnRH和多巴胺[7]。鱼类下丘脑中的促性腺激素释放抑制激素(Gonadotropin Release-Inhibitory Hormone,GRIH)可能就是多巴胺[10]。多巴胺能抑制脑垂体释放GTH,减少血浆GTH的浓度[7, 10]。DOM是多巴胺D-2型受体拮抗物,不仅能抑制多巴胺作用的强特异性和高活性,而且不能通过血-脑屏障,因而不会产生副作用,是比较理想的鱼类催产激素[7]。无论是PG和HCG作用途径,还是LHRH-A、DOM作用途径,最终目的是要通过分泌性类固醇激素,促使卵母细胞成熟、排卵,促使精母细胞成熟、精子生成、排精[9]。
2 倒刺鲃属鱼类的繁殖习性倒刺鲃属鱼类种间生长速度存在差异,其中倒刺鲃体色艳丽,生长速度快;中华倒刺鲃生长速度中等;黑脊倒刺鲃生长速度较慢[2, 15]。非繁殖季节雌雄亲鱼较难区分,如同一批鱼中,一般雌鱼生长速度较雄鱼快;繁殖季节雌鱼腹部较膨大,雄鱼追星发达,手按可以挤出精液[2, 6]。黑脊倒刺鲃的珠星在尾柄及尾鳍上明显,中华倒刺鲃和倒刺鲃的珠星均在吻部及臀鳍[2]。倒刺鲃属鱼类的繁殖习性见表 1[2]。中华倒刺鲃雌鱼和雄鱼性成熟年龄分别为4-5龄和3-4龄,而雌鱼适宜繁殖年龄为5-9龄[2, 15];黑脊倒刺鲃雌鱼和雄鱼性成熟年龄分别为3-4龄和2-3龄,而雌鱼适宜繁殖年龄为4-8龄[2, 15];倒刺鲃雌鱼和雄鱼性成熟年龄分别为4-5龄和3-4龄,而雌鱼适宜繁殖年龄为5-10龄[6]。中华倒刺鲃和倒刺鲃绝对怀卵量大[2, 6, 15],黑脊倒刺鲃绝对怀卵量小[2, 15]。倒刺鲃属鱼类均为分批产卵类型[2],催产适宜水温为22-28 ℃[2],福建每年5-9月[2, 15]、广西每年4-8月可以催产[6],催产间期为40-50 d[2]。
| 种类 Species |
性成熟年龄/龄 Sexual maturation age/Age |
雌性适宜繁殖年龄/龄 Suitable for breeding age of female/Age |
催产适宜水温/℃ Suitable spawning water temperature/℃ |
催产间期/d Induction interval periods/d |
雄鱼珠星的分布部位 The position of male fish pearl organ |
|
| 雌 Female |
雄 Male |
|||||
| S.hollandi | 3-4 | 2-3 | 4-8 | 24-28 | The caudal peduncle and tail fin | |
| S.denticulatus | 4-5 | 3-4 | 5-10 | 22-28 | Snout and anal fin | |
| S.sinensis | 4-5 | 3-4 | 5-9 | 22-28 | 40-50 | Snout and anal fin |
3 鱼用催产激素种类
我国在20世纪50-60年代已经利用同类或异类鱼的PG作为催产剂[16],PG易溶于水,具有促进生殖细胞生长、发育、成熟以及促进生殖细胞排放的双重作用,其效价与亲缘关系密切相关。除GTH外,PG匀浆液还含有其他多种激素,它们可能会对生殖生理产生负面影响,也可能引起鱼体的免疫反应,从而导致抗药性,使催产效果减弱[8, 12]。目前最常用的是鲤鱼、鲫鱼的PG,从鱼体上取下的PG,放入丙酮(或无水酒精)中进行脱水和脱脂[9, 17],妥善保存10年内有效。当鱼类PG数量远远不能满足生产后,人们提出用HCG替代PG,HCG使用方便,易储存,易于标准化,因此被广泛应用[10]。HCG是由孕妇胎盘的滋养层细胞分泌的一种糖蛋白,易溶于水,从孕妇尿中提取,具有促排卵、加快性腺发育的作用[18, 19]。HCG是由239个氨基酸组成的糖蛋白激素,呈白色或淡黄色粉末,遇热和水易失效[8]。HCG和鲤鱼PG是最早用于四大家鱼人工催产的激素,而且均为糖蛋白激素[9]。早期人工合成的LHRH-A是一种9肽类似物,它是由哺乳类GnRH的第6位甘氨酸改为D型丙氨酸,同时去掉第10位的甘氨酸再加上乙酰胺改造而来,分子结构为焦谷氨酸-组氨酸-色氨酸-丝氨酸-酪氨酸-D-丙氨酸-亮氨酸-精氨酸-脯氨酸-乙酰胺[7, 9, 20],直接作用于脑垂体,效果甚佳。目前应用的GnRH类似物主要有LHRH-A2(9肽)和LHRH-A3(10肽),二者均为高效催产剂,均促使脑垂体分泌GTH,LHRH-A2有显著的促熟作用[8]。鲑鱼GnRH的分子结构为焦谷氨酸-组氨酸-色氨酸-丝氨酸-酪氨酸-甘氨酸-色氨酸-亮氨酸-脯氨酸-甘氨酸-乙酰胺[21-23],而鲑鱼GnRH的类似物sGnRH-A也是9肽,其分子结构为焦谷氨酸-组氨酸-色氨酸-丝氨酸-酪氨酸-D-精氨酸-色氨酸-亮氨酸-脯氨酸-乙酰胺,它的催产活性比LHRH-A强几倍[7, 20, 24],且低温下对鱼类的催产效果更佳[8]。DOM是多巴胺D-2型受体的拮抗剂(抑制剂)[7, 8, 25, 26],一般与LHRH-A配合使用,可显著加快和提高催情、催熟和催产效果[8]。著名的林彼方法(Linpe method)是采用多巴胺的抑制剂匹莫齐特(Pimozide)或DOM加LHRH-A诱导鱼类产卵[27, 28]。倒刺鲃属鱼类人工繁殖的催产激素有PG、LHRH-A2、LHRH-A3、HCG、sGnRH-A和DOM,其物理特性、作用与特点见表 2[8]。
| 催产激素 Oxytocin hormone |
物理性质 Physical property |
作用 Effect |
特点 Characteristics |
剂型 Dosage forms |
| PG | GTH,Glycoprotein hormones | Stimulating germ cell development, maturation and releasing | GTH dissolves easily in water.There was a positive correlation between fish affinities and effectiveness of PG.Fish pituitary homogenate also contains a variety of other hormones.They may have side effects on reproductive physiology and may also cause immune responses in the fish.Eventually they lead to drug resistance, which weakens the effectiveness of PG | Granula |
| HCG | Glycoprotein hormones containing 239 amino acids | Stimulating mature eggs and sperms releasing | White or light yellow powder, easy to dissolve in water, easy to lose efficacy in heat, easy to decompress and lose efficacy in aqueous solution | Powder |
| LHRH-A2 | Luteinizing hormone-releasing hormone analogue; peptide containing 9 amino acids | Stimulating secretion of GTH by the pituitary gland | A significant effect on promoting mature | Powder |
| LHRH-A3 | Luteinizing hormone-releasing hormone analogue; peptide containing 10 amino acids | Stimulating secretion of GTH by the pituitary gland | A highly effective oxytocin | Powder |
| sGnRH-A | Salmon gonadotropin-releasing hormone analogue | Stimulating secretion of GTH by the pituitary gland | Often used at low temperature | Powder or solution |
| DOM | Dopamine D-2 receptor antagonist | It can block the inhibitory effect of dopamine on GTH release and stimulate secretion of GTH | Generally used with LHRH-A; fast courtship, stimulating mature and easy propagation | Powder or solution |
4 倒刺鲃属鱼类催产激素和使用剂量
催产激素的组合使用和使用剂量是人工繁殖成功的关键。在生产实践中,可以从作用于脑垂体和/或性腺这两个途径来选用合适的催产激素。作用于脑垂体的LHRH-A为9-10个氨基酸组成的小肽,小剂量的激素会引起机体产生抗原,这需要较长时间的积累,不会引起亲鱼死亡[29];作用于性腺的HCG和PG是由200多个氨基酸组成的糖蛋白激素,较易引起免疫反应,甚至引起亲鱼死亡。倒刺鲃属鱼类催产激素是根据林彼方法(作用于脑垂体)或林彼方法的延伸(作用于脑垂体和性腺)进行选择(表 3)。
| 种类 Species |
催产激素和剂量(每千克体质量) Oxytocin hormones and dose (per kg body weight) |
注射次数 Injection times |
文献来源 Reference source |
| S.hollandi | sGnRH-A 50-80 μg + DOM 5-8 mg | 1 | [2] |
| LHRH 1.5-3.0 mg+HCG 1 000-1 200 IU+DOM 3 mg | 2 | [30] | |
| PG 2 mg+LHRH-A2 3 μg+DOM 3 mg | 2 | [31] | |
| PG 3 mg+LHRH-A2 3 μg+DOM 3 mg | 2 | [32] | |
| LHRH-A2 10-20 μg + DOM 5-10 mg | 1 or 2 | [33] | |
| LHRH-A2 5-10 μg+HCG 800-1 500 IU+DOM 8-10 mg | 2 | [15] | |
| LHRH-A2 5-8 μg+DOM 3-5 mg | 1 | [34] | |
| S.yunnanensis | LHRH-A2 9-16 μg+DOM 3-5 mg | 2 | [35] |
| S.denticulatus | sGnRH-A 50-80 μg+ DOM 5-8 mg | 1 | [2] |
| PG 2 mg+LHRH-A2 3 μg+DOM 3 mg | 1 | [6] | |
| LHRH-A 8 μg+DOM 5 mg | 2 | [36] | |
| LHRH-A2 5 μg+HCG 1 000 IU+DOM 5 mg | 2 | [37] | |
| PG 30 mg/LHRH-A 40 μg+DOM 10 mg | 1 | [38] | |
| S.sinensis | LHRH-A3 3 μg+HCG 500 IU+DOM 3 mg | 1 | [39] |
| sGnRH-A 50-80 μg+DOM 5-8 mg | 1 | [2] | |
| LHRH-A2 10-15 μg+HCG 1 000-1 200 IU+DOM 5-6 mg | 2 | [40] | |
| PG 1.5-2 mg+LHRH-A 5-8 μg+HCG 500-600 IU | 2 | [41] | |
| LHRH-A 5-10 μg+HCG 1 000-2 000 IU+DOM 3-5 mg | 2 | [42] | |
| PG 2-3 mg+LHRH-A2 5-8 μg+HCG 1 000-1 200 IU; LHRH-A2 10-15 μg+HCG 1 000-1 200 IU+DOM 5-6 mg | 2 | [43] | |
| DOM 8 mg+LHRH-A2 30 μg+HCG 2 000 IU | 2 | [44] | |
| sGnRH-A 50-80 μg+DOM 5-8 mg | 1 | [45] | |
| LHRH-A 15-20 μg+HCG 1 000-1 500 IU+DOM 5 mg | 2 | [46] | |
| PG/DOM 3-5 mg+LHRH-A 5-10 μg+HCG 1 000-2 000 IU | 2 | [47] | |
| LHRH-A2 5-10 μg+HCG 1 000-2 000 IU+DOM 3-5 mg | 2 | [48] | |
| HCG 1 000-1 200 IU+DOM 3 mg | 1 | [49] | |
| LHRH-A 15-30 μg+HCG 800-2 000 IU+DOM 5-10 mg | 2 | [50] |
5 催产激素的使用方式
我国催产激素的使用方式有注射、浸泡、口服和包埋4种[8]。按注射部位可分为腹腔注射和肌肉注射,按注射次数可分为一次注射和两次注射[9, 51]。一次注射操作简便,不易损伤亲鱼,但亲鱼体内某些酶会对催产激素造成破坏,从而降低活性;两次注射操作麻烦,对亲鱼造成的应激反应大,但可以减轻或防止某些酶对催产激素的破坏,保证催产激素的活性,特别是在水温较低时采用两次注射的效果更为明显[9]。采用激素浸泡泥鳅的催产方法方便省时,催产效果与使用注射法差别不大[52],但该浸泡方法可能只适于有鳃、皮肤和肠呼吸功能的鱼类。口服方式虽然使用方便,但是吸收差。光唇鱼(Acrossocheilus fasciatus)的投喂激素剂量是注射法的3倍时,出苗数高于注射法[53]。LHRH-A粗制品拌料投喂金鲫(Carassius auratus)8周后,其血清GTH水平明显提高,进而促进性腺的发育成熟[54]。埋植技术是将LHRH-A与胆固醇或胆固醇-纤维素或生物可降解聚合物混合制成药条埋植在鱼体内,使LHRH-A缓慢释放并在较长时间保持血液中较高的GTH含量,促使不同步发育的卵母细胞最终成熟[7]。包埋技术主要应用于海水鱼类催产,利用该技术已成功诱导鲑鳟鱼类、遮目鱼(Chanos chanos)、日本鳗鲡(Anguilla japonica)、尖吻鲈(Lates calcarifer)、金头鲷(Sparus auratus)、大口黑鲈(Micropterus salmoides)、大西洋鲱鱼(Clupea harengus)、美洲西鲱(Alosa sapidissima)、赤点石斑鱼(Epinephelus akaara)、地中海赤鲷(Pagrus pagrus)、条纹狼鲈(Morone saxatilis)、大西洋鲽(Pleuronectes ferrugineus)、大西洋牙鲆(Paralichthys dentatus)、大菱鲆(Scophthalamus maximus)、南方鲆(P.lethostigma)、鲻鱼(Mugil cephalus)等鱼类排卵[7, 55-57]。倒刺鲃属鱼类均采用注射方式,并且大多采用二次注射。
6 催产激素的配制激素的用量要根据注射亲鱼的体质量来确定,雄鱼减半或不注射。一般大型鱼类(四大家鱼)每5 kg注射1 mL催产激素,中小型鱼类(鲤、鲫)每尾注射0.5-2.0 mL[51],20 g以下的泥鳅亲鱼适宜注射0.1 mL左右[8]。倒刺鲃的雌鱼注射1 mL催产激素,雄鱼注射0.5 mL[6]。在人工繁殖时,催产激素需现配现用,配制好的催产激素最好在30 min内注射完毕[51]。考虑到在注射催产激素时有一定的药物损失,催产药物和生理盐水的量均增加5%-10%[8, 51]。配制时,首先估算出亲鱼总体质量(即雌鱼总体质量+1/2雄鱼总体质量)以及所需要的激素总剂量和生理盐水总体积(按雌鱼注射1 mL,雄鱼注射0.5 mL),然后将生理盐水和激素混合均匀即可[6]。
例如:光倒刺鲃30尾,其中20尾雌鱼平均体质量2 kg,10尾雄鱼平均体质量2 kg,雄鱼注射剂量减半。每千克鱼体质量注射剂量为LHRH-A2 10 μg+HCG 800 IU+DOM 5 mg。
计算理论激素用量:LHRH-A2=10×(20×2+10×2×0.5)=500 μg;HCG=800×(20×2+10×2×0.5)=40 000 IU;DOM=3×(20×2+10×2×0.5)=150 mg。
计算实际激素用量(实际配制时,各种激素用量增加10%):LHRH-A2 =500×1.1=550 μg;HCG=40 000×1.1=44 000 IU;DOM=150×1.1=165 mg。
计算生理盐水的用量(生理盐水的用量增加10%):按雌鱼注射1 mL,雄鱼注射0.5 mL,需用生理盐水的量=(20×1+10×0.5)×1.1=27.5 mL。
对于二次注射的情况,需要确定第一次和第二次注射的激素种类,然后分别计算出第一次和第二次激素的用量,分别配制,同时还需要根据亲鱼的成熟度和水温来确定第二次注射激素的用量和时间。
7 展望从20世纪80年代起,鱼类催产激素已应用于倒刺鲃鱼类人工繁殖中,但是催产激素的种类并没有改变,且催产激素的作用机理也未深入阐述,大部分研究都是基于催产效果的研究。为实现倒刺鲃属鱼类规模化生产,建立成熟的人工繁育技术,针对下丘脑-脑垂体-性腺轴开展调控机制研究,提出以下4个研究方向:(1)倒刺鲃属鱼类促性腺激素释放激素及其受体的研究;(2)倒刺鲃属鱼类类固醇激素的正反馈机制研究;(3)新型高效催产激素的研发,尤其是稳定高效的LHRH-A;(4)基于基因调控的倒刺鲃属鱼类人工繁育技术的发展方向。
| [1] |
杨君兴, 陈银瑞. 倒刺鲃属鱼类系统分类的研究(鲤形目: 鲤科)[J]. 动物学研究, 1994, 15(4): 1-10. |
| [2] |
陈晓. 三种倒刺鲃全人工批量繁育技术[J]. 河北渔业, 2010(4): 26-29. DOI:10.3969/j.issn.1004-6755.2010.04.014 |
| [3] |
胡安忠. 刺鲃、中华倒刺鲃及倒刺鲃的研究现状分析[J]. 江西水产科技, 2006(1): 33-38. |
| [4] |
熊天寿, 陈明忠. 中华倒刺鲃的人工繁殖和移养试验[J]. 淡水渔业, 1988, 18(6): 11-13. |
| [5] |
罗钦洪, 林义浩, 钟良明, 等. 光倒刺鲃的人工繁殖技术研究[J]. 福建水产, 1999, 21(4): 48-52. |
| [6] |
江林源, 梁万文, 黄光华, 等. 倒刺鲃的人工繁殖技术研究[J]. 西南农业学报, 2006, 19(6): 1172-1175. DOI:10.3969/j.issn.1001-4829.2006.06.043 |
| [7] |
林浩然. 激素和人工诱导鱼类繁殖[J]. 生物学通报, 1999, 34(8): 1-3. |
| [8] |
骆小年, 赵兴文, 段友健. 中国主要养殖经济鱼类人工催产药物使用进展[J]. 大连海洋大学学报, 2020, 35(1): 10-18. |
| [9] |
刘筠. 中国养殖鱼类繁殖生理学[M]. 北京: 中国农业出版社, 1993.
|
| [10] |
施瑔芳. 我国鱼类生殖生理学研究概况[J]. 海洋与湖沼, 1992, 23(3): 325-333. |
| [11] |
HOSSAIN M B, RAHMAN M M, SARWER M G, et al. Comparative study of carp pituitary gland (PG) extract and synthetic hormone ovaprim used in the induced breeding of stinging catfish, Heteropneustes fossilis (Siluriformes: Heteropneustidae)[J]. Our Nature, 2013, 10(1): 89-95. DOI:10.3126/on.v10i1.7755 |
| [12] |
BEGUM N, RAHAMN M, HUSSAIN M, et al. Effect of carp PG doses on induced breeding of Shing, Heteropneustes fossilis (Bloch)[J]. Bangladesh Journal of Fisheries Research, 2001, 5(2): 145-148. |
| [13] |
AL-BACHRY W S J, AL-TAWASH A S A. Use of GnRH and HCG hormones in the artificial propagation of common carp fish (Cyprinus carpio L.)[J]. Plant Archives, 2019, 19(2): 1436-1439. |
| [14] |
SHANTHANAGOUDA A H, KHAIMAR S O. Breeding and spawning of fishes: role of endocrine gland[J]. International Journal of Fisheries and Aquatic Studies, 2018, 6(4): 472-478. |
| [15] |
廖经球, 杨小立, 黄廷河, 等. 黑脊倒刺鲃的人工繁育技术[J]. 海洋与渔业, 2015(7): 50-52. |
| [16] |
曹克驹. 鲤鱼脑垂体注射液的制备及其使用[J]. 动物学杂志, 1960(3): 141-143. |
| [17] |
刘敬中. 鱼类常见催产剂的使用及比较[J]. 渔业致富指南, 2009(21): 28. |
| [18] |
潘庭双, 凌俊, 江河, 等. 不同催产激素对黄颡鱼♀×瓦氏黄颡鱼♂繁殖的影响[J]. 中国农学通报, 2019, 35(7): 153-157. |
| [19] |
ELAKKANAI P, FRANCIS T, AHILAN B, et al. Role of GnRH, HCG and Kisspeptin on reproduction of fishes[J]. Indian Journal of Science and Technology, 2015, 8(17): 1-10. |
| [20] |
LIN H R, VAN DER KRAAK G, ZHOU X J, et al. Effects of [D-Arg6, Trp7, Leu8, Pro9NEt]-luteinizing hormone-releasing hormone (sGnRH-A) and [D-Ala6, Pro9NEt]-luteinizing hormone-releasing hormone (LHRH-A), in combination with pimozide or domperidone, on Gonadotropin release and ovulation in the Chinese loach and common carp[J]. General and Comparative Endocrinology, 1988, 69(1): 31-40. |
| [21] |
高敏. 糙米型日粮蛋白质水平和促排三号(LHRH-A3)注射剂量对溆浦鹅繁殖的影响[D]. 武汉: 华中农业大学, 2007.
|
| [22] |
林浩然. 促性腺激素释放激素(GnRH)结构与功能及其受体的进化发展[J]. 中山大学学报(自然科学版), 2004, 43(6): 1-5. |
| [23] |
胡健饶. 脊椎动物促性腺激素释放激素的结构、基因表达与调控的研究进展[J]. 杭州师范学院学报(自然科学版), 2001(6): 16-20. |
| [24] |
林浩然, 梁坚勇, 周溪涓, 等. 鲑鱼促性腺激素释放激素类似物和Domperidone诱导几种养殖鱼GtH分泌和排卵的研究[J]. 动物学报, 1989, 35(2): 139-146. |
| [25] |
王黎, 林浩然. 促黄体素释放激素类似物和多巴胺对鲤鱼幼鱼和性成熟雌鱼生长激素分泌的作用[J]. 动物学报, 1997(3): 303-308. |
| [26] |
周立斌, 刘晓春, 林浩然, 等. 促性腺激素释放激素类似物/地欧酮对长臀血清雌二醇和睾酮质量浓度的影响[J]. 中山大学学报(自然科学版), 2007, 46(4): 69-73. |
| [27] |
王德寿, 林浩然, 蒲德永, 等. 注射促黄体素释放激素类似物和地欧酮诱导大鳍鳠和长吻鮠排卵的研究[J]. 动物学研究(英文), 1998, 19(3): 191-196. |
| [28] |
PETER R E, LIN H R, VAN DER KRAAK G. Induced ovulation and spawning of cultured freshwater fish in China: advances in application of GnRH analogues and dopamine antagonists[J]. Aquaculture, 1988, 74(1/2): 1-10. |
| [29] |
宋艳. 高活性促性腺激素类似物及其复配制剂在鱼类人工繁殖中的应用[J]. 水产科技情报, 1999, 26(1): 16-20. |
| [30] |
蒋云龙, 邓小红. 倒刺鲃鱼养殖技术之一光倒刺鲃人工繁殖技术初探[J]. 中国水产, 2003(3): 44-45. |
| [31] |
张盛, 吕业坚. 光倒刺鲃规模化繁育技术[J]. 科学养鱼, 2009(11): 10-11. |
| [32] |
唐志斌, 林岗, 吕业坚, 等. 光倒刺鲃人工繁殖技术研究[J]. 广西农业科学, 2008, 39(3): 385-388. |
| [33] |
黄洪贵, 黄种持, 林学文, 等. 黑脊倒刺鲃的繁殖与养殖技术[J]. 福建水产, 2004, 26(3): 12-16. |
| [34] |
张克烽. 黑脊倒刺鲃人工繁育技术要点[J]. 渔业致富指南, 2016(18): 34-35. |
| [35] |
张四春, 夏黎亮, 张友存, 等. 云南倒刺鲃人工驯养繁殖技术研究[J]. 现代农业科技, 2013(7): 278-280, 283. |
| [36] |
陈焜慈, 谢刚, 胡隐昌, 等. 池养倒刺鲃的人工繁殖和胚胎发育[J]. 水产养殖, 2002, 23(6): 9-10. |
| [37] |
林伟强, 陈挺, 廖显平, 等. 倒刺鲃规模化育苗关键技术研究[J]. 安徽农学通报, 2016, 22(9): 129-131. |
| [38] |
TRUNG D V, BART A J A R. Controlled reproduction of an important indigenous fish species, Spinibarbus denticulatus (Oshima, 1926), in Southeast Asia[J]. Aquaculture Research, 2007, 38(5): 441-451. |
| [39] |
邴旭文. 不同外源激素对中华倒刺鲃的催产效果[J]. 浙江海洋学院学报(自然科学版), 2004(4): 298-301. |
| [40] |
张德志. 中华倒刺鲃的人工催产试验[J]. 内陆水产, 2008, 33(4): 25-26. |
| [41] |
罗江兰. 中华倒刺鲃的人工繁殖及苗种培育技术[J]. 水产养殖, 2003, 24(6): 14-15. |
| [42] |
丁磊, 顾金寿. 中华倒刺鲃的人工繁殖技术[J]. 科学养鱼, 2006(8): 9. |
| [43] |
蔡焰值, 蔡烨强, 何长仁. 中华倒刺鲃人工繁殖技术研究[J]. 淡水渔业, 2005, 35(1): 35-38. |
| [44] |
杜强, 赵谱远, 杨昌齐, 等. 中华倒刺鲃的人工繁殖试验[J]. 贵州畜牧兽医, 2021, 45(1): 25-28. |
| [45] |
胡振禧. 中华倒刺鲃全人工批量育苗技术[J]. 河北渔业, 2012(8): 34-35, 61. |
| [46] |
王贤刚. 中华倒刺鲃人工繁育实用技术[J]. 渔业致富指南, 2005(19): 35-36. |
| [47] |
王贵英, 李清, 王青云, 等. 中华倒刺鲃人工繁殖和苗种培育技术[J]. 中国水产, 2004(4): 84-85. |
| [48] |
余鹏, 苏时萍, 李西雷, 等. 中华倒刺鲃人工繁殖技术研究[J]. 水产科技情报, 2017, 44(5): 241-244. |
| [49] |
金灿彪, 祝新文. 中华倒刺鲃人工繁殖试验[J]. 水利渔业, 2002(2): 7. |
| [50] |
贺红川. 中华倒刺鲃人工繁殖研究[J]. 淡水渔业, 2003, 33(4): 43-45. |
| [51] |
侯文久, 王宏军. 催产剂在鱼类人繁中的应用[J]. 科学养鱼, 2010(6): 9. |
| [52] |
胡廷尖, 王雨辰, 陈丰刚, 等. 泥鳅激素浸泡催产试验的研究[J]. 中国农学通报, 2012, 28(8): 82-86. |
| [53] |
林衍峰, 严云志. 投喂激素催产光唇鱼试验[J]. 河北渔业, 2016(1): 42-45. |
| [54] |
谢嘉华, 刘晓春, 龙进, 等. 投喂LHRH-A粗品对雌性金鲫促性腺激素分泌和卵巢发育的作用[J]. 中山大学学报(自然科学版), 2007, 46(1): 91-94, 99. |
| [55] |
舒琥, 刘晓春, 林浩然. LHRH-A缓释剂对雌性赤点石斑鱼卵巢发育、性类固醇激素分泌及脑垂体GTH细胞超微结构的影响[J]. 动物学研究, 2005, 26(4): 422-428. |
| [56] |
王吉桥. 养殖鱼类催产剂持续缓释系统的应用[J]. 水利渔业, 2003, 24(1): 7-8. |
| [57] |
李加儿, 区又君. 用LHRH-A2埋植法诱导池养鲻鱼卵母细胞发育成熟的试验[J]. 热带海洋学报, 2002, 21(1): 83-86. |