2. 广西微生物与酶工程技术研究中心, 广西南宁 530004;
3. 广西科学院, 广西南宁 530007
2. Guangxi Microorganism and Enzyme Research Center of Engineering Technology, Nanning, Guangxi, 530004, China;
3. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
当今工业、农业、生活废水以及垃圾渗滤液等的大量排放大大增加水生生态系统中的活性氮含量,不仅导致水体富营养化,危害人类健康,也加大了污染治理难度,造成严峻的生态压力和生物多样性丧失[1, 2]。离子交换和吸附等物理处理方法对有机污染物具有很高的保留率[3],而化学方法工作量大、操作繁琐、价格昂贵,并且需要二次处理[4]。与一般的物理、化学方法脱氮处理相比,生物法脱氮因其高效、环保和低成本而最具前景。目前已有许多脱氮菌株在工业废水、淡水栖息地、盐碱湖、海洋沉积物和海水养殖水以及活性污泥中被发现。细菌中主要有亚硝酸菌属(Nitrosomonas)、硝酸菌属(Nitrobacter)等自养型细菌[5],还有假单胞菌属(Pseudomonas)[6]、产碱杆菌属(Alcaligenes)[7]、不动杆菌属(Acinetobacter)[8]、芽孢杆菌属(Bacillus)[9]等异养型细菌,这些异养型细菌的氨氮降解率为66.0%-93.6%[10]。虽然有研究证明真菌可以脱氮[11],但是关于真菌生物脱氮的研究并不多,已报道的有青霉属(Penicillium)、曲霉菌属(Aspergillus)真菌[12]和酵母[13]。例如,一株青霉菌EC3从活性污泥中被分离鉴定,48 h后其氨氮降解率达97.7%[14];腐皮镰刀菌(Fusarium solani)RADF-77在好氧条件下以葡萄糖和茶渣为碳源时对硝酸盐的平均去除率分别为4.43 mg/(L·h)和4.50 mg/(L·d)[15];一株新型酵母Barnettozyma californica K1以蔗糖为最佳碳源在140 mg/L的氮浓度下培养48 h,其对氨氮的最大去除效率为99.11%[13];孢汉逊氏酵母(Hanseniaspora uvarum)KPL108在好氧条件下对硝酸盐的去除率为99%,总有机碳去除率为93%[16]。目前,生物脱氮法的研究大多集中在细菌方面,对真菌特别是酵母的研究甚少。与细菌相比,酵母更具有优势,除脱氮外,它还具有降解多种有机基质和抵抗极端条件的潜力[17],并且酵母的适应性强,可以吸附抱团从而更好地沉淀,利于回收且不易损失[18]。因此有必要拓宽真菌在废水脱氮中的利用途径,并通过探究不同环境条件因素的影响优化酵母的脱氮条件,从而提高其氨氮降解效率,弥补细菌脱氮的不足。本研究从实验室沼气发酵污泥中筛选能降解氨氮的菌株,使用18S rDNA序列分析, 对筛选出的优良菌株进行种类鉴定,并采用单因素试验和正交试验优化其脱氮条件,以使其达到更高效的脱氮效果。
1 材料与方法 1.1 材料 1.1.1 污泥样品污泥样品取自本实验室沼气发酵污泥。
1.1.2 主要酶和试剂LA Taqase购自TaKaRa公司,苯酚、酒石酸钠(国药集团化学试剂有限公司),EDTA [生工生物工程(上海)股份有限公司],亚硝基铁氰化钠、对氨基苯磺酸、盐酸萘乙二胺(成都西亚化工股份有限公司)等均为分析纯。
1.1.3 仪器与设备PB-10台式pH计(Sartorius公司),ZQZY-HB恒温摇床(上海知楚仪器有限公司),LRH-250生化培养箱(上海齐欣科学仪器有限公司),CR22G Ⅲ高速冷冻离心机[日立(中国)有限公司],ELX800多功能酶标仪(BioTek公司),Biometra GmbH PCR仪(广西百谷生物科技有限公司),DYY-8C核酸电泳仪(北京六一生物科技有限公司),Tanon 1600凝胶成像仪(上海天能科技有限公司)。
1.1.4 培养基LB培养基[19]。筛选培养基:葡萄糖2 g/L、氯化铵3.82 g/L、磷酸二氢钾1 g/L、七水合硫酸镁0.05 g/L、氯化钾1 g/L、氯化钙0.05 g/L、pH值7.0。SOC培养基[20]。酵母浸出粉胨葡萄糖琼脂(YPD)培养基[21]。异养硝化培养基:葡萄糖2 g/L、氯化铵0.764 3 g/L、磷酸二氢钾1 g/L、七水合硫酸镁0.05 g/L、氯化钾1 g/L、氯化钙0.05 g/L。反硝化培养基:将异养硝化培养基中的氯化铵换成0.985 7 g/L的亚硝酸钠即可。固体培养基则需加入1.5%(W/V)的琼脂。按倍数调整培养基中氯化铵和亚硝酸钠的含量以达到实验所需的氨氮(NH4+-N)浓度和亚硝酸氮(NO2--N)浓度。
1.2 方法 1.2.1 菌株的筛选与分离富集:10 g污泥样品加入装有100 mL去离子水的无菌锥形瓶中,200 r/min、30 ℃摇床培养30 min后静置15 min。取1 mL污泥菌悬液于100 mL LB培养基中,200 r/min、30 ℃摇床培养24 h。
初筛、驯化:取上述富集的菌液,按1%(V/V)的接种量接种到NH4+-N浓度为200 mg/L的筛选培养基中,200 r/min、30 ℃摇床培养48 h。逐次增大筛选培养基的NH4+-N浓度,由200、400、600、800 mg/L直至1 000 mg/L,多次重复接种,进行菌株驯化。将驯化后得到的菌液梯度稀释涂布于固体筛选培养基上,30 ℃恒温培养48 h。选取单菌落重新划线于LB平板上,重复划线3次,得到分离纯化的单菌落。
复筛:将分离纯化的单菌接种到YPD培养基中,200 r/min、30 ℃摇床培养12-24 h后,按1%(V/V)的接种量转接到100 mL筛选培养基中,200 r/min、30 ℃摇床培养48 h。离心取上清液检测残余NH4+-N浓度,选择氨氮降解率较高的菌株进行后续试验。
1.2.2 菌株18S rDNA基因的测序鉴定提取所得菌株的总DNA,用通用引物18S1(5′-CTACGGGGTCTGACGCTCAGTGGAACGCCTG
AGAAACGGCTACC-3′)和18S2(5′-CCAAAATCCCTTAACGTGAGTTTTCCTCGTTGAAGAGCG-3′)进行18S rDNA的PCR扩增。反应体系(50 μL):模板DNA 1 μL,18S1和18S2各1 μL,dNTP mixture 4 μL,LA Taqase 0.5 μL,10×LA Taqase Buffer 5 μL,灭菌H2O 37.5 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min;4 ℃保存。将PCR扩增产物送至北京睿博兴科生物技术有限公司测序,在NCBI网站上进行同源性比对(BLAST软件),并用MEGA 6.0软件构建系统发育树。
1.2.3 单因素试验将筛选所得菌株接种到YPD培养基中活化,OD595达到1.0(对数生长期)时,按1%的接种量接种到NH4+-N浓度为200 mg/L的异养硝化培养基中,改变单一变量,包括培养温度(16、23、30、37、44 ℃)、初始pH值(5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)、盐浓度(氯化钠浓度,0、5、10、20、30、40、60 g/L)、碳氮比(C/N,5、10、20、30、40、50),200 r/min培养48 h后,测定不同条件变化下菌液的OD595以及上清液中的NH4+-N浓度。
1.2.4 正交试验优化基于单因素试验结果,采用软件Minitab 17(Minitab Inc.,State College,USA)设计四因素三水平的正交试验。按照表 1设计的正交试验方案,将菌株接种到NH4+-N浓度为200 mg/L的异养硝化培养基中,在不同因素条件下培养48 h,测定不同因素条件下菌液的OD595以及上清液中的NH4+-N浓度。
| 水平 Level |
因素Factor | |||
| A (Culture temperature)/℃ | B (Initial pH value) | C (Carbon nitrogen ratio, C/N) | D (Salt concentration)/(g/L) | |
| 1 | 25 | 7.5 | 20 | 20 |
| 2 | 30 | 8.0 | 30 | 30 |
| 3 | 35 | 8.5 | 40 | 40 |
1.2.5 菌株的氨氮浓度耐受性
将OD595达到1.0(对数生长期)的菌株接种到耐受培养基(NH4+-N浓度为100、200、300、500、700、1 000 mg/L)中。根据正交试验优化结果,在菌株的最优氨氮降解条件下培养,培养过程中每间隔12 h检测菌体OD595和培养液上清液的NH4+-N浓度。
1.2.6 菌株的反硝化降解特性将对数生长期的菌株接种到200 mg/L的亚硝酸钠培养基中,最适温度(25 ℃)、200 r/min摇床培养5 d。每间隔12 h测定培养基中菌体OD595和培养液上清液中的NO2-N浓度。
1.2.7 测定方法利用靛酚蓝分光光度法[22]进行NH4+-N浓度的测定,制作氨氮标准曲线,根据标准曲线公式y=0.594x+0.002(R2=0.998)计算上清液中的NH4+-N浓度。
采用N-(1-萘基)-乙二胺光度法[23]进行测定,制作亚硝酸氮标准曲线,根据标准曲线公式y=0.40988x-0.0001(R2=0.997 9)计算上清液中的亚硝酸钠和NO2-N浓度。
2 结果与分析 2.1 菌株的筛选、分离和鉴定本实验经过筛选得到的菌株命名为Y-4。提取菌株Y-4基因组并扩增其18S rDNA序列,经18S rDNA基因测序,同源性比对(BLAST软件)后用MEGA 6.0软件构建系统发育树,如图 1所示。系统发育树结果表明菌株Y-4与杰丁毕赤酵母(Pichia jadinii)的亲缘关系最近,同时根据其菌落形态特征,将菌株Y-4鉴定为毕赤酵母(Pichia sp.),其具有兼性厌氧、化能异养、无致病性等特征。
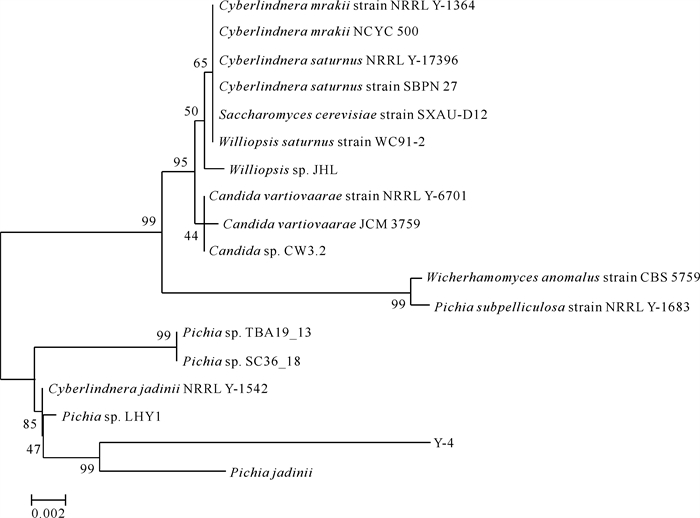
|
| 图 1 菌株Y-4系统发生树 Fig. 1 Phylogenetic tree of strain Y-4 |
2.2 单因素试验结果分析 2.2.1 不同培养温度对菌株Y-4生长和脱氮的影响
由图 2可知,比较在不同培养温度下菌株Y-4的生长情况与氨氮降解率,菌株Y-4的最适生长温度为23 ℃,最佳脱氮温度为30 ℃,氨氮降解率在达到最高值(88.9%)后便随着温度的升高而下降。在较低温度(≤23 ℃)和较高温度(>40 ℃)下,菌株Y-4的菌体浓度和氨氮降解率都处于较低的水平;30-37 ℃的温度较适合菌株Y-4的生长和脱氮,此温度范围下菌株Y-4的氨氮降解率可维持在70%以上。在30 ℃时,菌株Y-4的生长未受到明显抑制,且拥有最高的氨氮降解率,因此菌株Y-4的最适氨氮降解温度为30 ℃左右。
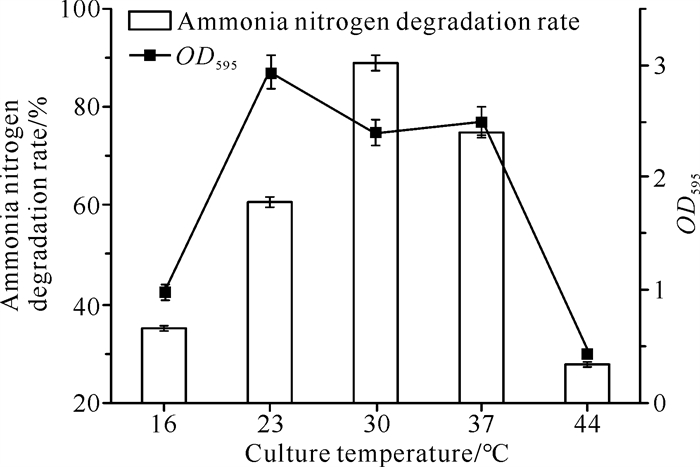
|
| 图 2 不同培养温度对菌株Y-4生长和脱氮的影响 Fig. 2 Effects of different culture temperatures on the growth and nitrogen removal of strain Y-4 |
2.2.2 不同初始pH值对菌株Y-4生长和脱氮的影响
图 3表明菌株Y-4生长的最适初始pH值为6.0;脱氮最佳初始pH值为8.0,氨氮降解率达到84.96%。比较菌株Y-4的生长情况与氨氮降解率,发现在初始pH值为5.5-8.5时菌株Y-4的生长和脱氮能力较为稳定,可在偏酸性的环境中生长,氨氮降解率保持在60%以上;pH值一旦超过8.5则不利于菌株Y-4的生长和脱氮,严重影响其异养硝化效率。可见,菌株Y-4在pH偏中性的弱碱环境下的除氮效果最佳。
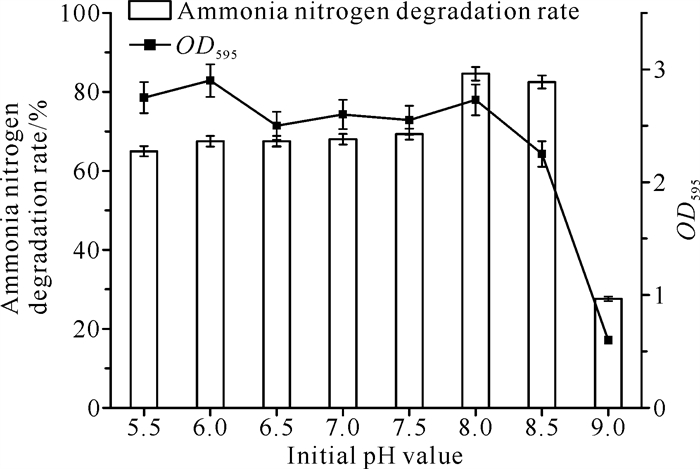
|
| 图 3 不同初始pH值对菌株Y-4生长和脱氮的影响 Fig. 3 Effect of different initial pH value on the growth and nitrogen removal of strain Y-4 |
2.2.3 不同盐浓度对菌株Y-4生长和脱氮的影响
图 4表明菌株Y-4最适生长盐浓度和最佳脱氮盐浓度均为30 g/L,菌体OD595达到3.5,氨氮降解率可达到99.88%,NH4+-N几乎完全去除。菌株Y-4的OD595与氨氮降解率变化趋势一致,菌体OD595降低或升高,脱氮效率同时降低或升高。盐浓度>40 g/L的环境对菌株Y-4的生长和异养硝化过程存在较大的抑制作用。可见,菌株Y-4具有较高的盐耐受性,适合用于较高盐浓度的废水脱氮。
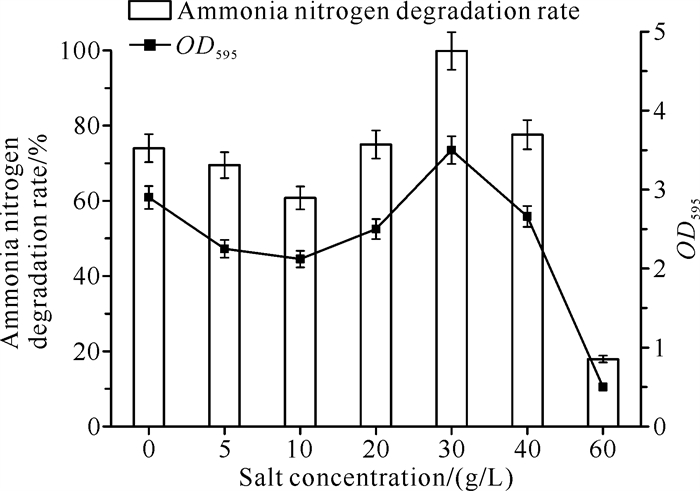
|
| 图 4 不同盐浓度对菌株Y-4生长和脱氮的影响 Fig. 4 Effects of different salt concentration on the growth and nitrogen removal of strain Y-4 |
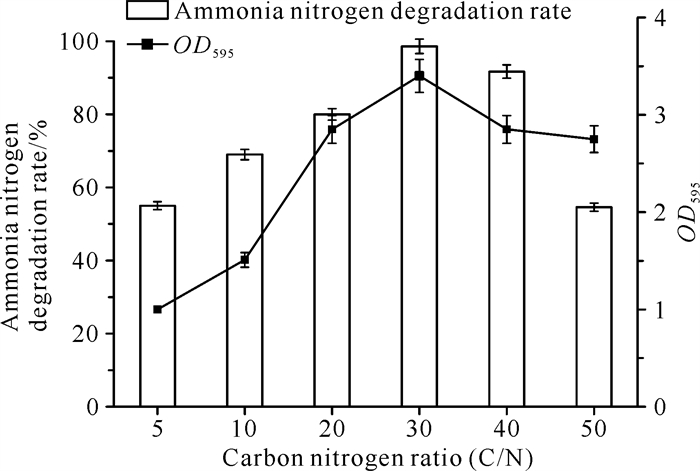
2.2.4 不同C/N对菌株Y-4生长和脱氮的影响
以葡萄糖为碳源,通过增加培养基中的葡萄糖含量,测定不同C/N下菌株Y-4的脱氮情况。如图 5所示,菌株Y-4的最适生长C/N和最佳脱氮C/N均为30,氨氮降解率最大可达95.61%,对NH4+-N的去除较为完全,之后便呈现出下降的趋势,菌株Y-4整体上脱氮率维持在50%以上。当C/N>30时,随着C/N的升高,菌株Y-4的生长以及脱氮效率开始受到影响,这可能是由于在以葡萄糖为碳源的培养基中,高浓度的葡萄糖导致环境渗透压升高,从而进一步影响菌株Y-4的生长以及脱氮。
|
| 图 5 不同C/N对菌株Y-4生长和脱氮的影响 Fig. 5 Effects of different C/N on the growth and nitrogen removal of strain Y-4 |
2.3 菌株Y-4氨氮降解条件的正交实验优化
表 2为菌株Y-4氨氮降解条件的四因素三水平正交实验优化结果。从表 2可知,决定菌株Y-4脱氮效率的影响因素的主次顺序为初始pH值>盐浓度>C/N>培养温度,菌株Y-4的最佳组合为初始pH值8.0、盐浓度30 g/L、C/N=30、培养温度25 ℃,该菌株能在48 h内将200 mg/L的氨氮几乎降解完全,氨氮降解率提升至99.92%,达到优化效果。
| 试验编号 Test number |
A | B | C | D | 氨氮降解率/% Ammonia nitrogen degradation rate/% |
| 1 | 1 | 1 | 1 | 1 | 87.33 |
| 2 | 1 | 2 | 2 | 2 | 99.92 |
| 3 | 1 | 3 | 3 | 3 | 44.12 |
| 4 | 2 | 1 | 2 | 3 | 64.08 |
| 5 | 2 | 2 | 3 | 1 | 89.84 |
| 6 | 2 | 3 | 1 | 2 | 70.74 |
| 7 | 3 | 1 | 3 | 2 | 59.52 |
| 8 | 3 | 2 | 1 | 3 | 68.26 |
| 9 | 3 | 3 | 2 | 1 | 60.92 |
| K1 | 77.123 | 70.310 | 75.443 | 79.363 | |
| K2 | 74.887 | 86.007 | 74.973 | 76.727 | |
| K3 | 62.900 | 58.593 | 64.493 | 58.820 | |
| R | 2.240 | 27.414 | 10.950 | 20.543 |
2.4 不同初始氨氮浓度对菌株Y-4生长和异养硝化的影响
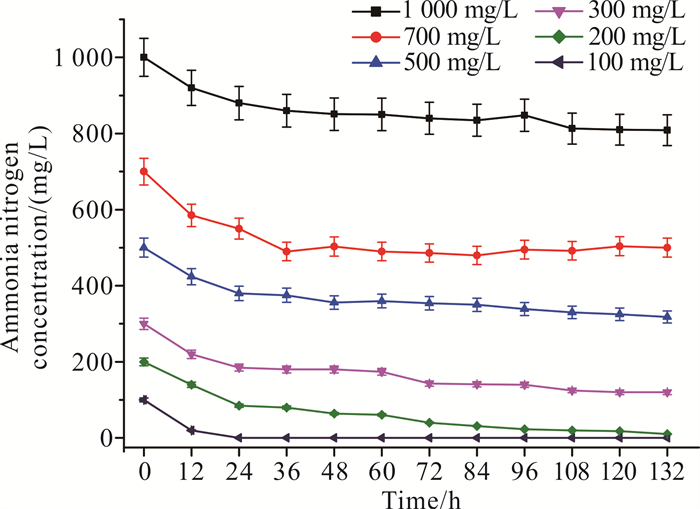
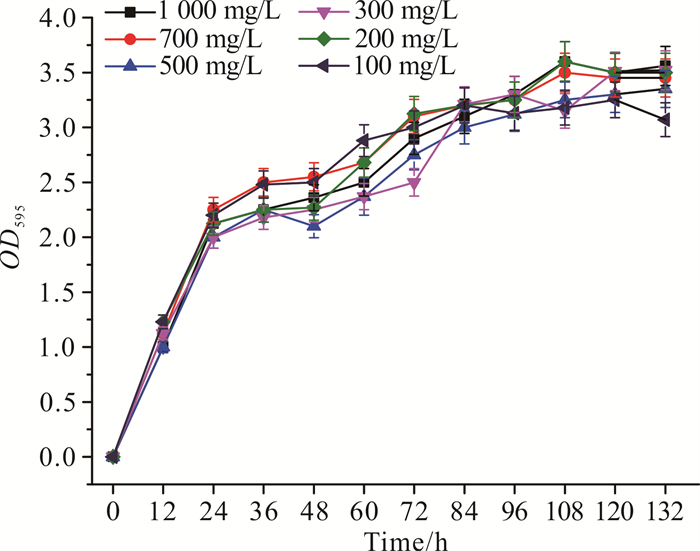
如图 6所示,在不同初始NH4+-N浓度(100、200、300、500、700、1 000 mg/L)条件下培养132 h后,菌株Y-4的氨氮降解率分别为100.0%、94.9%、60.0%、36.4%、28.6%、19.1%,且菌体OD595均超过3.0 (图 7),表明菌株Y-4最高可耐受1 000 mg/L的NH4+-N浓度,可用于高氨氮浓度废水的脱氮。如图 6所示,在不同初始NH4+-N浓度(100、200、300、500、700、1 000 mg/L)条件下分别对菌株Y-4培养不同时间,结果表明在0-24 h内,菌株Y-4对不同初始浓度的氨氮的平均降解速率分别为4.16、4.70、4.79、5.08、6.25、5.00 mg/(L·h),其中,初始NH4+-N浓度为700 mg/L时菌株Y-4的平均降解速率达最高。结合图 7进行分析,随着NH4+-N浓度的升高以及时间的延长,24 h后菌株Y-4的生长趋势并未出现明显的抑制情况,氨氮降解量维持在一定的水平,36 h后由于营养物质的不断消耗,降解速率和脱氮效率逐渐降低,菌株Y-4硝化作用不明显,残余氨氮量基本不变。
|
| 图 6 初始氨氮浓度对菌株Y-4异养硝化的影响 Fig. 6 Effect of initial ammonia nitrogen concentration on heterotrophic nitrification of strain Y-4 |
|
| 图 7 初始氨氮浓度对菌株Y-4生长的影响 Fig. 7 Effect of initial ammonia nitrogen concentration on the growth of strain Y-4 |
2.5 菌株Y-4的好氧反硝化降解能力
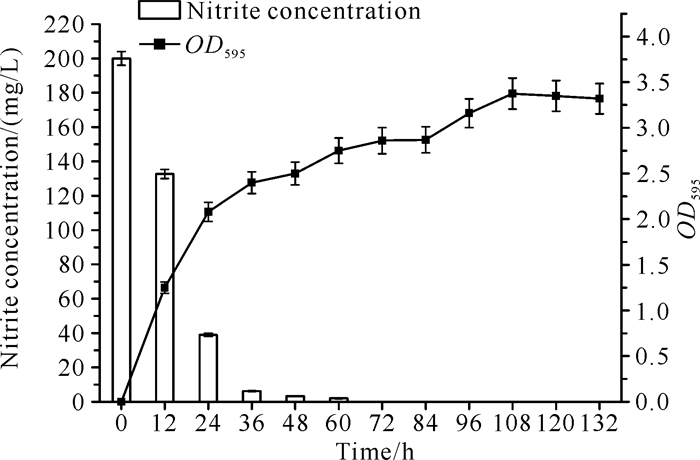
如图 8所示,初始亚硝酸盐浓度为200 mg/L,好氧反硝化24 h时,菌株Y-4的菌体OD595达2.0以上,亚硝酸氮降解率为80.50%。0-24 h菌株Y-4的平均亚硝酸氮降解速率为6.71 mg/(L·h),12-24 h期间的平均亚硝酸氮降解速率达最大,达7.81 mg/(L·h),因此菌株Y-4的反硝化作用集中在对数生长期阶段,到60 h时亚硝酸氮降解率接近100%。相比异养硝化作用的氨氮降解速率,菌株Y-4好氧反硝化作用的亚硝酸氮的降解速率更快。
|
| 图 8 菌株Y-4在亚硝酸盐中的好氧反硝化作用 Fig. 8 Aerobic denitrification of strain Y-4 in nitrite |
3 讨论
本研究发现筛选得到的毕赤酵母菌株Y-4可以进行异养硝化和好氧反硝化,并探究了培养温度、初始pH值、盐浓度、C/N对Y-4的脱氮能力的影响。这些因素从不同方面影响微生物细胞膜的流动性、通透性、营养物质的存在形式以及代谢产物的产生等,是微生物废水脱氮的重要因素[24]。
温度是影响菌株活性的重要环境因素之一,其变化直接影响微生物的酶活和生长速度,因此只有在最佳的温度条件下,好氧脱氮细菌才能拥有最佳的脱氮性能[25]。菌株Y-4生长和脱氮的最佳温度为23-37 ℃,与大部分的好氧反硝化菌的最佳温度范围相似[26]。当温度为15-20 ℃时,菌株Y-4的氨氮降解率仍有30%-60%,并且在45 ℃时仍能降解氨氮,可见该菌株的温度适应范围较宽,有利于菌株在环境中竞争与存活。大多数的异养硝化菌在温度低于15 ℃和高于45 ℃时脱氮性能都受到严重抑制[27-29],本研究中不同温度对菌株Y-4的影响与该研究结果一致。
pH值不但会影响细胞内的酶的活性,而且还会影响溶液中营养物质或抑制物质的浓度,从而直接或间接影响好氧硝化或者反硝化菌株的活性[30]。研究表明,污泥氨氧化的最适pH值为7.5-8.3[31],本研究筛选得到的毕赤酵母菌株Y-4在pH值为5.5-8.5时其氨氮降解率仍达到60%以上,这是因为在酶催化下异养硝化过程会产生酸,所以适宜的温度和偏中性的弱碱环境有利于硝化反应的正向发生,提高脱氮速率,而Y-4在pH值为8.0时的脱氮性能最优,这与谭俊杰等[32]和邰勇等[33]的研究结果一致。
盐浓度直接影响细胞渗透压和通透性,是物质交换的限制条件。当废水中的盐浓度大于1%(W/V)时,即可被认为是高盐废水,在此条件下生物脱氮效率低下[34]。适宜的盐浓度不会引起细胞质壁分离、脱水,以及细菌的生长缓慢或死亡,反之,过高的盐浓度则会致使其氨氮降解能力减弱[35]。本研究筛选得到的毕赤酵母菌株Y-4可耐受60 g/L的盐浓度,在30 g/L盐浓度下的脱氮效果最优,因此可应用于高盐浓度的氨氮废水处理。
研究表明,菌株在脱氮过程中,不同的C/N会影响菌株生长,因此探究最佳C/N有利于提高菌株的脱氮效率[36]。碳源是菌株生长过程中的主要限制因素,在硝化或反硝化过程中起电子供体的作用,同时参与细胞物质的合成,有机碳源质量浓度越高,脱氮速率就越快[37]。多数异养硝化细菌以柠檬酸盐[38-40]或者琥珀酸钠[41, 42]为最佳碳源,最适C/N为10-20[43, 44]。本研究通过改变葡萄糖的浓度来改变C/N,结果表明在C/N为30-40时,菌株Y-4脱氮效果最优,而多数异氧硝化反硝化菌的最适C/N为10-20[34],与细菌相比,菌株Y-4的适宜C/N较高,这表明菌株Y-4可以应用于高碳废水处理;在C/N为5-20时,菌株Y-4的氨氮降解率仍有50%-80%,可见菌株Y-4具有良好的生存能力,能够在低营养的环境中生存,具有较大的竞争优势。
一般认为反硝化的发生仅限于细菌(原核生物),但也有研究证明许多真菌(真核生物)表现出不同的反硝化活性。前人研究表明,真菌反硝化系统由含铜亚硝酸盐还原酶(NirK)和细胞色素P450一氧化氮(NO)还原酶(Nor),即P450nor组成,将亚硝酸盐还原为N2O[45, 46]。本研究中,菌株Y-4在初始亚硝酸盐浓度为200 mg/L、好氧反硝化24 h后,亚硝酸氮降解率为80.50%,到60 h时亚硝酸氮降解率可接近100%。
此外,与细菌相较之下,真菌产生的降解酶来源丰富并且能够承受恶劣条件,特别是波动的污染物负荷[47]。菌株Y-4具有耐高NH4+-N浓度、高盐浓度和高C/N的特点,可用于榨菜等食品加工厂废水、海水养殖业废水等的处理。同时,菌株Y-4为毕赤酵母,既可以治理污水还可以利用其生产单细胞蛋白产生收益[48],在降低治理成本的同时也可以带来经济收益,这也为微生物废水脱氮提供了一些新的选择与思路。
4 结论毕赤酵母菌株Y-4通过异养硝化以及好氧反硝化作用具有一定的脱氮性能。在以氯化铵和亚硝酸钠作为唯一氮源时,Y-4对NH4+-N和NO2--N的最高降解率分别达到99.92%和80.50%,24 h内降解速率最大分别为6.25和6.71 mg/(L·h),且可耐受1 000 mg/L的NH4+-N浓度,在废水氮污染处理以及生物修复方面具有一定的应用潜力。
| [1] |
李一依, 赵勇娇, 刘芳, 等. 马赛菌属Massilia neuiana异养硝化-好氧反硝化脱氮特征实验[J]. 环境工程, 2020, 38(10): 103-107. |
| [2] |
杜全能, 朱文娟, 兰时乐. 一株异养硝化-好氧反硝化皱褶念珠菌(Diutina rugosa)的分离及脱氮特性[J]. 生物技术通报, 2020, 36(1): 60-65. |
| [3] |
GUPTA V K, ALI I, SALEH T A, et al. Chemical treatment technologies for waste-water recycling: an overview[J]. RSC Advances, 2012, 2(16): 6380-6388. DOI:10.1039/c2ra20340e |
| [4] |
CRUZ H, LAW Y Y, GUEST J S, et al. Mainstream ammonium recovery to advance sustainable urban wastewater management[J]. Environmental Science & Technology, 2019, 53(19): 11066-11079. |
| [5] |
马英, 钱鲁闽, 王永胜, 等. 硝化细菌分子生态学研究进展[J]. 中国水产科学, 2007, 14(5): 872-879. DOI:10.3321/j.issn:1005-8737.2007.05.025 |
| [6] |
XIE F X, THIRI M, WANG H. Simultaneous heterotrophic nitrification and aerobic denitrification by a novel isolated Pseudomonas mendocina X49[J]. Bioresource Technology, 2021, 319: 124198. DOI:10.1016/j.biortech.2020.124198 |
| [7] |
陈均利, 彭英湘, 罗沛, 等. 异养硝化-好氧反硝化菌的脱氮特性及其对猪场废水处理的研究[J]. 环境污染与防治, 2021, 43(3): 295-299, 303. |
| [8] |
CHEN S N, LI S L, HUANG T L, et al. Nitrate reduction by Paracoccus thiophilus strain LSL 251 under aerobic condition: performance and intracellular central carbon flux pathways[J]. Bioresource Technology, 2020, 308: 123301. DOI:10.1016/j.biortech.2020.123301 |
| [9] |
HUANG F, PAN L Q, LV N, et al. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124(5): 564-571. DOI:10.1016/j.jbiosc.2017.06.008 |
| [10] |
XI H P, ZHOU X T, ARSLAN M, et al. Heterotrophic nitrification and aerobic denitrification process: promising but a long way to go in the wastewater treatment[J]. Science of the Total Environment, 2022, 805: 150212. DOI:10.1016/j.scitotenv.2021.150212 |
| [11] |
邹平, 李传宽, 徐志强, 等. 一株反硝化真菌的分离鉴定及其对生物塔脱氮效率的影响[J]. 湖南大学学报(自然科学版), 2017, 44(6): 142-150. |
| [12] |
杨晓华. 一株异养硝化好氧反硝化真菌的筛选及特性研究[D]. 太原: 太原理工大学, 2012.
|
| [13] |
FANG J K, LIAO S A, ZHANG S S, et al. Characteristics of a novel heterotrophic nitrification-aerobic denitrification yeast, Barnettozyma californica K1[J]. Bioresource Technology, 2021, 339: 125665. DOI:10.1016/j.biortech.2021.125665 |
| [14] |
赵中艳. 一株青霉菌异养硝化和好氧反硝化特性的研究[J]. 水资源保护, 2008, 24(2): 73-75. |
| [15] |
CHENG H Y, XU A A, AWASTHI M K, et al. Aerobic denitrification performance and nitrate removal pathway analysis of a novel fungus Fusarium solani RADF-77[J]. Bioresource Technology, 2020, 295: 122250. DOI:10.1016/j.biortech.2019.122250 |
| [16] |
ZHANG H H, ZHAO Z F, KANG P L, et al. Biological nitrogen removal and metabolic characteristics of a novel aerobic denitrifying fungus Hanseniaspora uvarum strain KPL108[J]. Bioresource Technology, 2018, 267: 569-577. DOI:10.1016/j.biortech.2018.07.073 |
| [17] |
GIOVANELLA P, VIEIRA G A L, RAMOS OTERO I V, et al. Metal and organic pollutants bioremediation by extremophile microorganisms[J]. Journal of Hazardous Materials, 2020, 382: 121024. DOI:10.1016/j.jhazmat.2019.121024 |
| [18] |
李平, 张山, 郑永良, 等. 反硝化真菌-细菌优化组合及其脱氮能力研究[J]. 环境科学与技术, 2006(3): 9-10, 45, 115. |
| [19] |
樊笑, 胡子涵, 刘国, 等. 异养硝化-好氧反硝化菌的分离及脱氮特性[J]. 环境科学与技术, 2022, 45(11): 1-9. |
| [20] |
李清扬. CRISPR系统对大肠杆菌Ⅰ类整合子的敲除、抑制及基因重组工具的开发[D]. 广州: 华南理工大学, 2020.
|
| [21] |
张利华. 热带假丝酵母生产萜类天然产物的系统代谢工程[D]. 无锡: 江南大学, 2022.
|
| [22] |
吴宁安, 王瑞瑞, 刘金利, 等. 靛酚蓝分光光度法测定高浓度氨氮的低吸光度反常分析[J]. 中国有色冶金, 2022, 51(6): 54-59, 102. |
| [23] |
国家环境保护总局, 《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
|
| [24] |
胡丹, 何富强, 杜全能, 等. 1株异养硝化-好氧反硝化神户肠杆菌的鉴定及脱氮特性[J]. 安徽农业科学, 2022, 50(10): 70-74. |
| [25] |
安健, 宋增福, 杨先乐, 等. 好氧反硝化细菌YX-6特性及鉴定分析[J]. 中国水产科学, 2010, 17(3): 561-569. |
| [26] |
魏巍, 黄廷林, 苏俊峰, 等. 1株贫营养好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生态环境学报, 2010, 19(9): 2166-2171. |
| [27] |
ZHANG J B, WU P X, HAO B, et al. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001[J]. Bioresource Technology, 2011, 102(21): 9866-9869. |
| [28] |
魏渤惠, 罗晓, 吕鹏翼, 等. 高效异养硝化-好氧反硝化菌Glutamicibacter sp.WS1低温下对多种氮源的脱氮特性及氮代谢机制[J]. 环境科学, 2023, 44(9): 5006-5016. |
| [29] |
胡锦刚, 肖春桥, 邓祥意, 等. 稀土浸矿场地土壤异养硝化-好氧反硝化菌株K3的分离及脱氮研究[J]. 稀土, 2021, 42(5): 1-12. |
| [30] |
杨洋, 左剑恶, 沈平, 等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J]. 环境科学, 2006, 27(4): 691-695. |
| [31] |
李兵, 林炜铁. 1株好氧反硝化芽孢杆菌的脱氮特性研究[J]. 水生态学杂志, 2009, 2(3): 48-52. |
| [32] |
谭俊杰, 李立君, 李雪洁, 等. 异养硝化-好氧反硝化菌株GNR选育及对猪场废水脱氮实验[J]. 环境工程, 2021, 39(2): 21-26. |
| [33] |
邰勇, 邓敬轩, 任洪艳, 等. 一株Agrobacterium sp.异养硝化菌的分离鉴定及其氨氧化性能[J]. 应用与环境生物学报, 2020, 26(2): 325-331. |
| [34] |
GUO Y, ZHOU X M, LI Y G, et al. Heterotrophic nitrification andaerobic denitrification by a novel Halomonas campisalis[J]. Biotechnology Letters, 2013, 35(12): 2045-2049. |
| [35] |
陈应运. 铁基修饰菌丝球构建耐盐好氧颗粒污泥及抗逆特性研究[D]. 北京: 北京化工大学, 2021.
|
| [36] |
FABBRICINO M, PETTA L. Drinking water denitrification in membrane bioreactor/membrane contactor systems[J]. Desalination, 2007, 210(1/3): 163-174. |
| [37] |
ROBERTSON L A, KUENEN J G. Thiosphaera pantotropha gen.nov.sp.nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J]. Journal of General Microbiology, 1983, 129(9): 2847-2855. |
| [38] |
刘淳, 李永红, 刘颖颖, 等. 1株高效异养硝化细菌的分离鉴定及硝化特性[J]. 环境科学与技术, 2019, 42(3): 152-157. |
| [39] |
刘丽珂. 异养硝化-好氧反硝化菌的筛选及其脱氮性能研究[D]. 武汉: 华中农业大学, 2022.
|
| [40] |
顾鑫. 碳氮比对Acinetobacter junii ZHG-1异养硝化好氧反硝化性能的影响机制研究[D]. 西安: 长安大学, 2022.
|
| [41] |
汪旭晖, 杨垒, 任勇翔, 等. 异养硝化细菌Pseudomonas putida YH的脱氮特性及降解动力学[J]. 环境科学, 2019, 40(4): 1892-1899. |
| [42] |
张宇红, 董先博, 刘香宇, 等. 新型异养硝化-好氧反硝化菌Paracoccus sp.QD-19的分离及脱氮特性研究[J]. 生物技术通报, 2023, 39(3): 301-310. |
| [43] |
胡丹. 一株异养硝化-好氧反硝化细菌的分离鉴定及脱氮特性研究[D]. 长沙: 湖南农业大学, 2021.
|
| [44] |
陈均利, 张苗苗, 张树楠, 等. Alcaligenes faecalis WT14的异养硝化-好氧反硝化特性及对高氨废水处理潜力[J]. 环境工程, 2021, 39(2): 27-32, 40. |
| [45] |
DESLOOVER J, VLAEMINCK S E, CLAUWAERT P, et al. Strategies to mitigate N2O emissions from biological nitrogen removal systems[J]. Current Opinion in Biotechnology, 2012, 23(3): 474-482. |
| [46] |
SHOUN H, FUSHINOBU S, JIANG L, et al. Fungal denitrification and nitric oxide reductase cytochrome P450nor[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2012, 367(1593): 1186-1194. |
| [47] |
ESPINOSA-ORTIZ E J, RENE E R, PAKSHIRAJAN K, et al. Fungal pelleted reactors in wastewater treatment: applications and perspectives[J]. Chemical Engineering Journal, 2016, 283: 553-571. |
| [48] |
骆杨庆, 吴增林, 李升福, 等. 响应面法优化玉米浸液蛋白提取工艺及单细胞蛋白发酵的研究[J]. 食品工业科技, 2022, 43(10): 231-237. |



