2. 桂林医学院药学院, 广西桂林 541004
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541004, China
乙型肝炎病毒(HBV)作为一种DNA病毒,是目前传播较为广泛的病毒之一。世界各地约有2.5亿人感染HBV,该病毒常导致慢性肝炎,并引起严重的肝硬化、肝癌,甚至死亡[1, 2]。目前治疗慢性乙型肝炎的药物有恩替卡韦、拉米夫定以及干扰素等,常具有明显的耐药性和不良反应[3, 4],如嗜睡、疲劳和低血压等[5]。因此,迫切需要开发天然、低毒的抗乙型肝炎病毒药物。
中药不仅具有多成分、多靶点的治疗作用[6],而且成本低、毒性小[7]。目前,临床常采用中药辅助治疗乙型肝炎的相关疾病[8]。旱田草又称朋锯咪,是玄参科(Scrophulariaceae)母草属(Lindernia)植物旱田草[Lindernia ruellioides(Colsm.)Pennell]的全草,为瑶族人民常用的一种药材,具有消肿、止痛、活血等功效,民间常用于治疗瘀伤、蛇狗咬伤、月经不调等[9]。前期研究发现,旱田草中化合物des(rhamnosyl) verbascoside具有抗乙型肝炎病毒的作用,其对HepG2.2.15细胞分泌的HBsAg、HBeAg、HBV-DNA具有明显的抑制作用,但其机制尚不清楚[10]。蛋白质组学可以实时监测和准确量化药物治疗前后肿瘤细胞的蛋白表达变化[11],广泛应用于中医药相关领域,主要用于药物作用机制的研究[12],其中串联质谱标签(Tandem Mass Tag, TMT)法在复杂蛋白混合物组分的鉴定和定量方面具有明显优势[13, 14]。由于天然活性产物抗病毒是多靶点、多信号通路作用的结果,因此可通过蛋白质组学来深入分析其作用机制。本研究通过定量蛋白质组学方法检测des(rhamnosyl) verbascoside干预HepG2.2.15细胞后对照组和药物干预组的差异蛋白,并进行生物信息学分析,拟进一步阐明des(rhamnosyl) verbascoside抗乙型肝炎病毒的机制,为其治疗乙型肝炎提供蛋白质组学证据。
1 材料与方法 1.1 材料 1.1.1 药物制备将旱田草(4 kg)的茎叶晒干后碾碎成粉状,用75%乙醇提取3次,合并提取物,减压浓缩干燥。将所得粗提物重新悬浮于水,用乙酸乙酯萃取,得到提取物,随后使用硅胶色谱柱进行柱层析,采用小孔树脂(MCI)对其进行脱色,经RP-18柱层析分离后,进一步用半制备高效液相色谱(HPLC,35% MeOH-H2O,1 mL/min)进行分析及分离。采用HPLC、1H-NMR、13C-NMR等技术鉴定化合物为des(rhamnosyl) verbascoside[10],于-20 ℃低温保存备用。
1.1.2 HepG2.2.15细胞HepG2.2.15细胞株(稳转HBV病毒HepG2细胞)由桂林医学院苏何玲教授赠送,本课题组自行传代培养,用G418 (380 μg/mL)定期筛选。
1.1.3 试剂TMT标记试剂盒、甲酸均购自美国Thermo Fisher Scientific公司;碘乙酰胺、NH3·H2O均购自瑞典Sigma公司;BCA定量试剂盒购自上海碧云天生物技术股份有限公司;SDT裂解液、UA buffer、IAA buffer和四乙基溴化铵(TEAB)溶液均购自上海吉凯基因医学科技股份有限公司;牛血清白蛋白(BSA)购自生工生物工程(上海)股份有限公司。
1.1.4 仪器与设备Votex振荡器购自美国GENIE公司,Nano Dro酶标仪、Q Exactive plus质谱仪购自美国Thermo Fisher Scientific公司,5430R低温高速离心机购自德国Eppendorf公司,GNP-9080恒温培养箱购自上海精宏实业有限公司,HCM-100 pro精巧型恒温混匀仪购自上海大龙实业有限公司。
1.2 方法 1.2.1 细胞培养采用含10%胎牛血清的达尔伯克改良伊格尔培养基(DMEM),在温度为37 ℃、含5% CO2的培养箱中培养HepG2.2.15细胞。以380 μg/mL G418常规筛选HepG2.2.15细胞,每隔2 d更换新鲜培养基,当细胞浓度为80%-90%时,用0.25%胰酶消化传代。
1.2.2 蛋白质抽提取HepG2.2.15细胞,首先用胰酶消化,然后加DMEM制成2×106个/mL的细胞悬液接种于培养皿中(直径100 mm),每皿加入悬液的体积为6 mL,24 h后给药,分别设置正常细胞对照组和药物干预组(100 mg/L),各设3个复孔。孵育48 h后,用磷酸盐(PBS)缓冲液轻柔冲洗细胞3次,加入裂解液(4% SDS,100 mmol/L Tris-HCl,1 mmol/L DTT)300 μL,金属浴15 min,12 000 r/min离心15 min,取上清,测定蛋白质浓度。分装样品,-20 ℃保存备用。
1.2.3 超滤管内酶解(FASP)与TMT标记取各蛋白质样品200 μg,添加二硫苏糖醇(DTT)至终浓度为100 mmol/L,沸水浴5 min,冷却至室温。加入200 μL UA buffer尿素缓冲液混匀,转入30 kD超滤离心管中,12 000 r/min离心25 min,弃滤液,重复两次。加入100 μL吲哚-3-乙酸(IAA) buffer,600 r/min振荡1 min,室温避光30 min,12 000 r/min离心25 min。再加入100 μL UA buffer,12 000 r/min离心15 min,重复两次。加入100 μL 0.1 mol/L三乙基二乙胺盐(TEAB)溶液,12 000 r/min离心15 min,重复两次。加入40 μL胰蛋白酶(Trypsin) buffer,600 r/min振荡1 min,37 ℃放置16-18 h。换新收集管,12 000 r/min离心15 min。最后加入20 μL 0.1 mol/L TEAB溶液,12 000 r/min离心15 min,收集滤液。TMT标记参照TMT标记试剂盒说明书操作。
1.2.4 High PH RP分离与质谱分析色谱柱用缓冲液(10 mmol/L HCOONH4, 5% ACN, pH值为10.0)平衡,流速为1 mL/min;再用缓冲液(10 mmol/L HCOONH4, 85% ACN, pH值为10.0)梯度洗脱,最后维持在100%。监测214 nm处的吸光度值,每隔1 min收集组分,约收集40份,将样品冻干后用0.1% FA(甲酸)复溶备用。样品用Q Exactive plus质谱仪进行质谱分析。检测方式为正离子模式,母离子扫描范围为350-1 800 m/z,一级质谱分辨率为70 000。
1.2.5 生物信息学分析使用Matplotlib v3.3.4软件对蛋白质和样本表达进行二维分类。通过整合Uniprot(https://www.uniprot.org/)、HPA(https://www.proteinatlas.org/)、Cell-PLOC (http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc/) 3个数据库的信息对差异蛋白进行亚细胞定位分类,并使用WoLF PSORT(https://wolfpsort.hgc.jp/)软件对无法直接分类的差异蛋白进行定位预测分析。在基因本体论(Gene Ontology,GO)数据库(https://www.geneontology.org/)进行功能富集分析。以DAVID数据库(https://david.ncifcrf.gov/)进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路分析。利用STRING网站(https://cn.string-db.org/)对抗HBV密切相关的蛋白进行蛋白质互作(Protein-Protein Interaction,PPI)分析。
1.2.6 数据分析使用Proteome Discoverer 2.1软件分析结果,以错误发现率(False discovery rate, FDR)<0.01的标准对数据进行筛选。将对照组和药物干预组获得的蛋白样品进行质谱鉴定和生物信息学分析,表达差异倍数大于1.2倍且P值小于0.05的即为差异蛋白。
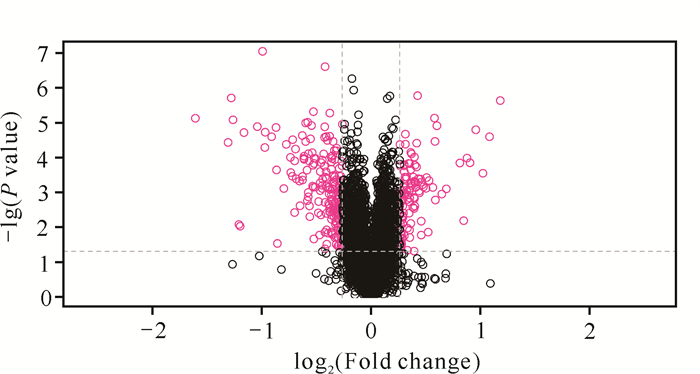
2 结果与分析 2.1 差异蛋白鉴定结果筛选得到des(rhamnosyl) verbascoside作用后的差异表达蛋白300个,其中差异表达上调蛋白和下调蛋白分别为109和191个(图 1)。对药物干预组和对照组进行聚类分析,结果显示组内数据模式相似度较高,组间数据模式相似度较低(图 2),进一步证明了筛选差异蛋白的合理性。
|
| The red circle on the left in the diagram represents the number of down regulated proteins, while the red circle on the right represents the number of up regulated proteins.The horizontal axis represents the multiple of differences, and the vertical axis represents the P value. 图 1 药物干预组和对照组差异表达蛋白的火山图 Fig. 1 Volcano plot of differentially expressed proteins between drug intervention group and control group |

|
| 图 2 药物干预组和对照组的蛋白聚类分析 Fig. 2 Protein cluster analysis of drug intervention group and control group |
2.2 差异蛋白的生物信息学分析 2.2.1 差异蛋白GO分析
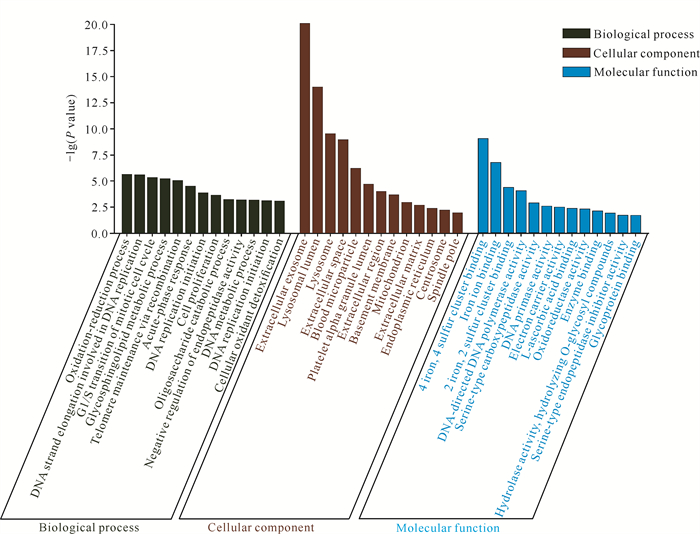
利用DAVID数据库对300个差异蛋白进行GO分析,选择P值最高的13个差异条目进行分析(图 3)。差异蛋白主要富集于外泌体(Exosome)、溶酶体(Lysosome)、线粒体(Mitochondrion)、细胞外基质(Extracellular matrix)、血液微粒(Blood microparticle)等细胞组分。化合物des(rhamnosyl) verbascoside主要在细胞内调控DNA聚合酶活性(DNA polymerase activity)、DNA引物酶活性(DNA primase activity)和氧化还原酶活性(Oxidoreductase activity)。同时,化合物des(rhamnosyl) verbascoside能在DNA复制(DNA replication)、鞘糖脂代谢过程(Glycosphingolipid metabolic process)、通过重组维持端粒(Telomere maintenance via recombination)、细胞增殖(Cell proliferation)、寡糖分解代谢(Oligosaccharide catabolic process)等生物过程发挥作用。
|
| 图 3 GO富集分析结果 Fig. 3 Results of GO enrichment analysis |
2.2.2 差异蛋白KEGG通路分析
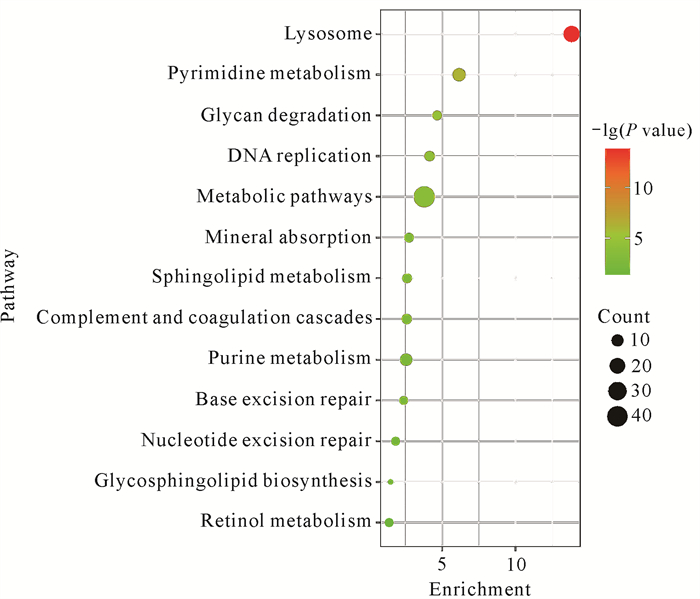
通过KEGG途径对300个差异蛋白进行分析,并筛选出13个显著富集的途径(P<0.05),见图 4和表 1。这些途径包括细胞代谢(Metabolism)中的代谢途径(Metabolism pathways)、溶酶体、多糖降解(Glycan degradation)、鞘脂类代谢(Sphingolipid metabolism)、鞘糖脂生物合成(Glycosphingolipid biosynthesis)、视黄醇代谢(Retinol metabolism);遗传信息传导类通路(Genetic information processing)中的嘧啶代谢(Pyrimidine metabolism)、DNA复制(DNA replication)、嘌呤代谢(Purine metabolism)、碱基剪切修复(Base excision repair)和核酸剪切修复(Nucleotide excision repair);生物系统通路(Organismal systems)中的主要代谢通路:免疫系统(Immune system)中的补体途径(Complement and coagulation cascades)和消化系统(Digestive system)中的矿质养分吸收(Mineral absorption)。
|
| Vertical axis is the pathway name, horizontal axis is the enrichment coefficient. 图 4 富集的前13个KEGG通路 Fig. 4 Top 13 enriched KEGG pathways |
| 项目 Item |
KEGG途径 KEGG pathway |
数目 Number |
P值 P value |
差异表达蛋白 Differentially expressed proteins |
| hsa04142 | Lysosome | 22 | 1.5E-14 | SORT1, SMPD1, NPC1, NPC2, CTSA, CTSD, CTSL, DNASE2, GLA, GNS, GBA, HEXA, HEXB, LGMN, LIPA, MAN2B1, MANBA, NEU1, PPT1, PLA2G15 |
| hsa00240 | Pyrimidine metabolism | 13 | 6.8E-07 | NT5E, POLA1, POLD1, POLD2, POLD3 POLE, POLR3C, POLR3F, DUT, PRIM1, PRIM2, TK1, TYMS |
| hsa00511 | Other glycan degradation | 6 | 2.1E-05 | GBA, HEXA, HEXB, MAN2B1, MANBA, NEU1 |
| hsa03030 | DNA replication | 7 | 6.9E-05 | POLA1, POLD1, POLD2, POLD3, POLE, PRIM1, PRIM2 |
| hsa01100 | Metabolic pathways | 43 | 1.6E-04 | HMGCS1, ALAS1, NT5E, POLA1, POLD1, POLD2, POLD3, POLE, ASAH1, NDUFA3, POLR3C, POLR3F, UGT1A1, UGT2B7, AOX1, AKR1B10, CYP1A1, DEGS1, DUT, DGKK, DHFR, GNS, GBA, GLUL, HKDC1, HEXA, HEXB, IDO2, MTMR6, NOS1, PPT1, PAH, PLD3, PPAT, GALNT4, PRIM1, PRIM2, P4HA1, SMPD1, SDHA, SDHB, TK1, TYMS |
| hsa04978 | Mineral absorption | 6 | 1.7E-03 | STEAP1, FTH1, FTL, HMOX1, MT1E, MT2A |
| hsa00600 | Sphingolipid metabolism | 6 | 2.4E-03 | ASAH1, DEGS1, GLA, GBA, NEU1, SMPD1 |
| hsa04610 | Complement and coagulation cascades | 7 | 2.5E-03 | F2, F13A1, C3, PLG, SERPINC1, SERPIND1, TFPI |
| hsa00230 | Purine metabolism | 11 | 2.7E-03 | NT5E, POLA1, POLD1, POLD2, POLD3, POLE, POLR3C, POLR3F, PPAT, PRIM1, PRIM2 |
| hsa03410 | Base excision repair | 5 | 4.0E-03 | POLD1, POLD2, POLD3, POLE, NTHL1 |
| hsa03420 | Nucleotide excision repair | 5 | 1.4E-02 | POLD1, POLD2, POLD3, POLE, ERCC2 |
| hsa00603 | Glycosphingolipid biosynthesis | 3 | 3.1E-02 | GLA, HEXA, HEXB |
| hsa00830 | Retinol metabolism | 5 | 3.9E-02 | UGT1A1, UGT2B7, AOX1, CYP1A1, RETSAT |
2.2.3 蛋白质亚细胞定位分析
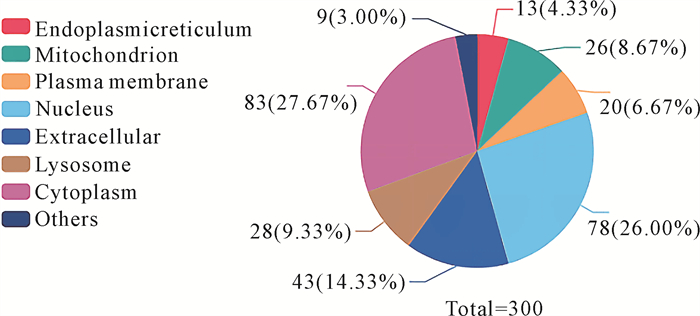
对300个差异蛋白进行亚细胞定位分析,结果见图 5。差异蛋白表达在细胞质(Cytoplasm)中有27.67%,细胞核(Nucleus)有26.00%,细胞外(Extracellular)有14.33%,线粒体(Mitochondrion)有8.67%,质膜(Plasma membrane)有6.67%,溶酶体(Lysosome)有9.33%,内质网(Endoplasmic reticulum)有4.33%。
|
| 图 5 蛋白质亚细胞定位 Fig. 5 Subcellular localization of proteins |
2.2.4 筛选HBV相关的关键差异蛋白
通过以上生物信息学分析,发现MAN2B1、SORT1、ERCC2、PRIM1、POLA1、POLD2、POLD1、POLE、PRIM2、POLD3、HGF、LAMC1、SDC1等蛋白与des(rhamnosyl) verbascoside抗乙肝病毒密切相关(表 2)。
| 蛋白 Protein |
蛋白质描述 Protein description |
表达情况 Expression situation |
P值 P value |
| MAN2B1 | Lysosomal alpha-mannosidase | Up | 9.70E-05 |
| SORT1 | Sortilin | Up | 2.13E-02 |
| ERCC2 | General transcription and DNA repair factor IIH helicase subunit XPD | Down | 1.22E-02 |
| PRIM1 | DNA primase small subunit | Down | 1.72E-04 |
| POLA1 | DNA polymerase alpha catalytic subunit | Down | 3.42E-05 |
| POLD2 | DNA polymerase delta subunit 2 | Down | 1.11E-03 |
| POLD1 | DNA polymerase delta catalytic subunit | Down | 4.20E-04 |
| POLE | DNA polymerase epsilon catalytic subunit A | Down | 5.38E-04 |
| PRIM2 | DNA primase large subunit | Down | 1.69E-04 |
| POLD3 | DNA polymerase delta subunit 3 | Down | 2.29E-04 |
| HGF | Hepatocyte growth factor | Up | 1.42E-04 |
| LAMC1 | Laminin subunit gamma-1 | Down | 1.16E-03 |
| SDC1 | Syndecan-1 | Down | 1.20E-02 |
| Note: "Up" means up-regulated, "Down" means down-regulated. | |||
2.2.5 HBV相关差异表达蛋白相互作用分析
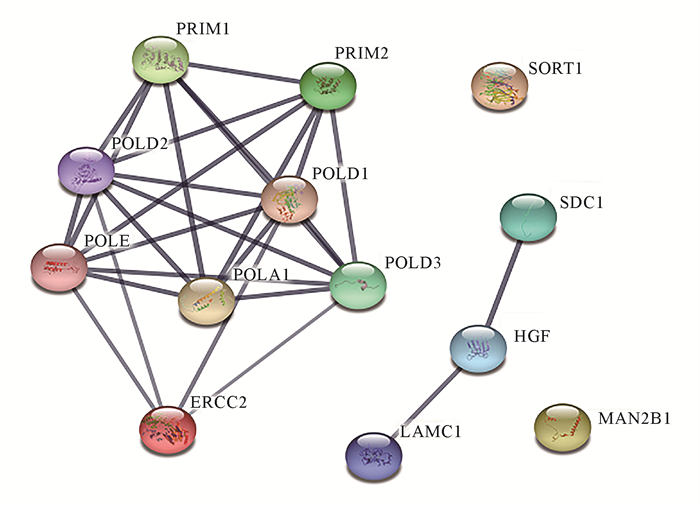
在识别出的13个差异蛋白中,有11个差异蛋白相互连接,节点为13,代表相互作用的边有27条,PPI富集P值<1.0E-16 (图 6)。
|
| Proteins are represented by nodes of different colors, and the thickness of the connecting lines indicates the strength of their interactions. 图 6 蛋白质-蛋白质相互作用网络分析 Fig. 6 Network analysis of protein-protein interactions |
3 讨论
HBV属于嗜肝DNA病毒,HBV感染是世界性的公共卫生问题,严重时可能会导致肝硬化和肝癌[15],目前仍无有效的抗乙肝药物。大量文献报道发现,中草药及其活性成分具有抗乙肝病毒活性,其作用机制包括直接抑制HBV复制、抑制生物合成、改善肝功能、抗氧化应激、提高免疫力、MAPK与JAK-STST等信号通路调节等[16]。研究发现,具有抗HBV作用的中草药如当归[Angelica sinensis (Oliv.) Diels]、黄芪[Astragalus membranaceus (Fisch.) Bunge]等,还具有护肝、提高机体免疫、抗炎祛热等功效,因此中草药可能通过改善肝功能来抗HBV[17]。前期研究发现,从旱田草中提取的化合物des(rhamnosyl) verbascoside有抗HBV的活性[10],但其具体机制尚不明确。为探索des(rhamnosyl) verbascoside抗HBV的机制,本研究通过TMT蛋白筛选技术对药物干预组和对照组的差异蛋白进行检测,发现有300个差异蛋白,其中109个上调蛋白,191个下调蛋白。人类生长因子(HGF)是一种能促进肝细胞再生,间接减少胶原纤维产生,从而减轻肝纤维化程度的生长因子[18]。细胞外基质组分是反映肝纤维化的重要指标之一,当肝脏纤维化改变时,就会引起其生成增多,出现沉积或纤维蛋白溶解能力增强的现象[19]。本研究在des(rhamnosyl) verbascoside作用于HepG2.2.15细胞后,发现肝生长因子HGF上调,而层黏连蛋白LAMC1、跨膜蛋白SDC1等细胞外基质组分下调,推测药物可能通过改善乙肝病毒引起的肝损伤,从而起到肝损伤保护作用,但具体作用机制还需要进一步验证。
Sortilin-1 (SORT1)是一种多配体受体,可广泛参与细胞过程,属于VPS10P结构域受体家族。该蛋白可附着于VPS10结构域上的各种配体并将其运输至溶酶体[20],其可在肝脏的脂蛋白代谢过程中发挥作用[21, 22]。此外,SORT1是溶酶体通路的关键蛋白,该蛋白上调可能在溶酶体通路中发挥一定的抗HBV的作用。研究发现,肝脏SORT1蛋白表达与肝脏HBsAg表达呈负相关[23]。MAN2B1基因编码ɑ-甘露糖苷酶,该酶可在炎症反应、细胞的黏附和免疫监视等方面发挥作用[24]。
HBV感染细胞后,经过包膜剥离、衣壳分解等过程,使HBV rcDNA释放至细胞核内,然后在细胞内DNA聚合酶催化下迅速补齐长短链的缺口形成cccDNA,该过程是HBV自我复制的基础[25]。从HBV的生命周期中可以发现,DNA聚合酶在其致病性上发挥着重要作用。ERCC2是一种进化保守的螺旋酶,参与基因转录和核苷酸切除修复。本研究发现,当des(rhamnosyl) verbascoside作用于HepG2.2.15细胞后,ERCC2、PRIM1、PRIM2、POLA1、POLD3、POLD2、POLD1、POLE的表达水平明显下调;通过KEGG和PPI分析发现,ERCC2与DNA聚合酶催化基团PRIM1、PRIM2、POLA1、POLD3、POLD2、POLD1、POLE之间存在相互作用,它们之间可能通过抑制DNA聚合酶的活性,使HBV DNA的复制受到抑制,但des(rhamnosyl)verbascoside抗HBV的作用机制还需要进一步深入分析。
4 结论本研究通过TMT标记蛋白质组学技术筛选des(rhamnosyl) verbascoside干预HepG2.2.15细胞后的差异表达蛋白,发现药物干预组与对照组之间有300种差异表达蛋白,其中有109种上调蛋白,191种下调蛋白。GO富集分析结果发现具有显著差异的条目分别为生物学过程、分子功能和细胞组分。KEEG通路富集分析结果发现有13条差异显著的代谢通路。亚细胞定位分析结果发现差异表达蛋白主要位于细胞质和细胞核,分别占27.67%和26.00%;其次是位于胞外的蛋白质,约占14.33%。研究结果可为后续筛选抗乙肝病毒或肝损伤分子标记物奠定基础。
| [1] |
NGUYEN M H, WONG G, GANE E, et al. Hepatitis B virus: advances in prevention, diagnosis, and therapy[J]. Clinical Microbiology Reviews, 2020, 33(2): e00046-19. |
| [2] |
YUEN M F, CHEN D S, DUSHEIKO G M, et al. Hepatitis B virus infection[J]. Nature Reviews Disease Primers, 2018, 4: 18035. DOI:10.1038/nrdp.2018.35 |
| [3] |
LI H, YAN L B, SHI Y, et al. Hepatitis B virus infection: overview[J]. Advances in Experimental Medicine and Biology, 2020, 1179: 1-16. |
| [4] |
相佳瑶, 许敏, 冯阳. 抗HBV天然化合物作用机制的研究进展[J]. 中国药理学通报, 2021, 37(10): 1346-1351. |
| [5] |
PALACIOS-ÁLVAREZ I, ROMÁN-CURTO C, MIR-BONAFÉ J M, et al. Autoimmune response as a side effect of treatment with interferon-α in melanoma: does this have prognostic implications?[J]. International Journal of Dermatology, 2015, 54(3): e91-e93. |
| [6] |
SUCHER N J. The application of Chinese medicine to novel drug discovery[J]. Expert Opinion on Drug Discovery, 2013, 8(1): 21-34. DOI:10.1517/17460441.2013.739602 |
| [7] |
SONG P P, GAO J J, KOKUDO N, et al. Standardization of traditional Chinese medicine and evaluation of evidence from its clinical practice[J]. Drug Discoveries & Therapeutics, 2011, 5(6): 261-265. |
| [8] |
LI Z X, ZHAO Z M, LIU P, et al. Treatment of HBV cirrhosis with Fuzheng Huayu tablet and entecavir: design of a randomized, double-blind, parallel and multicenter clinical trial[J]. Chinese Journal of Integrative Medicine, 2021, 27(7): 509-513. DOI:10.1007/s11655-020-3257-6 |
| [9] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999: 351.
|
| [10] |
MOU J F, LIN X Z, SU H L, et al. Anti-hepatitis B virus activity and hepatoprotective effect of des(rhamnosyl) verbascoside from Lindernia ruellioides in vitro[J]. Phytotherapy Research, 2021, 35(8): 4555-4566. DOI:10.1002/ptr.7159 |
| [11] |
SEO J, LEE K J. Post-translational modifications and their biological functions: proteomic analysis and systematic approaches[J]. Journal of Biochemistry and Molecular Biology, 2004, 37(1): 35-44. |
| [12] |
牟翔宇, 孙鹏, 薛玲, 等. 基于整体观念探讨中医药应用蛋白质组学的研究进展[J]. 中华中医药杂志, 2021, 36(11): 6585-6588. |
| [13] |
HUGHES C S, SPICER V, KROKHIN O V, et al. Investigating acquisition performance on the orbitrap fusion when using tandem MS/MS/MS scanning with isobaric tags[J]. Journal of Proteome Research, 2017, 16(5): 1839-1846. DOI:10.1021/acs.jproteome.7b00091 |
| [14] |
WANG W, LI Q, HUANG G, et al. Tandem mass tag-based proteomic analysis of potential biomarkers for hepatocellular carcinoma differentiation[J]. OncoTargets and Therapy, 2021, 14: 1007-1020. DOI:10.2147/OTT.S273823 |
| [15] |
SHIRVANI-DASTGERDI E, SCHWARTZ R E, PLOSS A. Hepatocarcinogenesis associated with hepatitis B, delta and C viruses[J]. Current Opinion in Virology, 2016, 20: 1-10. |
| [16] |
肖冬焱, 刘正芸. 中药抗乙型肝炎病毒机制的研究进展[J]. 贵州医药, 2018, 42(2): 164-166. |
| [17] |
雷攀, 任攀, 王珊, 等. 中药抗乙型肝炎病毒作用机制及临床应用研究进展[J]. 中国药师, 2018, 21(7): 1258-1262. |
| [18] |
史美娜, 王小众, 郑伟达, 等. 白介素-10对肝纤维化大鼠星状细胞EGF及HGF表达的影响[J]. 中国药理学通报, 2005, 21(3): 327-331. |
| [19] |
夏海珊, 陈少茹, 钟月春, 等. 肝纤维化的发病机制和药物治疗现况[J]. 中国医药导报, 2014, 11(18): 162-165, 168. |
| [20] |
STRONG A, RADER D J. Sortilin as a regulator of lipoprotein metabolism[J]. Current Atherosclerosis Reports, 2012, 14(3): 211-218. |
| [21] |
DUBÉ J B, JOHANSEN C T, HEGELE R A. Sortilin: an unusual suspect in cholesterol metabolism: from GWAS identification to in vivo biochemical analyses, sortilin has been identified as a novel mediator of human lipoprotein metabolism[J]. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2011, 33(6): 430-437. |
| [22] |
BESHARAT S, KATOONIZADEH A, MOOSSAVI S, et al. The possible impact of sortilin in reducing HBsAg expression in chronic hepatitis B[J]. Journal of Medical Virology, 2016, 88(4): 647-652. |
| [23] |
刘波. 乙型肝炎病毒通过干扰溶酶体成熟抑制细胞自噬性降解途径[D]. 杭州: 浙江大学, 2013.
|
| [24] |
MOREMEN K W. Golgi α-mannosidase Ⅱ deficiency in vertebrate systems: implications for asparagine-linked oligosaccharide processing in mammals[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2002, 1573(3): 225-235. |
| [25] |
SCHREINER S, NASSAL M. A role for the host DNA damage response in hepatitis B virus cccDNA formation-and beyond?[J]. Viruses, 2017, 9(5): 125. |



