海草是主要生长于温带与热带海域海湾、澙湖等海洋区域沿岸的维管束植物[1]。海草床生态系统由海草植物群落构成,具有固碳、净化水质、为海洋生物提供栖息和繁殖场所等诸多价值[2]。关于水温对海草植物的影响已有大量研究报道。例如,高温可以明显降低鳗草(Zostera marina)的幼芽成活率和叶片伸长速率[3];在光照充足时,鳗草的生长速率会随着水温的升高而加快,而在光照不足时却随着环境温度的升高而下降,说明水温可与光照强度一起对海草产生协同影响[4];与之类似的是龟裂泰来草(Thalassia testudinum)叶片的生产力与叶绿素浓度也明显受到温度的调控[5];尽管泰来草(T.hemprichii)、齿叶丝粉草(Cymodocea serrulata)、海菖蒲(Enhalus acoroides)和全楔草(Thalassodendron ciliatum)对其生境中正午时分的高温胁迫具有耐受性,但这种高温环境已接近海草所能承受高温胁迫的上限[6]。上述研究关注的全都是水温绝对值过高或过低对海草的胁迫,而非水温在高低值之间的波动性。
全球范围内的海草床大多分布于近岸浅海区域,主要位于潮间带和潮下带[7, 8]。在潮间带生态系统中,海草周期性地没于水下和暴露在空气中意味着其长期生存在水文条件不断变化的环境中[9]。在人类活动干扰[10]和全球气候变化导致极端天气频发的环境背景下[9, 11],潮间带水温还有可能发生更为剧烈的变化[12],海草对这一环境特点的适应性如何,值得探究。然而,仅针对水温的不稳定性对海草造成影响的科学研究,目前尚未见报道[3-5]。水温波动性的模拟实验可能由于实验中水温波动幅度(简称“波幅”)过大时,温度绝对值过高或过低对海草构成胁迫,从而掩盖水温的波动性对海草的影响,形成实验干扰。有研究表明,海南海草床周边海水温度变化为19.46-33.00 ℃[13, 14],因此,本研究设定实验水温为22-32 ℃。由于泰来草和圆叶丝粉草(C.rotundata)是海南海草床较为常见的海草[2],在本实验室人工环境下长势良好,因此被选为实验对象。综上所述,本研究将泰来草和圆叶丝粉草种植于6组不同波幅的水温波动环境中,测定不同波幅下2种海草的主要生理指标和生长指标,旨在探究2种热带海草对水温波动的适应阈值与适应机制,从而为全球环境变化对海草床可能产生的影响提供水温不稳定性方面的评价,为拓展海草植物的基础生态学知识提供数据支持。
1 材料与方法 1.1 采样与暂养海南陵水新村湾(18°24′-18°27′N,109°57′-110°02′E)为天然潟湖[图 1(a)],面积约22.6 km2,底质以细砂为主[15]。本研究在实验前测得海水盐度为30.7,水温年际变化为(27.6±3.0) ℃。新村湾发育有较大面积的海草床,主要分布在湾内南部水深1.5 m内的区域,以泰来草、圆叶丝粉草、海菖蒲等为主要种类[15]。本研究选择新村湾海草床中每株茎枝数量为4的泰来草、圆叶丝粉草,采集后栽入长×宽×高为80 cm×50 cm×40 cm的亚克力实验缸[图 1(b)],每个实验缸以“长×宽=6×4株”的方式栽入24株海草,海草间距约为10 cm。每个实验缸铺入8 cm厚的沉积物为底质并加入120 L天然海水,水深30 cm。沉积物与海水均采自新村湾海草床。用造浪泵(3 W,JVP-110,森森集团股份有限公司)模拟海水流动并提供溶氧,泵口流速为(0.30±0.04) m/s。每日用新鲜海水置换实验缸中1/3海水,每日9时与19时分别测定实验缸中海水盐度1次并用蒸馏水补充蒸发失水,确保盐度恒定。光照采用自然光照。各实验缸的本底条件保持一致,泰来草和圆叶丝粉草分开栽种。

|
| Sampling area is in the yellow frame. 图 1 海南陵水新村湾卫星图(a)与实验缸(b) Fig. 1 Satellite map (a) and experimental cylinder (b) of Lingshui Xincun Bay, Hainan |
1.2 方法
实验地点为海南热带海洋学院园艺大棚内,实验时间为2022年7-12月,实验周期为150 d。每种海草设置6个不同水温波幅(含1个水温恒定的空白对照),每个处理组设3个重复,2种海草共设置36个实验缸。实验中使用加热棒(50 W,GR-50C,森森集团股份有限公司)或冷水机(AL-SF102,深圳市奥凌恒业科技有限公司)实现实验缸海水升温或降温。
根据文献[13, 14]和上述实测所得的新村湾海水温度年际变化情况,确定实验温度变化为22-32 ℃,据此设定6个温度波幅处理,波幅值分别是0、2、4、6、8、10 ℃,以确保各处理组的水温波幅均匀增大。另外,当调节实验缸水温时,水温在某一高位值或低位值对应时间段是白天或是夜晚,可能会因植物的光合或呼吸作用差异而成为干扰。因此,各实验缸每24 h进行一次温度调节,即各处理在每个温度值维持24 h后调至下一个温度值,循环往复,确保海草在每个温度值下经过的白天或夜晚等长。各处理组的水温调节范围与对应编号如表 1所示。
| 处理组编号 Number of treatment group |
水温波动范围/℃ Fluctuation range of water temperature/℃ |
水温波幅/℃ Amplitudes of water temperature/℃ |
| A | 27 | 0 |
| B | 26-28 | 2 |
| C | 25-29 | 4 |
| D | 24-30 | 6 |
| E | 23-31 | 8 |
| F | 22-32 | 10 |
选取生长状况、氧化与抗氧化产物、渗透调节物质、光合色素和光合荧光特征共4类14项常见指标对泰来草、圆叶丝粉草的生理与生长特性进行评价和测定。除生长状况和光合荧光特征的相关指标外,其余指标全部基于分光光度法,采用索莱宝试剂盒(https://www.solarbio.com/index.php)测定。
1.2.1 生长状况(1) 初级生产速率的测定。实验结束前10 d,每株海草随机选取1枚新鲜叶片,在其叶基分生点扎孔,10 d后剪下该孔与叶基之间的叶片区段,除去叶表附着物后称量鲜重,除以10 d,得到该海草叶片的初级生产速率[16]。
(2) 平均叶面积的测定。对每株海草随机选择3枚新鲜叶片,用手持式叶面积仪(LD-G10,山东莱恩德智能科技有限公司)[17]测量其面积,先计算每株海草的平均叶面积,再计算每个实验缸海草的平均叶面积,并得出每个处理组的海草平均叶面积。
1.2.2 氧化与抗氧化产物采用超氧化物歧化酶(SOD)活性检测试剂盒(https://www.solarbio.com/goods-6111.html)、过氧化氢酶(CAT)活性检测试剂盒(https://www.solarbio.com/goods-6114.html)、过氧化物酶(POD)活性检测试剂盒(https://www.solarbio.com/goods-6104.html)、抗坏血酸过氧化物酶(APX)活性检测试剂盒(https://www.solarbio.com/goods-6116.html)、丙二醛(MDA)含量检测试剂盒(https://www.solarbio.com/goods-6098.html)分别测定海草叶片的SOD、CAT、POD、APX活性与MDA含量。从每株海草上随机剪取1枚新鲜叶片,用蒸馏水冲洗叶片并清理干净叶表附着物后,称取0.1 g组织,加入1 mL提取液,冰浴并研磨搅拌成匀浆,随后8 500 r/min、4 ℃离心10 min,取上清液,置冰上。按照试剂盒说明书步骤向上清液中依次加入试剂1、2、3,随后将分光光度计(UV-VIS,德国Julabo公司)波长分别调节至560、240、470、290 nm并用蒸馏水调零,对所得溶液进行吸光度测定,最后根据说明书上提供的公式将上述4个吸光值分别换算为SOD、CAT、POD、APX的酶活性(U/g FW);将波长分别调至532和600 nm,用分光光度计测定吸光值,计算二者差值,代入说明书上的公式计算MDA含量(nmol/g)。
1.2.3 渗透调节物质(1) 脯氨酸(Pro)含量测定。采用Pro含量检测试剂盒(https://www.solarbio.com/goods-6123.html)测定海草叶片Pro含量。从每株海草上随机剪取1枚新鲜叶片,用蒸馏水冲洗叶片并清理干净叶表附着物后,称取约0.1 g组织,加入1 mL提取液进行冰浴匀浆;之后置沸水浴振荡提取10 min,9 500 r/min常温离心10 min,取上清液,冷却后待测。分光光度计预热30 min以上后调节波长至520 nm进行测定,用标准品绘制标准曲线,并根据说明书上的公式计算样品的Pro含量(μg/g)。
(2) 可溶性糖含量测定。采用植物可溶性糖含量检测试剂盒(https://www.solarbio.com/goods-6099.html)测定海草叶片可溶性糖含量。从每株海草上随机剪取1枚新鲜叶片,用蒸馏水冲洗叶片并清理干净叶表附着物后,称取约0.1 g样本,加入1 mL蒸馏水研磨成匀浆,倒入带盖离心管中,沸水浴10 min,冷却后,8 500 r/min常温离心10 min,取上清液于10 mL试管中,用蒸馏水定容至10 mL后摇匀。按照试剂盒说明书步骤用蒸馏水稀释样品并进行加样,混匀,95 ℃水浴10 min,冷却至室温后于620 nm处测定吸光值,并根据说明书上的公式按样本质量计算样品的可溶性糖含量(mg/g)。
(3) 可溶性蛋白含量测定。采用植物可溶性糖含量检测试剂盒测定海草叶片可溶性蛋白含量。将试剂盒中标准品按0、2、4、6、8、12、16、20 μL分别加到96孔板中,在595 nm波长处测定吸光度,绘制标准曲线。加磷酸缓冲盐溶液(PBS),稀释液补足到20 μL。从每株海草上随机剪取1枚新鲜叶片,取10 mL离心管,加入100 μL标准蛋白BSA与2.4 mL PBS,用蒸馏水稀释至终浓度为0.2 mg/mL;另外将5×G250染色液稀释成1×G250染色液,按试剂盒使用说明书依次往各离心管加入相应浓度的BSA、PBS和G250染色液。反应3 min后在波长595 nm下测定吸光度,按照标准曲线计算样品的可溶性蛋白浓度。
1.2.4 光合色素(1) 叶绿素a、叶绿素b与类胡萝卜素含量测定。采用植物叶绿素(Chlorophyll)含量检测试剂盒(https://www.solarbio.com/goods-6173.html)与植物类胡萝卜素含量检测试剂盒(https://www.solarbio.com/goods-67350.html)分别测定海草叶片叶绿素a、叶绿素b与类胡萝卜素含量。从每株海草上随机剪取1枚新鲜叶片,用蒸馏水清洗海草叶片,清理干净叶表附着物,剪取约0.1 g,放入研钵中磨碎;加入1 mL蒸馏水与10 mg试剂1,在黑暗或弱光条件下充分研磨后,转入10 mL试管中,用提取液冲洗研钵,将所有冲洗液转入10 mL试管中,用提取液定容至10 mL,包上锡箔纸浸提3 h至组织残渣颜色接近于白色。取上层浸提液1 mL放入玻璃比色皿,将分光光度计波长分别调节至645、663和470 nm,用提取液调零,测定吸光值。将吸光值代入试剂盒说明书上的公式,分别计算叶绿素a、叶绿素b与类胡萝卜素的含量(mg/g)。
(2) 光合作用光反应的荧光特征测定。清理干净海草叶片叶表附着物后,采用水下调制叶绿素荧光仪(Diving-PAM 2500,德国Heinz Walz GmbH公司)和数据采集软件Wincontrol-3测定快速光曲线(RLCs)。每株海草选取1枚新鲜叶片,测量前,将暗叶夹夹于叶片(离顶端3 cm左右),经暗适应20 min后,打开暗叶夹,开启检测光,光合有效辐射强度(PAR)梯度分别为0、100、200、300、500、700、900、1 100和1 250 μmol/(m2·s),时间约2 min。相对电子传递速率(rETR)值由系统选定模式自动计算生成[18]。
1.3 数据统计分析采用Excel 2021对各项指标在不同处理间的变化规律绘制统计图。用SPSS 19.0软件对不同水温波幅下2种海草的各项指标的观测值进行单因素方差分析(One-way ANOVA),同时基于不同水温波幅与不同海草种类进行双因素方差分析(Two-way ANOVA),并进行检验[19]。
2 结果与分析 2.1 地上部生产力泰来草和圆叶丝粉草的生长速率、平均叶面积随水温波幅增大的变化情况如图 2所示(图中误差棒为标准差,下同)。相对于对照组,泰来草和圆叶丝粉草的初级生产速率随水温波幅增大呈先极显著增大后极显著减小的趋势(P < 0.01),在处理B达到峰值;相对于对照组,泰来草和圆叶丝粉草的平均叶面积同样呈先极显著增大后极显著减小的趋势(P < 0.01),并分别在处理C和处理B达到峰值。总体上水温波幅对2种海草的初级生产速率和平均叶面积影响极显著。水温波幅与不同海草种类的互作效应对海草的初级生产速率、平均叶面积的影响极显著(P < 0.01)。
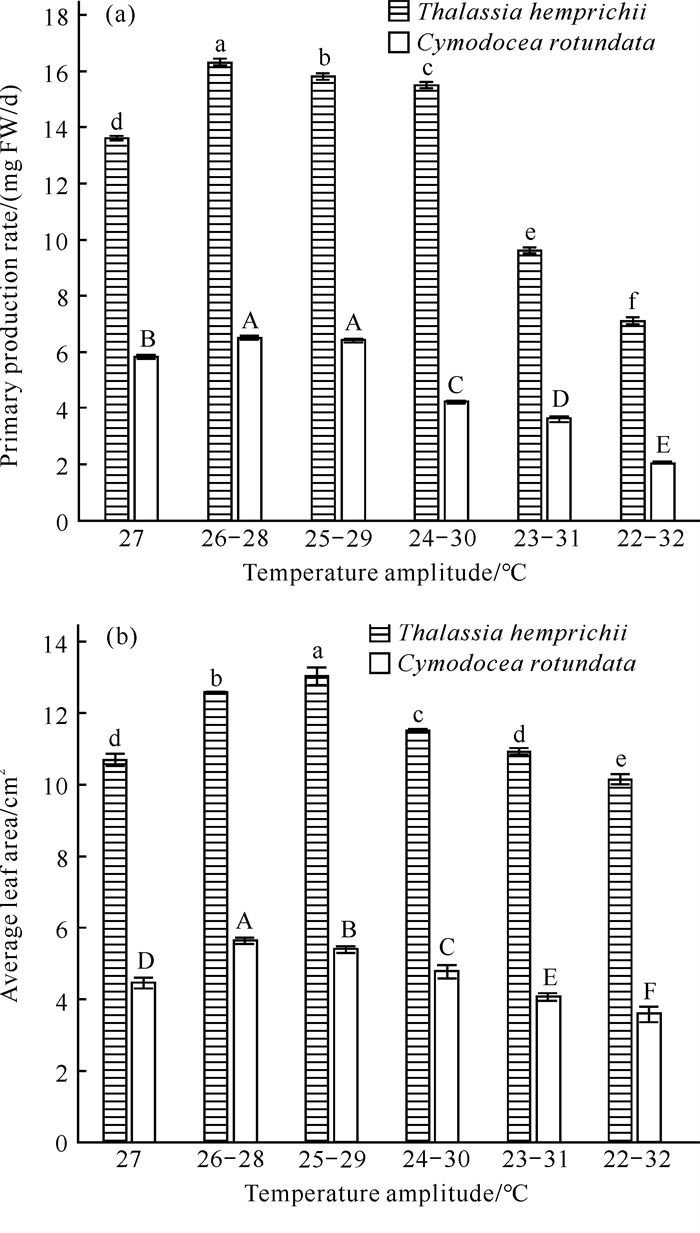
|
| Different capital letters indicate extremely significant differences (P < 0.01) between treatments for C.rotundata, and different lowercase letters indicate extremely significant differences (P < 0.01) between treatments for T.hemprichii. 图 2 不同水温波幅下泰来草、圆叶丝粉草初级生产速率(a)和平均叶面积(b)的变化情况 Fig. 2 Primary production rate (a) and average leaf area (b) of T.hemprichii and C.rotundata under different water temperature fluctuations |
2.2 氧化与抗氧化产物
泰来草和圆叶丝粉草SOD、CAT、POD、APX活性、MDA含量随水温波幅增大的变化情况如图 3所示。相对于对照组,2种海草的SOD、CAT、POD、APX活性以及MDA含量随水温波幅增大呈先极显著减小再极显著增大的趋势(P < 0.01),并且均在处理B达到最小值;总体上水温波幅对2种海草的SOD、CAT、POD、APX活性和MDA含量影响极显著(P < 0.01),水温波幅与不同海草种类的互作效应对海草SOD、CAT、POD、APX活性、MDA含量的影响极显著(P < 0.01)。此外,除POD活性外,在其余指标的观测值上,圆叶丝粉草在最大波幅组相对于对照组的变化幅度均大于泰来草。
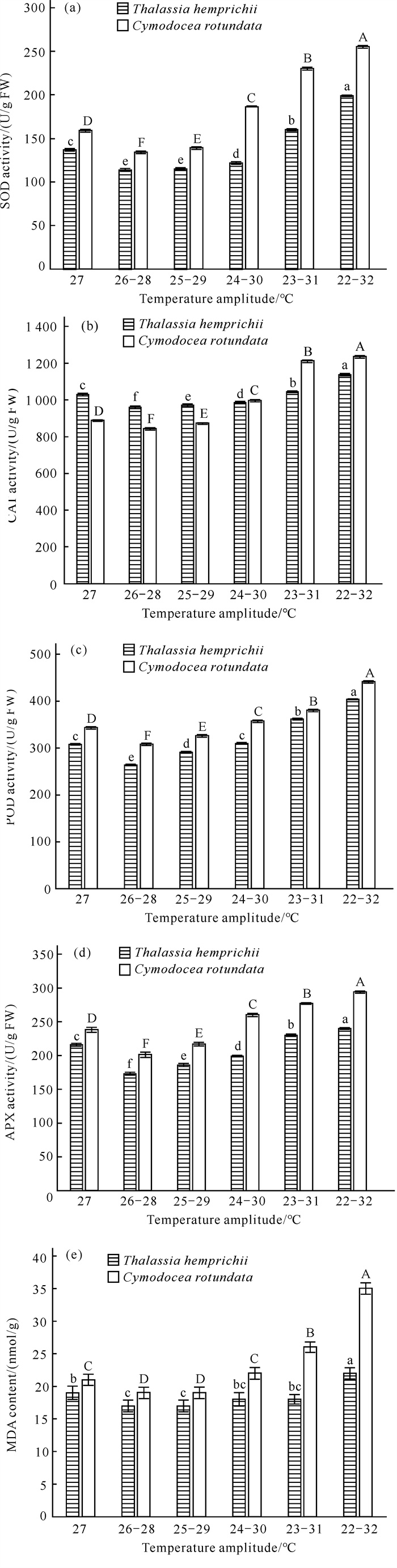
|
| Different capital letters indicate extremely significant differences (P < 0.01) between treatments for C.rotundata, and different lowercase letters indicate extremely significant differences (P < 0.01) between treatments for T.hemprichii. 图 3 不同水温波幅下泰来草、圆叶丝粉草SOD (a)、CAT (b)、POD (c)、APX (d)活性和MDA (e)含量的变化情况 Fig. 3 Activity changes of SOD (a), CAT (b), POD (c), APX (d) and MDA (e) in T.hemprichii and C.rotundata under different water temperature fluctuations |
2.3 渗透调节物质
泰来草和圆叶丝粉草可溶性糖、可溶性蛋白、Pro含量随水温波幅增大的变化情况如图 4所示。相对于各自的对照组,2种海草的可溶性糖和可溶性蛋白含量均随水温波幅增大而先极显著增大,后极显著减小(P < 0.01),并在处理B达到峰值;2种海草的Pro含量均先极显著减小,后极显著增大(P < 0.01),并在处理B达到最低值。总体上水温波幅对2种海草可溶性糖、可溶性蛋白和Pro含量影响极显著(P < 0.01)。水温波幅与不同海草种类的互作效应对海草可溶性糖、可溶性蛋白和Pro含量的影响极显著(P < 0.01)。此外,在水温最大波幅时,圆叶丝粉草的3种渗透调节物质含量相对于对照组的变化幅度均大于泰来草。
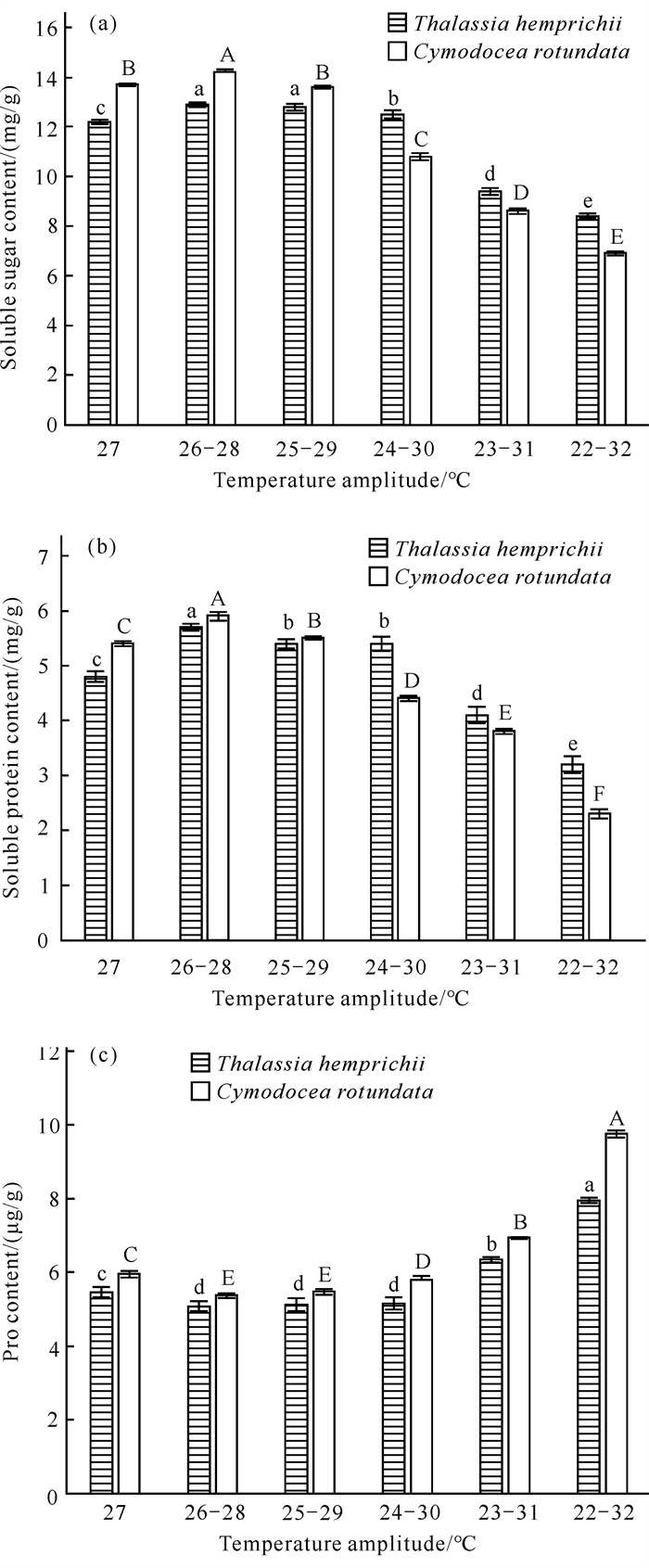
|
| Different capital letters indicate extremely significant differences (P < 0.01) between treatments for C.rotundata, and different lowercase letters indicate extremely significant differences (P < 0.01) between treatments for T.hemprichii. 图 4 不同水温波幅下泰来草、圆叶丝粉草可溶性糖(a)、可溶性蛋白(b)和Pro (c)含量的变化情况 Fig. 4 Changes of soluble sugar (a), soluble protein (b) and Pro (c) content in T.hemprichii and C.rotundata under different water temperature fluctuations |
2.4 光合作用
泰来草和圆叶丝粉草叶绿素a、叶绿素b、类胡萝卜素含量随水温波幅增大的变化情况如图 5所示。相对于各自的对照组,2种海草的叶绿素a、叶绿素b含量,以及泰来草的类胡萝卜素含量随水温波幅增大而先极显著增大,后极显著减小(P < 0.01)。圆叶丝粉草类胡萝卜素含量随水温波幅增大,初期未出现显著变化(P>0.05),随后极显著减小(P < 0.01)。总体上水温波幅对2种海草的3种光合色素含量影响极显著(P < 0.01),且水温波幅与不同海草种类的互作效应对3种光合色素含量的影响极显著(P < 0.01)。此外,在最大水温波幅时,圆叶丝粉草3种光合色素含量下降幅度均大于泰来草。
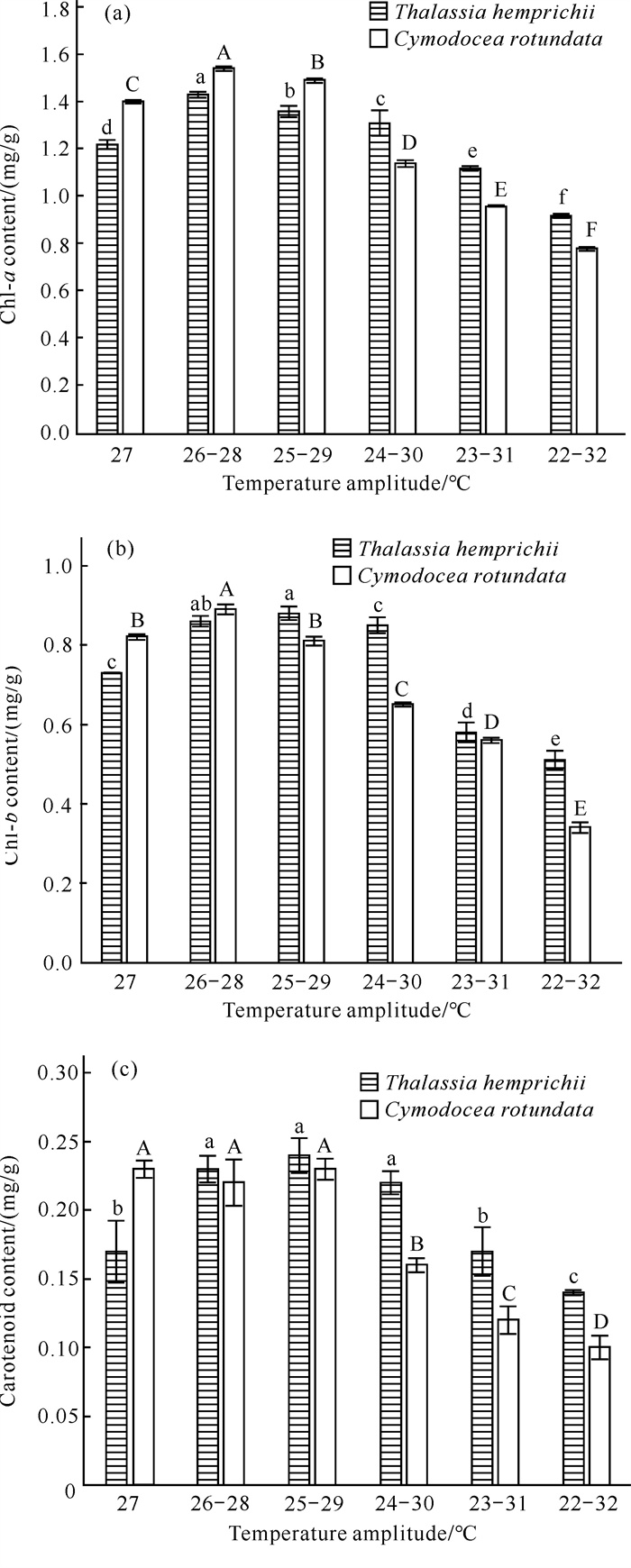
|
| Different capital letters indicate extremely significant differences (P < 0.01) between treatments for C.rotundata, and different lowercase letters indicate extremely significant differences (P < 0.01) between treatments for T.hemprichii. 图 5 不同水温波幅下泰来草和圆叶丝粉草叶绿素a (a)、叶绿素b (b)、类胡萝卜素(c)变化情况 Fig. 5 Changes of chlorophyll a (a), chlorophyll b (b) and carotenoids (c) in T.hemprichii and C.rotundata under different water temperature fluctuations |
通过设定PAR测定不同水温波幅下海草叶片的相对光合电子传递速率rETR值,拟合出快速光曲线,结果如图 6所示。2种海草的rETR值随着PAR的增大均呈现快速上升而后缓慢下降的趋势。泰来草、圆叶丝粉草在PAR分别为300和435 μmol/(m2·s)时,rETR值达到峰值。2种海草的最大相对电子传递速率(rETRmax)值在各处理组的变化趋势均为C>B>A>D>E>F。
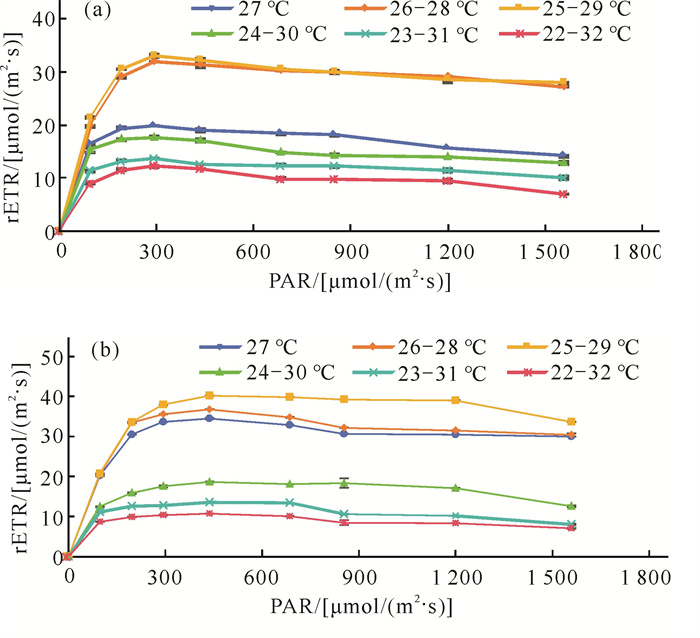
|
| 图 6 泰来草(a)和圆叶丝粉草(b)的快速光曲线 Fig. 6 RLCs in T.hemprichii (a) and C.rotundata (b) |
3 讨论 3.1 生长状况
初级生产速率能够反映海草在特定时间内提供初级生产力的能力[20],而植物叶片是植物的营养器官,叶面积的增加有利于提高植物的光合作用,促进植物营养生长[21]。本研究中当水温波幅为2-4 ℃时,泰来草和圆叶丝粉草叶片的初级生产速率、平均叶面积均显著增加。因此,24 h内波幅不超过4 ℃的水温环境可能是2种海草生长的最适环境,但随着波幅达到并超过8 ℃,圆叶丝粉草的初级生产力与营养生长开始下降;随着波幅达到10 ℃,泰来草的初级生产力与营养生长也开始下降。Aioi等[22]认为来自斐济群岛的针叶草(Syringodium isoetifolium)叶片自分生点抽出到凋落的最长周期为56 d;莱氏二药草(Halodule wrightii)叶片在21 d内全部完成更新[23]。而本研究团队发现当水温为(30±2) ℃时,泰来草的叶片生长周期约为29 d,圆叶丝粉草叶片生长周期约为18 d(未发表)。本研究认为,水温的波动性会通过改变初级生产速率来影响这一周期。由于海草主要是通过凋落物将碳元素储藏于海床下[24],因此海草叶片的周转率不仅指示海草的初级生产效率[23],还是评价海草固碳能力的重要指标。由此,本研究认为海草床系统的生产力与固碳能力还受到水温波幅的影响。
3.2 氧化与抗氧化产物活性变化本研究中,泰来草和圆叶丝粉草的SOD、POD、CAT、APX活性、MDA含量总体上随水温波幅增大而先减小后增大。相对于水温恒定时,圆叶丝粉草的4种抗氧化酶活性值均在波幅为6 ℃时开始升高,而泰来草的抗氧化酶活性值在波幅为8 ℃时开始升高,且圆叶丝粉草除POD活性外其余指标在最大波动时相对对照组的上升幅度均大于泰来草。这表明,当水温波幅达到8 ℃时,圆叶丝粉草的叶片细胞膜脂过氧化程度开始加剧,表现为MDA含量明显上升,当波幅达到10 ℃时,泰来草也开始出现这一趋势;当水温波幅超过4 ℃时,圆叶丝粉草可通过增加抗氧化酶活性抵御水温波动造成的过氧化胁迫,当波幅为8-10 ℃时,泰来草也开始有此表现。总体而言,2种海草对水温波动表现出一定的适应性。这与夏优等[25]对鳗草在高温胁迫下抗氧化酶与MDA的变化趋势的研究结果具有相似性,该研究认为鳗草通过抗氧化系统的调节对高温胁迫具有一定的耐受性,但调节能力有限。若水温持续超过鳗草的阈值,其抗氧化酶系统最终会被破坏。与夏优等[25]和杨冉[26]的研究结果不同的是,本研究并未发现在波幅为0-10 ℃时海草抗氧化酶活性呈降低趋势,推测这是选择在2种海草适宜温度范围内进行实验所造成的结果。另外,本研究观察到2种海草抗氧化酶活性与MDA含量最低值均在水温波幅为2-4 ℃而非水温恒定时,这也进一步验证了一定程度的水温不稳定性更有利于泰来草、圆叶丝粉草的生长。与之类似的是,杨冉[26]发现水温在20-30 ℃时,卵叶喜盐草(Halophila ovalis) SOD、POD、CAT活性相对于其他温度处理组更高,且MDA含量相对其他水温区间较低,因此认为卵叶喜盐草的最适温度是20-30 ℃,水温若继续升高,卵叶喜盐草的抗氧化性能将受到影响。上述结果表明,水温波幅过大与水温过高对海草造成的过氧化胁迫具有一定的相似性。
3.3 渗透调节变化本研究中,泰来草和圆叶丝粉草的可溶性蛋白、可溶性糖含量均呈现先增大后减小的趋势,且在波幅为2 ℃时达到最大,推测波幅在2 ℃左右的水温波动可加速海草体内可溶性糖与蛋白质的合成,提高其抗逆性,这表明水温波动可能改变2种海草细胞的渗透性[27],但海草可通过加速合成可溶性糖与可溶性蛋白对这种胁迫进行抵御[28, 29]。与之相似的是,高温胁迫下不同品种玉簪(Hosta plantaginea)的耐热性与其体内可溶性蛋白含量的上升值呈正相关,可溶性蛋白含量在耐热性强的品种上增加较多[30],而茶树(Camellia sinensis)在受到低温胁迫时淀粉可降解成可溶性糖以调节细胞渗透压,从而提高植物抗冻能力,因此可溶性糖含量上升[31]。另外,本研究中,随水温波幅增大,圆叶丝粉草可溶性糖、可溶性蛋白含量的下降早于泰来草;在最大波幅组,圆叶丝粉草中这2种物质的含量相对水温恒定组的下降幅度也大于泰来草。因此,水温波动对圆叶丝粉草细胞渗透调节能力的影响大于对泰来草的影响。圆叶丝粉草、泰来草的Pro含量随水温波幅增大先降低后升高,并且前者在最大波幅时相对对照组的增幅大于后者的增幅。泰来草、圆叶丝粉草叶片Pro含量的变化趋势表明,水温波动超过8 ℃可能改变这2种海草的细胞膜渗透性,但水温波幅为2-4 ℃的环境可能是2种海草适宜生长的环境。总体上水温波动可影响上述2种海草的细胞膜渗透调节过程,但仅在波幅超过8 ℃时对海草构成明显胁迫。
3.4 光合作用变化本研究中,圆叶丝粉草和泰来草的叶绿素a、叶绿素b、类胡萝卜素含量总体上呈先增大后减小的规律。圆叶丝粉草的叶绿素与类胡萝卜素含量从水温波幅为4 ℃开始极显著减小,早于泰来草。泰来草的叶绿素含量与类胡萝卜素含量分别在波幅为6和8 ℃时开始下降。这表明圆叶丝粉草叶绿素含量对温度波动的响应更敏感。因此,水温波幅为2-4 ℃是2种海草适宜生长的环境。随着波幅继续增大,这一环境特点类似于高温胁迫损害5-氨基乙酰丙酸生物合成[32],由于该物质是叶绿素合成的关键前体[33],因此可间接降低叶绿素的合成,并通过引起活性氧(ROS)的积累消耗类胡萝卜素,由于类胡萝卜素可猝灭活性氧,防止膜脂过氧化[34],因此类胡萝卜素含量下降可加速叶绿素降解[35]。由此,本研究认为水温波幅超过6 ℃可引起圆叶丝粉草叶片的ROS升高,对海草产生膜质过氧化胁迫,超过8 ℃则对2种海草均是如此。这与水温波幅在6、8 ℃时分别对应圆叶丝粉草与泰来草的抗氧化酶活性开始上升的结果相吻合,进一步说明了水温波幅过大可引起海草叶片的ROS升高,对海草产生膜质过氧化胁迫。此外,2种海草在光合色素含量上表现出对水温波幅为2-4 ℃的水环境的良好适应,即水温波幅在2-4 ℃时比水温恒定更有利于海草光合色素的积累。
快速光曲线不仅可以评估植物当前的最大光合能力,还可以评估植物在各种不同光照强度时的潜在光活性[36]。本研究中圆叶丝粉草、泰来草的rETR值随着PAR的增加而增加,然后下降并趋于平缓,表现出光抑制[19]。水温波幅为4 ℃时2种海草的rETRmax值最大,其次是水温为2 ℃时,而后随着水温波幅继续增大,rETRmax值减小。这反映了水温波幅过大可使2种海草光合作用PSⅡ中电子传递速率显著受到光抑制,光合活性下降,但波幅不超过4 ℃的水温波动环境比水温恒定的环境更能促进光电子传递效率。
综上所述,当水温波幅为2-4 ℃时,泰来草、圆叶丝粉草的初级生产速率与平均叶面积值较大,表明初级生产力较高;SOD、POD、CAT、APX活性与MDA含量较低,表明氧化应激产物和抗氧化酶活性较低;可溶性糖和可溶性蛋白含量较高,Pro含量较低,表明细胞膜渗透调节能力良好,渗透压未发生明显变化;叶绿素与类胡萝卜素含量较高,rETRmax值较大,表明光合作用良好。但当水温波幅超过6 ℃时,圆叶丝粉草的上述指标绝大部分出现相反的变化趋势;而当波幅超过8 ℃时,泰来草的上述指标绝大部分也出现相反的变化趋势。这表明波幅为2-4 ℃的水温波动是适宜泰来草、圆叶丝粉草生长的环境,随着波幅不断增大,2种海草因水温波动受到过氧化胁迫。
4 结论泰来草、圆叶丝粉草在各项生理指标上表现出对水温波幅为2-4 ℃环境的高度适应。这一环境比水温恒定更适宜泰来草、圆叶丝粉草的生长,但波幅超过6 ℃可对圆叶丝粉草造成胁迫,超过8 ℃可对泰来草造成胁迫,引起海草生长状况的下降。此外,圆叶丝粉草各项生理与生长指标值在水温波幅为10 ℃时相对于波幅为0 ℃时的变化幅度均大于泰来草,表明圆叶丝粉草对水温变化的敏感性高于泰来草。
| [1] |
DENNISON W C, ORTH R J, MOORE K A, et al. Assessing water quality with submersed aquatic vegetation[J]. BioScience, 1993, 43(2): 86-94. DOI:10.2307/1311969 |
| [2] |
蔡泽富. 文昌主要海草床微生物群落特征及两类陆源污染物与弧菌对泰来草细菌群落影响的研究[D]. 海口: 海南大学, 2021.
|
| [3] |
HÖFFLE H, THOMSEN M S, HOLMER M. High mortality of Zostera marina under high temperature regimes but minor effects of the invasive macroalgae Gracilaria vermiculophylla[J]. Estuarine, Coastal and Shelf Science, 2011, 92(1): 35-46. DOI:10.1016/j.ecss.2010.12.017 |
| [4] |
BULTHUIS D A. Effects of temperature on photosynthesis and growth of seagrasses[J]. Aquatic Botany, 1987, 27(1): 27-40. DOI:10.1016/0304-3770(87)90084-2 |
| [5] |
LEE K S, DUNTON K H. Production and carbon re-serve dynamics of the seagrass Thalassia testudinum in Corpus Christi Bay, Texas, USA[J]. Marine Ecology Progress Series, 1996, 143: 201-210. DOI:10.3354/meps143201 |
| [6] |
GEORGE R, GULLSTRÖM M, MANGORA M M, et al. High midday temperature stress has stronger effects on biomass than on photosynthesis: a mesocosm experiment on four tropical seagrass species[J]. Ecology and Evolution, 2018, 8(9): 4508-4517. DOI:10.1002/ece3.3952 |
| [7] |
RAMAGE D L, SCHIEL D R. Patch dynamics and response to disturbance of the seagrass Zostera novazelandica on intertidal platforms in southern New Zealand[J]. Marine Ecology Progress Series, 1999, 189: 275-288. DOI:10.3354/meps189275 |
| [8] |
MASSA S I, ARNAUD-HAOND S, PEARSON G A, et al. Temperature tolerance and survival of intertidal populations of the seagrass Zostera noltii (Hornemann) in Southern Europe (Ria Formosa, Portugal)[J]. Hydrobiologia, 2009, 619(1): 195-201. DOI:10.1007/s10750-008-9609-4 |
| [9] |
ZHANG M, ZHANG L, LI H, et al. The lack of low te-mperature tolerance of tropical seagrasses strongly restricts their geographical distribution[J]. Marine Environmental Research, 2022, 173: 105539. DOI:10.1016/j.marenvres.2021.105539 |
| [10] |
OUYANG H, TANG X, ZHANG R, et al. Resilience building and collaborative governance for climate change adaptation in response to a new state of more frequent and intense extreme weather events[J]. International Journal of Disaster Risk Science, 2023, 14(1): 162-169. DOI:10.1007/s13753-023-00467-0 |
| [11] |
ARMSTRONG MCKAY D I, STAAL A, ABRAMS J F, et al. Exceeding 1.5 ℃ global warming could trigger multiple climate tipping points[J]. Science, 2022, 377(6611): eabn7950. DOI:10.1126/science.abn7950 |
| [12] |
MANCUSO F P, GIOMMI C, MANGANO M C, et al. Evenness, biodiversity, and ecosystem function of intertidal communities along the Italian coasts: experimental short-term response to ambient and extreme air temperatures[J]. The Science of the Total Environment, 2023, 858(Pt 3): 160037. |
| [13] |
韩舞鹰, 王明彪, 马克美. 我国夏季最低表层水温海区: 琼东沿岸上升流区的研究[J]. 海洋与湖沼, 1990, 21(3): 267-275. |
| [14] |
张喆, 俞晓磊, 梁宇娴, 等. 海水升温对非虫黄藻共生型珊瑚Cladopsammia sp.的生理影响[J]. 热带海洋学报, 2022, 41(5): 141-149. |
| [15] |
樊敏玲, 黄小平, 张大文, 等. 海南新村湾海草床主要鱼类及大型无脊椎动物的食源[J]. 生态学报, 2011, 31(1): 31-38. |
| [16] |
高亚平, 方建光, 唐望, 等. 桑沟湾大叶藻海草床生态系统碳汇扩增力的估算[J]. 渔业科学进展, 2013, 34(1): 17-21. |
| [17] |
冯冬霞, 施生锦. 叶面积测定方法的研究效果初报[J]. 中国农学通报, 2005, 21(6): 150-152, 155. DOI:10.3969/j.issn.1000-6850.2005.06.043 |
| [18] |
高桂青. 鄱阳湖湿地沉水植物对环境变化的生理生态响应[D]. 南昌: 南昌大学, 2019.
|
| [19] |
刘兴诏, 周国逸, 张德强, 等. 南亚热带森林不同演替阶段植物与土壤中N、P的化学计量特征[J]. 植物生态学报, 2010, 34(1): 64-71. |
| [20] |
唐望. 桑沟湾大叶藻生理生态学及草场恢复研究[D]. 上海: 华东理工大学, 2013.
|
| [21] |
杨国虎, 李建生, 罗湘宁, 等. 干旱条件下玉米叶面积变化及地上干物质积累与分配的研究[J]. 西北农林科技大学学报(自然科学版), 2005, 33(5): 27-32. |
| [22] |
AIOI K, POLLARD P C. Biomass, leaf growth and loss rate of the seagrass Syringodium isoetifolium on Dravuni Island, Fiji[J]. Aquatic Botany, 1993, 46(3/4): 283-292. |
| [23] |
VIRNSTEIN R W. Leaf growth rate of the seagrass Halodule wrightii photographically measured in situ[J]. Aquatic Botany, 1982, 12: 209-218. |
| [24] |
罗红雪, 刘松林, 江志坚, 等. 海草床有机碳组成与微生物转化及其对富营养化的响应[J]. 科学通报, 2021, 66(36): 4649-4663. |
| [25] |
夏优, 生西玲, 孙田力, 等. 高温对鳗草氧化损伤和抗氧化系统的影响[J]. 海洋湖沼通报, 2021, 43(5): 136-142. |
| [26] |
杨冉. 温度、光照、盐度对喜盐草生长及生理生化特性的影响[D]. 湛江: 广东海洋大学, 2015.
|
| [27] |
门胜男. 籽粒建成期高温干旱胁迫对玉米叶片生理特性、养分积累及产量的影响[D]. 重庆: 西南大学, 2020.
|
| [28] |
DING Y, WANG X T, WANG F, et al. The effects of chilling stress on antioxidant enzymes activities and proline, malondialdehyde, soluble sugar contents in three Paphiopedilum species[J]. Russian Journal of Plant Physiology, 2023, 70(4): 61. |
| [29] |
田治国. 万寿菊属植物耐热性与抗旱性的评价及生长生理特性的研究[D]. 杨凌: 西北农林科技大学, 2012.
|
| [30] |
莫健彬, 陈必胜, 黄梅, 等. 高温对玉簪品种部分生理指标的影响研究[J]. 种子, 2007, 26(5): 48-51. |
| [31] |
朱政, 蒋家月, 江昌俊, 等. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J]. 安徽农业大学学报, 2011, 38(1): 24-26. |
| [32] |
KUMAR T A, CHARAN T B. Temperature-stress-induced impairment of chlorophyll biosynthetic reactions in cucumber and wheat[J]. Plant Physiology, 1998, 117(3): 851-858. |
| [33] |
汪良驹, 姜卫兵, 章镇, 等. 5-氨基乙酰丙酸的生物合成和生理活性及其在农业中的潜在应用[J]. 植物生理学通讯, 2003, 39(3): 185-192. |
| [34] |
WILLEKENS H, VAN CAMP W, VAN MONTAGU M, et al. Ozone, sulfur dioxide, and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes in Nicotiana plumbaginifolia L[J]. Plant Physiology, 1994, 106(3): 1007-1014. |
| [35] |
汪炳良, 徐敏, 史庆华, 等. 高温胁迫对早熟花椰菜叶片抗氧化系统和叶绿素及其荧光参数的影响[J]. 中国农业科学, 2004, 37(8): 1245-1250. |
| [36] |
RALPH P J, GADEMANN R. Rapid light curves: a powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005, 82(3): 222-237. |



