2. 广东海洋大学深圳研究院, 广东深圳 518108;
3. 深圳市碧海蓝天海洋科技有限公司, 广东深圳 518108
2. Research Institute of Guangdong Ocean University in Shenzhen, Shenzhen, Guangdong, 518108, China;
3. Shenzhen Bihai Blue Sky Marine Technology Co., Ltd., Shenzhen, Guangdong, 518108, China
珊瑚礁被称为海洋中的“热带雨林”,是海洋中生物多样性较丰富的生态系统之一,为许多生物提供了栖息地,同时也为渔业提供了丰富的捕捞资源,具有极其重要的生态价值和经济价值。然而,近年来珊瑚礁面临着严重威胁,过度捕捞、海洋污染、气候变化等因素导致了珊瑚白化、死亡和珊瑚礁生态系统的退化。这些因素长期对珊瑚礁的干扰给生态系统带来的压力超过了自然恢复的阈值,因此珊瑚礁生态从被动保护状态转向更积极的干预状态[1]。为了保护和修复珊瑚礁,人为干预修复变得至关重要[2]。目前,最常见的人工珊瑚礁修复技术有珊瑚园艺(移植珊瑚断枝,包括苗圃和移植阶段)、直接移植(使用珊瑚断枝进行移植,不需要苗圃阶段)和人工珊瑚礁[3],这些技术需要大量的珊瑚,通过种苗培育和引入,加速珊瑚礁的恢复过程,提高珊瑚生存率和珊瑚礁生态系统的稳定性。依靠自然界有限的供体珊瑚或低效率高成本的人工繁育都无法满足珊瑚礁修复工程的需求,解决珊瑚礁修复过程中大批量珊瑚种苗问题显得至关重要[4]。
造礁石珊瑚种苗在生长过程中会受到温度、海洋酸化、悬浮物和富营养化等环境因素的影响[5-8]。珊瑚生长速度较慢,培育和引种需要长期投入。目前,通过微电流手段促进珊瑚种苗生长,国外学者已积累一定理论与经验。印度尼西亚的Wallace等[9]研究了电压对鹿角珊瑚(Acropora sp.)存活和生长的影响,测定了鹿角珊瑚的长度和存活率,同时还监测了营养盐的变化情况,结果表明实验组鹿角珊瑚的生长速度比对照组快2-3倍。Hilbertz等[10]研究发现微电流可以使鹿角珊瑚在10周内生长5-8 cm。生物岩石(Biorock)技术通过电化学方式促进珊瑚骨架的生长,提高造礁石珊瑚的存活率和降低造礁石珊瑚的脱落率,实验组造礁石珊瑚的生长速度均高于对照组,且存活率均在75%以上[11]。目前,国内对微电流技术促进珊瑚生长的研究较少,并且微电流对珊瑚种苗长期的影响尚不清楚。
深圳市大鹏半岛是一个重要的海洋生态环境区域,该地区拥有丰富的海洋生物,造礁石珊瑚种类众多,优势物种有滨珊瑚(Porites sp.)、蜂巢珊瑚(Favositidae sp.)、蔷薇珊瑚(Montipora sp.)等[12,13]。然而随着人类活动和自然因素的影响,珊瑚礁开始慢慢退化[14,15],因此,本研究在深圳市大鹏半岛大鹏湾珊瑚自然海域培育区人工培育设施上开展5种造礁石珊瑚种苗培育,将电压为6、12和18 V的微电流分别持续作用于培育设施,监测局部海水水质参数、造礁石珊瑚存活率和生长状况的变化,分析微电流对造礁石珊瑚存活和生长的影响。研究结果可为微电流胁迫影响造礁石珊瑚种苗存活及生长的机制研究提供思路,为低压通电技术促进造礁石珊瑚种苗生长提供理论基础数据,为珊瑚礁生态系统的保护提供基础数据和指导性建议。
1 材料与方法 1.1 研究区域与样品收集2017年8月在大鹏湾海域采集造礁石珊瑚母株,团块状珊瑚和分枝状珊瑚均属于深圳海域的优势种珊瑚,团块状珊瑚生长速度慢,对温度的耐受程度大; 分枝状珊瑚生长速度快,对温度比较敏感; 叶状珊瑚介于二者之间。因此,采集霜鹿角珊瑚(Acropora pruinosa)、澄黄滨珊瑚(Porites lutea)、盾形陀螺珊瑚(Turbinaria peltata)、十字牡丹珊瑚(Pavona decussata)、膨胀蔷薇珊瑚(Montipora turgescens),浸水保温运回实验室,切割成大小相同的断枝或团块各120株,开展恢复性培养。造礁石珊瑚适宜的生长温度为23-29 ℃,自然光照强度在250 μmol·photons·m-2·s-1左右;室内培养水体温度为(26±0.5) ℃,光照强度为250 μmol·photons·m-2·s-1,光暗比为12 h∶12 h,每天换水1次,每次换水量为30%,培养时间为两周,直到造礁石珊瑚恢复至健康状态时,将其固定在珊瑚底托上,放置在珊瑚自然海域培养区(22°33′33.879″N,114°27′36.493″E)开始野外实验培育。
1.2 实验条件设计珊瑚自然海域培育区位于大鹏湾海域(图 1),共有4个苗圃,分为3个实验组和1个对照组。实验组苗圃供电电压分别为6、12、18 V,对照组苗圃不供电。将5种造礁石珊瑚各30株通过陶瓷基座间接固定于苗圃(图 2),剩余各90株直接通过扎带固定在钛网上,对所有珊瑚都进行编号与标记。每个苗圃安置1组HOBO温度记录仪(设置间隔6 h记录1次温度数据);低压通电苗圃系统设施间隔2周维护1次。
|
| 图 1 珊瑚自然海域培育区 Fig. 1 Coral natural marine cultivation area |

|
| 图 2 造礁石珊瑚的种植和培养 Fig. 2 Planting and culture of reef-building corals |
自然海域实验时间为11个月,分别于第15、30、90、180、300天对水质参数、造礁石珊瑚存活和生长状况进行监测,造礁石珊瑚存活数量和生长参数直接在水下原位统计记录。
1.3 水质参数分析水样采集于苗圃上方0.5 m区域,经47 mm GF/F膜过滤,一部分水样用于现场测定pH值和溶解氧含量,另一部分水样运回实验室测定铵盐、硝酸盐、亚硝酸盐、活性磷酸盐。水质参数测定参照《海洋调查规范:第4部分海水化学要素调查》(GB 12763-2007)[16]。
1.4 存活状况和生长率分析第15天水下统计5种珊瑚种苗存活数量,计算脱落率和存活率,其中脱落率=(脱落珊瑚数/总珊瑚数)×100%,存活率=(存活珊瑚数/总珊瑚数)×100%。在第300天统计5种珊瑚种苗的生长率,生长率=(最终宽度-初始宽度)/时间。
1.5 生长参数分析根据造礁石珊瑚的不同形状特点,水下原位测量造礁石珊瑚的基部扩展长度、横向扩展长度、纵向扩展长度。分枝状造礁石珊瑚统计分枝增加数目和生长宽度,团块状和瓦片状造礁石珊瑚主要根据扩展长度的增加值评估其生长宽度。
1.6 数据处理具体数据均通过Microsoft Office Excel 2019软件进行录入汇总处理,使用SPSS 18.0软件进行分析,根据单因素方差分析(One-way ANOVA) 检验数据显著差异性,用最小显著差异(LSD)法进行多重比较,显著性水平α等于0.05。
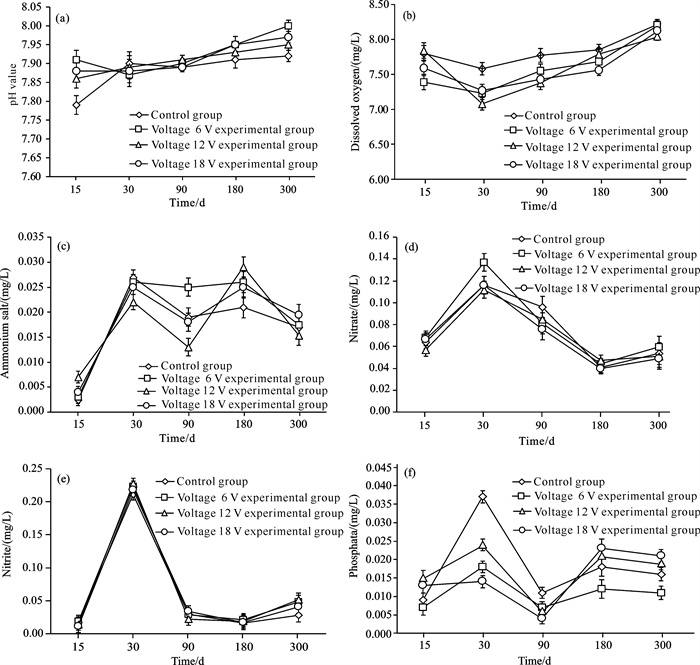
2 结果与分析 2.1 水体参数变化通过对实验组和对照组为期300 d的水质监测发现,只有电压6 V实验组的水体pH值在前90 d呈下降趋势,后面210 d呈上升趋势,其他实验组和对照组的水体pH值均呈上升趋势[图 3(a)];在实验的第15天和第300天,各组水体pH值高低排序一致,即电压6 V实验组>电压18 V实验组>电压12 V实验组>对照组;在第15天,对照组和实验组水体pH值存在显著性差异(P<0.05)。
|
| 图 3 低压通电对水体参数的影响 Fig. 3 Effect of low-voltage current on water parameters |
实验组和对照组溶解氧含量在前30 d均呈下降趋势,在后面270 d均呈上升趋势,在第15天电压6 V实验组的溶解氧含量最低,在第300天对照组和电压6 V实验组的溶解氧含量均高于电压12、18 V实验组溶解氧含量[图 3(b)],在第30天对照组和实验组溶解氧含量均存在显著性差异(P<0.05),在第90天、第300天对照组和电压6 V实验组的溶解氧含量无显著性差异(P>0.05)。
铵盐含量在第15天到第30天和第90天到第180天呈上升趋势,在其他时间段呈下降趋势;电压12 V实验组在实验开始时铵盐含量最高,在实验结束时铵盐含量最低[图 3(c)],在第15天对照组和电压12 V实验组的铵盐存在显著性差异(P<0.05),在第30天、第90天、第180天和第300天对照组和实验组铵盐含量均无显著性差异(P>0.05)。
硝酸盐含量在第15天到第30天和第180天到第300天呈上升趋势,在第30天到第180天呈下降趋势,在第30天电压6 V实验组的硝酸盐含量最高[图 3(d)],在第15天、第30天、第180天和第300天对照组和实验组硝酸盐含量均无显著性差异(P>0.05),在第90天对照组和电压18 V实验组的硝酸盐含量存在显著性差异(P<0.05)。
亚硝酸盐含量在第15天到第30天和第30天到第90天变化波动大,在第90天到第300天变化缓慢[图 3(e)],在第15天、第30天对照组与电压6、12 V实验组的亚硝酸盐含量均存在显著性差异(P<0.05),在第90天对照组和电压12 V实验组的亚硝酸盐含量存在显著性差异(P<0.05),在第180天对照组和实验组的亚硝酸盐含量均无显著性差异(P>0.05),在第300天对照组和电压6、12 V实验组的亚硝酸盐含量存在显著性差异(P<0.05)。
磷酸盐含量在第15天到第30天和第90天到第180天呈上升趋势,在第30天到第90天和第180天到第300天呈下降趋势[图 3(f)],在第30天磷酸盐含量排序为对照组>电压12 V实验组>电压6 V实验组>电压18 V实验组,在第300天磷酸盐含量排序为电压6 V实验组 < 对照组 < 电压12 V实验组 < 电压18V实验组,在第30天和第90天对照组和实验组的磷酸盐含量均存在显著性差异(P<0.05)。
海水中一定浓度的营养盐可以促进珊瑚的生长,珊瑚礁区营养盐浓度较低,硝酸盐浓度为0.1-0.5 μmol/L,铵盐浓度为0.2-0.5 μmol/L,磷酸盐浓度小于0.3 μmol/L[17],营养盐浓度过高会抑制珊瑚的生长。研究结果表明对照组和实验组水体中pH值以及溶解氧、铵盐、硝酸盐、亚硝酸盐和磷酸盐含量的变化范围不大,说明海水中的营养盐对本研究中造礁石珊瑚种苗的生长影响很小。
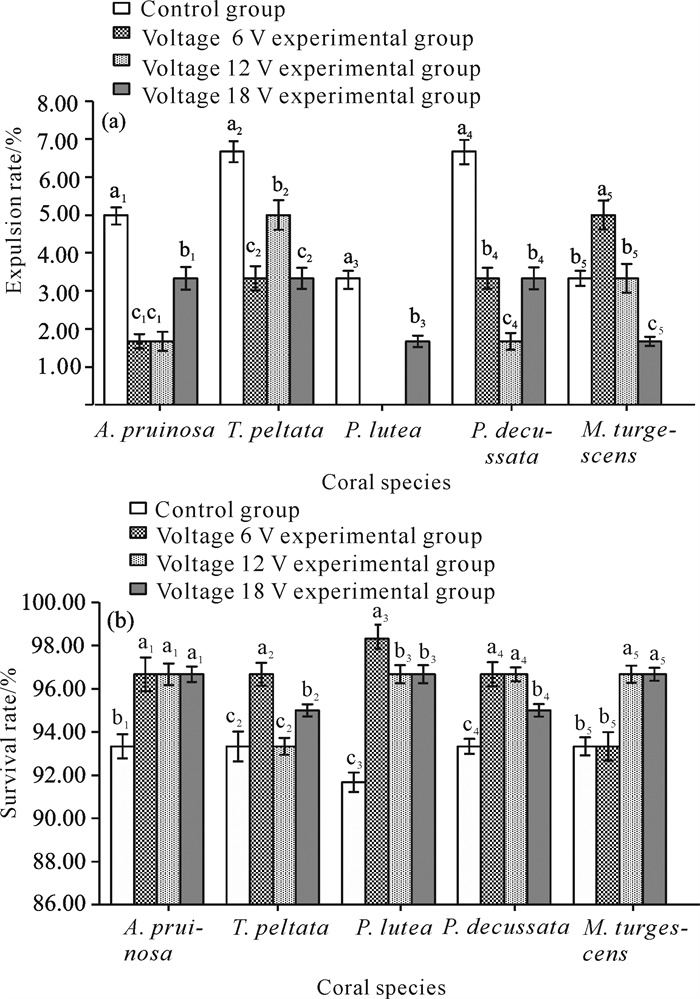
2.2 珊瑚种苗存活状况通过对造礁石珊瑚第15天的监测数据统计发现,对照组培育珊瑚脱落率为3.33%-6.67%,实验组培育珊瑚脱落率为0.00%-5.00%[图 4(a)],表明实验组电压6、12、18 V对霜鹿角珊瑚、盾形陀螺珊瑚、澄黄滨珊瑚、十字牡丹珊瑚和膨胀蔷薇珊瑚的脱落率存在显著性影响。对照组霜鹿角珊瑚、盾形陀螺珊瑚、澄黄滨珊瑚、十字牡丹珊瑚的脱落率均明显高于实验组,而对照组膨胀蔷薇珊瑚的脱落率与电压12 V实验组相同,但低于电压6 V实验组,高于电压18 V实验组。其中澄黄滨珊瑚电压6、12 V实验组的脱落率最低,脱落率均为0。
|
| The letters a1, b1 and c1 indicate the significance of the control group and the experimental group of the A.pruinosa, the letters a2, b2 and c2 indicate the significance of the control group and the experimental group of the T.peltata, the letters a3, b3, c3 and d3 indicate the significance of the control group and the experimental group of the P.lutea, the letters a4, b4 and c4 indicate the significance of the control group and the experimental group of the P.decussata, and the letters a5 and b5 indicate the significance of the control group and the experimental group of the M.turgescens.There is no significant difference in the comparison of the same letters, but there are significant differences in the comparison of different letters. 图 4 第15天低压通电对造礁石珊瑚脱落率、成活率的影响 Fig. 4 Effect of low-voltage electricity on the shedding rate and survival rate of reef-building corals on the 15th day |
5种珊瑚的平均存活率较为接近,对照组存活率为91.67%-93.33%,实验组存活率为93.33%-98.33%[图 4(b)],实验组电压6、12、18 V对霜鹿角珊瑚、澄黄滨珊瑚和十字牡丹珊瑚的存活率存在显著性影响;电压6、18 V对盾形陀螺珊瑚的存活率有显著性影响,电压12 V对盾形陀螺珊瑚的存活率无显著性影响;电压12、18 V对膨胀蔷薇珊瑚的存活率有显著性影响,电压6 V对膨胀蔷薇珊瑚的存活率无显著性影响;实验组珊瑚存活率均明显高于对照组珊瑚存活率。澄黄滨珊瑚对照组存活率仅为91.67%,而实验组存活率在96.50%以上,澄黄滨珊瑚的平均存活率最高,为95.83%,而盾形陀螺珊瑚的平均存活率最低,为94.58%。
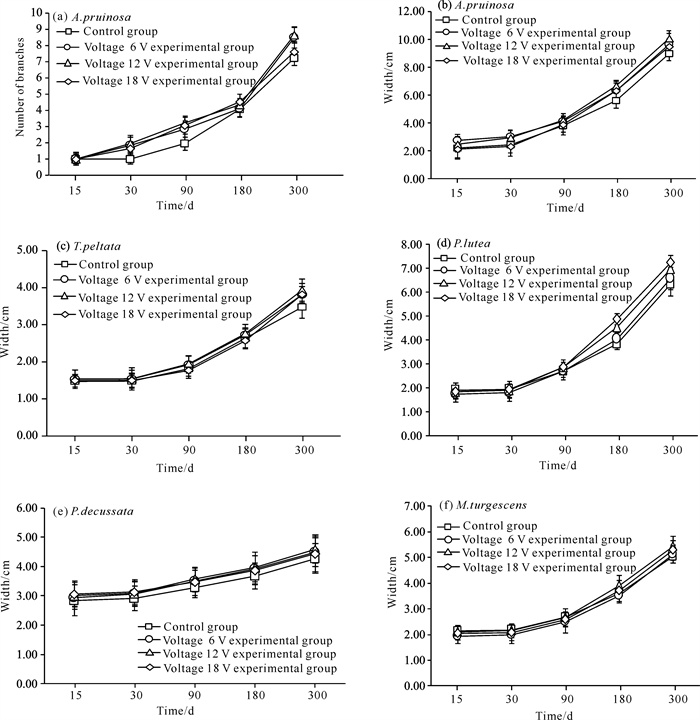
2.3 珊瑚种苗生长状况通过对造礁石珊瑚300 d的生长监测发现,实验组和对照组造礁石珊瑚的生长均呈现上升趋势。霜鹿角珊瑚的生长速度在第180天到第300天比第15天到第180天快;在第300天时,对照组霜鹿角珊瑚分枝数和宽度均低于实验组,电压6、12 V实验组的分枝数最多,电压12 V实验组的宽度最大;在第300天实验组霜鹿角珊瑚宽度平均比对照组增长0.76 cm [图 5: (a)、(b)],在第90天和第300天对照组珊瑚的分枝数和实验组均存在显著性差异(P<0.05),在第180天和第300天对照组霜鹿角珊瑚的宽度和实验组均存在显著性差异(P<0.05)。
|
| 图 5 低压通电对造礁石珊瑚生长的影响 Fig. 5 Effect of low-voltage electricity on the growth of reef-building corals |
盾形陀螺珊瑚在前30 d内缓慢生长,几乎没有变化,在第90天后生长速度明显增加,在第300天时实验组盾形陀螺珊瑚宽度平均比对照组增长0.38 cm,电压12 V实验组的宽度最大[图 5(c)],在第15、30、90天对照组盾形陀螺珊瑚的宽度与实验组均无显著性差异(P>0.05),在第180天和第300天对照组盾形陀螺珊瑚的宽度和实验组存在显著性差异(P<0.05)。
澄黄滨珊瑚的生长速度随着时间变化呈现上升趋势,在第300天实验组澄黄滨珊瑚宽度平均比对照组增长0.61 cm,电压18 V实验组的宽度最大[图 5(d)],在第15、30、90天对照组澄黄滨珊瑚的宽度与实验组均无显著性差异(P>0.05),在第180天和第300天对照组澄黄滨珊瑚的宽度和实验组存在显著性差异(P<0.05)。
十字牡丹珊瑚生长速度慢,在第300天时实验组十字牡丹珊瑚宽度平均比对照组增长0.23 cm,电压12 V实验组的宽度最大[图 5(e)];在第15天和第30天对照组十字牡丹珊瑚的宽度和电压6 V实验组无显著性差异(P>0.05),但和电压12、18 V实验组存在显著性差异(P<0.05);在第90、180、300天对照组十字牡丹珊瑚宽度和实验组存在显著性差异(P<0.05)。
膨胀蔷薇珊瑚在实验前30 d生长速度缓慢,在30 d后生长速度明显提高,在第300天时实验组膨胀蔷薇珊瑚宽度平均比对照组增长0.24 cm,电压12 V实验组的宽度最大[图 5(f)],在第15天和第30天对照组膨胀蔷薇珊瑚的宽度和电压6、18 V实验组存在显著差异(P<0.05),在第300天对照组和电压6 V实验组无显著性差异(P>0.05),但和电压12、18 V实验组存在显著性差异(P<0.05)。
微电流对5种造礁石珊瑚生长率的影响不同,霜鹿角珊瑚的生长率最高,十字牡丹珊瑚的生长率最低(图 6),生长率排序为霜鹿角珊瑚>澄黄滨珊瑚>膨胀蔷薇珊瑚>盾形陀螺珊瑚>十字牡丹珊瑚,其中对照组澄黄滨珊瑚的生长率和实验组澄黄滨珊瑚的生长率存在显著差异(P<0.05),而对照组十字牡丹珊瑚的生长率和实验组十字牡丹珊瑚的生长率均无显著差异(P>0.05)。
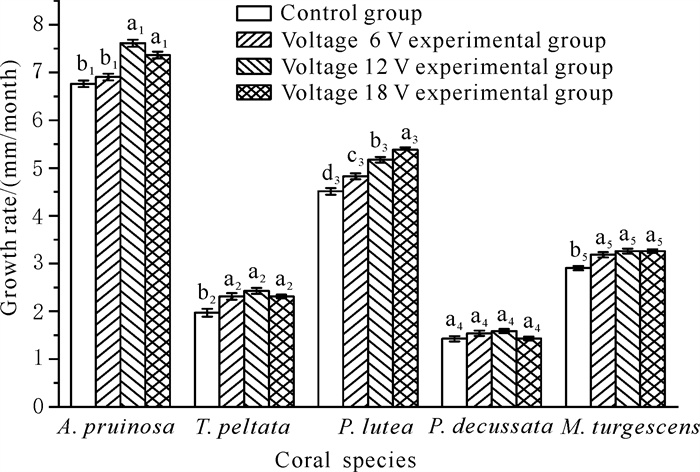
|
| The letters a1 and b1 indicate the significance of the control group and the experimental group of the A.pruinosa, the letters a2 and b2 indicate the significance of the control group and the experimental group of the T.peltata, the letters a3, b3, c3 and d3 indicate the significance of the control group and the experimental group of the P.lutea, the letters a4 and b4 indicate the significance of the control group and the experimental group of the P.decussata, and the letters a5 and b5 indicate the significance of the control group and the experimental group of the M.turgescens.There is no significant difference in the comparison of the same letters, but there are significant differences in the comparison of different letters. 图 6 低压通电对造礁石珊瑚生长率的影响 Fig. 6 Effect of low-voltage electricity on the growth rate of reef-building corals |
研究结果表明低压通电对霜鹿角珊瑚宽度的生长影响最大,对十字牡丹珊瑚宽度的生长影响最小,在实验组电压12 V的条件中,霜鹿角珊瑚、盾形陀螺珊瑚、十字牡丹珊瑚生长速度比对照组和电压6、18 V实验组生长速度快,膨胀蔷薇珊瑚在电压12、18 V的环境中生长速度快,而澄黄滨珊瑚在电压18 V的环境中生长速度最快。
3 讨论 3.1 微电流对造礁石珊瑚存活率和脱落率的影响本研究发现矿物质浓度的累积或增加,会引起阴极附近营养盐浓度变化和pH值升高。溶解氧、铵盐、硝酸盐、亚硝酸盐、磷酸盐含量的变化范围较小。吴静等[18]研究发现深圳海域内无机氮组成部分呈现明显的季节性变化,春季和冬季以硝酸盐为主,夏季和秋季以铵盐为主。韩丽君等[19]分析了涠洲岛邻近海域海水中营养盐的变化特征,结果表明无机氮和活性磷酸盐浓度的季节变化特征均为冬季>秋季>夏季。本研究结果中,微电流对海水中营养盐影响不大,可能是因为微电流的影响在海水内被迅速弱化。pH值升高抑制了纤维状或肉质状的藻类附着,藻类的附着会与珊瑚形成空间上的竞争,藻类附着降低会提高珊瑚的生长率[20,21]。尽管有一些研究表明矿物质的增加可提高造礁石珊瑚的存活率、生长率,但这种现象最多能维持4个月,因为在阴极被矿物质腐蚀之前的过程阻碍了电流的效果[22,23]。本研究中实验组珊瑚断枝存活率比对照组高,矿物质碳酸钙的增加使珊瑚断枝更加稳固地固定于基质上,从而提高了移植珊瑚的存活率,降低了移植珊瑚的脱落率,这与Miller等[21]和Tanner[24]的研究结果一致。
3组微电流通电网圃上培育的5种珊瑚存活率均明显高于未通电网圃,尤其是块状的澄黄滨珊瑚,其实验组存活率最高为98.33%,脱落率最低为1.25%;本研究结果表明微电流技术提高了造礁石珊瑚种苗存活率,降低了造礁石珊瑚种苗脱落率,实验组造礁石珊瑚存活率均明显高于对照组造礁石珊瑚,脱落率低于对照组。微电流将海水电解为H2和OH-,由于低压通电网圃带正电,造礁石珊瑚种苗周围的负离子增加,水体中游离的Ca2+、Mg2+与造礁石珊瑚种苗处OH-、HCO3-结合生成霰石CaCO3和镁石Mg(OH)2,增加细胞与底座之间的黏附力,有助于造礁石珊瑚种苗在底座上黏合[25-27],从而降低了造礁石珊瑚脱落率,提高了造礁石珊瑚存活率。本研究与Sabater等[28]的研究结果一致,在微电流作用下澄黄滨珊瑚的存活率和增长率的变化趋势相似,未通电的造礁石珊瑚种苗存活率最低。也有研究表明在微电流作用下鹿角珊瑚成活率均在75%以上[11],在电场中的造礁石珊瑚的存活率明显高于对照组[29-32]。
3.2 微电流对造礁石珊瑚生长状况的影响通过300 d的长期监测发现,微电流可促进造礁石珊瑚生长。微电流通过电解作用将水中的化学物质分解成正离子和负离子,从而改变了局部海水的pH值和离子浓度,说明微电流可以改变电场内的酸碱平衡,使电场内产生更适合珊瑚钙化生长的碱性环境。实验组珊瑚附近矿物质浓度的增加使珊瑚水螅体和电场内形成一个较高的浓度梯度,该浓度梯度能够使矿物质离子经细胞旁路径从外部环境经过上皮细胞间隙自由扩散至珊瑚的腔肠部位,然后通过跨细胞路径运输至钙化位点,经过细胞内运输体与Ca2+结合,同时细胞旁路径被当前的Ca2+浓度梯度驱动,Ca2+在外部上皮组织和腔肠体之间,一旦进入腔肠体,Ca2+主动耗能进入上皮组织中胶层,与CO32-结合,从而形成珊瑚的骨骼,这个过程可以解释造礁石珊瑚生长较快的原因[33,34]。有研究表明在微电流作用下鹿角珊瑚在10周内生长5-8 cm,同时生长速度提高2-3倍[9,10]。
有研究表明,微电流可促进造礁石珊瑚组织的延伸,同时提高造礁石珊瑚的耐压能力,因为造礁石珊瑚后期快速在基质上稳固,从而使其快速从培育、移植过程中的各种影响压力中恢复,因此能分配更多的能量用于损伤组织的修复和后续生长[35,36]。实验组培育的同形态造礁石珊瑚生长状况与微电流电压大小具有显著相关性,研究结果表明,在同一阶段,霜鹿角珊瑚、盾形陀螺珊瑚、膨胀蔷薇珊瑚和十字牡丹珊瑚都在电压12 V作用下表现出较快的生长速度,澄黄滨珊瑚则是在电压18 V作用下表现出较快的生长速度。这与其他学者提出的较低的电压和电流水平更有利于霰石而不是氢氧镁石的增积,电流越小越有利于钙化生长的研究结果不一致[37]。造礁石珊瑚阴极上的固定点位置会影响移植珊瑚的生长速度和延伸方向,因为沉淀作用直接发生在阴极上,而不是发生在水体中,导致阴极附近形成一个矿物质离子浓度梯度,浓度最高点在阴极附近,随着与阴极的距离增加,矿物质离子浓度递减。如果珊瑚断枝位于阴极顶端垂直水面方向,相对于顶部的珊瑚水螅体,基部的水螅体将处在高浓度的矿物质离子浓度中,因此,造礁石珊瑚基部的钙化率可能相对较高。不同的电流强度下珊瑚生长状况可能不同,电流密度和电压强度降低会导致较低的矿物质沉淀作用[38,39],而在高电压环境中碳酸钙和氢氧化镁在阴极表面的电化学沉淀加强了珊瑚的黏附牢固程度,从而提升了移植珊瑚的存活率[28]。
4 结论微电流促进了造礁石珊瑚组织的延伸,降低了造礁石珊瑚培育移植过程中的脱落率,提高了造礁石珊瑚的存活率;不同种类的造礁石珊瑚钙化速率受微电流促进效果不同,微电流电压大小对造礁石珊瑚生长率也有影响,不同形态特征的珊瑚种类生长率差异较大,分枝状的霜鹿角珊瑚生长率高于其他类型的珊瑚;相比于电压6、18 V,电压12 V对霜鹿角珊瑚、十字牡丹珊瑚、澄黄滨珊瑚、膨胀蔷薇珊瑚、盾形陀螺珊瑚生长速度的影响效果最佳。
| [1] |
BOSTRÖM-EINARSSON L, BABCOCK R C, BAYRA-KTAROY E, et al. Coral restoration: a systematic review of current methods, successes, failures and future directions[J]. PLoS One, 2020, 15(1): e0226631. DOI:10.1371/journal.pone.0226631 |
| [2] |
RINKEVICH B. Conservation of coral reefs through active restoration measures: recent approaches and last decade progress[J]. Environmental Science & Technology, 2005, 39(12): 4333-4342. |
| [3] |
BOSTRÖM-EINARSSON L, CECCARELLI D, BAB-COCK R, et al. Coral restoration in a changing world: a global synthesis of methods and techniques [R]. [S. l. ]: Reef and Rainforest Researchm Centre Ltd, Cairns, 2018.
|
| [4] |
XIA J Q, ZHU W T, LIU X B, et al. The effect of two types of grid transplantation on coral growth and the in-situ ecological restoration in a fragmented reef of the South China Sea[J]. Ecological Engineering, 2022, 177: 106558. DOI:10.1016/j.ecoleng.2022.106558 |
| [5] |
HUGHES T P, ANDERSON K D, CONNOLLY S R, et al. Spatial and temporal patterns of mass bleaching of corals in the Anthropocene[J]. Science, 2018, 359(6371): 80-83. DOI:10.1126/science.aan8048 |
| [6] |
TEIXIDÓ N, CAROSELLI E, ALLIOUANE S, et al. Ocean acidification causes variable trait-shifts in a coral species[J]. Global Change Biology, 2020, 26(12): 6813-6830. DOI:10.1111/gcb.15372 |
| [7] |
LUO Y, HUANG L, LEI X, et al. Light availability regulated by particulate organic matter affects coral assemblages on a turbid fringing reef[J]. Marine Environmental Research, 2022, 177: 105613. DOI:10.1016/j.marenvres.2022.105613 |
| [8] |
DUPREY N N, YASUHARA M, BAKER D M. Reefs of tomorrow: eutrophication reduces coral biodiversity in an urbanized seascape[J]. Global Change Biology, 2016, 22(11): 3550-3565. DOI:10.1111/gcb.13432 |
| [9] |
WALLACE C C, WOLSTENHOLME J. Revision of the coral genus Acropora (Scleractinia: Astrocoeniina: Acroporidae) in Indonesia[J]. Zoological Journal of the Linnean Society, 1998, 123(3): 199-384. DOI:10.1111/j.1096-3642.1998.tb01302.x |
| [10] |
HILBERTZ W, GOREAU T. Third generayion Artificial Reefs [EB/OL]. [2023-12-16]. https://www.globalcoral.org/_oldgcra/third_generation_artificial_reef.htm.
|
| [11] |
MUNANDAR, MAHENDRA, RIZAL M, et al. The escalation of coral growth by biorock technology applied in Sabang marine ecotourism[J]. AACL Bioflux, 2018, 11(5): 1633-1647. |
| [12] |
ZHAO Y, LAW Y S, ZHAI X, et al. Urban coral communities and water quality parameters along the coasts of Guangdong Province, China[J]. Marine Pollution Bulletin, 2022, 180: 113821. DOI:10.1016/j.marpolbul.2022.113821 |
| [13] |
郭峰, 肖家光, 田鹏, 等. 大亚湾及大鹏半岛沿岸造礁石珊瑚现状与生态脆弱性评价[J]. 应用海洋学学报, 2022, 41(4): 568-582. |
| [14] |
XIE J Y, YEUNG Y H, KWOK C K, et al. Localized bleaching and quick recovery in Hong Kong's coral communities[J]. Marine Pollution Bulletin, 2020, 153: 110950. DOI:10.1016/j.marpolbul.2020.110950 |
| [15] |
KLEIN S G, GERALDI N R, ANTON A, et al. Projecting coral responses to intensifying marine heatwaves under ocean acidification[J]. Global Change Biology, 2022, 28(5): 1753-1765. DOI:10.1111/gcb.15818 |
| [16] |
暨卫东, 许昆灿, 吴省三, 等. 海洋调查规范: 第4部分海水化学要素调查: GB 12763.4-2007 [S]. 北京: 中国标准出版社, 2007.
|
| [17] |
江志坚, 黄小平. 富营养化对珊瑚礁生态系统影响的研究进展[J]. 海洋环境科学, 2010, 29(2): 280-285. |
| [18] |
吴静, 唐俊逸, 李迎龙, 等. 深圳大亚湾海域无机氮的组成、分布特征及其富营养化状况再探[J]. 环境科学导刊, 2019, 38(3): 79-83. |
| [19] |
韩丽君, 郑新庆, 蓝文陆, 等. 近10年涠洲岛周边海域表层海水营养盐含量变化特征[J]. 应用海洋学学报, 2015, 34(1): 65-72. |
| [20] |
HELMUT S, LOTHAR S. Integrated electrochemical and biogenic deposition of hard material: a nature-like colonization substrate[J]. Bulletin of Marine Science, 1994, 55(2/3): 672-679. |
| [21] |
MILLER M W, HAY M E. Coral-seaweed-grazer-nutrient interactions on temperate reefs[J]. Ecological Monographs, 1996, 66(3): 323-344. |
| [22] |
SCHUHMACHER H, VAN TREECK P, EISINGER M, et al. Transplantation of coral fragments from ship groundings on electrochemically formed reef structures[C]//Proceedings of the 9th International Coral Reef Symposium. [S. l. : s. n], 2002.
|
| [23] |
SABATER M G, YAP H T. Long-term effects of induced mineral accretion on growth, survival and corallite properties of Porites cylindrica Dana[J]. Journal of Experimental Marine Biology and Ecology, 2004, 311(2): 355-374. |
| [24] |
TANNER J E. Competition between scleractinian cor-als and macroalgae: an experimental investigation of coral growth, survival and reproduction[J]. Journal of Experimental Marine Biology and Ecology, 1995, 190(2): 151-168. |
| [25] |
SCHMITT R J, HOLBROOK S J, DAVIS S L, et al. Experimental support for alternative attractors on coral reefs[J]. Proceedings of the National Academy of Sciences, 2019, 116(10): 201812412. |
| [26] |
PAUSCH R E, MILLER M W, WILLIAMS D E, et al. Effects of outplant size on Acropora palmata fragment survivorship, growth, and condition [R]. [S. l. ]: Protected Resources and Biodiversity Division Report, 2015.
|
| [27] |
王铭彦, 王磊, 彭在先, 等. 电流强度对人工珊瑚礁生长的影响: 模型试验[J]. 实验室研究与探索, 2016, 35(10): 43-45, 55. |
| [28] |
SABATER M G, YAP H T. Growth and survival of coral transplants with and without electrochemical deposition of CaCO3[J]. Journal of Experimental Marine Biology and Ecology, 2002, 272(2): 131-146. |
| [29] |
JOMPA J, ANPUSYAHNUR E, DWJJ P, et al. Electrically stimulated corals in Indonesia reef restoration projects show greatly accelerated growth rates [M]//GOREAU T J, TRENCH R K. Innovative methods of marine ecosystem restoration. Boca Raton: CRC Press, 2012: 47-58.
|
| [30] |
BAKTI L A A, VIRGOTA A, DAMAYANTI L, et al. Biorock reef restoration in Gili Trawangan, North Lombok, Indonesia [M]// GOREAU T J, TRENCH R K. Innovative Methods of Marine Ecosystem Restoration. Boca Raton: CRC Press, 2012: 59-80.
|
| [31] |
ZAMANI N P, ABDALLAH K, SUBHAN B. Electrical current stimulates coral branching and growth in Jakarta Bay [M]//GOREAU T J, TRENCH R K. Innovative Methods of Marine Ecosystem Restoration. Boca Raton: CRC Press, 2012: 81-89.
|
| [32] |
NITZSCHE J. Electricity protects coral from over-growth by an encrusting sponge in Indonesia [M]// GOREAU T J. TRENCH R K. Innovative Methods of Marine Ecosystem Restoration. Boca Raton: CRC Press, 2012: 91-103.
|
| [33] |
FURLA P, ALLEMAND D, ORSENIGO M N. In-volvement of H+-ATPase and carbonic anhydrase in inorganic carbon uptake for endosymbiont photosynthesis[J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 2000, 278(4): R870-R881. |
| [34] |
AL-HOANI F A, AL-MOGHRABI S M, DE BEER D. Microsensor study of photosynthesis and calcification in the scleractinian coral, Galaxea fascicularis: active internal carbon cycle[J]. Journal of Experimental Marine Biology and Ecology, 2003, 288(1): 1-15. |
| [35] |
LINDAHL U. Low-tech rehabilitation of degraded coral reefs through transplantation of staghorn corals[J]. Ambio, 1998, 27(8): 645-650. |
| [36] |
AMMAR M, AMIN E M, GUNDACKER D, et al. One rational strategy for restoration of coral reefs: application of molecular biological tools to select sites for rehabilitation by asexual recruits[J]. Marine Pollution Bulletin, 2000, 40(7): 618-627. |
| [37] |
HILBERTZ W, GOREAU T. Method of enhancing the growth of aquatic organisms and structures created thereby: US5543034 [P]. 1996-08-06.
|
| [38] |
HILBERTZ W H. Solar-generated building material from seawater as a sink for carbon[J]. Ambio, 1992, 21: 126-129. |
| [39] |
VAN TREECK P, SCHUHMACHER H. Initial survi-val of coral nubbins transplanted by a new coral transplantation technology: options for reef rehabilitation[J]. Marine Ecology Progress Series, 1997, 150: 287-292. |



