2. 广西诺亚生物科技发展有限公司, 广西柳州 545000
2. Guangxi Nuoya Biotechnology Development Limited Company, Liuzhou, Guangxi, 545000, China
罗非鱼(Oreochromis mossambicus)是世界性的经济鱼类,我国是罗非鱼的主产区,拥有世界上最大的罗非鱼养殖产量,罗非鱼养殖在我国的水产养殖业中占据重要地位。目前我国水产养殖正在从传统池塘养殖模式转向高密度且资源节约型的工厂化养殖模式[1],养殖过程中提高养殖密度的目的是在有限的养殖空间里,尽可能地提高养殖产量,实现降本增效[2, 3]。但不同的养殖系统[4]、养殖规格[5]以及管理水平下[4],适宜的养殖密度都不尽相同。养殖密度过高易导致水质恶化[6-8],从而引发养殖鱼疾病并抑制其生长[9, 10]、增加养殖成本[11],反而降低收益[12, 13]。在高密度养殖的趋势驱动下,循环流水的养殖模式应运而生[14, 15],这种养殖模式不仅能节约水资源,而且循环水的使用能降低换水带来的鱼体应激[16]。但这种方法需要前期对养殖设施进行改造和投入[17],并且在养殖过程中持续地耗费一定的动力成本和人工成本,如持续使用抽水机促进水体循环、人工清洗滤材等。因此,在封闭型养殖水体条件下,探究最适宜的养殖密度,获得最高的养殖效益,将成为水产养殖业关注的方向。本试验在全程零换水条件下,研究罗非鱼的最适养殖密度,跟踪不同养殖密度下的水质变化情况,为罗非鱼的集约化养殖提供参考。
1 材料与方法 1.1 试验材料及饲养管理试验在广西壮族自治区水产科学研究院广西特色淡水鱼综合试验基地开展。室内养殖池使用长方形混凝土结构,养殖池规格12 m×5 m×2 m,水深1.6 m。共设4个密度组,每组3个平行,一共12组。试验用水为曝气自来水,每个池底布置一个微孔增氧圆盘,通过曝气的方式增氧。试验用鱼选用“桂非1号”,属吉富品系,该品系是广西壮族自治区水产科学研究院罗非鱼良种场选育的快速生长品系,挑选产自同一批次、规格整齐、体质健壮的苗种,体质量为(11.95±0.50) g/尾。按设定的分组数量随机分配鱼种,Ⅰ组450尾、Ⅱ组630尾、Ⅲ组882尾、Ⅳ组1 235尾。密度为Ⅰ组7.5尾/m2、Ⅱ组10.5尾/m2、Ⅲ组14.7尾/m2、Ⅳ组20.6尾/m2。试验用饲料采购于南宁通威饲料有限公司,粗蛋白含量为36%。
每日投喂2次(8:00-9:00,17:00-18:00),投喂量按体质量的3%计,从试验开展的第15天开始,每隔30 d测量鱼的体质量和体长。试验鱼经分组后驯养适应1周,试验开始后,每天晚上22:00至次日8:00和中午12:00-14:00开微孔增氧机。整个试验过程水温为26.5-30.5 ℃,pH值为6.6-8.0,溶解氧为5.03-7.80 mg/L,试验共135 d。试验期间不换水,只补充蒸发掉的水分,每月检测水质结束后投1次益生菌。经过135 d的养殖后,停食起捕,统计12个试验池鱼的成活率(Survival Rate,SR)和总产量(Total Gross Production,TGP),并计算饵料系数(Feed Conversion Rate,FCR)。
1.2 水质分析水质采集及检测的时间为第0、15、45、75、105和135天,定于上午9:00采集水样,采用对角线方式选择等距的3个点,采集上层水,3个点混合后进行现场检测并记录数据。溶解氧使用雷磁便携式溶氧测定仪(JPB-607A型,上海仪电科学仪器股份有限公司)检测,pH值、氨氮、亚硝酸盐采用奥克丹水质分析仪(OCT-B型,无锡奥克丹生物科技有限公司)检测。
1.3 生长指标的测定试验结束后,每个密度组随机挑选30尾,测量个体的终末体质量(Final Body Weight,FBW),计算增重率(Weight Gain Rate,WGR)、特定生长率(Specifit Growth Rate,SGR)、肥满度(Condition Factor,CF),并统计各试验池鱼的成活率、总产量和饵料系数。计算公式如下:
| $ \begin{array}{l} \quad 增重率 ( \text{WGR}, \%)=\left(W_t-W_0\right) / W_0 \times 100 \% ,\\ \quad 特定生长率 (\mathrm{SGR}, \%)=\left(\ln W_t-\ln W_0\right) / t \times \\ 100 \%, \\ \quad 肥满度 (\text{CF})=\left(W / L^3\right) \times 100, \\ \quad 成活率 (\mathrm{SR}, \%)=N_t / N_0 \times 100 \%, \\ \quad 总产量 (\mathrm{TGP}, \mathrm{kg})=W_t / 1000, \\ \quad 饵料系数 (\mathrm{FCR}, \%)=W_{\mathrm{f}} /\left(W_t-W_0\right) \times 100 \%, \end{array} $ |
式中,W0为试验开始时鱼体总质量(g);Wt为试验结束时鱼体总质量(g);Nt为试验结束时鱼尾数;N0为试验开始时鱼尾数;Wf为试验期间摄入的饲料总量(g);L为采样个体体长(cm);W为采样个体体质量(g)。
1.4 数据分析数据统计使用SPSS 15.0软件,采用单因素方差分析(One-way ANOVA)和Duncan法进行多重比较,检验组间差异的显著性,P<0.05为差异具有统计学意义。
2 结果与分析 2.1 养殖密度对罗非鱼生长性能的影响在本试验条件下,养殖密度对罗非鱼生长性能的影响见表 1。本试验过程中,4个密度组的终末体质量、增重率和特定生长率均随着养殖时间的增加逐渐拉开差距,养殖密度越大,罗非鱼生长越缓慢,到135 d时,各组间差异显著(P<0.05),说明养殖密度对罗非鱼的生长产生重要影响。从养殖全程看,肥满度在各组间基本无差异。
| 采样时间/d Sampling time/d |
组别 Group |
终末体质量/g FBW/g |
增重率/% WGR/% |
特定生长率/(%·d-1) SGR/(%·d-1) |
肥满度/(g·cm-3) CF/(g·cm-3) |
| 15 | Ⅰ | 34.68±1.20b | 190.20±10.05b | 7.10±0.23b | 4.26±0.35 |
| Ⅱ | 33.73±0.29ab | 182.33±2.49ab | 6.92±0.06ab | 4.26±0.02 | |
| Ⅲ | 32.90±2.00ab | 175.33±16.77ab | 6.74±0.41ab | 4.30±0.46 | |
| Ⅳ | 31.40±0.42a | 177.66±13.54a | 6.44±0.08a | 4.15±0.19 | |
| 45 | Ⅰ | 138.48±1.93c | 1 058.86±16.21c | 5.44±0.03c | 4.37±0.05c |
| Ⅱ | 129.53±1.43b | 983.96±12.02b | 5.29±0.02b | 4.04±0.08a | |
| Ⅲ | 120.90±0.10a | 911.73±0.85a | 5.14±0.00a | 4.10±0.04ab | |
| Ⅳ | 121.43±4.70a | 916.16±39.61a | 5.15±0.08b | 4.21±0.11b | |
| 75 | Ⅰ | 244.46±11.15b | 1 943.06±93.30b | 4.02±0.06b | 4.42±0.29 |
| Ⅱ | 240.46±10.55b | 1 912.26±88.33b | 4.00±0.06b | 4.35±0.39 | |
| Ⅲ | 210.56±6.49a | 1 662.10±54.33a | 3.82±0.04a | 4.36±0.34 | |
| Ⅳ | 204.52±3.68a | 1 611.53±30.81a | 3.78±0.02a | 4.24±0.27 | |
| 105 | Ⅰ | 348.85±8.80b | 2 819.26±73.66b | 3.21±0.02b | 4.71±0.17 |
| Ⅱ | 358.51±5.11b | 2 900.56±42.83b | 3.24±0.01b | 4.64±0.16 | |
| Ⅲ | 296.03±6.46a | 2 377.26±54.09a | 3.06±0.02a | 4.37±0.23 | |
| Ⅳ | 302.33±0.47a | 2 430.00±3.98a | 3.08±0.00a | 4.47±0.46 | |
| 135 | Ⅰ | 409.87±3.80d | 3 329.86±31.88d | 2.62±0.01d | 4.47±0.46 |
| Ⅱ | 385.45±12.94c | 3 125.53±108.34c | 2.57±0.15c | 4.65±0.04 | |
| Ⅲ | 362.77±7.67b | 2 935.73±71.13b | 2.52±0.01b | 4.65±0.04 | |
| Ⅳ | 340.67±8.50a | 2 750.83±71.13a | 2.48±0.01a | 4.60±0.26 | |
| Note: different shoulder letters at the same time period in the same column represent significant differences (P<0.05).The data is expressed as average±standard deviation. | |||||
2.2 养殖密度对罗非鱼养殖效果的影响
养殖密度对罗非鱼养殖效果的影响见表 2。当养殖密度分别为7.5、10.5和14.7尾/m2时,罗非鱼的成活率不受影响;当养殖密度为20.6尾/m2时,成活率急剧下降为67.23%,说明养殖密度过高会降低罗非鱼的成活率。养殖总产量随养殖密度的变化而变化,最高为Ⅲ组和Ⅳ组,均与Ⅰ组、Ⅱ组差异显著(P<0.05)。饵料系数从高到低的排列顺序为Ⅳ组、Ⅰ组、Ⅱ组、Ⅲ组,各组间差异显著(P<0.05)。
| 组别 Group |
成活率/% SR/% |
总产量/kg TGP/kg |
饵料系数 FCR |
| Ⅰ | 89.20±1.80b | 164.52±11.9a | 1.84±0.03c |
| Ⅱ | 88.90±1.57b | 218.37±3.72b | 1.72±0.03b |
| Ⅲ | 90.50±1.17b | 283.38±3.72c | 1.63±0.01a |
| Ⅳ | 67.23±1.13a | 283.38±8.17c | 2.02±0.17d |
| Note: different shoulder letters in the same column represent significant differences (P<0.05).The data is expressed as average±standard deviation. | |||
2.3 养殖密度对水质的影响 2.3.1 养殖密度对溶解氧含量的影响
在零换水条件下,罗非鱼不同养殖密度对溶解氧含量的影响见图 1。溶解氧含量随着养殖时间的增加逐渐降低,而且密度越高溶解氧含量下降越多,说明随着鱼体的生长以及密度的增加,耗氧量增加。从第15到45天的养殖过程中,溶解氧含量下降幅度最大;Ⅰ组、Ⅱ组和Ⅲ组的溶解氧含量从第45到135天时,显著高于Ⅳ组(P<0.05)。Ⅱ组和Ⅲ组的溶解氧含量在各个养殖时间段差异不显著(P>0.05)。养殖全过程中,溶氧量最高是7.10 mg/L,出现在养殖0 d时;最低是4.73 mg/L,出现在养殖75 d时,均在罗非鱼养殖适宜的溶氧量范围内。
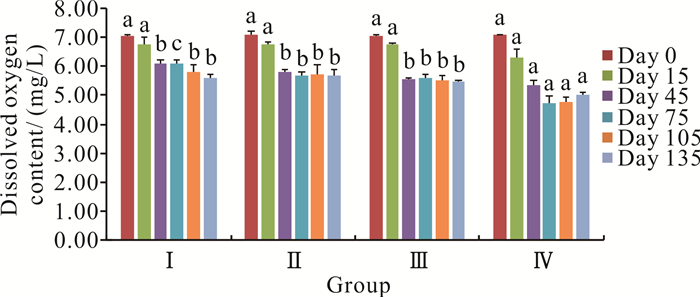
|
| Different letters at the same time period represent significant differences (P < 0.05). 图 1 罗非鱼不同养殖密度对水体溶解氧含量的影响 Fig. 1 Effect of different culture density of O.mossambicus on the dissolved oxygen content |
2.3.2 养殖密度对氨氮含量的影响
在零换水条件下,罗非鱼不同养殖密度对氨氮含量的影响见图 2。各密度组的氨氮含量在养殖第0和15天时均无显著差异。不同密度组的氨氮含量整体上均随着养殖时间的增加而升高,且养殖密度越高,氨氮含量上升越多,其中密度最高的Ⅳ组上升幅度最大。Ⅱ组与Ⅲ组的氨氮含量在同一时间段内无显著差异(P>0.05),但与Ⅰ组、Ⅳ组在第45、75、105和135天时均有显著差异(P<0.05)。从养殖时间的第45天起至第135天,Ⅱ组、Ⅲ组和Ⅳ组的氨氮含量显著高于第0天和第15天时的含量(P<0.05)。Ⅰ组的氨氮含量为0.13-0.18 mg/L,Ⅱ组的氨氮含量为0.15-0.37 mg/L,Ⅲ组的氨氮含量为0.09-0.56 mg/L,Ⅳ组的氨氮含量为0.09-0.65 mg/L。
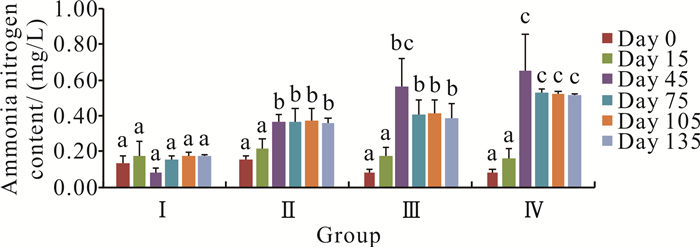
|
| Different letters at the same time period represent significant differences (P < 0.05). 图 2 罗非鱼不同养殖密度对水体氨氮含量的影响 Fig. 2 Effect of different culture density of O.mossambicus on the ammonia nitrogen content |
2.3.3 养殖密度对亚硝态氮含量的影响
在零换水条件下,罗非鱼不同养殖密度对亚硝态氮含量的影响见图 3。当养殖时间进入第45至135天时,亚硝态氮的含量总体上随着养殖密度的增加而增加。在整个养殖过程中,亚硝态氮的含量为0.02-0.09 mg/L。
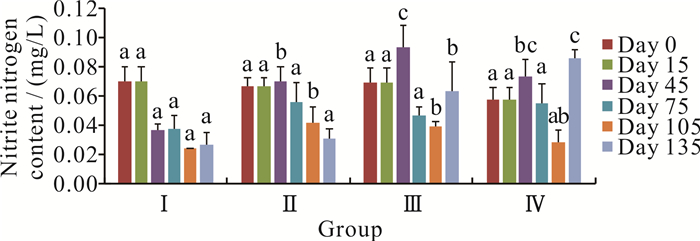
|
| Different letters at the same time period represent significant differences (P < 0.05). 图 3 罗非鱼不同养殖密度对水体亚硝态氮含量的影响 Fig. 3 Effect of different culture density of O.mossambicus on the nitrite nitrogen content |
2.3.4 养殖密度对磷酸盐含量的影响
在零换水条件下,罗非鱼不同养殖密度对磷酸盐含量的影响见图 4。从整体上看,磷酸盐含量随着养殖时间和养殖密度的增加而增加,其中随着养殖时间的增加,Ⅳ组比其他各组增加更多。养殖时间进入到第45天和第105天时,随着养殖密度的增加,磷酸盐含量升高,且不同密度组之间差异显著(P<0.05)。Ⅰ组、Ⅱ组和Ⅲ组的磷酸盐含量均未超过8.00 mg/L,而Ⅳ组养殖至第135天时,磷酸盐含量达到11.19 mg/L。
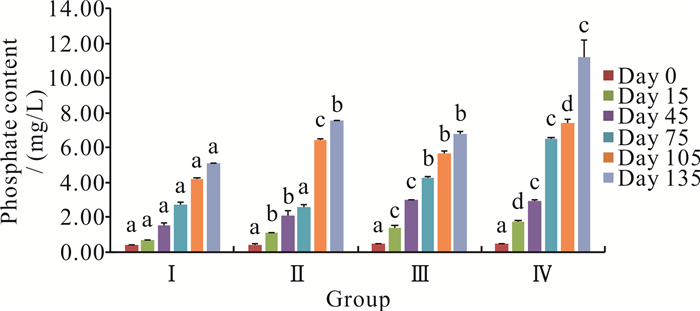
|
| Different letters at the same time period represent significant differences (P < 0.05). 图 4 罗非鱼不同养殖密度对水体磷酸盐含量的影响 Fig. 4 Effect of different culture density of O.mossambicus on the phosphate content |
3 讨论 3.1 不同养殖密度对罗非鱼生长性能的影响
鱼类有集群的特性,养殖密度过低,不利于鱼类摄食,原因是活动范围过大,在其觅食过程中消耗的能量就会增多,而且密度过低易造成鱼相互攻击导致生长分化,降低其生长速率[18],同时低密度也浪费养殖空间,降低养殖产量。然而,过度密集的养殖环境存在着抢食不均的现象,体弱的个体长期抢不到足够的食物,加上环境拥挤,其机体被迫通过一系列的生理调节来适应高密度环境带来的胁迫。鱼类机体在面对外界的胁迫时,首先响应的是神经内分泌活动,如释放儿茶酚胺以及激活丘脑-垂体-肾间质(HPI)轴;然后促使机体产生对应的生理、生化和免疫等反应;最后影响机体的行为变化,主要表现为降低生长速率和抗病能力[19]。长期处于高密度胁迫下的鱼类,因拥挤会造成机械损伤、免疫力低下[20]。在应对这种胁迫的过程中鱼类也需要消耗相应的能量,而且当这种胁迫超过机体自身的调节能力时,就会造成其机体生理功能的紊乱,进而影响生长性能、成活率和产量[21]。范立民等[22]研究表明,密度过高会抑制罗非鱼的生长,使得高密度组罗非鱼的体质量和体长均小于低密度组。
本试验设置4种养殖密度,分别为7.5、10.5、14.7和20.6尾/m2,在零换水条件下,养殖密度对罗非鱼生长性能产生显著的影响。试验从第15天开始,终末体质量、增重率和特定生长率均随着养殖密度的增加而逐渐降低,到第135天时,各组间差异显著,该结果与养殖密度对虹鳟(Oncorhynchus mykiss)[23]、大菱鲆(Scophthalmus maximus)[24]和杂交鲟[西伯利亚鲟(Acipenser baerii)(♀)×施氏鲟(A.schrenckii)(♂)][25]生长的影响相似。说明密度胁迫对罗非鱼的生长速度产生了重要影响,密度越高生长速度越慢。本试验中,当密度增加到20.6尾/m2时,成活率急剧下降,只有67.23%,说明密度胁迫对罗非鱼的成活率产生了影响,这也使得试验结束时,密度为14.7尾/m2的试验组总产量与密度为20.6尾/m2的试验组持平,均为283.38 kg。试验过程中发现,最高密度组的罗非鱼在养殖中后期开始持续出现死亡的现象,导致其饵料系数也相应升高,达到2.02。这种变化可能是随着养殖时间的推移,最高密度组的罗非鱼在摄食方面的竞争更大,抢食能力较弱的罗非鱼由于长期处在摄食和生长的劣势而导致其体质较弱,加上养殖后期,在零换水的情况下,环境胁迫加剧,极易造成罗非鱼死亡。在Sveen等[26]的研究中,发现大西洋鲑(Salmo salar)的养殖密度高于100 kg/m3时,其伤口愈合时间会延迟。侯明华等[27]的研究结果显示,当大西洋鲑的养殖密度超过12 kg/m3时,鱼体出池均重、特定生长率均急剧减小,成活率急剧降低,饵料系数升高。本试验中,养殖密度为14.7尾/m2时可获得较快的生长速度、最高的成活率及最低的饵料系数。
3.2 不同养殖密度对养殖水体水质的影响养殖动物作为水体氧气消耗的主体,随着养殖密度的提高和养殖时间的延长,其耗氧量逐步增大[28]。本试验中,溶解氧含量的最高值出现在养殖第0天,随后逐渐降低,最低值出现在最高密度组(20.6尾/m2),符合一般养殖的规律。试验过程中持续进行微孔增氧,使得溶解氧在整个养殖过程中保持在4.73 mg/L以上,维持较好的溶氧环境。
养殖水体中的氮和磷主要来源于残饵、动物排泄物及死亡动物尸体的分解[29-31]。含氮有机物在微生物作用下分解成氨氮,氨氮在硝化细菌的作用下转化为硝态氮;水生植物通过同化作用将氨氮和硝态氮合成自身的物质[32],促进能量流动和物质循环,维系着养殖系统的整体平衡[16]。
由于养殖密度的增加,饵料的投入也增加,相同的水体内,残饵和粪便等有机物质随之增加。随着养殖时间的延长,有机物质的积累量逐渐增加,在微生物的作用下,产生的氨氮和硝态氮含量也增加。养殖密度越大、养殖时间越长,水体的氨氮和硝态氮的含量就越高。刘国兴等[28]研究4种不同养殖密度下的水质指标,发现养殖密度越高,氨氮和亚硝态氮的含量越高。王秋实等[33]在研究养殖密度对施氏鲟(A.schrencki)养殖水质的影响时也发现,氨氮和亚硝态氮的浓度随着养殖密度的增加逐渐升高。本试验中,随着养殖密度和养殖时间的增加,养殖水体中的氨氮随之增加,与前人的研究结果相似。硝态氮可作为水生植物的营养盐,对养殖动物并无害,当水体中溶解氧含量降低时,可能会导致氨氮向硝态氮转化的过程因溶氧不足而停留在亚硝态氮的阶段。本试验中,从养殖时间的第45天起,亚硝态氮随着养殖密度的增加而大幅增加,这可能与此时溶解氧的大幅度降低有关;亚硝态氮的大量积累也阻碍了氨氮的转化,导致氨氮含量在45 d时出现大幅度上升。
罗非鱼水产饲料配方中磷酸二氢钙的添加量一般为2%左右[34],残饵直接融入水中导致水体磷酸盐含量急剧升高,另外,排泄物的分解也会增加水体的磷酸盐含量。随着养殖密度增加,饵料的投入也增加,导致养殖水体中磷酸盐的含量升高。本试验中,当养殖密度增加到14.7尾/m2时,磷酸盐含量与养殖密度为10.5尾/m2时差异不大,但当密度增加到20.6尾/m2时,磷酸盐含量急剧增加。当养殖密度为10.5和14.7尾/m2时,溶解氧含量无显著差异,但当养殖密度增加至20.6尾/m2时,从养殖第45天开始,溶解氧含量显著下降。说明除了养殖动物的密度增加而增加了耗氧量以外,细菌或原生动物在分解残饵、碎屑等过程中也增加了氧气的消耗,同时释放了更多的磷酸盐[32]。
3.3 不同养殖密度下的水质对罗非鱼的影响水体中的氨氮通常以游离氨(NH3)和铵离子(NH4+)的形式存在,两者间受pH值的影响相互转化,当pH值超过8时,水体中的氨氮主要以NH3的形式存在,而NH3会从水中渗入组织液内引起生物中毒[32, 35]。本试验中,不同密度组的pH值保持在6.6-8.0,最高密度组(20.6尾/m2)进入养殖期的第45天后,氨氮含量显著高于其他3个密度组,这可能会导致该密度组受到比其他密度组更强烈的氨氮胁迫。亚硝态氮进入血液后,直接与血红蛋白反应生成高铁血红蛋白,导致血液的氧气输送能力降低,对机体造成生理缺氧。研究表明,养殖动物长期受到亚硝态氮作用时,其组织器官会被破坏、生长被抑制,导致死亡率上升[36-38]。本试验中,最高密度组(20.6尾/m2)进入养殖期的第135天时,亚硝态氮含量显著高于其他密度组,因此推测该密度组在养殖的第105至135天之间受到亚硝态氮的胁迫最大,可能是引起该密度组罗非鱼生长缓慢和成活率下降的原因之一。磷酸盐对罗非鱼机体并不产生直接影响,但磷酸盐含量过高会导致藻类及一些有害细菌大量繁殖并争夺氧气,甚至产生水华而导致翻塘。本试验中,最高密度组(20.6尾/m2)从养殖的第105到135天时,磷酸盐含量显著升高,相对于其他密度组,产生水华的风险更大。
4 结论在养殖过程中不换水,养殖持续135 d,采用微孔增氧方式,养殖密度的增加在一定程度上能提高罗非鱼产量,但养殖密度达到20.6尾/m2时显著降低罗非鱼的成活率;养殖密度控制在14.7尾/m2时,获得最高的养殖产量,同时饵料系数最低。随着养殖密度和养殖时间的增加,水体的溶解氧含量逐渐降低,氨氮含量逐渐升高,但密度分别在14.7和10.5尾/m2时的溶解氧含量、氨氮含量在相同时间内差异不显著;超过45 d以后,密度在14.7尾/m2时的亚硝态氮和磷酸盐含量显著低于最高密度组(20.6尾/m2)。综合生长性能指标和水质指标分析,在本试验条件下,建议体质量规格为(11.95±0.50) g/尾的罗非鱼的养殖密度为14.7尾/m2。
| [1] |
桂建芳, 张晓娟. 新时代水产养殖模式的变革[J]. 长江技术经济, 2018, 2(1): 25-29. |
| [2] |
陈伟, 谭洪新, 罗国芝, 等. 构建硝化型生物絮凝系统过程中凡纳滨对虾养殖密度对水质与生长的影响[J]. 上海海洋大学学报, 2019, 28(2): 247-256. |
| [3] |
ELLIS T. The relationships between stocking density and welfare in farmed rainbow trout[J]. Journal of Fish Biology, 2002, 61(3): 493-531. DOI:10.1111/j.1095-8649.2002.tb00893.x |
| [4] |
戴杨鑫, 冯晓宇, 戴瑜来, 等. 罗非鱼适宜养殖的密度[J]. 浙江农业科学, 2020, 61(7): 1446-1449. |
| [5] |
朱佳杰, 甘西, 谢尔登, 等. 放养规格、养殖密度和水深对吉富罗非鱼养殖效果的影响[J]. 水产科技情报, 2012, 39(2): 99-101. DOI:10.3969/j.issn.1001-1994.2012.02.012 |
| [6] |
张萍. 培养基和虾蟹放养密度对池塘水质和底质的影响[D]. 上海: 上海海洋大学, 2014.
|
| [7] |
麻艳群, 司楠, 董升辉, 等. 不同放养密度对黄颡鱼生长性能及水质的影响[J]. 水产养殖, 2021, 42(8): 26-31. DOI:10.3969/j.issn.1004-2091.2021.08.006 |
| [8] |
侯文杰, 臧维玲, 刘永士, 等. 室内凡纳滨对虾养殖密度对水质与生长的影响[J]. 安徽农业大学学报, 2010, 37(2): 284-289. |
| [9] |
王丽娜, 申玉春, 叶宁, 等. 养殖密度对珍珠龙胆石斑鱼行为活动和生长性能的影响[J]. 南方农业学报, 2017, 48(5): 920-925. DOI:10.3969/j.issn.2095-1191.2017.05.027 |
| [10] |
左腾, 黄凯, 汪婷, 等. 养殖密度对吉富罗非鱼幼鱼生长、免疫功能的影响[J]. 水产科学, 2019, 38(5): 581-588. |
| [11] |
宋红桥, 张海耿, 张宇雷, 等. 循环水养殖系统中饲养密度对罗非鱼幼鱼生长及经济效益的影响[J]. 中国农学通报, 2015, 31(11): 94-97. DOI:10.11924/j.issn.1000-6850.2014-2197 |
| [12] |
陈静, 何吉祥, 方燚, 等. 稻鳖共作中华鳖放养密度对稻鳖产量和经济效益的影响[J]. 安徽农学通报, 2022, 28(8): 123-125, 164. DOI:10.3969/j.issn.1007-7731.2022.08.039 |
| [13] |
杨志强, 李潇轩, 马行空, 等. 循环水养殖系统中养殖密度对锦鲤幼鱼生长及经济效益的影响[J]. 水产养殖, 2018, 39(5): 3-5. DOI:10.3969/j.issn.1004-2091.2018.05.002 |
| [14] |
熊向英, 王志成, 刘旭佳, 等. 工厂化循环水养殖系统微生物群落结构和功能分析[J]. 水产科学, 2022, 41(5): 810-819. |
| [15] |
MARTINS C I M, EDING E H, VERDEGEM M C J, et al. New developments in recirculating aquaculture systems in Europe: a perspective on environmental sustainability[J]. Aquacultural Engineering, 2010, 43(3): 83-93. DOI:10.1016/j.aquaeng.2010.09.002 |
| [16] |
王楠楠. 循环水养殖中放养密度对点带石斑鱼幼鱼生长、存活和水质的影响[J]. 水产学杂志, 2015, 28(3): 44-47. |
| [17] |
赵晨. 大菱鲆工厂化循环水养殖与流水养殖经济效益比较研究[D]. 上海: 上海海洋大学, 2015.
|
| [18] |
曹阳, 杜震宇, 陈立侨, 等. 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[C]//集美大学水产学院. 第九届世界华人鱼虾营养学术研讨会论文摘要集. 福建: 厦门, 2013: 278.
|
| [19] |
于淼. 拥挤胁迫对鱼类影响研究进展[J]. 安徽农业科学, 2008, 36(3): 1078-1080, 1082. DOI:10.3969/j.issn.0517-6611.2008.03.100 |
| [20] |
MARCO P D, PRIORI A, FINOIA M G, et al. Physiological responses of European sea bass Dicentrarchus labrax to different stocking densities and acute stress challenge[J]. Aquaculture, 2008, 275(1/2/3/4): 319-328. |
| [21] |
张晓雁, 李罗新, 危起伟, 等. 养殖密度对中华鲟行为、免疫力和养殖环境水质的影响[J]. 长江流域资源与环境, 2011, 20(11): 1348-1354. |
| [22] |
范立民, BARRY K, 宋超, 等. 不同养殖密度下吉富罗非鱼生长性状的通径分析[J]. 中国农学通报, 2015, 31(11): 83-87. DOI:10.11924/j.issn.1000-6850.casb14110027 |
| [23] |
PAPOUTSOGLOU S E, PAPAPARASKEVA-PA-POUTSOGLOU E, ALEXIS M N. Effect of density on growth rate and production of rainbow trout (Salmo gairdneri Rich.) over a full rearing period[J]. Aquaculture, 1987, 66(1): 9-17. DOI:10.1016/0044-8486(87)90279-1 |
| [24] |
LIU B L, JIA R, HAN C, et al. Effects of stocking density on antioxidant status, metabolism and immune response in juvenile turbot (Scophthalmus maximus)[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2016, 190: 1-8. |
| [25] |
程佳佳, 李吉方, 温海深, 等. 养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J]. 中国水产科学, 2015, 22(3): 433-441. |
| [26] |
SVEEN L R, TIMMERHAUS G, KRASNOV A, et al. High fish density delays wound healing in Atlantic salmon (Salmo salar)[J]. Scientific Reports, 2018, 8: 16907. DOI:10.1038/s41598-018-35002-5 |
| [27] |
侯明华, 韩厚伟, 张黎黎, 等. 放养密度对大西洋鲑循环水养殖效果的影响[J]. 海洋湖沼通报, 2020(2): 113-121. |
| [28] |
刘国兴, 李玲, 彭刚, 等. 放养密度对克氏原螯虾生长和养殖水质的影响[J]. 江西农业学报, 2014, 26(4): 86-89, 93. DOI:10.3969/j.issn.1001-8581.2014.04.024 |
| [29] |
赵晨英. 乳山湾近海与黄渤海溶解氧、有机碳、氮和磷的循环与收支的关键过程研究[D]. 青岛: 国家海洋局第一海洋研究所, 2017.
|
| [30] |
陈丽婷, 檀午芳, 肖俊, 等. 我国池塘养殖尾水处理技术研究进展[J]. 广西农学报, 2021, 36(4): 40-45. DOI:10.3969/j.issn.1003-4374.2021.04.011 |
| [31] |
魏大鹏. 固定化复合菌处理养殖水体中氨氮和亚硝氮的研究[D]. 青岛: 中国海洋大学, 2014.
|
| [32] |
雷衍之. 养殖水环境化学[M]. 北京: 中国农业出版社, 2004.
|
| [33] |
王秋实, 张镜群. 放养密度和微生态制剂对施氏鲟养殖水质的影响[J]. 水产学杂志, 2017, 30(5): 39-42. DOI:10.3969/j.issn.1005-3832.2017.05.009 |
| [34] |
冯健, 吴彬, 王斐, 等. 吉富罗非鱼(Oreochromis niloticus)幼鱼日粮中添加植酸酶替代磷酸二氢钙的效果研究[J]. 海洋与湖沼, 2014, 45(5): 1051-1057. |
| [35] |
肖炜, 李大宇, 徐杨, 等. 慢性氨氮胁迫对吉富罗非鱼幼鱼生长、免疫及代谢的影响[J]. 南方水产科学, 2015, 11(4): 81-87. |
| [36] |
徐杨. 尼罗罗非鱼(Oreochromis niloticus)对氨氮和亚硝酸盐氮胁迫的生理响应[D]. 南京: 南京农业大学, 2015.
|
| [37] |
刘桂芳. 水产养殖中氨氮和亚硝酸盐氮的危害及防治[J]. 养殖与饲料, 2018(5): 37-38. |
| [38] |
方成, 黎兰诗, 梁震宇, 等. 不同浓度亚硝酸盐亚急性胁迫对凡纳滨对虾生长与免疫功能的影响[J]. 渔业科学进展, 2022, 43(4): 180-189. |



